INTRODUCCIÓN
Un nódulo tiroideo es una lesión discreta dentro de la glándula tiroides que es radiológicamente distinta al parénquima tiroideo circundante. Éstos representan un problema clínico a nivel mundial con una prevalencia que varía según la población estudiada y la metodología utilizada para su detección. La misma es de, aproximadamente un 5% en mujeres y 1% en hombres que viven en áreas de yodo suficiencia, cuando los nódulos son palpables -(1) y hasta un 68% cuando son evaluados por ecografía, pudiendo detectar aquellos no palpables, que no presentan manifestaciones clínicas y de pequeño tamaño (menores a 1 cm)(2). La importancia clínica del estudio de los nódulos tiroideos radica en la necesidad de excluir el cáncer de tiroides, que ocurre en 7% -15% de los casos -(1) .
En nuestra población la prevalencia de alteraciones morfológicas tiroideas detectadas por palpación es del 11% según un trabajo realizado en el área metropolitana del Buenos Aires en 2013(3). Los factores que se relacionan con el aumento en la frecuencia son la edad avanzada, el sexo femenino, la deficiencia de yodo y la historia de irradiación de cabeza y cuello.
El cáncer de tiroides (CT), es el tumor endocrino más frecuente. Su incidencia aumentó en el último tiempo debido a una mayor detección de tumores en un estadio más temprano o silente. En Argentina, un estudio realizado durante el período 2003-2011, estimó la incidencia del carcinoma tiroideo en la población de Capital Federal y Gran Buenos Aires, siendo la misma de 2,65/100.000 habitantes/año en hombres y 11,76/100.000 habitantes/año en mujeres (4).
Aproximadamente el 90% de todos los cánceres de tiroides son diferenciados, siendo el carcinoma papilar de tiroides (CPT) el tipo histológico más común, seguido por el carcinoma folicular de tiroides (CFT)(5). En nuestra población, en un estudio realizado entre el 2004 y el 2013 en la provincia de Río Negro, la frecuencia por tipo histológico fue de 98,7% para el CPT; 0,63% para el carcinoma medular (CM); 0.63% para el carcinoma anaplásico, no encontrándose ningún caso de CFT dentro de los 157 pacientes diagnosticados con CT(6).
La ecografía y el diagnóstico citológico por punción aspiración con aguja fina (PAAF), son las herramientas utilizadas para clasificar correctamente la mayoría de los casos; sin embargo, cuando el resultado citológico es indeterminado (clasificación de Bethesda III y IV), el paciente es sometido con frecuencia a una intervención quirúrgica con finalidad diagnóstica, ya que dichas categorías presentan un riesgo asociado de CT que se considera demasiado alto para la vigilancia pero insuficiente como para merecer una tiroidectomía total . Con un resultado histopatológico benigno en, aproximadamente, tres de cada cuatro de estos casos, la cirugía resulta en un inconveniente ya que expone al paciente a innecesarios riesgos quirúrgicos. En el caso de lesiones malignas, una tiroidectomía en una segunda etapa es a menudo indicada, lo que se asocia con costos adicionales y mayores riesgos de complicaciones quirúrgicas(7). Por lo tanto resulta crítico contar con otras herramientas para mejorar el diagnóstico preoperatorio en dichos pacientes.
El análisis molecular del tejido tiroideo se convierte en un poderoso complemento para el diagnóstico preoperatorio de los nódulos tiroideos con citología indeterminada, ya que entre el 60 al 70% de los cánceres de tiroides albergan al menos una mutación genética conocida.
Técnicas diagnósticas actuales
La PAAF es reconocida como el método de referencia en el diagnóstico inicial diferencial de los nódulos tiroideos. Desde el año 2007 el Sistema Bethesda para el informe de Citopatología de la Tiroides estableció un sistema de notificación para PAAF que incluye 6 categorías estandarizadas, basadas en características citopatológicas, con una tasa de malignidad asociada y una recomendación de gestión para cada una de ellas (8). En el 2017 se realizó una revisión del mismo que tuvo en cuenta nuevos datos y desarrollos en el campo de la patología tiroidea: nuevas directrices en el manejo de pacientes con nódulos tiroideos, la introducción de pruebas moleculares como complemento del examen citopatológico y la reclasificación de la variante folicular no invasiva del carcinoma papilar de tiroides como neoplasia folicular no invasiva de tiroides con características nucleares de tipo papilar (NIFTP)(9).Según la categoría Bethesda será el riesgo de malignidad asociado y por lo tanto la conducta médica frente a ese nódulo tiroideo. (Tabla 1)
Para los extremos de categoría está bien determinado cuál es el manejo clínico a seguir. El problema radica en las categorías Bethesda III y IV en dónde el panorama no está bien definido. Es por esta razón que, en un principio, se esperaba que el uso de la categoría Bethesda III sea limitado, con una frecuencia de un 7% de todas las PAAFs -(1), pero estudios posteriores revelaron que resultaba un desafío para muchos laboratorios alcanzar dicha frecuencia. Por lo tanto, en la revisión del 2017 se reconoció que un límite más realista podría ser del 10% (9). Un meta análisis publicado en el 2012 determinó que los casos de PAAFs con categoría Bethesda III y IV oscilaron entre un 3% y un 27,2% y entre un 1,2 % a 25,3%, respectivamente (10). Esto implica una frecuencia mucho mayor a la deseada que trae como consecuencia una cantidad importante de pacientes sin un diagnóstico preciso.
Alteraciones moleculares asociadas a la patología En las últimas décadas, los investigadores han desentrañado importantes mecanismos moleculares detrás de la tumorigénesis tiroidea y han designado un gran número de alteraciones genéticas relacionadas con los diversos tipos de carcinoma de tiroides.
En el CPT la alteración mejor conocida es la mutación en BRAF, presente hasta en el 40-45% de los casos (BRAF V600E), seguida de mutaciones en RAS (en sus diferentes isoformas, H-K- y N-RAS) y los rearreglos RET/PTC en alrededor de un 20% de los casos. En el carcinoma folicular de tiroides se describen mutaciones en RAS en un 40-50% de los casos, seguida por el rearreglo PAX8/ PPARy en un 30-35% (11).
Varios de estos marcadores moleculares pueden ser utilizados en el diagnóstico preoperatorio de nódulo tiroideo con citología indeterminada.
Mutación BRAF: la mutación BRAFV600E presenta una altísima especificidad (99-100%) para CPT, lo que determina que la presencia de dicha mutación llevaría a una tiroidectomía total de los nódulos con citología indeterminada, obviando la cirugía en dos pasos.
Con respecto a la sensibilidad, la misma varía mucho (0-83%) entre los distintos estudios, asociada a la prevalencia de CPT de la población, y en particular en las categorías indeterminadas. Esto sumado a que otros tipos de carcinomas (con diferente incidencia de la mutación BRAFV600E) se presentan como nódulos con citología indeterminada: CFT, carcinoma papilar de tiroides variante folicular (FVPTC) o carcinoma de la célula de Hürthle, y que predominada por el carcinoma de tipo folicular, la mutación BRAF rara vez ocurre en la citología Bethesda IV, trae como consecuencia que este marcador resulte menos útil para descartar malignidad de los nódulos tiroideos con citología Bethesda IV (7).
Rearreglo RET/PCT: el protooncogén RET codifica un receptor transmembrana con un dominio de tirosina quinasa. Los rearrelgos denominados RET / PTC llevan a una activación constitutiva del receptor RET en ausencia de ligando promoviendo el crecimiento y la transformación de la célula folicular.
Hasta el día de hoy se han detectado al menos 12 diferentes variantes de fusión con diferentes genes, de las cuales RET / PTC, y RET / PTC, son las más prevalentes. Tienen una asociación conocida con el CPT, aunque pueden hallarse en nódulos benignos, tiroiditis de Hashimoto, tumores oncocíticos y otras lesiones (12).La sensibilidad y especificidad es de 0-29% y 73-100%, respectivamente (7) y por todas estas razones se debe tener precaución en su utilidad clínica.
Mutación RAS: en nódulos tiroideos indeterminados, son la alteración genética más común, debido a una fuerte asociación de mutaciones que involucran regiones específicas de los tres oncogenes RAS (K-RAS, H-RAS, N-RAS) con la lesión de patrón folicular que conforman estas categorías citológicas: adenoma folicular (FA), FTC, FVPTC y NIFTP. Las mutaciones de RAS no son específicas para el carcinoma y se encuentran tanto en lesiones malignas como benignas (como ser adenomas). La sensibilidad y especificidad de la mutación RAS varía entre 0-77% y 75-100 %, respectivamente según diferentes estudios (7) .
Fusión PAX8/PPARy: el gen PAX8 codifica para factores de transcripción específicos tiroideos y resulta esencial en el desarrollo de células tiroideas foliculares.
Presenta una sensibilidad del 0-29% y una especificidad del 96-100% y raramente ocurre en nódulos tiroideos con citología indeterminada (7). Por lo tanto, este reordenamiento debe ser evaluado en nódulos tiroideos indeterminados en combinación con otras alteraciones genéticas más frecuentes.
Otro proceso que juega un papel crítico en la tumorigénesis es la desregulación de la expresión génica por los microARNs (miRNAs). Los miRNAs son moléculas pequeñas de RNA no codificantes que contienen aproximadamente 22 nucleótidos que funcionan en la regulación postranscripcional de la expresión génica, apareándose por complementaridad con los ARN mensajeros (ARNm) que se traducirán en proteínas. Como consecuencia el ARNm es degradado o se impide la traducción y el resultado es una menor síntesis proteica.
El análisis del perfil de expresión de los miRNAs en neoplasias humanas ha revelado la presencia de perfiles de miRNAs para cada neoplasia indicando a los miRNAs como excelentes herramientas para el diagnóstico y pronóstico del cáncer (13).
Paneles de genes
La combinación de alteraciones genéticas individuales en un
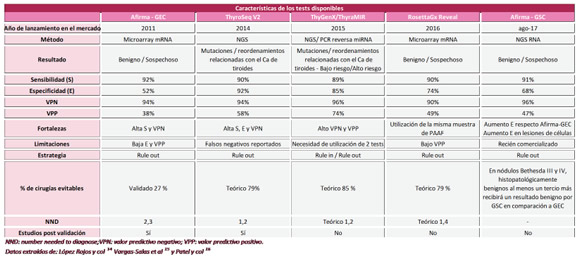
panel de mutación de genes mejora la precisión diagnóstica. Existen actualmente varios paneles moleculares, entre los que se encuentran Thyroseq, ThyGenX, ThyraMIR, Afirma GEC (hoy Afirma GSC) y RosettaGx Reveal. (14).
Por un lado, los paneles moleculares (Thyroseq y ThyGenX) analizan genes específicos cuyas mutaciones están relacionadas con el cáncer de tiroides, que reportan un riesgo de cáncer basado en el genotipo. Por otro lado, se encuentran los clasificadores de la expresión génica (Afirma, ThyraMIR, RosettaGx) que analizan los niveles de expresión de múltiples genes de forma simultánea para crear un perfil de la expresión génica del nódulo estudiando que mediante algoritmos se traducirá en un perfil con al ato riesgo o bajo riesgo de malignidad, trayendo como consecuencia que los resultados de dichos paneles tenga el formato de reporte binario: sospechoso o benigno.
Afirma GEN: Esta primera versión de la firma Veracyte utiliza la tecnología de microarrays para evaluar los perfiles de expresión de ARNm.
La prueba requiere 3 muestras de PAAF: 2 que van a ser recolectadas en un vial que contiene conservante para ácidos nucleicos y van a ser utilizadas para la técnica molecular y una que va a ser utilizada para el análisis citológico. Se realiza en primera instancia un screening del perfil de expresión de 25 genes asociados a entidades menos comunes en la tiroides: tumores metastásicos (mama, riñón y melanoma), tejido paratiroideo, y MTC. Si se activa uno de estos casetes de detección, se informa que la muestra tiene un resultado Afirma sospechoso y no se somete a un análisis adicional. Aquellas muestras que resultan negativas en este primer screening, se someten a un segundo análisis del perfil de expresión de 142 genes(15).
Afirma GSC: La nueva versión de Veracyte utiliza NGS RNA para clasificar los nódulos en bajo o alto riesgo de malignidad. Se necesitan dos muestras para realizar la prueba: una para el análisis citológico y otra para el molecular.
RosettaGX REVEAL: Analiza utilizando la tecnología de microarrays los perfiles de expresión de 24 miRNAs.
El test puede realizarse utilizando la muestra que fue prepara y teñida para el análisis citológico, lo que implica dos ventajas: disminuir el número de muestras que se deben obtener de la PAAF y que el análisis del perfil de miRNA se realiza en las mismas células que se examinaron citológicamente (15). ThyGenX/ThyraMIR: ThyGenX utiliza NGS (next generation sequencing) para detectar mutaciones en 10genes (ALK, BRAF, GNAS, HRAS, KRAS, NRAS, PIK3CA, PTEN, RET, TERT) y la expresión de 6 ARN (ALK, BRAF, NTRK, PPARy, RET, THADA).
Para realizar dicho test se necesita una muestra de PAAF que contenga al menos 50 ng de material celular recolectado en un vial con conservante para ácidos nucleicos, distinta a la utilizada para el diagnóstico citológico (16).
A pesar de su alto valor predictivo positivo, el panel está limitado tanto por la baja especificidad de algunos marcadores para el cáncer, así como el no despreciable riesgo residual de cáncer que permanece en la ausencia de mutación/ detección de fusión. Para sobrellevar dicho problema, se recomienda utilizar ThyGenX en combinación con ThyraMIR.
ThyraMIR utiliza PCR reversa para analizar los niveles de expresión de 10 miRNAs en aquellas muestras que resultaron negativas o con mutaciones/reordenamientos con baja especificidad en ThyGenX (15).
ThyroSeq: ThyroSeq v3 utiliza NGS para analizar 42 fusiones de genes, así como mutaciones puntuales e inserciones/deleciones en 112 genes. La misma fue lanzada recientemente con el objetivo de mejorar la estratificación de riesgo de los aspirados con alta concentración de células Hürtle (15).
Para llevar a cabo este panel se necesita una muestra de PPAF recolectada en un vial con conservante de ácidos nucleicos, diferente a la utilizada para el diagnóstico citológico(15).
En función del riesgo de malignidad del propio nódulo y de si buscamos confirmar una malignidad o descartarla, debemos escoger el test más adecuado. La características principales del test que nos van a servir para realizar correctamente esta elección son el valor predictivo positivo (VPP) y valor predictivo negativo (VPN). Escogeremos por tanto un «rule out» test (alto VPN y especificidad [E]) cuando queramos buscar aquellos nódulos en los que se pueda evitar cirugía y un «rule in» (alto VPP y sensibilidad [S]) test cuando busquemos los nódulos a los que indicar cirugía.
En un metaananálisis realizado por Vargas et al en el 2016 (17) en el que comparan los distintos paneles de genes disponibles hasta ese momento (no está incluido el Afirma GSC) incluyendo 26 estudios de centros estadounidenses (19 Afirma GEC, 5 ThyroSeq, 1 ThyGenX/ThyraMIR y un RosettaGx Reveal), no se encontraron diferencias significativas en cuanto a la S (en torno al 90%) y VPN (92-96%); por lo que todos los tests tendrían similar performance en la estrategia rule out. En cuanto a la E, ThyGenX/ThyraMIR (85%) y ThyroSeq (92%) son notablemente mejores que Afirma GEC (52%) y RosettaGx Reveal (74%) trayendo como consecuencia un mejor VPP en torno al 78% para los casos de ThyGenX/ThyraMIR y ThyroSeq frente a un 38% de Afirma y un 49% de RosettaGx Reveal; siendo más útiles los primeros para estrategia de rule in. Con respecto a la nueva versión de Afirma, el Afirma GSC (Genomic Sequencing Classifier), en el estudio de validación que se llevó a cabo con las mismas muestras utilizadas para validar la versión anterior (Afirma GEC)(18), la S fue del 91%, E del 68% con un VPN del 96% y un VPP del 47%. Respecto al Afirma GEC no se observaron cambios en la S y VPN, pero si se evidenció una mejora significativa en la E (68% vs 50%) y VPP (47% vs 38%). En la práctica, esta mejora en el rendimiento sugiere que entre los nódulos de Bethesda III y IV que resultan histopatológicamente benignos, al menos un tercio más recibirá un resultado benigno usando el GSC comparado con el GEC. El aumento en la E se debe en parte a la mejor performance del Afirma GSC para clasificar de manera correcta los adenomas y carcinomas de células de Hürthle y en parte a la mejora del desempeño analítico ya que la técnica NGS es mucho más robusta en comparación al uso de microarrays. La E para los casos de células de Hürthle de Afirma GSC reportada es de 59% vs 12% del Afirma GEC (18).
Las principales características de los paneles moleculares disponibles se encuentran resumidas en la Tabla 2.

Tabla 1: El Sistema Bethesda 2017 para informar la citopatología de la tiroides junto al riesgo implícito de malignidad y la recomendación sobre el manejo clínico
CONCLUSIÓN
En los casos de PAAF con citología indeterminada, el problema radica en diferenciar cuáles de esos nódulos son benignos y pueden seguirse en el tiempo, y cuáles de ellos son malignos y requieren cirugía. El uso complementario de paneles moleculares ha sido, de momento, la única herramienta que parece ayudar en este difícil escenario.
Distintas asociaciones de tiroides, recomiendan utilizar las pruebas moleculares ennódulos con citología indeterminada con fines diagnósticos para determinar el manejo clínico del mismo. De todas maneras, hay que tener en cuenta que estos paneles moleculares son uno de los muchos factores que contribuyen a la probabilidad general de malignidad para un paciente. La decisión de utilizar pruebas moleculares auxiliares, la selección de la prueba molecular apropiada y la interpretación de sus resultados siempre deben realizarse dentro del contexto de los hallazgos citológicos, clínicos y ecográficos.
Aunque en los estudios de validación estas técnicas parecen prometedoras, faltan a día de hoy estudios prospectivos, aleatorizados, multicéntricos que estudien la utilidad real en la práctica clínica, y sobre todo en nuestro país, en los costos y en la calidad de vida de los pacientes, así como recomendaciones acerca del seguimiento a largo plazo.