Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.84 no.1 Vicente López jun. 2015
ARTÍCULOS ORIGINALES
Caracterización morfológica y molecular de poblaciones de zacate tempranero (Setaria macrostachya Kunth) en Chihuahua, México
Morphological and molecular characterization of populations of plains bristlegrass (Setaria macrostachya Kunth) in Chihuahua, México
Morales-Nieto CR1, C Avendaño-Arrazate2, A Melgoza-Castillo1, M Martinez-Salvador3, P Jurado-Guerra4
1 Facultad de Zootecnia y Ecología Km 1 Perif. Francisco R. Aldama, CP 3103, Chihuahua Chih. Doctor en Ciencias en Genética.
2 Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP). C. E. Rosario Izapa, Chiapas. Doctor en Ciencias en Genética.
1 Facultad de Zootecnia y Ecología Km 1 Perif. Francisco R. Aldama, CP 3103, Chihuahua Chih. Doctora en Ciencias.
3 INIFAP. Campo Experimental La Campana. Km 33.3 Carretea Chihuahua-Ojinaga. Doctor en Ciencias Forestales.
4 INIFAP. Campo Experimental La Campana. Km 33.3 Carretea Chihuahua-Ojinaga. Doctor en Ciencias en Pastizales.
Address Correspondence to: Carlos Avendaño Arrazate, Campo Experimental Rosario Izapa. Km 18 carretera Tapachula-Cacahoatán C.P. 30870 Tuxtla Chico, Chiapas México avendano.carlos@inifap.gob.mx
Recibido / Received 28.V.2014.
Aceptado / Accepted 6.VIII.2014
Resumen. El zacate tempranero (Setaria macrostachya Kunth) es una gramínea nativa de importancia forrajera. Sin embargo, debido a malas prácticas de pastoreo se han reducido sus poblaciones, lo cual puede causar también una reducción en la diversidad genética. Se analizó la variabilidad morfológica y genética de 44 poblaciones de zacate tempranero del estado de Chihuahua. Las plantas fueron trasplantadas en un área común bajo condiciones naturales. Dos años después se realizó la caracterización morfológica utilizando nueve variables, y para la evaluación de la variabilidad genética se utilizaron marcadores moleculares AFLP. El análisis de componentes principales (CP) mostró que los tres primeros componentes principales explican el 73,74% de la variación. Las variables que explicaron más la variación en el CP1 fueron altura de planta y longitud de inflorescencia, en el CP2 densidad de tallos y ancho de hoja, y en el CP3 grosor de tallo. La aplicación de cuatro pares de iniciadores presentó 186 bandas totales, de las cuales el 87,10% presentó polimorfismo y el 12,90% monomorfismo. La combinación de iniciadores EcoRI-AGG+MseI-CAG detectó el mayor porcentaje (93%) de polimorfsmo con 40 bandas polimórficas. El análisis de conglomerados y el coeficiente de Dice integró dos grupos de poblaciones. La amplia variabilidad genética y las características morfológicas de las diferentes poblaciones servirán de base para la selección de las mismas con diversos propósitos en la rehabilitación de ecosistemas. Además, este estudio permitirá establecer estrategias de conservación in situ.
Palabras clave: Setaria macrostachya; Variación morfológica; Poblaciones.
Abstract. Plains bristlegrass (Setaria macrostachya Kunth) is a native grass with forage value. However, due to the lack of grazing management practices, populations and thus genetic diversity, have been reduced. Morphological and genetic variability were analyzed on 44 populations of plains bristlegrass in the State of Chihuahua. Plants were transplanted in a common area under natural conditions. Two years later, morphological characterization was evaluated measuring nine variables, and genetic variability using AFLP molecular markers. The principal components analysis (PC) showed that the three first principal components explained 73.74% of the variation. The variables with the greatest contribution to the variance in PC1 were plant height and inflorescence length; in CP2, tiller number and leaf width; and in PC3, tiller thickness. Application of four pairs of primers, presented 186 total bands, from which 87.10% showed polymorphism and 12.90% monomorphism. The combination of EcoRI-AGG MseI-CAG primers detected the highest percentage (93%) of polymorphism with 40 polymorphic bands. The cluster analysis and Dice coeficient indicated that populations clump into two groups. The wide genetic variability and morphological characteristics detected among populations represent the basis for the selection of populations that could be used with different purposes in the rehabilitation of ecosystems. In addition, this study will allow establishment of in situ conservation strategies.
Keywords: Setaria macrostachya; Morphological diversity; Populations.
INTRODUCCIÓN
Los pastizales nativos de la región centro y norte de México comprenden casi los 10 millones de hectáreas de los cuales el 65% presenta cierto tipo de degradación (SEMARNAT, 2011). El resultado es la pérdida de biodiversidad la cual cada día adquiere mayor relevancia con la desaparición de especies de importancia ganadera (Gauthier et al., 2003.). En el estado de Chihuahua, el sobrepastoreo ha sido una de las principales causas de este deterioro y de la fuerte invasión de especies exóticas (Valerio et al., 2005). El zacate tempranero (Setaria macrostachya) es una especie perenne del noreste de México que al ser examinada citológicamente demostró que es un miembro poliploide de un complejo agámico que se reproduce sexualmente (2n = 54). Es decir, es una especie en la que domina la autogamia. Nguyen y Pernes (1985) y Decker (2003) señalaron para este género un sistema de polinización combinado, donde predomina la autogamia con un reducido porcentaje de alogamia. Sin embargo, al analizar el peso de 1000 semillas bajo dos sistemas de polinización, no encontraron diferencias significativas en dicho peso bajo los tratamientos de polinización (Pensiero et al., 2005). La autogamia es el mecanismo reproductivo dominante, obteniendo porcentajes de producción de caríopsides superiores al 50%, independientemente del tipo de polinización (Pensiero, 1995). El zacate tempranero es una planta nativa de gran importancia forrajera con amplia distribución en el estado de Chihuahua (Melgoza et al., 2008). El valor forrajero de esta especie ha sido reportado por diversos autores (Valdez et al., 1975; Lebgue, 2002; Melgoza et al., 2008). Ramírez et al. (2001) reportan hasta un 13% de proteína cruda y 69% de digestibilidad. Sin embargo, entre otros factores y debido al valor forrajero, el sobrepastoreo ha provocado la reducción y desaparición de poblaciones de esta especie (Holecheck et al., 1989; Weber et al., 2000). La amplia distribución de esta especie en zonas de matorrales xerófitos y valles centrales de pastizales refleja una adaptación a diversos ambientes que puede dar lugar a diferentes ecotipos. Estos ecotipos tienen diferencias morfológicas, por lo que es importante realizar evaluaciones ex situ, donde todos se coloquen en un ambiente uniforme para detectar características de importancia dentro de la especie (Erickson et al., 2004; Morales, 2006).
En la caracterización morfológica y fisiológica de otras gramíneas como Festuca pratensis se detectó una correlación significativa entre la diversidad de características morfológicas y la localización de los sitios muestreados. Por otro lado, para Lolium multiforum no se detectó una correlación significativa entre dichas variables (Peter-Schmid et al., 2008). Además, Loos (1994) al evaluar la variación morfológica de poblaciones de ryegrass perenne (Lolium perenne L.) encontró una correlación significativa con factores ambientales.
Por lo tanto, es importante no sólo evaluar características morfológicas sino también genéticas, ya que las características morfológicas son influenciadas por el ambiente. Por lo anterior, es necesario utilizar marcadores de ADN que no son afectados por el ambiente y pueden detectar diversidad a nivel del genotipo. Los marcadores moleculares, como es el polimorfismo en la longitud de fragmentos amplificados (AFLP), han sido empleados en estudios en pastos (Puecher et al., 2001; Renganayaki et al., 2001) para conocer su variabilidad genética (Meudt y Clarke, 2006). El objetivo del presente trabajo fue caracterizar la diversidad morfológica y molecular en poblaciones de zacate tempranero del estado de Chihuahua, México.
MATERIALES Y MÉTODOS
Trabajo de campo. En el año 2006 se recolectaron 107 ecotipos de zacate tempranero en ranchos ganaderos, los cuales se agruparon en 44 poblaciones procedentes de 16 municipios del estado de Chihuahua, México (Fig. 1). Las poblaciones fueron clasificadas de acuerdo a la distancia y establecimiento en campo. Cada población estaba separada por una distancia mínima de 50 km. Se recolectaron cuatro ecotipos en cada una de las 44 poblaciones y se establecieron 107 ecotipos. De los 107 ecotipos establecidos se consideró solo uno por población para la caracterización morfológica y molecular.
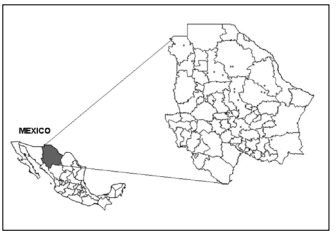
Fig. 1. Ubicación de los sitios de muestreo de 44 poblaciones de zacate tempranero (Setaria macrostachya) en Chihuahua, México.
Fig. 1. Location of sampling sites of 44 populations of bristlegrass (Setaria macrostachya) in Chihuahua, Mexico.
Los municipios y las variables ambientales de los sitios de recolecta se listan en la Tabla 1. En cada sitio de muestreo se extrajeron cuatro plantas, con un diámetro de 2.5 cm y provista de raíz. La parte aérea se cortó a una altura de 15 a 20 cm, y cada planta fue identificada con un número de recolecta (Morales, 2009); cada uno de los 44 ecotipos representaba a una población diferente. Las plantas fueron colocadas en cajas con suelo húmedo para su transporte y trasplante en el Campo Experimental La Campana del INIFAP.
Tabla 1. Características ambientales de los municipios donde se recolectaron 107 ecotipos (44 poblaciones) de zacate tempranero (Setaria macrostachya) en Chihuahua, México.
Table 1. Environmental characteristics of the municipalities where 107 ecotypes (44 populations) of bristlegrass (Setaria macrostachya) in Chihuahua, Mexico were collected.
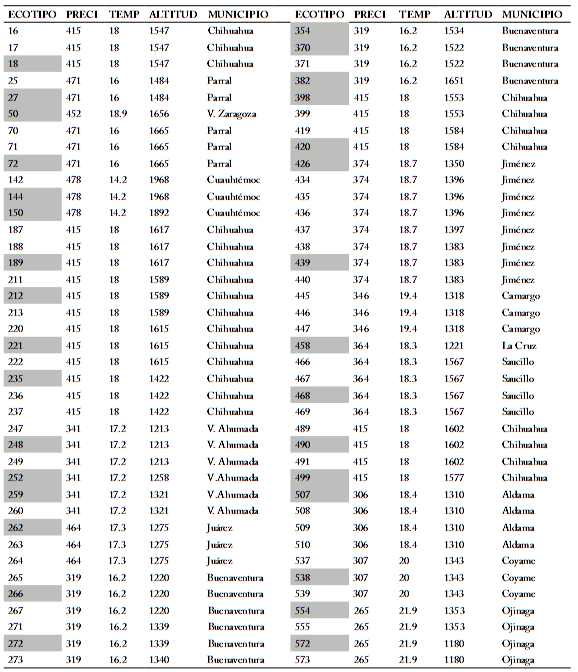
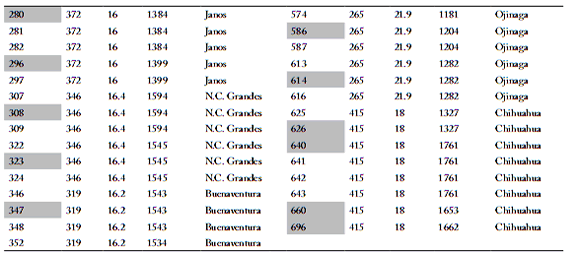
Población; PRECI=precipitación; TEMP=temperatura
El sitio donde se trasplant ó el material recolectado es de topografía plana, suelos de origen aluvial con textura franco arenoso y pH de 6,5. El clima es seco templado con veranos cálidos BWk, temperatura media anual de 15 a 18 °C y una precipitación promedio de 355 mm anuales (Royo y Lafón, 2008). Al momento del trasplante, las plantas fueron regadas para asegurar su establecimiento. Posteriormente, las plantas se mantuvieron en condiciones de precipitación natural, sin riegos adicionales.
Caracterización morfológica. La caracterización morfológica se realizó en forma individual en solo un estado fenológico (durante la floración). Los datos analizados corresponden a una planta (ecotipo) por población. Dos años después del establecimiento se realizó la caracterización considerando las siguientes características: altura total de la planta (AP), altura de follaje (AF), densidad de tallos (DT), grosor de tallos (GT), ancho de hoja (AH), largo de hoja (LH), longitud de inflorescencia (LI), diámetro del macollo (DM) y producción de materia seca (MS). La AP se midió desde el nivel del suelo hasta la punta de la inflorescencia más alta. La AF se midió desde el suelo hasta la altura de las hojas. El GT se midió tomando un tallo al azar de la parte central de la planta. Para medir LH y AH se tomó una hoja al azar de la parte central de la planta. La LI se midió tomando una inflorescencia al azar y midiendo de la base hasta la punta de la misma. El DM se midió en la base, a nivel del suelo. La MS se obtuvo cortando las plantas a 5 cm sobre el nivel del suelo. Este material fue colocado en bolsas de papel y luego en una estufa de aire forzado a 70 °C por 48 horas.
Caracterización molecular. Los ecotipos se agruparon en 44 poblaciones para su análisis. La caracterización molecular se realizó siguiendo el método de Doyle y Doyle (1990) para la extracción de ADN, y se usó el protocolo de Vos et al. (1995) para el análisis de los AFLPs. Los marcadores de AFLP utilizados fueron del tipo quimioluminiscentes (Hoisington et al., 1998). La extracción del ADN se realizó en forma individual en cada uno de los 44 ecotipos que representaron a las 44 poblaciones.
Digestión: se añadieron 1,5 μL de solución amortiguadora de reacción (RL) 10X; 2 μL de templado de DNA a 50 ng/μL; 0,5 μL de enzima Eco RI (10 U/μL); 0,5 μL de enzima Mse I (10 U/μL), y se llevó la reacción hasta un volumen de 12,5 μL con agua deionizada estéril. La mezcla se centrifugó e incubó a 37 °C durante 2 h, y a 70 °C por 15 min, para inactivar las enzimas de restricción. Se corroboró en un gel de agarosa al 1% teñido con bromuro de etidio.
Ligación de adaptadores: a la reacción de digestión se añadieron 0,3 μL de adaptador Eco RI (50 pmol); 0,3 μL de adaptador Mse I (50 pmol); 1,2 μL de ATP (10 mM, pH 7,0); 1,0 μL de solución amortiguadora de reacción (RL) 10X; 1,0 μL de T4 DNA ligasa (5U/μL), y 6,2 μL de agua desionizada estéril. Se mezcló, centrifugó e incubó por 2 h a 16 °C.
Preamplificación: se añadieron 2,5 μL de DNA digerido, ligado y diluido 1:10; 1,15 μL de Oligo Eco RI + A (50 ng/μL); 1,15 μL de Oligo Mse I + A (50 ng/μL); 0,5 μL de dNTPs (10mM); 2,5 μL de solución amortiguadora de reacción de la enzima Taq DNA polimerasa, para PCR (10X); 0,65 μL de MgCl2 (50 mM); 0,2 μL de enzima Taq DNA polimerasa (5U/μL), y 16,85 μL de agua deionizada estéril. Se mezcló, centrifugó y se puso en un termociclador a 20 ciclos a 94 °C por 30 s, un minuto a 56 °C, y un minuto a 72 °C, y mantenimiento fnal a 4 °C.
Amplificación selectiva: se añadieron 2,0 μL de DNA preamplificado y diluido 1:40; 4,9 μL de agua deionizada estéril; 1,1 μL de solución amortiguadora de reacción de la enzima Taq DNA polimerasa, para PCR (10X); 0,3 μL de MgCl2 (50 mM); 0,5 μL de enzima Taq DNA polimerasa (5 U/ μL); 1,0μL de Oligo Mse I + 4 bases selectivas (30 ng/μL); 0,2 μL de dNTPs (10 mM); 0,5 μL de Oligo Eco RI + 3 bases selectivas marcado a 700; 0,5 μL de Oligo Eco RI + 3 bases selectivas marcado a 800. Se programó el termociclador con 1 ciclo a 94 °C por 30 s, 30 s a 65 °C y un minuto a 72 °C. Doce ciclos en donde subsecuentemente se disminuyó la temperatura de hibridación (65 °C) a razón de 0,7 °C por ciclo, mientras las otras temperaturas se mantuvieron igual. Seguido de 23 ciclos a 94 °C por 30 s, 30 s a 56 °C y un minuto a 72 °C; al fnal, se mantuvo la reacción a 4 °C. La electroforesis se realizó en gel de acrilamida al 6,5%, con urea 8M y TBE 1X (Tris 1M, ácido bórico 1M, EDTA 20 mM, pH 7,0). La separación de los fragmentos amplificados se hizo en el analizador de DNA LI-COR, cargando 0,8 μL de muestra en un pozo y utilizando el marcador de peso molecular de 50 a 700 pb. Se utilizaron oligos o primers, marcados con fluorescencia, a diferentes longitudes de onda (700 nm y 800 nm) (Vos et al., 1995).
Análisis de datos. A los datos morfológicos se les realizó un análisis de componentes principales (ACP) y un análisis de conglomerados (AC), mediante el método de Ward (SAS, 1999). Para obtener la gráfica de dispersión se utilizó el programa PC-ORD y el MINITAB v15 para obtener el dendograma. Además, el análisis del ADN se hizo en forma individual para determinar variabilidad o similitud genética. Con el patrón de bandeo de los datos moleculares se realizó una matriz binaria de presencia y ausencia de bandas. Estos datos moleculares se analizaron con el paquete estadístico NTSysPC (v 2.1). La estimación de la similitud genética entre los ecotipos fue con el programa SIMQUAL mediante el coeficiente Dice, y como método de agrupamiento se utilizó el de Medias Aritméticas por Grupo No Ponderadas (UPGMA).
RESULTADOS
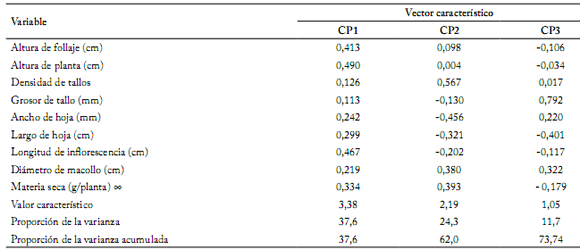
Caracterización morfológica. Los rangos de los valores obtenidos de las variables evaluadas se puede observar en la Tabla 2. El análisis de componentes principales (ACP) mostró que los tres primeros componentes principales (CP), explicaron el 73,74% de la variación (Tabla 3). Al correlacionar materia seca con las otras variables originales (Tabla 4), se presentaron correlaciones significativas en variables como densidad de tallos (r= 0,58; p≤0,0001), altura de planta (r=0,53; p≤0,0002) y altura de follaje (r= 0,48; p≤0,0009). Además, se correlacionaron las nueve variables con los tres primeros componentes principales. El CP1 presentó una correlación significativa (p≤0,0001) con altura de planta (90%), longitud de inflorescencia (86%), altura de forraje (76%), materia seca (61%) y largo de hoja (55%). El CP2 presentó una correlación significativa (p≤0,0001) con densidad de tallos (84%), ancho de hoja (67%), materia seca (58%) y diámetro de macolla (56%). Por último, el CP3 sólo presentó correlación significativa (p≤0,0001) con grosor de tallo (81%) (Tabla 4).
Tabla 2. Valores medios de nueve variables evaluadas en 44 poblaciones de zacate tempranero (Setaria macrostachya) en Chihuahua, México.
Table 2. Average values of nine variables assessed in 44 plains bristlegrass (Setaria macrostachya) populations in Chihuahua, Mexico.
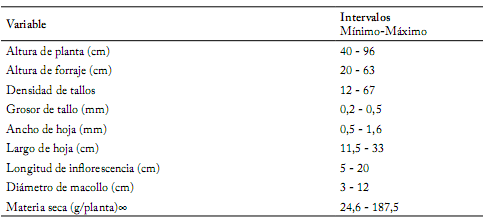
∞ Rendimiento de materia seca (g/planta/35 días)
Tabla 3. Vectores característicos de las variables de mayor valor descriptivo, respecto a su componente principal en 44 poblaciones de zacate tempranero (Setaria macrostachya) en Chihuahua, México.
Table 3. Characteristic vectors of more descriptive value variables, relative to its principal component in 44 populations of bristlegrass (Setaria macrostachya) in Chihuahua, Mexico.
∞ Rendimiento de materia seca (g/planta/35 días)
Tabla 4. Correlación de variables con los componentes principales en 44 poblaciones de zacate tempranero (Setaria macrostachya) en Chihuahua, México.
Table 4. Correlation of variables with the principals components in 44 populations of bristlegrass (Setaria macrostachya) in Chihuahua, Mexico.
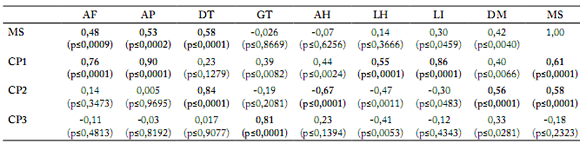
CP1= componente principal uno; CP2= componente principal dos; CP3= componente principal tres. AF= altura de forraje; AP= altura de planta; DT= densidad de tallos; GT= grosor de tallos; AH= ancho de hoja; LH= largo de hoja; LI= longitud de inflorescencia; DM= diámetro del macollo; RF= rendimiento de forraje
La amplitud de la diversidad morfológica observada en la Figura 2 refleja la variación morfológica existente en esta especie. Las variables que más contribuyeron a esta variación fueron densidad de tallos, rendimiento de forraje y altura de planta. Además, se observó que la dispersión no fue aleatoria, ya que se pudieron establecer grupos en base a sus áreas de adaptación climática o entidades de origen. El análisis de conglomerados jerárquicos integró a cinco grupos basados en el método de ligamiento WARD (Fig. 3). El grupo I (G-I) estuvo integrado por siete poblaciones originarias de los municipios de Chihuahua, Ojinaga, Cuauhtémoc y Coyame. Estos ecotipos se caracterizaron por presentar los valores más bajos de las nueve variables evaluadas. El grupo II (G-II) integró seis poblaciones, originarias de los municipios de Juárez, V. Zaragoza, Buenaventura y Jiménez. Los valores de estos ecotipos presentaron rendimientos intermedios de forraje, buena densidad de tallos pero los valores de las otras variables fueron bajos. El grupo III (G-III) integró 12 poblaciones originarias de los municipios de Chihuahua, Buenaventura, V. Ahumada, Ojinaga y Parral. Estas poblaciones presentaron buena altura de forraje, buen rendimiento de forraje, y buena densidad de tallos y largo de hoja. El grupo IV (G-IV) reunió ocho poblaciones originarias de los municipios de Janos, N.C. Grandes, V. Ahumada, Buenaventura y Ojinaga. Estas poblaciones presentaron los mayores valores de altura de forraje, altura de planta, y densidad y grosor de tallos. Por último, el grupo V (G-V) integró a once poblaciones, originarias principalmente de los municipios de Chihuahua, Cuauhtémoc, Camargo y Aldama. Estas poblaciones se caracterizaron por presentar el mayor ancho y largo de hoja, características importantes en la calidad del forraje.
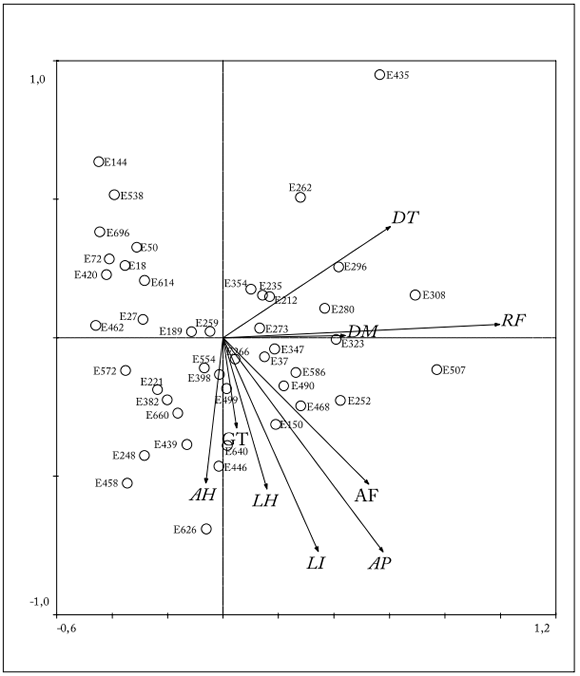
Fig. 2. Distribución de la diversidad morfológica de 44 poblaciones de zacate tempranero (Setaria macrostachya), en función de los dos primeros componentes principales, procedentes de diferentes zonas altitudinales del estado de Chihuahua, México.
Fig. 2. Distribution of morphological diversity of 44 populations of bristlegrass (Setaria macrostachya), based on the first two principal components, coming from different altitudinal zones of the state of Chihuahua, Mexico.
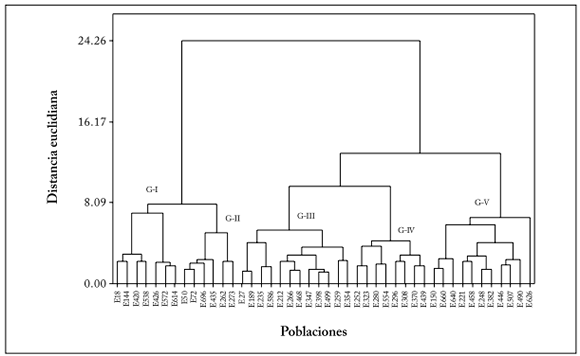
Fig. 3. Dendrograma del análisis de nueve variables morfológicas en 44 poblaciones de zacate tempranero (Setaria macrostachya), en base al método de ligamiento Ward, procedentes de diferentes zonas altitudinales del estado de Chihuahua, México.
Fig. 3. Dendrogram from the morphological analysis of nine variables in 44 populations of bristlegrass (Setaria macrostachya), based in the Ward linkage method, coming from different altitudinal zones of the state of Chihuahua, Mexico.
Caracterización molecular. El análisis de AFLP, con los cuatro pares de iniciadores, detectó 186 bandas; 87,09% (162 bandas) presentaron polimorfismo y 12,91% (24 bandas) monomorfsmo (Tabla 5). El número de bandas polimórficas fue de 44, 36, 40 y 42 para las combinaciones de iniciadores EcoRI-AAG+MseI-CTG, EcoRI-ACT+MseI-CTG, EcoRI-AGG+MseI-CAG y EcoRI-AAC+MseI-CAG, respectivamente. Los fragmentos monomórficos para estas mismas combinaciones fueron de 5 para EcoRI-AAG+MseI-CTG, 12 para EcoRI-ACT+MseI-CTG, 3 para EcoRI-AGG+MseI-CAG y 4 para EcoRI-AAC+MseI-CAG. El mayor porcentaje de polimorfismo (93,02%) y bandas polimórficas (40) se obtuvo con la combinación de iniciadores EcoRI-AGG+MseI-CAG. Los valores de similitud obtenidos al utilizar el coeficiente de Dice en las comparaciones apareadas de las 44 poblaciones del zacate tempranero, variaron entre 0,60 y 0,95 (Fig. 4). Considerando estos valores de similitud hasta 0,60, los resultados indican que existe bastante diversidad genética en esta especie como para iniciar programas de mejoramiento genético (Fig. 4).
Table 5. Nivel de polimorfismo detectado en ecotipos del zacate tempranero (Setaria macrostachya) para cada combinación de iniciadores, empleados en el análisis de AFLP.
Table 5. Polymorphism level detected in ecotypes of bristlegrass (Setaria macrostachya) for each combination of initiators used in the AFLP analysis.
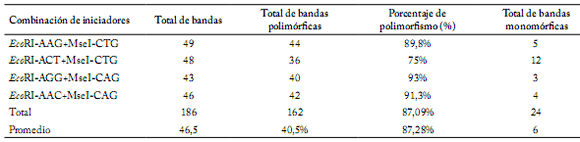
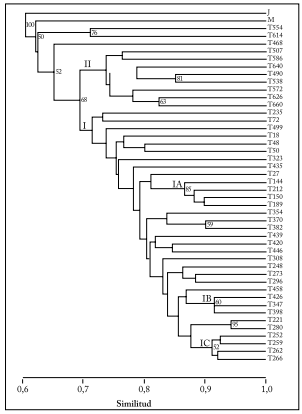
Fig. 4. Análisis de agrupamiento de 44 poblaciones del zacate tempranero (Setaria macrostachya) mediante el coeficiente de Dice, utilizando como método de agrupamiento-UPGMA, sobre la base de 186 marcadores AFLP, generados con cuatro combinaciones de iniciadores, procedentes de diferentes zonas altitudinales del estado de Chihuahua, México.
Fig. 4. Cluster analysis of 44 populations of bristlegrass (Setaria macrostachya) using the Dice coefficient, by using as-UPGMA clustering method, on the basis of 186 AFLP markers generated with four primer combinations coming from different altitudinal areas of the state of Chihuahua, Mexico.
El análisis de conglomerados, utilizando el coeficiente de Dice, separó dos grupos. El grupo I incluyó la mayoría de las poblaciones analizadas (33) y el grupo II integró 8 poblaciones. Las poblaciones 554 y 614, originarias del municipio de Ojinaga, y la población 468 (originaria de Saucillo) salieron fuera de los grupos y fueron morfológicamente muy distintos. Los principales subgrupos del grupo I fueron: en el subgrupo I-A se detectaron las poblaciones 212, 150 y 189 (85%), originarias del municipio de Chihuahua y Cuauhtémoc, caracterizadas por una mayor altura de forraje y planta. Además, integró a las poblaciones 370 y 382 (59%), originarias de Flores Magón con diferencias morfológicas no definidas. En el subgrupo I-B se identificaron a las poblaciones 426, 347 y 398 (60%), procedentes de los municipios de Chihuahua y Buenaventura con diferencias morfológicas no definidas. Por último, el subgrupo I-C integró a las poblaciones 252, 259, 262 y 266 (52%), originarias de Villa Ahumada y Juárez, con buenas características de rendimiento de forraje, altura de forraje y densidad de tallos. Las poblaciones 490 y 538 (81%), y 626 y 660 (63%), presentaron caracteres morfológicos contrastantes: (1) la población 490 originaria del municipio de Chihuahua presentó mayor altura de forraje (40 cm) y altos rendimientos de forraje, mientras que la población 538 originaria del municipio de Coyame, mostró bajos rendimientos de forraje, y (2) la población 626 originaria del municipio de Chihuahua, mostró mayor altura de forraje y ancho de hoja, características que en la población 660 fueron muy bajas.
DISCUSIÓN
La colección ex situ de zacate tempranero presentó una amplia diversidad morfológica, debido probablemente a las condiciones ambientales de los sitios de origen (Morales et al., 2009). Por esta razón, estos ecotipos tienen características importantes para ser utilizados en la restauración de ecosistemas pastoriles.
A partir de las correlaciones obtenidas se pueden seleccionar ecotipos considerando el potencial que tiene esta especie para la protección y estabilidad del suelo. Estas correlaciones y varianzas observadas, son congruentes con las obtenidas por Ayana y Bekele (1999) al evaluar caracteres cuantitativos de 415 accesiones de sorgo (Sorghum bicolor L. Moench). Estos autores reportaron que los primeros cinco CP explicaron el 79% de la varianza total. Además, se han realizado otros estudios en zacates del género Lolium (Bennett et al., 2000), Sorghum (Grenier et al., 2004), Panicum (Casler, 2005), Bromus (Ferdinandez y Coulman, 2004) y Bouteloua (Morales et al., 2009). Estos estudios concluyen que la evaluación de la variabilidad morfológica constituye la base para seleccionar material para diversos usos: (1) rehabilitación o restauración ecológica; (2) producción forrajera; (3) materiales con potencial para retener suelo, (4) ecotipos resistentes a sequía, entre otros propósitos.
La amplitud de la diversidad morfológica observada en función de las variables que más contribuyeron (densidad de tallos, rendimiento de forraje y altura de planta), refleja la variación morfológica existente en esta especie (Tabla 3). Además, se observa que la dispersión no fue aleatoria, ya que se pudieron establecer grupos en base a sus áreas de adaptación climática o entidades de origen (Figs. 2 y 3). Con esta variación, se puede establecer un banco de germoplasma para conservar y evaluar dicha variación en programas de mejoramiento genético, y disponer de ecotipos mejorados con potencial para su uso en programas de rehabilitación de pastizales.
Respecto al análisis molecular, los resultados en el número de bandas obtenidos son congruentes con otras investigaciones realizadas, en relación a la eficiencia para utilizar esta técnica para generar buen número de polimorfismo (Valdés-Infante, 2009). Para estudios futuros de variabilidad genética en poblaciones del zacate tempranero, se recomienda utilizar la combinación EcoRI-AGG+MseI-CAG, ya que detectó la mayor variabilidad. También, estos resultados son congruentes con los realizados en Agrostis stolonifera, donde obtuvieron de 100 a 150 bandas con 22 a 94 bandas polimórficas (Vergara y Bughrara, 2004). Sin embargo, en Schizachyrium scoparium reportaron 854 y 653 fragmentos en tallo (18,5%) y semilla (24,2%) con 158 bandas polimórficas (Fu et al., 2004). Los mayores valores de similitud se presentaron en las poblaciones 221 y 280 (95%). Estas poblaciones con similitudes genéticas, son originarias de los municipios de Chihuahua y Janos y son las más cercanas genéticamente, según puede observarse en la figura 4 y por el valor de similitud entre ellas. Los rangos obtenidos en el coeficiente de similitud de las poblaciones de zacate tempranero son congruentes con los reportados en especies del género Festuca spp. (Mian et al., 2002) y en Cynodon transvaalensis (Wu et al., 2005). Estos resultados son congruentes con relación a la efectividad del uso de la técnica AFLP para estudios de diversidad genética en pastos (Roldán-Ruiz et al., 2000). Además, se pudo demostrar que esta técnica facilita valoraciones rápidas y eficientes de la diversidad genética en este tipo de poblaciones nativas (Hammer, 2003).
Considerando las variables morfológicas y genéticas evaluadas, las poblaciones que presentaron el mayor potencial de producción de forraje fueron la 507 (187,5 g/planta) y la 308 (170 g/planta), originarias de los municipios de Aldama y Nuevo Casa Grandes, respectivamente.
CONCLUSIONES
En base a las características morfológicas, la evaluación ex situ detectó poblaciones con potencial para utilizarse con diversos propósitos: forraje, producción de semilla, fijación del suelo o control de erosión, por mencionar algunos. Las poblaciones 252, 308 y 323, originarias de los municipios de Villa Ahumada, Nuevo Casas Grandes y Nuevo Casas Grandes, respectivamente, presentaron el mayor potencial para producción de forraje y uso en programas de rehabilitación de pastizales. Esta colección ex situ representa una oportunidad para continuar evaluando poblaciones a largo plazo en la selección de otras características como resistencia a sequía y adaptación al cambio climático.
Existió una amplia variabilidad en polimorfismo en las diferentes poblaciones de acuerdo al uso de marcadores AFLP. El uso de estos marcadores permitió estructurar la variabilidad genética de las poblaciones, dado el alto polimorfismo detectado con la combinación de iniciadores EcoRI-AAC+MseI-CAG. Estos elevados niveles de variación genética representan un recurso genético valioso para iniciar (1) programas de mejoramiento genético, (2) programas de conservación y restauración. Las poblaciones con alto potencial forrajero, basados en variabilidad genética, fueron las 308, 507 y 435, que pueden ser incluidas en programas de mejoramiento genéticos.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología (CONACyT) y al Fondo Mixto CONACYT-Gobierno del estado de Chihuahua por el apoyo financiero (clave del proyecto: CHIH-2005-C01-23250).
REFERENCIAS
1. Ayana, A. y E. Bekele (1999). Multivariate analysis of morphological variation in Sorghum [Sorghum bicolor (L.) Moench] germplasm from Ethiopia and Eritrea. Genetics Resources and Crop Evolutions 46: 273-284. [ Links ]
2. Báez, A.D., J.G. Reyes, A. Melgoza, M.H. Royo y R. Carrillo (1999). Características productivas del sistema vaca-cría en el estado de Chihuahua. Técnica Pecuaria de México 37: 11-24. [ Links ]
3. Bennett, S.J., M.D. Hayward y D.F. Marshall (2000). Morphological differentiation in four species of the genus Lolium. Genetics Resources and Crop Evolutions 47: 247-255. [ Links ]
4. Casler, M.D. (2005). Ecotypic variation among switchgrass populations from the Northern USA. Crop Science 45: 388-398. [ Links ]
5. Chávez, A. y F. González (2008). Estudios zootécnicos I (animales en pastoreo). En: A. Chávez (ed.). Rancho Experimental la Campana 50 años de investigación y transferencia de tecnología en pastizales y producción animal. Libro Técnico No. 2. Sitio Experimental La Campana-Madera. Centro de Investigación Regional Norte-Centro. INIFAP. Chihuahua, Chih. 213 pp. [ Links ]
6. Decker, J. (2003). Evolutionary biology of the foxtail (Setaria) species-group. En: Inderjit (Ed.) Weed Biology and Management. Kluwer. Ámsterdam, Holanda. pp. 65-114. [ Links ]
7. Doyle, J.J. y J.L. Doyle (1990). A rapid total DNA preparation procedure for fresh plant tissue. Focus 12: 13-15. [ Links ]
8. Erickson, V.J., N.L. Mandel y F.C. Sorensen (2004). "Landscape patterns of phenotypic variation and population structuring in a selfing grass, Elymus glaucus (blue wildrye)". Canadian Journal of Botany 82: 1776-1790. [ Links ]
9. Ferdinandez, Y.S.N. y B.E. Coulman (2004). Genetic relationships among smooth bromegrass cultivars of different ecotypes detected by AFLP markers. Crop Science 44: 241-247. [ Links ]
10. Fu, Y.B., Y.S.N. Ferdinandez, A.T. Phan, B.E. Coulman y K.W. Richards (2004). Genetic diversity in natural populations and corresponding seed collections of little bluestem as revealed by AFLP markers. Crop Science 44: 2254-2260. [ Links ]
11. Gauthier, D.A., A. Lafon, T.P. Toombs, J. Hoth y E. Wiken (2003). Grasslands toward a North American conservation strategy. Canadian Plains Research Center. University of Regina. Commission for Environment Cooperation. Montreal, Canada. 99 p. [ Links ]
12. Grenier, C., P.J. Bramel, J.A. Dahlberg, A.E. Ahmadi, M. Mahmoud, G.C. Peterson, D.T. Rosenow y G. Ejeta (2004). Sorghums of the Sudan: analysis of regional diversity and distribution. Genetics Resources and Crop Evolution. 51: 489-500. [ Links ]
13. Hammer, K. (2003). A paradigm shift in the discipline of plant genetic resourses. Genetics Resources and Crop Evolutions 43: 337-341. [ Links ]
14. Hoisington, D., M. Khairallah y D. González de-León (1998). Laboratory Protocols: CIMMYT Applied Molecular Genetics Laboratory. Second edition. México, D. F. CIMMYT. 72 p. [ Links ]
15. Holecheck, J.L., R.D. Pieper y C.H. Herbel (1989). Range management principles and practices. Regents Prentice-Hall, Inc. New Jerzy, EUA. 501 p. [ Links ]
16. Kölliker, R., B. Boller, M. Majidi, K. Madlaina, Peter-Schmid, S. Bassin y F. Widmer (2009). Characterization and utilization of genetic resources for improvement and management of grassland species. Molecular Breeding of Forage and Turf. pp 55-70. [ Links ]
17. Lebgue, K.T. (2002). Gramíneas de Chihuahua. Manual de identificación. 3ª edición. Textos Universitarios. Universidad Autónoma de Chihuahua. 336 p. [ Links ]
18. Loos, B.P. (1994). Morphological variation in Dutch perennial ryegrass (Lolium perenne L.) populations, in relation to environmental factors. Euphytica 74: 97-107. [ Links ]
19. Melgoza, A., C.R. Morales, J.S. Sierra, M.H. Royo, G. Quintana y T. Lebgue (2008). Manual práctico para la identificación de las principales plantas en los agostaderos de Chihuahua. Segunda edición Unión Ganadera Regional de Chihuahua-Fundación PRODUCE Chihuahua. 214 p. [ Links ]
20. Meudt, H.M. y A.C. Clarke (2006). Almost forgotten or latest practice? AFLP applications, analyses and advances. Trends Plant Science 12:1360-1385. [ Links ]
21. Mian, M.A., A. Hopkins y J. Zwonitzer (2002). Determination of genetic diversity in Tall Fescue with AFLP markers. Crop Science 42: 944-950. [ Links ]
22. Morales, N.C. (2006). Caracterización morfológica, citológica y molecular de recursos genéticos de Bouteloua cutipendula. Tesis Doctorado en Ciencias. Colegio de Posgraduados, Instituto de Enseñanza e Investigación en Ciencias Agrícolas, Campus Montecillo. Montecillo, Texcoco, Estado de México. [ Links ]
23. Morales, N.C., A.R. Quero, A. Melgoza, M. Martínezy P. Jurado (2009). Diversidad forrajera del pasto banderita [Bouteloua curtipendula (Michx.) Torr.], en poblaciones de zonas áridas y semiáridas de México. Técnica Pecuaria de México 47: 231-244. [ Links ]
24. Morales, N.C.R. (2009). Metodología para la recolecta y conservación de germoplasma de plantas forrajeras en la zonas áridas y semiáridas de México. Folleto Técnico No. 21. S.E. Campana-Madera. INIFAP-SAGARPA. 21 p. [ Links ]
25. Nguyen, V.F. y J. Pernes (1985). Genetic diversity of foxtail millet (Setaria italica). En: P. Jacquard, G. Heim y J. Antonovics (Eds.), pp. 113-128. Genetic differentiation and dispersal in plants. Springer. Berlin, Alemania. [ Links ]
26. Pellant, M, P. Shaver, D.A. Pyke y J.E. Herrick (2005). Interpreting Indicators of Rangeland Health. Versión 3. Tech. Ref. 1734-6. USDI, Bureau of Land Management. Denver, CO. 122 p. [ Links ]
27. Pensiero, J.F., G.D. Marino y G.E. Schrauf (1995). Características reproductivas de Setaria lachnea (Nees) Kunth (Poaceae, Paniceae). Rev. Fac. Agron. Univ. Nac. Bs. Aires 15: 59-66. [ Links ]
28. Pensiero, J.F., H.F., Gutiérrez y E. Exner (2005). Sistema de polinización y su efecto sobre la producción y el peso de semillas en nueve especies sudamericanas del género Setaria. Interciencia: Revista de Ciencia y Tecnología de América 30: 495-500. [ Links ]
29. Peter-Schmid, M.K., R. Kèolliker y B. Boller (2008). Value of permanent grassland habitats as reservoirs of Festuca pratensis Huds and Lolium multiforum Lam. populations for breeding and conservation. Euphytica 164: 239-253. [ Links ]
30. Puecher, D.I., C.G. Robredo, R. Ríos y P. Rimieri (2001). Genetic variability measures among Bromus catharticus Vahl. Populations and cultivars with RAPD and AFLP markers. Euphytica 121: 229-236. [ Links ]
31. Ramirez, R. G., A.E. Martell y F. Lozano (2001). Nutritional value and ruminal degradability of buffel grass and nine native grasses from the NE of Mexico. Ciencia UANL 4: 314-321. [ Links ]
32. Renganayaki, K., J.C. Read y A.K. Fritz (2001). Genetic diversity among Texas bluegrass genotypes (Poa arachnifera Torr.) revealed by AFLP and RAPD markers. Teorical Applied Genetics 102: 1037-1045. [ Links ]
33. Roldán-Ruiz I., J. Dendauw, E. Van Bockstaele, A. Depicker y M. De Loose (2000). AFLP markers reveal high polymorphism rates in ryegrass (Lolium spp.). Molecular Breeding 6: 125-134. [ Links ]
34. Royo, M.M. y A. Lafón (2008). Descripción fisiográfica, diversidad vegetal y vertebrados del rancho experimental La Campana. En: A. Chávez y R. Carrillo (eds.). Rancho Experimental La Campana 50 Años de Investigación y Trasferencia de Tecnología en Pastizales y Producción Animal. INIFAP. Chihuahua, Chih. 213 p. [ Links ]
35. SEMARNAT (2011). Vegetación natural remanente. http://app1.semarnat.gob.mx/dgeia/clave_2010/clave/indicadores/ibi_apps/ind_clave_01.html. [ Links ]
36. Statistical Analysis System (SAS) (1999). Institute Inc. User's guide. Statistics. Version 8. Sixth edition. SAS Inc. Cary, North Carolina, USA. [ Links ]
37. Valdés, J.A., A. Beetle y M.H. González (1975). Gramíneas de Chihuahua. Boletín Pastizales 6: 1-60. [ Links ]
38. Valdés-Infante, J. (2009). Utilización de caracteres morfoagronómicos y de marcadores de ADN para el desarrollo de una metodología que contribuya al mejoramiento genético del guayabo (Psidium guajava L.) en Cuba. Tesis de Doctor en Ciencias Biológicas. Universidad de la Habana. La Habana, Cuba. 120 p. [ Links ]
39. Valerio, A, E. Carreon, A. Lafon, J.M. Ochoa, P. Calderon, D.M. Soto, C. Chacon y E. Favela (2005). Distribución, Extensión Espacial y Condición de los Pastizales en el Estado de Chihuahua. Protección de la Fauna Mexicana, A.C.-The Nature Conservancy. Chihuahua, Mexico. [ Links ]
40. Vergara, G.V. y S. Bughrara (2004). Genetic differentiation of tetraploid creeping bentgrass and hexaploid redtop bentgrass genotypes by AFLP and their use in turfgrass breeding. Crop Science 44: 884-890. [ Links ]
41. Vos, P., R. Hogers, M. Bleeker, M. Reijans, T. Van de Lee, M. Hornes, A. Frijters, J. Pot, J. Peleman, M. Kuiper y M. Zabeau (1995). AFLP: a new technique for DNA fingerprinting. Nucleic Acids Research 23: 4407-4414. [ Links ]
42. Weber, G.E., K. Moloney y F. Jeltsch (2000). Simulated long-term vegetation response to alternative stocking strategies in savanna rangelands. Plant Ecology 150: 77-96. [ Links ]
43. Wu, Y.Q., C.M. Taliaferro, G.H. Bai y M.P. Anderson (2005). Genetic diversity of Cynodon transvaalensis Burtt-Davy and its relatedness to hexaploid C. dactylon (L.) Pers. as indicated by AFLP markers. Crop Sci 45: 848-853. [ Links ]














