Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciencia y Tecnología
versión On-line ISSN 1851-7587
Rev. cienc. tecnol. no.15 Posadas ene./jun. 2011
INGENIERÍA-TECNOLOGÍA-INFORMÁTICA
Microvinificación en blanco a 18ºc de uva isabella cultivada en misiones (ne argentina)
Winemaking at lab scale at 18ºc with isabella grapes grown in Misiones (ne argentina)
Jose Luis Herrera*, Juan Esteban Miño**
Maestría en Tecnología de Alimentos. Facultad de Ciencias Exactas Químicas y Naturales. Universidad Nacional de Misiones. Félix de Azara 1552. (3300) Posadas (Misiones-ARGENTINA). (minio@fiobera.unam.edu.ar; herrera@fecqyn.unam.edu.ar).
* Ingeniero Químico Facultad de Ciencias Exactas, Químicas y Naturales - Universidad Nacional de Misiones (1990). Dr. Ingeniero Químico - Universidad de Cantabria - Ministerio de Educación, Cultura y Deportes - España Reg. Nacional de Títulos (España) N° 2001-103549 (1999) - Profesor Adjunto Exclusiva (FCEQyN - UNaM) Categoría del programa de incentivos: Categoría II - jlherrera02@ gmail.com
** Ingeniero Químico Facultad de Ciencias Exactas, Químicas y Naturales - Universidad Nacional de Misiones (1986). Magister en Tecnología de Alimentos - Maestría en Tecnología de Alimentos - Facultad de Ciencias Exactas, Químicas y Naturales - Universidad Nacional de Misiones (2008). Jefe de Trabajos Prácticos Exclusiva (FI - UNaM) - Categoría del programa de incentivos: Categoría III minio@fio.unam.edu.ar
Resumen
No se ha investigado aun la microvinificación en blanco de uva Isabella tinto (Vitis Labrusca x Vitis vinífera?) cultivada en Misiones, ni tampoco las levaduras indígenas que contiene. El procedimiento enológico implicó el uso de Saccharomyces cerevisiae bayanus como referencia y cepas indígenas de levadura en fermentación espontánea a 18±1 ºC. Los procedimientos analíticos empleados fueron los aprobados por el Instituto Nacional de Vitivinicultura (INV - Argentina). Después de 15 días, la Actividad Fermentativa finalizó alcanzando el mismo valor para ambas cepas de levaduras (11,2 g de azúcar.día-1). El Poder Fermentativo fue más alto para S. bayanus (98,9 % v/v) que para las levaduras indígenas (89,8 % v/v), mientras que el rendimiento en alcohol fue de 17,1 y 18,8 g azúcar.ºAlcohol-1, respectivamente. Fue viable obtener vino blanco a partir de uva Isabella tinto y levaduras indígenas de las mismas bayas. Todos los vinos obtenidos cumplieron con los requisitos del Instituto Nacional de Vitivinicultura para consumo humano o añejamiento.
Palabras clave: Vinificación; Uva Isabella tinto; S. bayanus; Levaduras indígenas; Viabilidad.
Abstract
No research has been found on white winemaking from red Isabella (VitisLabrusca x Vitis vinífera?) grape at laboratory scale grown in Misiones Province. Likewise, there are no studies on the indigenous yeast contained in these grapes. The enological procedure involved the use of Saccharomyces cerevisiae bayanus as reference and indigenous yeast strains under spontaneous fermentation at 18±1 ºC. Analytical procedures approved by the National Institute of Vitiviniculture (INV - Argentina) were applied. After 15 days all Fermentative Activity was finished, having the same value for both yeast strains, (11,2 g sugar/ day). Fermentative Power was always higher for S. bayanus (98,9 % v/v) than indigenous yeasts (89,8 % v/v), while alcohol yield were 17,1 and 18,8 g initial sugar contentº/alcohol-1, respectively. White wine from Isabella red grape and indigenous yeast from the same grape were viably obtained and all wines obtained complied with the requeriments of the National Institute of Vitiviniculture for human consumption or maturing.
Key words: Winemaking; Isabella tinto grapes; S. bayanus; Indigenous yeast; Viability
Introduccion
Los vinos se obtienen por fermentación alcohólica de jugos de uva Vitis viníferas e involucran la conversión de glucosa y fructosa en etanol y dióxido de carbono. Esta actividad la llevan a cabo las levaduras del género Saccharomyces, por lo general S. cerevisiae y S. bayanus, por lo que los mohos y las bacterias aerobias no prosperan en el mosto (1).
A las levaduras vínicas se las encuentran en las uvas, los viñedos, los vinos sanos o enfermos y en las bodegas, presentan 18 géneros (omitiendo las más raras) (2). Los principales géneros de levaduras indígenas o espontáneas presentes en la uva son Kloechera, Metschnikowia, Hansenula, Candida y Hanseniaspora; pueden contaminarse con Brettanomyces y Saccharomyces en la bodega. (1) Los principales géneros de mohos hallados en los viñedos son: Aspergillus, Penicillium, Rhizopus y Mucor. Los mohos del género Botrytis pueden presentarse si los granos de uva se encuentran dañados. Pueden haber gran cantidad de bacterias aerobias y anaerobias facultativas bacilos lácticos y las bacterias acéticas en frutos sanos, pero en cantidades menores a las levaduras espontáneas eucarióticas. (3)
La persistencia de estas levaduras indígenas durante la fermentación depende de varios factores, tales como la temperatura, la disponibilidad de nutrientes, la cantidad de inóculo de Saccharomyces, agregado de dióxido de azufre y su tolerancia al alcohol. Proliferan en la corteza de la uva a medida que maduran, una uva sana puede presentar entre 1.103 a 1.106 individuos por baya. (4)
El éxito en la competencia por los nutrientes que se hallen en cantidades limitadas, es un factor que contribuye al predominio de una especie o género sobre otras en las fermentaciones con poblaciones mezcladas como el caso de la levaduras nativas. (5)
El etanol es el producto principal de la fermentación alcohólica, y puede alcanzar concentraciones extracelulares de hasta 14 % (v/v) de etanol en fermentación normal. La síntesis de 1 grado de etanol (1 % v/v) en fermentación alcohólica representa un consumo comprendido entre 16,5 y 17 g de azúcares reductores L-1 de mosto. (6)
La fermentación alcohólica en condiciones enológicas se efectúa de manera muy específica (anaerobiosis, alta concentración de azúcares, bajo valor de pH), este hecho explica el poco número de trabajos llevados a cabo en este ámbito. (4) No hay información científica respecto de la elaboración de vino blanco seco a partir de uva Isabella tinto cultivada en Misiones; ni del desempeño de las levaduras nativas espontáneas adheridas a esta. Por ello el presente trabajo tuvo como objetivo general elaborar vino blanco a 18±1ºC con uva Isabella tinto a escala laboratorio, utilizando inóculos de levaduras nativas contenidas en las uvas por un lado y cepas puras de S. bayanus por el otro (como referencia por su alta performance en elaboración de vino blanco a 18±1ºC). Los objetivos específicos fueron: a) evaluar la viabilidad del mosto de Isabella tinto para vinificación en blanco seco. b) determinar la Actividad, Poder y Rendimiento fermentativo de levaduras nativas respecto de levaduras vínicas especializadas. b) constatar la aptitud fisicoquímica. de los vinos obtenidos para el consumo humano.
Materiales y metodos
Uva: fue seleccionada (por estar bien adaptada al clima subtropical de Misiones) la uva Isabella tinto (Vitis labrusca x Vitis vinífera?). Código de variedad 951 INV.
Viñedo: fue seleccionado el viñedo ubicado en el lote 39-40 de Olegario V. Andrade (Misiones-Argentina), Registro Nº 103.647 (INV, Argentina). (7)
Cuando el viñedo llegó al tiempo de cosecha, se tomaron muestras de diferentes plantas, se almacenaron en bolsas plásticas y se transportaron refrigeradas al laboratorio de la Facultad de Ciencias Exactas Químicas y Naturales -UNaM- de la ciudad de Posadas (Misiones, Argentina).
Determinación del Peso y Volumen de las Bayas: se recolectaron 200 bayas sanas por muestra sin peciolo; previamente se lavaron y secaron con toalla de papel. El volumen se determinó por desplazamiento de líquido sumergiendo 200 bayas secas en una probeta graduada de 1.000 mL. Calculándose luego en volumen medio de las bayas. (8)
Se pesó con una balanza Marca Pocket, modelo TH 500; con capacidad 500±0,1 g y se calculó el peso promedio.
Cosecha: el grado de maduración de la uva se caracteriza principalmente por la cantidad de azúcar y concentración de los ácidos tartárico y málico en la baya debido a que los factores condicionantes del aumento de azúcares y disminución de los ácidos durante la maduración de las bayas, son independientes. Los indices más utilizados son:
. Indice de Cillis-Odifredi = ºBrix / (acidez total en g L-1 de ácido tartárico)
. Indice de Van Rooyen-Ellis-Du Plessi = ºBrix . pH Cuando las uvas Isabella tinto tuvieron la madurez adecuada se cosecharon. (8)
Rendimiento en Mosto de las Bayas: se prensó la uva manualmente y se filtró. Se midió el volumen de mosto extraído con probeta graduada de 1.000 mL. Esta medición permitió estimar el rendimiento, sobre la base del volumen de mosto obtenido por kg de uva y expresarlo en %. (8)
Determinaciones de Azúcares Reductores en g L-1: se midió por titulación con el método del Licor de Felhing- Causse-Bonnans. La glucosa y fructosa son capaces de reducir las soluciones de Cu, Hg o Bi, en medio fuertemente alcalino y en caliente. Tolerancia: para valores < 20 g L-1 es de ± 0,3 g L-1 y para valores > 20 g L-1 es de ± 10%. (9)
Determinaciones de Alcohol en (%) (v/v): se utilizó el método del Alcohómetro. El etanol separado de la muestra por destilación es medido con un alcoholímetro. Tolerancia: ± 0,3 % v/v. (9)
Determinaciones de Acidez Total en ácido tartárico en g L-1: se midió por titulación con NaOH y azul de bromotimol como indicador. Tolerancia ± 0,2 g L-1 (9)
Determinaciones de Acidez Volátil en ácido acético en g L-1: se eliminó el CO2 de la muestra y se midió por titulación del destilado con NaOH (indicador fenoftaleína). Tolerancia ± 0,2 g L-1 (9)
Determinaciones de pH: se midió el pH con una zonda conectada a un potenciómetro.(8)
Determinaciones del Recuento de Levaduras: la técnica utilizada fue la Cámara de Neubauer. Se colocaron unas gotas de la muestra en la Cámara (previa dilución con agua destilada). La Cámara tenía 16 áreas (de 16 mm2 y 1,6 mm3 c/u). Con ayuda del microscopio se seleccionaron 4 áreas de las 16. Cada área contenía a su vez 16 subáreas (de 1 mm2 y 0,1 mm3 c/u); se elegieron 5 subáreas. Se realizó el recuento de cada subárea elegida, se promedió el resultado y se calculó la cantidad de levaduras considerando la dilución inicial realizada. (8)
Determinaciones del Anhídrido Sulfuroso libre y total en mg L-1: se midió por titulación con el método de Rippert. El SO2 libre es oxidado por la acción del Iodo en medio ácido. El SO2 combinado con diversas sustancias es liberado por la acción del KOH para luego ser oxidado por el Iodo en medio ácido. Tolerancia: ± 35 mg L-1. (8)
Enzimas Pectolíticas:
Proveedor Lafazym CL . Origen: España
Ficha técnica: preparación enzimática (pectinasa) producida por fermentación inmersa de cepas seleccionadas de Aspergillus niger y de A. aculeatus no OGM. El soporte está constituido por maltodextrina (88%) y citrato de sodio E330 - E331 (0.6%). La preparación es un producto natural que no contiene conservantes añadidos.
Propiedades: Preparación enzimática concentrada y purificada (actividades secundarias controladas) destinada al desfangado de mostos y a la clarificación de vinos blancos o rosados. Permite reducir los tiempos de encubado y disminuye la turbidez y viscosidad.
Dosis: 1-2 g hL-1 (10-20 ppm)
Preparación del Mosto de una muestra: se prensaron manualmente 5 kg de uva. Con un colador de té se separaron los raspones, la piel y las pepitas de las bayas. Al mosto (jugo de pulpa prensada) se agregó 2 g hL-1 de enzimas pectolíticas y 3 g hL-1 de SO2 (solución de metabisulfito de potasio al 10%). Los envases se obturaron con válvula de agua y se dejaron decantar 24 horas para producir el desborre del mosto. La borra formada fue separada mediante ampolla de decantación. Se obtuvieron 2 L de mosto (sin borra) para cada ensayo. (8)
Preparación del pié de cuba con levaduras nativas (indígenas): se prensaron 2 kg de uva Isabella tinto con piel (sin escobajo) y se le adicionó 1 g hL-1 de fosfato de amonio (coadyuvante de fermentación alcohólica). Fermentó espontáneamente a 25±1 ºC durante 2 días; luego se tomó (sin piel) 3 % v/v del pie de cuba y se inoculó a 2 L de mosto Isabella preparado. La cantidad de levaduras al inicio de la fermentación era de 12.103 células nativas mL-1 mosto.
Levadura Enológica seleccionada: Saccharomyces cerevisiae (Variedad bayanus): Cepa de caraterísticas killer. Proveedor Anfiquímica S.L. Origen: España. Cepa Ficha técnica: OE_L_ESVR44. Rendimiento alcohólico 16,5 g L-1 por 1 % alc/vol. Temperatura de Fermentación: 12 a 35ºC. Poder alcoholígeno: 16% alc/vol. Características metabólicas: baja producción de (acetaldehído 30 mg L-1 ), de (acidez volátil 0,24 g L-1) y de espuma.
Inóculo de S. bayanus: Las levaduras se agregaron al mosto en dosis de 20 g hL-1 previamente hidratadas y reactivadas con agua destilada a 37±1 ºC durante 30 min. (8) La cantidad de levaduras al inicio de la fermentación era de 6.103 S. bayanus mL-1 mosto.
Temperatura de Fermentación: 18±1 es la adecuada para elaborar vinos blancos finos. (4)
Fermentación: se utilizaron envases permitidos de 2,5 L. Se inocularon con levaduras nativas 3 muestras y con S. bayanus otras 3. A cada fermentación se le adicionó 1 g hL-1 de fosfato de amonio (coadyuvante de fermentación alcohólica) (8). Los envases se mantuvieron obturados con válvula de agua para producir condiciones de anaerobiosis. Se iniciaron simultáneamente todas las fermentaciones en cámara isotérmica a 18±1 ºC (8). La vinificación finalizó el día 15 (su densidad se mantuvo constante 2 días consecutivos). A cada envase con vino se adicionaron 6 g hL-1 de SO2 (para favorecer el desborre, mantener la acidez, detener la fermentación maloláctica, evitar oxidaciones, inhibir desarrollo de bacterias y mohos, mejorar el color y aromas, inactivar la tirosinasa y lacasa) (8). Los vinos se guardaron en posición vertical a 0ºC en una cámara refrigerada durante tres semanas (para su clarificación por decantación de gomas, mucílagos, tartrato de Ca, bitartrato de K, levaduras y partículas vegetales); la borra formada fue separada. El vino se trasegó a botellas limpias y desinfectadas de 750 mL c/u (8). Se corrigió el SO2 libre llevándolo a 35 mg L-1 de vino (para su conservación) (9). Se obturaron los envases con corchos cilíndricos y se almacenaron 3 meses en posición horizontal a 0ºC (para estabilizarlos). Transcurrido este tiempo se analizaron los vinos obtenidos. (8)
Resultados y discusión
La tecnología de vinificación tradicional implica el uso de fermentos de levaduras indígenas obtenidas por fermentación espontánea. Esta práctica presenta dificultades en la definición de un producto estándar, puesto que no se ajusta a condiciones enológicas adecuadas, y la vinificación se desarrolla sin control de los parámetros indicadores de proceso. Las condiciones enológicas apropiadas para garantizar un producto que reúna condiciones de higiene y salubridad y que sea apto al consumo humano, requiere que se evalúe el comportamiento de levaduras indígenas respecto de S. bayanus en la fermentación de mostos de uva Isabella tinto (VitisLabrusca x Vitis vinífera?) a 18±1 ºC. En la Tabla 1 se presenta la ficha técnica de la uva y el mosto obtenido.
Tabla 1. Propiedades Fisicoquímicas de las uvas y mosto de Isabella tinto

Variación de la Densidad, ºBrix y pH
La densidad en los mostos está directamente relacionada con su riqueza en azúcar; en vinos también está relacionada y nos da información del grado de secado que ha alcanzado un vino en su proceso de fermentación. La diferencia de densidad entre el agua y el etanol permite conocer la composición en etanol de una mezcla hidroalcohólica, conociendo la densidad de esta última. (10)
En la Figura 1 se presentan los valores medios de las densidades registradas durante las microvinificaciones simultáneas de mostos de uva Isabella tinto en función del tiempo a 18±1 ºC realizadas por triplicado con inóculos de levaduras indígenas y por triplicado con inóculos de S. bayanus.
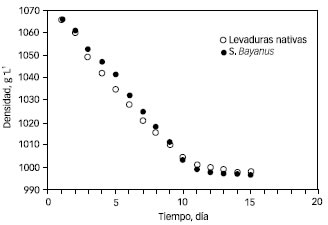
Figura 1. Densidad del mosto de uvas Isabella durante la vinificación a 18±1ºC
Los valores medios en ºBrix de las fermentaciones fueron al inicio 17,50 y al finalizar 7,50 en todas las vinificaciones, este hecho indicó que la fermentaron consumió la misma cantidad de azúcar en el mismo tiempo, a pesar de que el número de levaduras nativas inoculadas fue el doble respecto de las especializadas. Los valores medios de pH de uva Isabella tinto registrados durante las microvinificaciones isotérmicas a 18±1ºC presentaron un mínimo de 3,45 y un máximo de 3,73 para ambas inóculos; siendo los valores medios 3,62 para S. bayanus y 3,83 para las levaduras nativas. Los valores medios de finales de pH fueron menores a 4, lo que indicó fermentaciones en condiciones enológicas normales. (9)
Población de Levaduras
En la Figura 2 se presentan los valores medios de población de levaduras nativas y S. bayanus registrados durante las fermentaciones isotérmicas a 18±1 ºC en mostos de uva Isabella tinto.
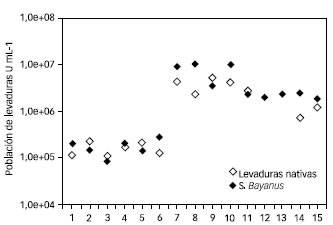
Figura 2. Población de levaduras durante la vinificación a 18±1 ºC de uva Isabella tinto
El comportamiento de S. bayanus fue el esperado, mientras que las levaduras indígenas obtenidas en fermentación espontánea e inoculadas siguieron un comportamiento similar, a pesar de que el número de levaduras nativas inoculadas fue el doble respecto de las especializadas: 6.103 y 12.103 células mL-1 respectivamente.
Los máximos de población de levaduras durante las fermentaciones fueron de 10-11 generaciones para las bayanus y de 8-9 generaciones para las nativas, respecto de sus generaciones iniciales iguales a 1; mientras que las medias de población final de levaduras fueron de 8-9 generaciones para las bayanus y 6-7 generaciones para las indígenas respecto de sus generaciones iniciales iguales a 1.
Las levaduras en su fase de crecimiento solo se multiplican durante 6 - 7 generaciones (entre 120-130.106 células mL-1) correspondientes a una inoculación inicial de alrededor de 1.106 células mL-1 (4).
Estos valores representaron la multiplicación de levaduras especializadas e indígenas y presentaron valores similares a los reportados en la bibliografía para mostos de Vitis vinífera puras. El número de generaciones es menor en mostos de Vitis vinífera a causa de haberse inoculado un número mayor de levaduras, para iniciar las fermentaciones. (11)
La Actividad, Poder y Rendimiento Fermentativo en condiciones enológicas
La Actividad, Poder y Rendimiento Fermentativo se utilizaron como medidas del desempeño de las levaduras nativas en estudio respecto de cepas puras de levaduras vínicas especializadas.
La Actividad Fermentativa (AF) se calculó haciendo el cociente entre los g azúcar fermentado y el tiempo que duró la fermentación. La AF calculada fue la misma tanto para levaduras nativas y como para S. bayanus 11,2 g azúcar fermentado/día. Aunque el inóculo de levaduras nativas fue el doble en cantidad de células respecto de S. bayanus, estas últimas procesaron la misma cantidad de azúcar al cabo de 15 días.
El Poder Fermentativo (PF) se calculó como la cantidad de etanol obtenido respecto del teórico esperado al final de la fermentación. Ver Ecuación 1.
![]()
En la Tabla 2 se presentan los valores medios del PF medioy el RF medio en mostos de uva Isabella tinto fermentados a 18±1 ºC con levaduras nativas por un lado y con cepas puras de S. bayanus por el otro.
Tabla 2. PF y RF de levaduras nativas y S. bayanus en mostos de uva Isabella tinto


El PF de las levaduras especializadas fue del 98,9 % v/v y las nativas de 89,9 % v/v.
La uva Isabella tinto (Vitis Labrusca x vitis vinífera?) presentó un tenor mas bajo de azúcares fermentables que las Vitis viníferas puras, por este motivo la graduación alcohólica obtenida no superó el 10 % v/v.
Probablemente la diferencia del PF a favor de las levaduras especializadas se deba a que las nativas son una mezcla cepas con diferentes PF entre si lo que haría bajar su promedio.
El Rendimiento Fermentativo (RF) se calculó haciendo el cociente entre la cantidad de azúcar inicial y el alcohol obtenido al finalizar la fermentación. El máximo valor teórico del RF en este caso fué de 16,97 g azúcar inicial / ºAlcohol final.
El RF de las S. bayanus fue de 17,14 y de 18,87 el de las nativas, ambas medidas en g azúcar/ºAlc. final; este dato confirma el uso ineficiente del azúcar disponible por parte de la levaduras nativas ya que ambas procesan la misma cantidad de azúcar inicial y llegan a la misma cantidad de azúcar final al cabo del mismo tiempo 15 días pero las especializadas obtuvieron mayor cantidad de etanol respecto de las nativas. Otras características observadas fueron menores pérdidas por borra en el mosto fermentado con S. bayanus respecto de las levaduras nativas. La producción de borra durante la fermentación puede dar lugar a alteraciones de olor y sabor desagradable del vino terminado así como también puede favorecer alteraciones patógenas. Por ello es importante que las levaduras produzcan la menor cantidad de borra posible (12).
Aptitud fisicoquímica de los vinos obtenidos para el consumo humano
La Acidez Total y Volátil
En la tabla 3 se presentan los valores medios de pH, acidez total y volátil, SO2 libre y total medidos en los vinos blancos obtenidos a partir de mostos de uva Isabella tinto (Vitis Labrusca x Vitis vinífera?). Estos valores se contrastan con las exigencias del INV para vinos blancos secos.
Tabla 3. Valores medios del pH Acidez total y volátil; SO2 total y libre

El pH medio alcanzado con inóculos de nativas y S. bayanus fueron 3,57 y 3,56 respectivamente, cumpliendo con el límite legal de 4 establecido por el INV.
La acidez total media alcanzadó con inóculos de nativas y S. bayanus fueron 6,97 y 6,52 respectivamente. Estos valores se encuentran entre 4 y 8 g L-1 expresados en ácido tartárico sugeridos por la práctica enológica.
La acidez volátil media alcanzó igual valor con inóculos de nativas y S. bayanus 0,98 expresados en ácidos acético, el mismo se encuentra por debajo de 1 g ácido L-1 por lo que se ajusta a las exigencias del INV y al Código Alimentario Argentino.
De lograr valores de pH más cercanos a 3 se obtendrían vinos con sabor más fresco y más estables. La práctica demuestra que los vinos de Isabella tinto con 9-10 % v/v de alcohol, a su pH y acidez normal, son estables al menos dentro del año de elaboración. Los vinos obtenidos pueden registrarse como vinos regionales de mesa para su comercialización dentro del país. (9) y (13).
Conclusiones
Cuando se realizaron las microvinificaciones a 18±1ºC con mostos de uva Isabella tinto (Vitis Labrusca x Vitis vinífera?) con inóculos de levaduras nativas por un lado e inóculos de S. bayanus puras por el otro, se observó que las fermentaciones se desarrollaron de manera continua (sin paradas) por 15 días.
Esto permitió establecer que la uva Isabella tinto cultivada en Misiones es una variedad apta para elaborar vinos blancos regionales; debido a que con inóculos de levaduras vínicas especializadas Sacharomyces cerevisiae bayanus a partir de 168 g azúcar inicial L-1 mosto desarrolla fermentaciones alcohólicas en condiciones enológicas normales y continuas (sin paradas), utilizando fosfato de amonio (coadyuvante) evolucionando hasta concentraciones menores a 1 g azúcar final L-1 mosto.
Aunque la ventaja comparativa fue mejor para las levaduras especializadas respecto de las nativas desde el punto de vista del poder fermentativo (98,9 y 89,9 % v/v) respectivamente y del rendimiento fermentativo (17,14 y 18,87) respectivamente, la actividad fermentativa se mantuvo igual a 11,2 g azúcar fermentado/día para especializadas y nativas.
Además como todos los vinos obtenidos fueron aptos para consumo humano desde el punto de vista fisicoquímico, según lo establecido por las Normas del INV (Argentina) se concluyó que las levaduras nativas fueron viables para la elaboración de vinos blancos regionales a partir de uva Isabella tinto a 18±1ºC cultivada en Misiones.
Por ello deberían profundizarse los estudios sobre las levaduras indígenas encontradas en Misiones, en búsqueda de cepas con potencial enológico.
1. Boulton R.B.; Singleton V.L.; Bisson L.F.; Kunkee R.E. Principles and Practices of Winemaking, Ed Acribia S.A., Zaragoza. p. 109-129. 2002. [ Links ]
2. Kunkee R.E.; Bisson L.F. Winemaking yeasts en The Yeasts 2nd ed.,Vol.5, Eds. Rose and Harrison, London Academic Press, England. p. 69-127. 1993. [ Links ]
3. Amerine M.A.; Berg H.W.; Kunkee R.E.; Ough C.S.; Singleton V.L.; Webb A.D. Technology of Winemaking, 4th ed., Westport, CT Avi Publishing Co. EE.UU. 1980. [ Links ]
4. Flanzy C. Enología Fundamentos Científicos y Tecnológicos. Ed. AMV y Mundi-Prensa, Madrid. 2003. [ Links ]
5. Bisson L.F.; Kunkee R.E. Microbial Interactions during Wine Production en Mixed Cultures in Biotechnology (Zeikus, J.G. and Johnson, E.A., Eds.), Ed. McGraw Hill., New York. p. 37- 68. 1993. [ Links ]
6. Dasari G.; Roddick F.; Connor M. A .; P amment N. B. Factors affecting the estimation of intracellular ethanol concentrations. Biothechnol Letters, 5(10): p. 715-720. 1983. [ Links ]
7. Piekun A. INTA: Proyecto frutal de desarrollo del área centro sur de la Provincia de Misiones, disponible en http://www.inta.gov.ar/cerroazul/actividad/pr_frut.htm (acceso Julio 2007). [ Links ]
8. Pszczólkowski, Ph.; Alemparte E.; Vallejo A. Manual Taller de Microvinificación 7ª Edición Corregida. Pontificia Universidad Católica de Chile, Departamento de Fruticultura y Enología. Colección de Docencia. p. 5-21. 2001. [ Links ]
9. Instituto Nacional de Vitivinicultura (INV ) Argentina, Normativas, www.inv.gov.ar/normativas.php (acceso Julio 2009). [ Links ]
10. Pardo González J.E. El Sistema de Análisis de Peligros y Puntos de Control Crítico (APPCC) en la Industria del Vino. Ed. AMV. Mundi Prensa. Madrid. p. 40-42. 2005. [ Links ]
11. Sa Correia I.; Uden, N. van. Ethanol-induced death of Saccharomyces cerevisiae at low and intermediate growth temperatures. Biotechnol Bioeng. 28(2): p. 301-303. 1986. [ Links ]
12. Blouin J.; Peynaud E. Enología Práctica: Conocimiento y Elaboración del Vino 4ta. edición. Ed. Mundiprensa. Madrid. p. 43-46. 2003. [ Links ]
13. Código Alimentario Argentino. Capitulo XVIII Bebidas Fermentadas. Art 1094 Ley Nac.18284/69 Links ] Helvetica, sans-serif">
Recibido: 05/05/10
Aprobado: 14/12/10














