Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciencia y Tecnología
versión On-line ISSN 1851-7587
Rev. cienc. tecnol. no.26 Posadas dic. 2016
SALUD
Obesidad y resistencia a la insulina como factores de riesgo en el cáncer de mama
Obesity and insulin resistance as risk factors in breast cancer
Carolina L. Zacharzewski1,*, Maria M. Tibolla1, Nora G. Marquez1, Bibiana Martin Talavera1, Carlos F. Insaurralde2, Carlos O Arce3, Maria A. Lorenzati1
1 Departamento de Bioquimica Clinica de la Facultad de Ciencias Exactas Quimicas y Naturales. Universidad Nacional de Misiones
2 Laboratorio de Analisis Clinicos de Alta Complejidad CEBAC SRL. Posadas. Misiones
3 Instituto GEMA de Ginecologia y Obstetricia. Posadas Misiones Facultad de Ciencias Exactas, Quimicas y Naturales - Universidad Nacional de Misiones. Laboratorio CEBAC SRL.
* E-mail: canelacz@gmail.com
Trabajo perteneciente al Programa Nacional de Incentivos a la Investigacion Docente, Argentina. Centro de Estudios Bioquimicos de Alta Complejidad CEBAC SRL, Posadas, Misiones, Argentina. Los autores no tienen conflictos de interes que declarar.
Resumen
Este trabajo tiene como proposito evaluar como incide la obesidad y resistencia a la insulina sobre el desarrollo del cancer de mama en mujeres menopausicas y no menopausicas. Se estudiaron 101 pacientes; 49 mujeres con cancer de mama, y 52 controles pareadas por edad. Se determinaron niveles de glucemia e insulina, HOMA y el Indice de masa corporal (IMC).El 67% de las pacientes con cancer se hallaba en etapa menopausica y el 33% restante, en etapa pre-menopausica o reproductiva. Las pacientes con cancer presentaron un valor de HOMA mayor (mediana= 2,26, RI= 1,29-4,46) que las pacientes sin cancer (mediana=1,76, RI= 1,37-2,43), con valor p=0,018.En las mujeres con cancer, 36,7% eran normopesas, 42,9% tenian sobrepeso y 20,4% eran obesas, observandose diferencia significativa respecto a la muestra control, y un IMC superior en las premenopausicas. El incremento del HOMA aumentaria un 33% el riesgo del CaM.
Palabras Clave: Cancer de Mama; Obesidad; Resistencia a la Insulina; HOMA; IMC.
Abstract
The aim of this paper is to evaluate how Obesity and Insulin Resistance affect the development of breast cancer in menopausal and no menopausal women. A total of 101 patients were studied; 49 women with breast cancer, and 52 controls matched by age. Glucose and insulin levels, HOMA and BMI (body mass index) were determined. The 67% of cancer patients was at menopausal stage and the remaining 33% in premenopausal or reproductive stage. The cancer patients had a higher HOMA value (median = 2,26, IR=1,29-4,46) than non-cancer patients (median = 1,76, IR= 1,37-2,43) with p-value 0,018. Among women with cancer, 36,7% were normal-weight, 42,9% were overweight and only 20,4% were obese, observing significant differences with regard to the control sample, and a higher BMI in premenopausal women. The HOMA increase, would raise breast cancer risk by a 33%.
Keywords: Breast Cancer; Obesity; Insulin Resistance; HOMA; BMI.
Introducción
El cáncer de mama (CaM) es una proliferación maligna de células epiteliales, que revisten los conductos o lobulillos de la mama (1), siendo este tipo de carcinoma la causa más común de mortalidad entre las mujeres alrededor del mundo. Si bien es una enfermedad hormono- dependiente, se deben considerar ciertos factores de riesgo, sean de tipo no modificables entre los que se encuentran: factores genéticos (antecedentes familiares directos), sexo femenino, edad mayor de 40 años, raza blanca, antecedentes de hiperplasia atípica de mama y factores hormonales (menarquia precoz, menopausia tardía, multigesta). Entre los factores modificables se encuentran la terapia hormonal sustitutiva, el uso prolongado de anticonceptivos, consumo de alcohol, obesidad y síndrome metabólico (SM). El SM –conocido también como síndrome plurimetabólico, síndrome de resistencia a la insulina o síndrome X- es una entidad clínica controvertida que se caracteriza por la presencia de insulino resistencia e hiperinsulinismo compensador asociados a trastornos del metabolismo hidrocarbonado, hipertensión arterial, alteraciones lipídicas (hipertrigliceridemia, descenso del HDL(High Density Lipoprotein) colesterol, aumento de LDL (Low Density Lipoprotein) colesterol, aumento de ácidos grasos libres y obesidad, con un incremento de la morbimortalidad de origen ateroesclerótico, aunque aún no se ha determinado con certeza el riesgo absoluto conferido por el síndrome metabólico en las diferentes poblaciones (2). La resistencia a la insulina (RI) se define como la incompetencia de una determinada concentración de insulina para conseguir el control de la glucosa, esto es cuando ante un nivel normal de la hormona se produce una menor respuesta biológica. Los tejidos que más presentan insulino resistencia son el músculo esquelético, el tejido adiposo, fundamentalmente el visceral, y el hígado. No todos los tejidos van a presentar insulino resistencia, por ello, resulta trascendente jerarquizar el concepto de hiperinsulinemia compensadora (HC). Es claro que, en su esfuerzo por mantener la normoglucemia, en la situación de insulino resistencia periférica, el páncreas aumenta su secreción de insulina para vencer esta resistencia e incorporar la glucosa al interior de la célula. Se genera entonces una hiperinsulinemia compensadora. La hiperinsulinemia compensadora va a sobreexpresar sus efectos sobre los tejidos que permanecen sensibles a la insulina. La hiperinsulinemia compensadora es la génesis de las múltiples alteraciones que presenta el síndrome de RI -HC. El tejido mamario es sensible a la acción de la insulina y va a resultar hiperestimulado en esta situación. Además la RI obliga a mantener unos niveles elevados de insulina en plasma (hiperinsulinismo), lo que somete a los tejidos a una inadecuada acción lipogénica. Se favorece de esta manera la obesidad abdominal y la producción hepática de triglicéridos, liberados como VLDL (Very Low Density Lipoprotein) hacia la sangre, por lo que se produce una dislipemia (hipertrigliceridemia, descenso de HDL colesterol y aumento de partículas de LDL pequeñas y densas). En una situación de RI-HC la producción de factores de crecimiento e inflamatorios podría activar la transformación del carcinoma mamario in situ, hacia la infiltración y expansión. La hiperestrogenemia también puede determinar esta transformación (3). La ganancia de grasa corporal, muy frecuente durante el climaterio puede favorecer ambas situaciones (4).
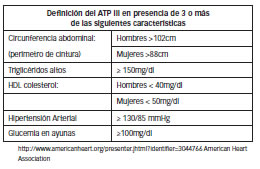
En cuanto al rol del síndrome metabólico, deben considerarse dos alteraciones metabólicas importantes, la resistencia a la acción de la insulina y la obesidad visceral o central, como así también la dislipemia asociada y se lo clasifica según el siguiente cuadro:
Figura Nº 1: Definicion del SM Criterios American Heart Association (2005). (ATPIII modificado)
El presente trabajo tiene como propósito evaluar como incide la obesidad y resistencia a la insulina sobre el desarrollo del cáncer de mama en mujeres menopáusicas y no menopáusicas.
Materiales y metodos
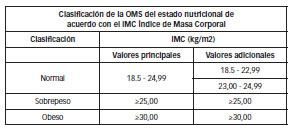
Se realizó un estudio de casos y controles pareados por grupos de edad (rango de apareamiento 5 años), de pacientes provenientes del ámbito de consultorios privados de la Provincia de Misiones, que dieron su consentimiento informado (según Declaración de Helsinki de la Asociación Médica Mundial – Principios Éticos para las Investigaciones Médicas en Seres Humanos). Las pacientes incluidas en el estudio, fueron aquellas diagnosticadas con CaM según clasificación propuesta por la OMS (5) (biopsia del tejido mamario post-cirugía), las cuales no habían recibido quimioterapia, radioterapia ni mastectomía antes de la toma de muestra y que aceptaron voluntariamente participar en el estudio. Se estudiaron en el término de 20 meses, comprendidos entre mayo del 2010 y diciembre del 2011, un total de 101 pacientes de las cuales, 49 mujeres fueron diagnosticadas con cáncer de mama, en diferentes estadios, y las 52 restantes fueron mujeres controles, sin CaM y con distribución etaria similar a las anteriores. Algunas de las pacientes evaluadas, estaban en edad reproductiva y otras menopáusicas (más de un año sin sangrado menstrual). Se dosaron los niveles de glucosa e insulina para el cálculo del índice HOMA, y se evaluó la obesidad mediante el IMC (índice de masa corporal), que es una medida de asociación entre el peso y la talla, utilizándose la Clasificación de la OMS del estado nutricional de acuerdo con el IMC Índice de Masa Corporal (peso/talla2) utilizándose la siguiente tabla para su clasificación (6)
Figura Nº 2: Clasificacion de la OMS (IMC)
El índice HOMA (homeostasis mode assessment), descripto por Turner y perfeccionado por Matthews, se emplea como medida de IR y simplifica el procedimiento matemático asumiendo una relación simple en el feedback glucosa – insulina (7,8)
HOMA = Insulina x glucemia (mg/dl) / 405
Las determinaciones se realizaron en muestras séricas (obtenidas en ayunas por punción venosa), analizadas dentro de las 2 hs de la extracción sanguínea. La glucemia se realizó mediante el método de la glucosa oxidasa, obteniendo una serie de productos (cromógenos) que luego fueron analizados mediante un equipo ARCHITECT. La insulina se determinó por inmunoanalisis en un paso, por el método de quimioluminiscencia de micropartículas utilizando el sistema ARCHITECT con protocolos de ensayos flexibles denominados CHEMIFLEX®. En todas las pacientes se midieron los niveles de TSH (hormona Tirotrofina u Hormona estimulante del tiroides), con el fin de excluir aquellas cuyos niveles fueran elevados y pudiera ser el hipotiroidismo la causa de la obesidad, actuando como una variable de confusión entre los factores que interesan analizar. La técnica empleada fue un inmuno-análisis-quimioluminiscente de micropartículas en 2 pasos (CMIA), con protocolo denominado Chemiflex – ARCHITECT ®.
En cuanto a las determinaciones que conforman el perfil lipídico, se utilizaron , para el colesterol metodología enzimática mediante el reactivo Abbot Clinical Chemistry Cholesterol (formula de Allain et al (9) modificado por Roeschlau (10)); los triglicéridos por la secuencia de reacción descrita por Fossati et al (11) y McGowan et al (12) con el uso de 4-clorofenol en lugar del original 2-H-3,5-diClbencenosulfonato, y el HDL con metodología detergente acelerador especifico y con el sistema ARCHITECT ® frente a AEROSET® igualmente que en los dos casos anteriores. Análisis estadístico Para el análisis estadístico se utilizó el programa Statgraphics Centurion, utilizándose gráficos descriptivos circulares, de barra y de distribución de cajas y bigotes. Se compararon grupos aplicando prueba de Chi cuadrado para datos cualitativos y Test de Mann Whitney para datos cuantitativos, ya que las variables no siguieron una distribución normal (Test de Shapiro Wilk). Los tamaños de muestra para cada comparación se especifican en las tablas de resultados. Se aplicó un modelo de regresión logística a efectos de estimar valores de razones de disparidad con niveles de confianza del 95 %.
Resultados
Se evaluaron un total de 101 pacientes, de las cuales 49 presentaban CaM al momento del estudio (Mediana= 55 años; Mínimo= 30, Máximo= 79) y 52 mujeres sanas con distribución etaria similar (Mediana= 52,5 años; Mínimo 31, Máximo= 81), p = 0,490.En las pacientes con CaM, un alto porcentaje se hallaba en etapa menopáusica (67,35%) y el 32,65% restante, en etapa premenopáusica o reproductiva, como se aprecia en el siguiente grafico
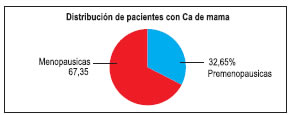
Figura Nº 3: Distribucion de pacientes con CaM
Mientras que en las controles, la proporción de pacientes en edad reproductiva fue de 38,5%, no hallándose diferencia significativa (p = 0,700) con el grupo de mujeres con CaM. En las pacientes con cáncer, un 36,7% tuvieron normopeso de acuerdo a su IMC, el resto estaba con sobrepeso (42,9%) o eran obesas (20,4%), mientras que en las pacientes sanas las proporciones fueron de 53,8%, 26,9% y 19,3% respectivamente.
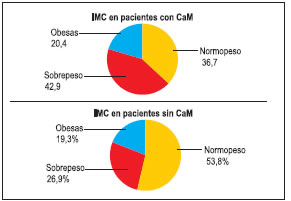
Figura Nº 4: IMC en pacientes con y sin CaM
Al comparar los valores del IMC en pacientes con y sin cáncer se hallaron diferencias significativas (p=0,039) entre ambos grupos, con una mediana de 25,8 y de 24,8 respectivamente, siendo los rangos intercuartilicos los que se observan en el grafico siguiente:

Figura Nº 5: Distribucion del IMC en pacientes con y sin CaM
Al discriminar entre pre-menopáusicas y menopáusicas, se hallaron diferencias significativas en el IMC de las primeras, no así en el otro grupo donde el valor p resultó no significativo, mostrándose en las tablas y gráficos los rangos intercuartilicos.
Tabla N° 1: IMC en pacientes con y sin CaM (Medianas y Rangos Intercuartilicos)
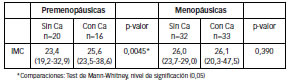

Figura Nº 6: IMC en pacientes premenopáusicas con y sin CaM
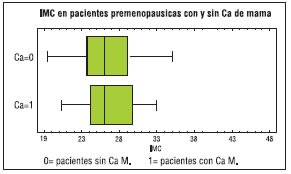
Figura Nº 7: IMC en pacientes menopáusicas con y sin CaM
Evaluación de la Resistencia a la Insulina: HOMA
Del análisis surgió que las pacientes con cáncer de mama (n=49) presentaron un valor de HOMA mayor (mediana= 2,26) que las pacientes sin cáncer (n= 52; mediana=1,76), resultando una diferencia significativa, con p = 0,018.

Figura Nº 8: Distribucion de los niveles de HOMA en pacientes con y sin CaM
Observándose en las pacientes con Ca de mama valores de HOMA extremos muy elevados (mayores a 10), mientras que en las sin Ca el máximo fue de 7,4. Con respecto al estado hormonal, pacientes premenopáusicas y menopáusicas, se hallaron para el índice HOMA diferencias significativas, entre las pacientes con y sin CaM, como se observa en la siguiente tabla y gráficos.
Tabla N° 2: HOMA en pacientes con y sin CaM (Medianas y Rangos Intercuartilicos)
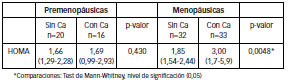
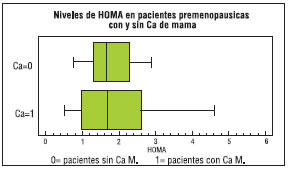
Figura Nº 9: Niveles de HOMA en pacientes premenopausicas con y sin CaM
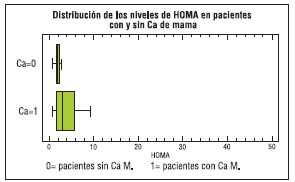
Figura Nº 10: Niveles de HOMA en pacientes menopausicas con y sin CaM
Finalmente, se ajustó un modelo de regresión logística considerando en forma simultánea a las variables independientes HOMA e IMC, resultando para los datos disponibles, significativo solo el valor de razón de disparidad del índice HOMA (RD: 1,33; IC 95%: 1,05 – 1,69).
Discusión
El tejido adiposo constituye un órgano endocrino y metabólicamente activo, estando asociado epidemiológicamente con una mayor incidencia a desarrollar tumores malignos (13). En el presente estudio se observó que las pacientes premenopáusicas con cáncer de mama presentaron mayor grado de obesidad (IMC significativamente más elevado) respecto a las pacientes menopáusicas sin carcinoma mamario. Nino Ferri y col., realizaron un estudio para investigar la asociación entre el cáncer de mama y el IMC en mujeres postmenopáusicas, no hallando al igual que nosotros, diferencias significativas para este factor de riesgo (14). Sin embargo Tehard B y col. tras analizar 860 mujeres postmenopáusicas con cáncer de mama, concluyeron que existe una asociación positiva entre la obesidad y el cáncer de mama, en este grupo (15). Estos últimos resultados contrastan con los obtenidos por nuestra investigación, probablemente por la importante diferencia en el tamaño de muestra y la composición de la población utilizada. El incremento en los niveles de insulina en pacientes no diabéticos se asocia independientemente con el desarrollo de cáncer de mama (16). Nuestros hallazgos coinciden con los de Lima y col (17), en el grupo etario de mujeres postmenopáusicas.
En la muestra estudiada nuestros hallazgos indican que la RI tiene un rol más importante como factor de riesgo a desarrollar cáncer de mama en mujeres menopáusicas que en las pacientes en etapa premenopáusicas, donde tienen mayor relevancia el sobrepeso y la obesidad, evidenciando que el estrógeno producido en el tejido adiposo (es decir la grasa corporal) de estas mujeres fomentaría la proliferación de células mamarias, siendo la obesidad desarrollada antes de la menopausia la que se prolongue por el resto de la vida y por consiguiente, con el tiempo presentar un mayor riesgo de cáncer de mama (18).
Sin embargo no podemos enunciar hallazgos concluyentes, ya que deberían llevarse adelante otros análisis de la relación entre las variables y los posibles factores de confusión o interacción para el desarrollo de cáncer de mama, para lo cual se requiere un mayor número de muestras.
Conclusión
El papel de los andrógenos en el cáncer de mama es confuso, y no está del todo claro si estos actúan como estimulantes o represores del crecimiento y la proliferación celular. Se sabe, que en la premenopausia los estrógenos no solo son producidos por el tejido adiposo, sino también por el ovario, por lo que ha de tenerse en cuenta, que el tejido adiposo no solo produce estrógenos que pueden fomentar la proliferación de las células mamarias, sino también una serie de adipoquinas que desempeñan un papel importante en la carcinogénesis mamaria (19,20,21).
Aunque la mayoría de los estudios respaldan la hipótesis de que los andrógenos podrían actuar contrarrestando el efecto mitogénico y promotor de los estrógenos sobre el tejido mamario, los resultados de los diferentes estudios (epidemiológicos y experimentales) son contradictorios. Sin embargo, se puede concluir que la IR constituye un factor de riesgo para el CaM, encontrándose que por cada unidad de aumento del HOMA, las mujeres se hallan 33% más expuestas a padecer cáncer de mama.
1. Lipman, M. Breast cancer. Harrison’s Principles of Internal Medicine. 15 ed.Nueva York NY: McGraw Hill Interamericana; 2001.
2. De Backer, G.; Ambrosioni, E.; Borch-Johnsen, K.; Brotons, C.; Cifkova, R.; Dallongeville, J., et al. European guidelines on cardiovascular disease prevention in clinical practice. Third Task Force of European and other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur Heart J. 2003;24(17):1601-10. [ Links ]
3. Nagata C, Shimizu H, Takami R, Hayashi M, Takeda N, Yasuda K. Relations of insulin resistance and serum concentrations of estradiol and sex hormone-binding globulin to potential breast cancer risk factors. Jpn J Cancer Res. 2000;91(9):948-53. [ Links ]
4. Jemstrom H, Barret-Connor E. Obesity, weight change, fasting insulin, proinsulin, C-peptide, and insulin-like growth factor-1 levels in women with and without breast cancer: the Rancho Bernardo Study. J Womens Health Gend Based Med. 1999; 8(10): 1265-72. [ Links ]
5. Tavassoli FA, Devilee P. (Eds.): World Health Organization Classification of Tumors. Pathology and Genetics of Tumors of the Breast and Female Genital Organs. IARC Press: Lyon 2003. [ Links ]
6. Organización Mundial de la Salud: Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies. Ginebra (Suiza): Organización Mundial de la Salud, 2004 [ Links ]
7. Turner R, Holman RR, Matthews D, Hockaday TR, Peto J. Insulin deficiency and insulin resistance interaction in diabetes: estimation of their relative contribution by feedback analysis from basal plasma insulin and glucose concentrations. Metabolism.1979; 28:1086-96. [ Links ]
8. Wallace TA, Levy JC, Matthews DR. Use y abuse of HOMA modeling. Diabetes care. 2004; 27:1487-95. [ Links ]
9. Allain CC, Poon LS, Chan CS, Richmond W, Fu PC. Enzymatic determination of total serum cholesterol. Clin Chem. 1974;20(4):470-5. [ Links ]
10. Roeschlau P, Bernt E, Gruber WA. Enzymatic determination of total cholesterol in serum. Z KlinChem Kin Biochem 1974; 12:226. [ Links ]
11. Fossati P,Prencipe L. Serum tryglicerides determined colorimetrically with an enzyme that produces hydrogen peroxide. ClinChem 1982;28:2077-80. [ Links ]
12. Mcgowan MW, Artiss JD, Strandbergh DR.A peroxidasecoupled method for de colorimetric determination of serum triglycerides. ClinChem 1983; 29:538-42. [ Links ]
13. Soto Monge T, Lagos Sánchez E. Obesidad y Cáncer: un enfoque epidemiológico. (Revisión Bibliográfica). Rev. Medica de Costa Rica y Centroamérica LXVI 2009; 587: 27-32. [ Links ]
14. Ferri N, Ferri FA, Brunicardi RH, Franco AF, Franco AL. Cáncer de Mama e Índice de Masa Corporal em mujeres postmenopáusicas. Rev.Venez. Oncol. 2010; 22(2):94- 102. [ Links ]
15. Tehard B, Clavel-Chapelon F. Several anthropometric measurements and breast cancer risk: results of the E3N cohort study. Int.J. Obes. 2006; 30(1): 156-163. [ Links ]
16. Goodwin PJ, Ennis M, Pritchard KI, Trudeau ME, Koo J, Madarnas Y, et al. Fasting insulin and outcome in early-stage breast cancer: Results of a prospective cohort study. J Clin Oncol. 2002; 20:42-51. [ Links ]
17. Lima MM, Velásquez E, Unshelm G, Torres C, Rosa F, Lanza P. Asociación de la insulina y el factor de crecimiento semejante a la insulina tipo 1 (IGF-1) en el cáncer de mama. Gac Méd Caracas 2009; 117(3): 226-231. [ Links ]
18. Chlebowski RT, Aiello E, McTiernan A. Weight loss in Breast Cancer Patient Management. J Clin Oncol. 2002; 20(4): 1128-1143. [ Links ]
19. Mantzoros C, Petridou E, Dessypris N, Chavelas C, Dalamaga M, Alexe DM, et al. Adiponectin and breast cancer risk. J Clin Endocrinol Metab 2004; 89: 1102-7. [ Links ]
20. Miyoshi Y, Funahashi T, Kihara S, Taguchi T, Tamaki Y, Matsuzawa Y, et al. Association of serum adiponectin levels with breast cancer risk. Clin Cancer Res 2003; 9:5699-704. [ Links ]
21. Cust AE, Kaaks R, Friedenreich. Plasma adiponectin levels and endometrial cancer risk in pre- and postmenopausal women. J Clin Endocrinol Metab 2007; 92: 255-63. [ Links ]
Recibido: 03/03/15
Aprobado: 18/12/15














