Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciencia y Tecnología
versión On-line ISSN 1851-7587
Rev. cienc. tecnol. no.26 supl.1 Posadas dic. 2016
INGENIERÍA, TECNOLOGÍA E INFORMÁTICA
Produccion de bioetanol a partir de cultivos contaminados: una alternativa para salvar las cosechas dañadas
Bioethanol production from contaminated crops: an alternative for saving damaged Harvests
Maria A. Sosa1, Jose Espinosa2, Juan C. Basilico3
1 Instituto Biotecnologia de Misiones (INBIOMIS). Facultad de Ciencias Exactas, Quimicas y Naturales, Universidad Nacional de Misiones (FCEQyN-UNaM). Ruta 12 km 7 y ½. (3300) Posadas, Misiones. Argentina. (angisosa@gmail.com)
2 INGAR-CONICET. Avellaneda 3657. (3000) Santa Fe, Santa Fe. Argentina. (destila@santafe-conicet.gov.ar)
3 Catedra de Microbiologia. Facultad de Ingenieria Quimica, Universidad Nacional del Litoral (FIQUNL). Santiago del Estero 2829.(3000) Santa Fe, Santa Fe. Argentina. (jcbasili@fiq.unl.edu.ar)
Resumen
El presente trabajo evalua la influencia presentada por el contenido de fumonisinas en maiz utilizado como materia prima para la produccion de bioetanol. Mediante experimentos de fermentacion a escala laboratorio, a partir de maiz con concentraciones crecientes de fumonisinas, se comparan tres parametros basicos del proceso de fermentacion (eficiencia, productividad y rendimiento) y se contrastan la concentracion final de etanol producido y el contenido inicial de almidon en la materia prima. Para valores de 0 y 1.400 ppm de fumonisinas en maiz, la concentracion promedio de etanol producido fue de 6,05% (p/p) y de 3,23% (p/p), respectivamente. Asi tambien, los tres parametros analizados disminuyeron al aumentar el nivel de contaminacion. Los resultados obtenidos demostraron que el maiz contaminado con fumonisinas puede ser utilizado como materia prima para la produccion de etanol en fermentaciones convencionales, siendo razonable utilizarlo hasta un nivel de contaminacion que no supere las 140 ppm de fumonisinas.
Palabras clave: Bio-etanol; Fermentacion; Maiz; Fumonisinas; Produccion.
Abstract
In this study, we evaluate the influence exerted by the presence of fumonisins in corn used as feedstock for the production of bioethanol. With fermentation experiments at laboratory scale, using corn with increasing concentrations of fumonisin as raw material, three basic parameters of the fermentation process (efficiency, productivity and performance) are compared and the final concentration of ethanol and initial starch content in the raw material are contrasted. For values of 0 and 1,400 ppm of fumonisins in corn, the average concentration of ethanol produced was 6.05% (w/w) and 3.23% (w/w), respectively. In addition, the three parameters analyzed decreased with increasing contamination level. The results showed that corn contaminated with fumonisin could be used as feedstock for ethanol production in conventional fermentation processes, being reasonable to use it up to a concentration not exceeding 140 ppm fumonisin.
Keywords: Bioethanol; Fermentation; Corn; Fumonisins; Production.
Introduccion
La energía en sus diferentes formas y aplicaciones, constituye un bien social y una necesidad permanente para el desarrollo del mismo. Su adecuado uso y maneras de obtención, constituyen un debate permanente que se replantea conforme evolucionan ciertos estándares de medición. Si bien el temor al agotamiento de una de las fuentes de energía principales como el petróleo parece revertirse al detectarse megareservas de este hidrocarburo, lejos están de resolverse los inconvenientes medioambientales generados por la quema de combustibles fósiles. Peor aún, el panorama se agrava [1, 2]. El incentivo al desarrollo de diferentes tipos de biocombustibles que puedan sustituir a aquellos combustibles se vislumbra hoy como la alternativa más lógica y socialmente más digna. Entre los diferentes biocombustibles descriptos, el etanol de obtención fermentativa ha sido reconocido como una importante alternativa a los combustibles fósiles para el transporte [3]. Como consecuencia de esto, se puede ver que la producción mundial de bioetanol para combustibles ha aumentado desde un valor cercano a los 14 millones de metros cúbicos en 2005 a más de 93 millones en el 2014 [4]. El bioetanol se puede producir a partir de diferentes tipos de materias primas, las que se subdividen en tres grupos principales de acuerdo a la forma en que se encuentran los azucares en su composición: azucaradas cuando las moléculas de azúcar están libres, amiláceas cuando se encuentran polimerizadas en almidón o lignocelulósicas cuando los azúcares se encuentran conformando celulosa y hemicelulosa. En este amplio conjunto de materias primas se destacan la caña de azúcar y el maíz, siendo este último, el material más utilizado para la producción industrial de bioetanol en Estados Unidos [5, 6]
El proceso productivo mediante el cual se obtiene bioetanol para combustibles a partir de maíz se denomina "de molienda seca" (Figura 1) y su nombre se debe a que no se agrega agua al triturar los granos de maíz. A través de este proceso, un "bushel" de maíz (25,4 kg al 10% de humedad) produce en promedio 10,2 litros de etanol, 8,2 kg de granos secos de destilería con solubles o DDGS (en inglés: "distiller’s dried grains with solubles") y 8,2 kg de CO2 [7]. La primera etapa de este proceso es la molienda del maíz y luego la etapa de hidrólisis enzimática del almidón incluye la gelatinización o cocción, la licuefacción y la sacarificación. Las etapas subsiguientes incluyen la concentración y purificación del etanol y el procesado de la vinaza, esto se logra convencionalmente mediante un tren de destilación que incluye una columna de destilación batch denominada comúnmente columna "beer" [8].
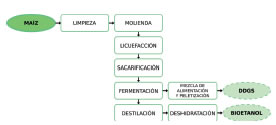
Figura 1: Diagrama de flujo esquematico del proceso de molienda en seco.
Los mayores costos de operación en el proceso de producción fermentativo del etanol son, en orden decreciente: la materia prima, la energía, las enzimas, los costos de procesamiento químico (tratamiento de agua, etc.) y la mano de obra [6]. Ahora bien, aunque las tecnologías de producción de este proceso están fuertemente consolidadas, el maíz resulta un sustrato cuestionable por su competencia para uso alimenticio. De esta manera, debido a que la producción de bioetanol presenta una fuerte dependencia con la materia prima [9,10,11], se plantea un problema de índole ético. Los cultivos de cereales, por su parte, pueden infectarse con hongos productores de micotoxinas ya sea antes de la cosecha o durante su almacenamiento. Los granos de maíz, en particular, están sujetos a la infección de una gran variedad de hongos toxicogénicos; entre los más comúnmente hallados se encuentran cepas de Aspergillus flavus, Fusarium verticillioides (antes llamado Fusarium moniliforme) y Fusarium proliferatum [12]. Los hongos del género Fusarium resultan de particular importancia ya que producen variadas y numerosas micotoxinas; las más importantes desde el punto de vista de la salud animal y la productividad de los cultivos son los tricotecenos, la zearalenona, la moniliformin y las fumonisinas B1, B2 y B3 [13]. Las fumonisinas son un grupo de al menos 15 micotoxinas estrechamente relacionadas cuya ocurrencia natural se reporta frecuentemente en el maíz, la más importante de ellas es la fumonisina B1. El riesgo que las fumonisinas representan para la salud humana y animal impulsó la "Food and Drug Administration" de los Estados Unidos a establecer un valor máximo de 2 ppm de fumonisinas en maíz y sus productos para el consumo humano [12].
Se ha reportado ocurrencia natural de fumonisinas (FB1, FB2 y FB3) en el maíz comercial y/o alimentos a base de maíz procedentes de Argentina, Australia, Brasil, Botswana, Bulgaria, Canadá, China, Egipto, Francia, Italia, Japón, Kenya, Hungría, Nepal, Perú, Sudáfrica, Suiza, Estados Unidos y Zimbabwe [13, 14, 15]. Estudios realizados durante el período de 2002 a 2004 por el Instituto Nacional de Tecnología Agropecuaria de Argentina (INTA), mostraron que la variabilidad en la concentración de fumonisinas en el maíz contaminado naturalmente varía entre 5,2 ppm hasta 154.4ppm [16]. La contaminación natural del maíz con hongos Fusarium depende principalmente de las condiciones ambientales que se presentan durante y después de la cosecha y, en consecuencia, se puede esperar que las concentraciones reportadas varíen en alto grado, no solo de país a país sino también de un año a otro. Chulze et al. [17] encontraron que la capacidad de producción de fumonisinas en maíz de aislamientos de Fusarium verticillioides recolectadas en Argentina, varía desde las 10 a las 3.990 ppm. Los valores presentados por Gallardo Reyes y col. [18] para aislamientos tomados en México del mismo hongo varían desde 500 a 4.893 ppm.
La contaminación con F. verticillioides produce cambios en el contenido nutricional del maíz y también, cuando la contaminación alcanza una etapa avanzada, el maíz es visiblemente más oscuro y presenta el típico aspecto putrefacto (Figura 2). Este maíz, que por lo general tiene una alta concentración de fumonisinas, no es aceptable para la alimentación humana o animal, por lo que representa una considerable pérdida de dinero para el agricultor. Sin embargo, una estrategia práctica para la salvar el valor de grano es la producción de etanol para combustibles [9, 19].

Figura 2: Fotografia tomada del maiz sano (izquierda) y luego de la contaminacion con Fusarium verticillioides (derecha).
Finalmente, debe tenerse en cuenta que aunque el maíz contaminado pueda presentar un gran valor potencial como materia prima para la producción de bioetanol, las micotoxinas podrían influir en los procesos metabólicos de la levadura Saccharomyces cerevisiae, debido a sus diversas propiedades tóxicas [20]. Kłosowski et al. [21] estudiaron la influencia debida a la presencia de fumonisinas en el maíz de partida de las fermentaciones alcohólicas (concentración de alcohol, productividad, rendimiento y energía), sin encontrar efecto alguno. Sin embargo, la concentración utilizada en sus experiencias es muy baja cuando se compara con los valores reportados, por ejemplo, por Presello et al. [16]. El objetivo principal del presente trabajo es evaluar el potencial que presenta el maíz contaminado con fumonisinas como materia prima para la producción de bioetanol. Para ello se investiga qué efectos produce la micotoxina analizando tres parámetros típicos de las fermentaciones alcohólicas (eficiencia, productividad y rendimiento).
Materiales y Metodos
El maíz utilizado como materia prima en este estudio fue provisto por el INTA sede Santa Fe. El mismo no tuvo niveles detectables de micotoxinas, y su composición química se muestra en la Tabla 1.
Tabla 1: Composicion centesimal del maiz utilizado como materia prima (porcentaje en base seca).
Como agente fermentativo se empleó la cepa N° 506 de la levadura Saccharomyces cerevisiae de la Facultad de Ingeniería Química, UNL. La contaminación previa del maíz para asegurar un alto contenido de fumonisinas se realizó mediante un cultivo de 2 semanas de edad de Fusarium verticillioides MRC826 en placas de Petri con medio PDA (Potato dextrose agar). Ambos microorganismos presentan las características descritas por Pitt y Hocking [22] y una eficacia comprobada [23]. Para asegurar la esterilidad inicial del maíz, los granos fueron emulsionados con agua a un 40% en peso y esterilizados por 15 minutos a 121 °C en un autoclave a vapor. La contaminación del maíz se realizó in vitro en erlenmeyers de vidrio de 1 litro. Un cultivo puro del hongo se obtuvo a partir de una placa de PDA, se diluyó en agua destilada estéril y el maíz fue entonces inoculado con esta solución. Los erlenmeyers se conservaron a 28 ºC por 40 días y luego fueron esterilizados nuevamente para frenar la producción de fumonisinas. La cuantificación de las fumonisinas en el maíz se llevó a cabo después de su esterilización mediante la prueba de Veratox siguiendo el procedimiento ELISA. La concentración final de fumonisinas medida en el maíz fue de 1400 ppm. El contenido de almidón final del maíz fue de 48,16%.
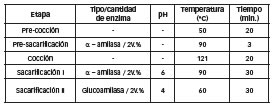
Las enzimas necesarias para la etapa de hidrólisis fueron proporcionadas por ARCOR SAIC sede San Pedro, Argentina. Se utilizaron Alfa-amilasa (GSAU) y glucoamilasa (GAU) de Genencor-DuPont con actividades enzimáticas de 940-1081 u/ml (unidades enzimáticas por ml) 350-390 u/ml. El maíz contaminado y no contaminado (MC y MNC, respectivamente) fueron molidos utilizando en un molinillo eléctrico. Para evaluar la performance del proceso fermentativo en el rango más amplio posible, se diluyo MC en MNC de manera de alcanzar las siguientes concentraciones de fumonisinas en el maíz inicial: 0, 140, 350, 700, 1050 y 1400 ppm. Para la preparación del medio de cultivo, se partió de suspensiones al 18% en peso de maíz molido en agua destilada. El mayor contenido de humedad en MC fue tomado en cuenta a fin de mantener constante la cantidad de sólidos en los medios de cultivo, ya que los sólidos pueden influenciar el proceso de fermentación interfiriendo en la transferencia de calor desde y hacia el medio exterior. La sacarificación del almidón se logró a través de un tratamiento enzimático y térmico. Varios autores utilizan este tipo de tratamiento [24, 25, 26, 27] y cada uno de ellos utiliza condiciones distintas para los diferentes pasos de la hidrólisis enzimática. Las condiciones suficientes para lograr la sacarificación completa del almidón durante este estudio se detallan en la Tabla 2. Una vez terminado el pretratamiento de sacarificación, los medios de cultivo se esterilizaron durante 15 minutos a 121 °C en un autoclave a vapor, y se dejaron enfriar a temperatura ambiente para su posterior inoculación con S. cerevisiae.
Tabla 2: Condiciones utilizadas en las diferentes etapas del tratamiento de sacarificacion.
Células puras liofilizadas de la levadura 506 se reactivaron en medios de cultivo frescos y estériles con 30 g/l de extracto de malta, 3 g/l de peptona y 100 g/l de glucosa, y se incubaron luego a 30 ºC bajo restricción de oxígeno durante 48 horas. La pureza y viabilidad de las células se verificó y luego se conservaron a una temperatura de refrigeración con sucesivos repiques en medio fresco estéril. La concentración de la suspensión de células utilizadas como inóculo fue de 1x107 UFC/ml (Unidades formadoras de colonia por mililitro). Los experimentos de fermentación se realizaron por duplicado a escala laboratorio en erlenmeyers de vidrio de 0,5 l. en donde el medio de cultivo abarcó 80% del volumen del frasco. La relación "volumen de inóculo/volumen de medio de cultivo" utilizada fue 0,1. Una vez inoculados, los erlenmeyers se incubaron a 30 ºC, con agitación suave cada 12 horas para evitar la transferencia de oxígeno a los medios de cultivo. El proceso de fermentación concluyó a las 96 horas, cuando cesó el desprendimiento de CO2 del medio de cultivo. El contenido final de los erlenmeyers fue pesado y luego se separaron los productos volátiles de los sólidos y el agua por destilación simple a presión atmosférica. La concentración de etanol en la fracción volátil se analizó por cromatografía de gases (Hewlett Packard 5890 serie II; CEMT-WAX Alltech, diámetro: 0,25 mm, espesor fase: 0.25μm, fase móvil: N2). Para el cálculo de los parámetros de fermentación se utilizaron las siguientes ecuaciones:

Resultados y discusión
En la Figura 3 se muestran las concentraciones finales de etanol obtenidas en los experimentos de fermentación a partir de maíz contaminado con 0, 140, 350, 700, 1050 y 1400 ppm de fumonisinas. Además, se muestran los valores de la concentración inicial de almidón (concentración de maíz en el medio x composición porcentual de almidón/100) y la concentración final teórica de etanol a partir de la Ecuación (4) [28]: (4)
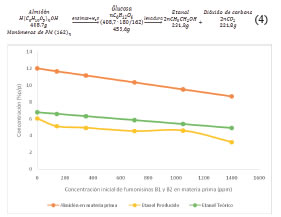
Figura 3: Concentracion inicial de almidon, de etanol final producido y de etanol teorico vs. Concentracion de fumonisinas en el maiz de partida.
Como se puede apreciar, la concentración de etanol producido en los experimentos de fermentación disminuyó acorde a la disminución de la fuente de carbono en el medio de cultivo. Las diferencias entre las concentraciones reales y teóricas se ven reflejadas en los valores obtenidos para la eficiencia de cada uno de los experimentos, las cuales se muestran junto con los parámetros de rendimiento y productividad en la Figura 4.
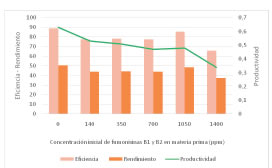
Figura 4: Valores de eficiencia, rendimiento y productividad obtenidos para los experimentos de fermentacion con concentraciones crecientes de fumonisinas en la materia prima.
Como se puede observar, los valores de eficiencia y rendimiento muestran la misma tendencia, con una disminución máxima del 12% hasta una concentración de 1050 ppm en el maíz de partida y un marcado descenso que llega a aproximadamente un 27% cuando el grado de contaminación alcanza las 1400 ppm. Los valores de la productividad, por su parte, presentan una tendencia descendente suave y constante para valores de contaminación hasta 1050 ppm, y un brusco descenso de aproximadamente un 53% para el máximo nivel de contaminación analizado. Cabe aclarar, que el caso de 1050 ppm de fumonisinas se presenta hasta aquí solo a fines informativos, y no se tendrá en cuenta en el análisis de los resultados por representar una desviación a la tendencia observada. De acuerdo a los resultados mostrados en las Figuras 3 y 4, se podría decir a primera vista que concentraciones menores a 700 ppm de fumonisinas en el maíz de partida conllevan una disminución de la eficiencia que supera el 13%. Sin embargo, si se observan los valores de productividad, que conservan una relación inversamente proporcional con el volumen del fermentador, el uso de materia prima con 140, 350 y 700 ppm de fumonisinas necesitaría un aumento de tamaño del equipo aproximado del 15, 18 y 25%, respectivamente. De esta manera, se puede prever que los niveles más altos de contaminación no se muestran como una opción atractiva desde el punto de vista económico. Esto se debe a que además de la disminución de los valores de productividad del proceso fermentativo, el proceso de purificación del etanol demandaría una cantidad mayor de energía debido a que la cantidad de agua a la salida del fermentador será también mayor.
De acuerdo a Ingledew [22], la eficiencia de conversión en la mayoría de las plantas de etanol es, en el mejor de los casos, de 90-93% y se debe mayormente al crecimiento celular, la producción de coproductos y la hidrólisis enzimática incompleta del almidón. En nuestro caso, mientras que la eficiencia del primer experimento de fermentación-cuando no hay fumonisinas en el medio- es aproximadamente 89%, la eficiencia disminuye inmediatamente a un 77% para el valor de 140 ppm de fumonisinas y se mantiene más o menos constante para los experimentos con 350 y 700 ppm. Finalmente, en la concentración máxima de fumonisinas experimentada (1400 ppm) la eficiencia disminuye de nuevo llegando a un valor de 65%. Estos resultados están de acuerdo con los presentados por Bothast et al. [19] que reporta un valor de eficiencia del 88% para fermentaciones a partir de maíz sano y de maíz con 15 ppm fumonisinas y del 75% a partir de maíz con 36 ppm de fumonisinas. Aunque estos autores señalan que el contenido de almidón inicial es la razón de esta disminución, en nuestro caso, en el que se puede calcular el contenido inicial de almidón y en el que las condiciones experimentales fueron las mismas para todos experimentos, la disminución en la eficiencia de fermentación observada puede deberse a tres razones principales: Las micotoxinas inhibieron el crecimiento celular o la performance fermentativa de la levadura. La contaminación inicial del maíz con F. verticillioides produjo sustancias secundarias que inhiben el crecimiento celular o la producción de etanol de la levadura. El hongo F. verticillioides no sólo produjo una disminución en la cantidad de almidón del maíz, sino que consumió las fuentes de nitrógeno y/o micronutrientes necesarias para el correcto funcionamiento del microorganismo fermentativo.
Debe aclararse que la razón por la que no se partió de la misma concentración de almidón en todos los experimento es que, si ese hubiera sido el caso, la concentración de sólidos inicial (maíz molido) hubiera aumentado junto con la concentración de fumonisinas. Hacer esto, hubiera significado cambiar las condiciones de fermentación de un experimento a otro.
Conclusiones
La concentración de fumonisinas en maíz influyó en la producción de etanol durante la fermentación. Cuando no hubieron fumonisinas detectables en el maíz, la concentración promedio de etanol producido fue de 6,05%(p/p), la eficiencia alcanzó un valor del 89%, la productividad fue de 0,63 gramos de etanol por hora por cada 1000 gramos de medio de cultivo, y el rendimiento fue de 50,42 gramos de etanol por cada 100 gramos de almidon en el medio de cultivo. Cuando la concentración de fumonisinas en el maíz alcanzó 1.400 ppm, la concentración final de etanol fue de 3,23%(p/p), la eficiencia del 65%, y los valores de productividad y rendimiento fueron un 26% y 53% menores, respectivamente. A partir de los resultados obtenidos se pudo concluir que el maíz contaminado con fumonisinas es un material factible de ser utilizado como materia prima para la producción de etanol en fermentaciones convencionales, siendo razonable utilizarlo hasta un nivel de contaminación que no supere las 140 ppm de fumonisinas. Concentraciones más altas en la materia prima llevarían a un aumento del tamaño del fermentador que supera el 15%.
Las posibles razones de la disminución de eficiencia en las experiencias de fermentación están directamente relacionadas con la contaminación del maíz por el hongo F. verticillioides, pudiendo deberse a la interacción de las fumonisinas en las rutas metabólicas de la S. cerevisiae, la producción de subproductos secundarios por el moho o el consumo de los micronutrientes o la fuente de nitrógeno, ambos necesarios para el correcto crecimiento y desarrollo de las células de levadura.
Agradecimientos
El presente trabajo pudo desarrollarse gracias al apoyo financiero del CONICET y la ANPCyT. Los autores desean agradecer además a ARCOR SA y al INTA Santa Fe que amablemente proporcionaron las materias primas utilizadas en este estudio.
1. IPCC, 2007. Cambio climático 2007: Informe de síntesis. Contribución de los Grupos de trabajo I, II y III al Cuarto Informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático. Ginebra, Suiza. [ Links ]
2. Plass G.N., 1959. Carbon Dioxide and Climate. Scientific American, Julio: 41-47. [ Links ]
3. Govindaswamy S., Vane L.M., 2007. Kinetics of growth and ethanol production on different carbon substrates using genetically engineered xylose-fermenting yeast. Bioresource Technol., 98: 677–685.
4. Renewable Fuels Association - Ethanol industry statistics, Noviembre 2015. Disponible en: http://ethanolrfa.org/page/-/PDFs/RFA%202013%20Ethanol%20Industry%20Outlook.pdf?nocdn=1 [ Links ]
5. Vane L., 2005. A review of pervaporation for product recovery from biomass fermentation processes. J Chem Technol Biot., 80: 603-629. [ Links ]
6. Lyons, T.P., 2003. Alcohol production: a traditional process changing rapidly, en: The alcohol textbook. 4th Edition. Editores: Jacques, K.A., Lyons, T.P., Kelsall, D.R., Alltech Inc., Nottingham, pp. x - xi. [ Links ]
7. O’Brien D., Woolverton M., 2010. Updated trends in U.S. wet and dry corn milling production. AgMRC Renewable energy newsletter.
8. Kwiatkowski J.R., McAloon A.J., Taylor F., Johnston D.B., 2006. Modeling the process and costs of fuel ethanol production by the corn dry-grind process. Industrial Crops and Products; 23(3): 288-296. [ Links ]
9. Sosa M.A., Chovau S., Van der Bruggen B., Espinosa J., 2013. Ethanol production from corn contaminated with fumonisins: A preliminary economic analysis including novel processing alternatives. Ind. Eng. Chem. Res., 52: 7504 – 7513.
10. Sosa M.A., 2014. Tesis Doctoral: Síntesis Óptima de Procesos Híbridos con Énfasis en la Recuperación de Solventes y la Producción de Bioetanol para Combustibles. Universidad Nacional del Litoral, Santa Fe, Argentina. [ Links ]
11. Sosa M.A., Figueroa Paredes D.A., Basilico J.C., Van der Bruggen B., Espinosa J., 2015. Screening of pervaporation membranes with the aid of conceptual models: an application to bioethanol production. Separation and purification technol., 146: 326-341. [ Links ]
12. Boeira L.S., Bryce J.H., Stewart G.G., Flannigan B., 2002. Influence of cultural conditions on sensitivity of brewing yeasts growth to Fusarium mycotoxins zearalenone, deoxynivalenol and fumonisin B1. Int Biodeter Biodegr., 50(2): 69-81. [ Links ]
13. Placinta C.M., D’Mello J.P.F., Macdonald A.M.C., 1999. A review of worldwide contamination of cereal grains and animal feed with Fusarium mycotoxins. Anim Feed Sci Tech., 78(1,2): 21-37.
14. Marasas W.F.O., 1995. Fumonisins: Their implications for human and animal health. Nat Toxins., 3(4): 193–198.
15. Sydenham E.W., Gelderblom W.C.A., Thiel P.G., Marasas W.F.O., 1990. Evidence for the Natural Occurrence of Fumonisin B1, a Mycotoxin Produced by Fusarium moniliforme, in Corn. J Agric Food Chem., 38: 285-290. [ Links ]
16. Presello D. A., Botta G., Iglesias J., Eyhérabide G.H., 2007. Severity of Fusarium ear rot and concentration of fumonisin in grain of Argentinean maize hybrids. Crop Prot., 26(6): 852-855. [ Links ]
17. Chulze S.N., Ramirez M.L., Pascale M., Visconti A., 1998. Fumonisin production by, and mating populations of, Fusarium section Liseola isolates from maize in Argentina. Mycol Res., 102(2): 141-144. [ Links ]
18. Gallardo-Reyes E., Ibarra-Moreno G.M., Sánchez-Mariñez R., 2006. Micobiota de maíz (Zea mays L.) recién cosechado y producción de Fumonisina B1 por cepas de Fusarium verticillioides (Sacc.) Nirenb. Rev Mex Fitopatolog., 24(1): 27-34. [ Links ]
19. Bothast R.J., Bennett G.A., Vancauwenberge J.E., Richard J.L., 1992. Fate of fumonisin B1 in naturally contaminated corn during ethanol fermentation. Appl Environ Microbiol., 58(1): 233-236. [ Links ]
20. Kłosowski G., Mikulski D., 2010. The effect of raw material contamination with mycotoxins on the composition of alcoholic fermentation volatile by-products in raw spirits. Bioresource Technol., 101(24): 9723-9727. [ Links ]
21. Kłosowski G, Mikulski D, Grajewski J, Błajet-Kosicka A., 2010. The influence of raw material contamination with mycotoxins on alcoholic fermentation indicators. Bioresource Technol., 101(9): 3147–3152.
22. Pitt J.I., Hocking A.D., 2009. Fungi and food spoilage, 3rd ed. Springer, New York. [ Links ]
23. Ricca A.P., 2006. Tesis Doctoral: Aprovechamiento de granos contaminados con fumonisina B1 para la obtención de etanol y análisis del posterior uso de las vinazas sólidas como complemento en alimento balanceado. Universidad Nacional del Litoral, Santa Fe, Argentina. [ Links ]
24. Graves T., Narendranath N.V., Dawson K., Power R., 2007. Interaction effects of lactic acid and acetic acid at different temperatures on ethanol production by Saccharomyces cerevisiae in corn mash. Appl Microbiol Biot., 73: 1190-1196. [ Links ]
25. Kłosowski G., Czuprynski B., Wolska M., 2006. Characteristics of alcoholic fermentation with the application of Saccharomyces cerevisiae yeasts: As-4 strain and I-7- 43 fusant with amylolytic properties. J Food Eng., 76: 500-505. [ Links ]
26. Narendranath N.V., Power R., 2004. Effect of yeast inoculation rate on the metabolism of contaminating lactobacilli during fermentation of corn mash. J Ind Microbiol Biot., 31: 581-584. [ Links ]
27. Taylor F., Marquez M.A., Johnston D.B., Goldberg N.M., Hicks K.B., 2010. Continuous high-solids corn liquefaction and fermentation with stripping of ethanol. Bioresource Technol., 101: 4403-4408. [ Links ]
28. Ingledew W.M., 1999. Alcohol production by Saccharomyces cerevisiae: a yeast primer, en: The alcohol textbook (3rd Edition). Editores: Jacques K.A, Lyons T.P. and Kelsall D.R., Alltech Inc., Nottingham, pp. 49- 87. [ Links ]
Recibido: 30/11/15.
Aprobado: 01/11/16.














