Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Argentina de Ciencias del Comportamiento
versión On-line ISSN 1852-4206
Rev Arg Cs Comp. vol.7 no.2 Córdoba ago. 2015
ARTÍCULO ORIGINAL
Efecto del haloperidol sobre el contraste sucesivo positivo consumatorio en ratas adultas con aislamiento adolescente
Cuenya, Lucasa; Serafini, Matíasa; Mustaca, Alba E.b y Kamenetzky, Giselle b
a Laboratorio de Psicología Experimental y Aplicada. Instituto de Investigaciones Médicas – IDIM – CONICET – Universidad de Buenos Aires
b Centro del Altos Estudios en Ciencias Humanas y de la Salud (CAECIHS), Universidad Abierta Interamericana (UAI).
*Enviar correspondencia a: Cuenya, Lucas. E- mail: lucascuenya@gmail.com
Resumen
Las ratas expuestas a aislamiento adolescente (AA) muestran alteraciones neurológicas y conductuales en la adultez, muchas de ellas relacionadas con cambios en la respuesta ante reforzadores apetitivos. En estudios previos las ratas con AA mostraron un incremento del Contraste Sucesivo Positivo consumatorio (CSPc, i.e, mayor consumo de una solución azucarada al 32%, 24 hs después de tener acceso a una solución al 4%), respecto de animales sin AA. El objetivo de este estudio fue evaluar si este efecto está asociado a la hiperactividad dopaminérgica. Se administró haloperidol a animales con AA (0.1 mg/kg, i.p.) antes de los ensayos de incremento del refuerzo y salina a un grupo control. No se halló CSPc en los animales que recibieron haloperidol, mientras que en los sujetos con salina se observó en un ensayo. Si bien los resultados apoyan la hipótesis propuesta, es necesario realizar futuros experimentos para determinar con mayor precisión el correlato neuroquímico del incremento de CSPc en animales con AA.
Palabras claves: Aislamiento Adolescente; Contraste Positivo; Haloperidol; Dopamina; Rata
Abstract. Effect of haloperidol on consummatory successive positive contrast in adult rats with adolescent isolation. Rats exposed to adolescent isolation (AA) show neurological and behavioral disorders into adulthood, many of them related to changes in response to appetitive reinforcers. Previous studies showed an increase of consummatory Successive Positive Contrast (cSPC, i.e., increased consumption of 32% sugar solution, 24 hours after having access to 4% solution) in rats exposed to AA, in comparison to animals without AA. This study aim at evaluating whether this effect is associated with dopaminergic hyperactivity. Haloperidol (0.1 mg / kg, i.p.) was administered before animals with AA were exposed to the presentation of the increased solution (4% to 32%), while saline was administered to the control group. cSPC effect was not observed in animals receiving haloperidol, while a one trial positive contrast was expressed in animals receiving saline. These results confirm the proposed hypothesis. Although the results are promising, further experiments are needed to determine more precisely the neurochemical correlate of increased cSPC in animals with AA.
Keywords: Adolescent Isolation; Positive Contrast; Haloperidol; Dopamine; Rat
Recibido el 01 de Diciembre de 2014; Recibido la revisión el 16 de Diciembre de 2014; Aceptado el 08 de Febrero de 2014.
La adolescencia es un período de transición entre la infancia y la edad adulta que presenta características conductuales y neuroquímicas, entre las cuales se destacan un incremento de las interacciones sociales entre pares, búsqueda de novedad y de nuevas sensaciones (Spear, 2000), cambios en las respuestas ante reforzadores apetitivos, tales como alimentos (Neumark-Sztainer et al., 2006; Patton, Coffey, & Sawyer, 2003; van Strien, van der Zwalum, & Engels, 2010) y drogas de abuso (e.g., Chen & Jacobson, 2012; Cuenya, 2006; Krank et al., 2011) y aumento de acercamiento a situaciones de incentivo (ver Ernst, Romeo, & Andersen, 2009). En ratas se caracteriza por cambios conductuales y neuroquímicos que acontecen entre el día postnatal 20 (DPN 20) y el DPN 55 (ver Spear, 2000). En ese período se observa un incremento de la conducta exploratoria, de las interacciones sociales y de juego con pares (Douglas, Varlinskaya, & Spear, 2003; Fox, Sterling, & Van Bockstaele, 2009; Vanderschure, Niesink, & Van Ree, 1996). A nivel neurofisiológico se produce un aumento de la secreción de glándulas gonadales (ver Sisk & Foster, 2004) y cambios en la actividad dopaminérgica mesolímbica (ver Wahlstrom, Collins, White, & Luciana, 2010).
El aislamiento temprano en ratas luego del destete es una de las preparaciones que produce cambios observables en la adultez. Consiste en el aislamiento social por un período de tiempo con la única manipulación necesaria para la limpieza de la jaula (e.g., Weiss, Domeney, Heidbreder, Moreau, & Feldon, 2001). Los cambios conductuales y neuroendocrinológicos se observan principalmente cuando el protocolo se aplica durante las dos semanas posteriores al destete (a partir del DPN 21). Se halló un extenso rango de alteraciones en la adultez comparados con animales criados en grupos, tales como decremento de las interacciones sociales, deterioro de los mecanismos inhibitorios y de integración sensoriomotora (i.e., inhibición latente e inhibición prepulso), hiper-responsividad a ambientes novedosos, inflexibilidad cognitiva, hiperactividad dopaminérgica en el núcleo accumbens (NAcc) y estriado ventral, así como hipoactividad glutamatérgica y dopaminérgica en la corteza prefrontal (ver Fone & Porkess, 2008).
Diferentes estudios mostraron que el aislamiento adolescente en ratas produce alteraciones en el consumo de reforzadores apetitivos en la adultez, como hiperfagia (Fiala, Snow, & Greenough, 1977; Jahng, Yoo, Ryu, & Lee, 2012), mayor preferencia por soluciones azucaradas (Hong et al., 2012) y cambios en la respuesta a comidas novedosas (Hall, Humby, Wilkinson, & Robbins, 1997), aunque estos efectos podrían depender de parámetros experimentales y variables relevantes como el sexo (Hall et al., 1997; Hellemans, Benge, & Olmstead, 2004; Hong et al., 2012). Todos estos trabajos exploraron la respuesta de los animales ante el valor absoluto del refuerzo. Sin embargo, el efecto que un reforzador tiene sobre la conducta está determinado también por su valor relativo, el cual depende de las experiencias previas que el animal haya tenido con diferentes calidades y cualidades de reforzadores (Flaherty, 1996).
Son pocos los estudios que han indagado acerca de los efectos del aislamiento sobre las respuestas ante el cambio inesperado del refuerzo y habitualmente aplican el tratamiento de aislamiento desde el destete hasta la adultez (e.g., Shanab & Ralph, 1979). Este tipo de diseños no permite discriminar el efecto del aislamiento adolescente (AA) del producido por el aislamiento adulto, que también es considerado un estresor capaz de generar alteraciones, aunque no son homologables a los producidos por AA (ver Morgan & Tromborg, 2007). En un estudio realizado por Hall et al. (1997) se indagó el efecto del aislamiento desde el DPN 21 hasta la adultez sobre el contraste negativo (i.e., devaluación inesperada del refuerzo) y el contraste positivo (i.e., incremento inesperado del refuerzo), evaluando la respuesta de consumo de las ratas en la adultez ante la presentación, en un orden ascendente o descendente, de concentraciones de agua azucarada (0.7%, 2.1%, 7%, 21% y 34%). Los autores concluyeron que el contraste positivo consumatorio se expresaba con mayor intensidad en animales aislados, mientras que no se observaban diferencias en el contraste negativo. Este estudio no permitió discriminar el efecto del AA del aislamiento adulto, ni tampoco descartar que las diferencias se debieran a un post efecto sensorial y no a la violación de una expectativa, ya que los ensayos de consumo estaban separados por intervalos de 25 minutos. Por último, el diseño utilizado no contaba con grupos que recibieran el mismo valor de refuerzo durante el entrenamiento a fin de determinar el efecto de contraste. Cuenya, Mustaca y Kamenezky (2015) replicaron los hallazgos con mayores controles. Se utilizaron animales aislados durante la adolescencia y no aislados y se les aplicó en la adultez un diseño de Contraste Sucesivo Positivo consumatorio (CSPc) en el cual los animales tenían acceso alternado, cada 24 hs, a soluciones al 32% y 4%, mientras que los grupos controles recibieron 32% durante todos los ensayos. Se halló que los animales con AA presentaron un efecto de contraste positivo más intenso y prolongado (i.e., consumían más el 32% tras un ensayo de 4%, en comparación con los controles que siempre recibían 32%) que los animales sin AA, sin mostrar diferencias ante la devaluación y posterior omisión del refuerzo. Estos datos fueron confirmados al observar la misma diferencia cuando los animales pasaban de ensayos no reforzados a ensayos de 32%. Este trabajo permitió asegurar que las alteraciones encontradas se debían al aislamiento en la etapa adolescente y no al aislamiento adulto y eliminar como posible mecanismo a los post efectos sensoriales, dado que el intervalo entre los ensayos fue de 24 hs.
Los trabajos previos muestran que cuando el animal se encuentra en una situación de contraste negativo o positivo consumatorio, la liberación de dopamina en el núcleo accumbens (NAcc) exhibe una respuesta bidireccional; el contraste negativo provoca la liberación disminuida en comparación con un grupo control, mientras que el contraste positivo genera el aumento de la liberación de dopamina (ver Phillips, Vacca, & Ahn, 2008). Fabricius, Steiniger-Brach, Helboe, Fink-Jensen y Wörtwein (2011) no registraron diferencias en sujetos con o sin AA en los niveles basales de dopamina en el NAcc, pero los sujetos con AA mostraron una liberación significativamente mayor del neurotransmisor en respuesta a la administración de anfetamina. Estos datos indican que el AA genera alteraciones de largo término en la función dopaminérgica en respuesta a los reforzadores apetitivos.
La respuesta dopaminérgica está implicada además en la predicción del error o en la imprevisibilidad de los refuerzos (Schultz, 2002), de manera que el desequilibrio dopaminérgico causado por el AA podría afectar la reacción ante un cambio inesperado de refuerzo. Sin embargo, cabe preguntarse por qué el aislamiento adolescente no afecta el comportamiento en cualquier situación de cambio de refuerzo, sino solo cuando el animal recibe una recompensa mayor a la esperada (Cuenya et al., 2015). Bayer y Glimcher (2005), en experimentos con monos, encontraron que las neuronas de dopamina del mesencéfalo codifican la señal de error de la predicción cuantitativa de la recompensa. Curiosamente, se observó un incremento de las tasas de disparo de las neuronas de dopamina cuando el valor de la recompensa actual era mayor que el promedio ponderado de las recompensas anteriores, pero este patrón no se observó cuando el valor de la recompensa actual fue más bajo que el promedio de las recompensas anteriores. Este dato sugiere que el AA podría afectar específicamente el funcionamiento dopaminérgico relacionado con la detección del error de predicción en situaciones en las que la recompensa resulta mayor a la esperada.
Teniendo en cuenta estos antecedentes, el presente trabajo tiene por objetivo explorar los mecanismos neuroquímicos subyacentes al efecto reportado en Cuenya et al. (2015). Dado que el AA está asociado a hiperactividad dopaminérgica en el sistema mesolímbico (ver Fone & Porkess, 2008) y que éste participa en la respuesta de los animales ante reforzadores apetitivos, se puede conjeturar que el aumento del efecto de CSPc en los animales AA está relacionado con ese mecanismo neurobiológico. Los receptores D2 se encuentran en diversas regiones del sistema mesolímbico (Hall et al., 1994) y están implicados en el reforzamiento de nuevas conductas y las respuestas apetitivas anticipatorias de las recompensas (Chih Wei Huang, Shyu, & Hsiao, 2010). A su vez, trabajos previos muestran que el AA genera alteraciones en la expresión postsináptica de los receptores D2 en estructuras mesolímbicas (ver Lapiz et al., 2003). Por tal razón, se hipotetiza que la aplicación de un antagonista dopaminérgico de los receptores D2, como el haloperidol, atenuará o eliminará el efecto incrementado del CSPc producido por el AA.
2.1. Sujetos
Se utilizaron 39 ratas Wistar macho de 4 meses de edad al comienzo del protocolo de CSPc (369-430 g) criadas en el bioterio del Instituto de Investigaciones Médicas (IDIM), Universidad de Buenos Aires. Los animales provenían de 10 camadas de entre 2 y 4 machos cada una. Las ratas se encontraban alojadas en grupos de a 4-5 en jaulas de acero inoxidable de 44 cm de largo, 32 cm de ancho y 22 cm de alto, bajo un ciclo de luz/oscuridad de 12 horas (luz desde las 07:00 h) con niveles de temperatura que se mantuvieron constantes a lo largo del experimento en aproximadamente 23ºC. Las ratas tuvieron acceso libre de agua durante todo el experimento. Luego del DPN 110 fueron privadas de alimento al 81-85% de su peso ad libitum, individualizando a los animales durante 3 horas diarias en jaulas de 28 cm de largo, 26 cm de ancho y 22 cm de alto en las que tenían acceso a cantidades apropiadas de alimento para mantener el nivel de privación. Este protocolo no altera las respuestas de euforia y frustración en procedimientos consumatorios, ya que estudios previos de nuestro laboratorio muestran que animales aislados de forma total desde el DPN 60 no muestran diferencias con sujetos no aislados (Cuenya, Fosacheca, Mustaca, & Kamenetzky, 2011; Cuenya, Fosacheca, Mustaca, & Kamenetzky, 2012). El experimento se realizó entre las 14:00 p.m. y las 17:00 p.m. Durante el entrenamiento, el alimento se entregaba al menos 30 min después de finalizado el ensayo. Todos los procedimientos se realizaron de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio (Institute of Laboratory Animal Resources, 1996).
2.2. Aparatos
Cajas de Condicionamiento: Se utilizaron 5 cajas de condicionamiento MED Associates, de 30 cm de frente, 24 cm de profundidad y 24 cm de alto de piso a techo, cuyas medidas eran 21 cm de alto desde el techo a la rejilla de barras de aluminio de 0.4 cm de diámetro, separadas unas de otras por espacio de 1.1 cm. Sobre una pared lateral, había un hueco de 5 cm de ancho, 5 cm de alto y 3.5 cm de profundidad, ubicada 1 cm por sobre el piso de barras. El tubo de vidrio del bebedero se insertó en el orificio desde fuera de la caja, sobresaliendo aproximadamente 2 cm dentro de la misma. Los sujetos debían introducir su cabeza en el hueco para consumir el refuerzo. Al alcanzar el tubo del bebedero, los animales interrumpían el haz de luz de un par de celdas fotoeléctricas ubicadas al costado del bebedero. El software MED-PC permitió registrar el tiempo (en unidades de 0.01 s) que los animales interrumpían el haz de luz. Estudios previos validaron la medida al mostrar correlaciones positivas y significativas con el consumo total en mililitros (Mustaca, Freidin, & Papini, 2002). En la pared opuesta al bebedero, se colocó una luz que iluminaba la caja durante la sesión y una palanca que sobresalía 1 cm. Al momento de introducir al animal, se empujaba con el mismo la palanca y se registraba la latencia entre el ingreso y el primer lameteo. Como reforzadores se utilizaron soluciones azucaradas de 32% y 4% (p/v), preparadas con azúcar comercial diluida en agua corriente. Para la solución al 32% se diluyó 160 g de azúcar en agua, hasta alcanzar 500 ml de solución total. La solución al 4 % se preparó diluyendo 20 g de azúcar en agua, hasta alcanzar 500 ml de solución.
Droga: Se utilizó Haloperidol Zerotidal 5 mg (1 ml) provisto por Laboratorios Duncan, disuelto en ácido láctico, con una disolución final en agua destilada. La droga fue administrada 30 min antes del ensayo (i.p.) en una dosis de 0.1 mg/kg (vol 2 ml/kg). Los sujetos controles recibieron solución fisiológica en igual volumen. Se eligió esta dosis por encontrarse dentro del rango utilizado en la literatura en estudios motivacionales que requieran el desempeño motor del animal (e.g., Ettenberg, 1990; Simon et al., 2000) y porque estudios preliminares de nuestro laboratorio mostraron que con dosis mayores (e.g., 0.2 mg/kg) disminuye el consumo general de soluciones. El tiempo entre la administración de la droga y la prueba conductual se encontró dentro del rango de intervalos utilizado en trabajos previos (e.g., Wiley & Evans, 2008).
2.3. Procedimiento
Aislamiento post-destete: Desde el nacimiento y hasta el DPN 20 los animales estuvieron en contacto con sus madres y camadas en jaulas de acero inoxidable de 44 cm de largo, 32 cm de ancho y 22 cm de alto. En el DPN 21 fueron destetados y aislados hasta el DPN 36 en jaulas individuales con paredes y piso de plástico negro y techo de barras metálicas (28 cm de largo, 20 cm de ancho y 15 cm de alto). Todas las jaulas estaban ubicadas en el mismo cuarto. A partir del DPN 36 se colocaron agrupados como se indicó en el apartado Sujetos y así continuaron hasta la finalización del experimento.
Contraste Sucesivo Positivo consumatorio: Se utilizó una versión abreviada del protocolo utilizado por Flaherty, Becker y Checke (1983). Los animales fueron entrenados durante 7 ensayos (uno por día) de 5 min cada uno, en los que tenían acceso a distintas concentraciones de agua azucarada. Las ratas eran transportadas en sus jaulas hogar (entre 4 y 5 sujetos) hasta la sala de entrenamiento, contrabalanceando el orden de las tandas. Cuando el animal se introducía en la caja se presionaba la palanca del extremo contralateral al bebedero para iniciar el conteo de la latencia hasta el primer lameteo, a partir del cual comenzaban los 5 min del ensayo. Entre cada ensayo se limpiaban las cajas con un paño húmedo para remover los olores. Los grupos experimentales recibieron en el primer ensayo acceso a la solución azucarada al 32%, mientras que en el resto de los ensayos recibieron presentaciones alternadas de 4% y 32%. Los grupos controles tuvieron acceso durante todo el entrenamiento a la solución al 32%. La administración de droga o vehículo se realizó 30 min antes de los ensayos 3, 5 y 7, dado que estos fueron los días de incremento del refuerzo para los grupos experimentales (4% a 32%). De este modo, el diseño experimental quedó compuesto por cuatro condiciones: Experimental Haloperidol (E-Hal, n=9), Experimental Salina (E-Sal, n=10), Control Haloperidol (C-Hal, n=10) y Control Salina (C-Sal, n=10).
2.4. Análisis Estadístico
Se utilizó el paquete estadístico SPSS 17. Se analizaron por separado los datos de los ensayos 3, 5 y 7 (en los que todos los sujetos recibieron 32%) de los ensayos 2, 4 y 6 (en los que los animales experimentales recibieron 4% y los controles 32%). Tanto para el análisis del TB como de la latencia se utilizaron modelos mixtos de ANOVA con un factor intrasujeto (Ensayos) y con dos factores intersujeto: Contraste (Experimental vs Control) y Droga (Haloperidol vs Salina). Cuando los datos violaban el supuesto de esfericidad, se empleó la corrección Greenhouse-Geisser. Se utilizó el análisis pairwise comparison para las comparaciones post-hoc, utilizando el ajuste de Bonferroni. El nivel de significación alpha se estableció en .05 para todas las pruebas.
3.1. Tiempo de Contacto con el Bebedero
Tal como se observa en la Figura 1, tanto en el grupo control como experimental el TB aumenta a lo largo de los ensayos en ambas condiciones de droga, evidenciando el aprendizaje de la conducta consumatoria. En los sujetos que recibieron solución salina, se observa que el grupo experimental presentó un mayor TB respecto al grupo control en el ensayo 5, mientras que en los sujetos con haloperidol, los animales del grupo experimental no muestran una diferencia sustancial con los controles en ninguno de los ensayos. Los análisis estadísticos confirman estas observaciones.
Figura 1
Tiempo de bebedero promedio (± ETM) en función de los ensayos. Panel izquierdo: comparación entre grupos que recibieron salina en los ensayos 3, 5 y 7. Panel derecho: comparación entre grupos que recibieron haloperidol 0.1 mg/kg en los ensayos 3, 5 y 7.
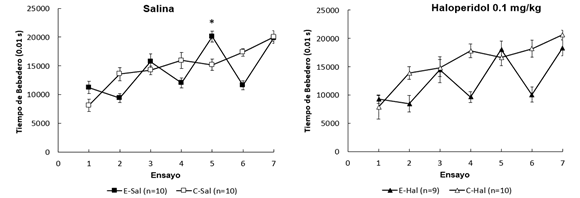
*: p < .01
El ANOVA realizado sobre los ensayos de devaluación del refuerzo (2, 4 y 6) arrojó efecto de Ensayo, F(2, 70)= 13.23, p < .001, y Contraste, F(1, 35)= 45.41, p < .001, mientras que las interacciones fueron no significativas, ps > .14. Estos datos muestran que los sujetos E-Hal y E-Sal tuvieron un TB por debajo los C-Hal y C-Sal, debido al efecto de la magnitud de la recompensa y la devaluación del incentivo. En conjunto, estos análisis muestran que los animales adquirieron la conducta consumatoria a lo largo del entrenamiento y que respondieron con su abrupta supresión en los ensayos con devaluación del refuerzo, sin diferencias entre los animales que recibieron la droga o salina.
El ANOVA realizado sobre los ensayos de incremento del refuerzo (3, 5 y 7) arrojó un efecto principal de Ensayo, F (2, 68)= 29.92, p < .001, e interacción Ensayo por Contraste, F (2, 68)= 5.8, p < .01. Los factores Droga, Contraste y el resto de las interacciones resultaron no significativas, ps > .18. Los análisis posteriores realizados con pairwise comparison para detectar diferencias entre los grupos en cada ensayo mostraron que los sujetos E-Sal tuvieron más TB que los C-Sal en el ensayo 5, F(1, 34)= 10.65, p < .01, mientras que no se observaron diferencias entre el E-Hal y C-Hal, entre el E-Hal y E-Sal o entre los grupos C-Hal y C-Sal en ningún día, ps > .1.
3.2. Latencia
En la Figura 2 se observa la latencia registrada entre el ingreso del animal a la caja y el primer lameteo. Al analizar los ensayos de devaluación del incentivo (2, 4 y 6) se halló efecto de Droga, F(1, 35)= 5.35, p < .03, e interacción Contraste x Droga, F(1, 35)= 10.03, p < .01. Los análisis posteriores mostraron que el grupo E-Hal tuvo una mayor latencia que el C-Hal en el ensayo 4, F(1, 35)= 5.75, p < .04, y en el ensayo 6, F(1, 35)= 9.75, p < .01, mientras que entre los grupos E-Sal y C-Sal las diferencias no fueron significativas, ps > .19. Por el contrario, cuando se analizaron los días de incremento del refuerzo (3, 5 y 7), se halló únicamente efecto de Ensayo, F(1.42, 49.84)= 4.87, p < .03, mientras que el factor Contraste, Droga y sus interacciones no fueron significativos, ps > .15.
Figura 2.
Latencia promedio en segundos (± ETM) de primer lameteo en función de los ensayos.
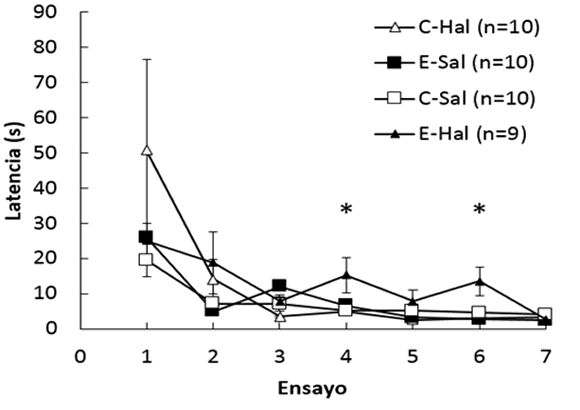
*: p < .05.
Estos datos muestran que no hubo diferencias entre los grupos en los ensayos en los que la droga había sido administrada (3, 5 y 7), sugiriendo que la misma no habría afectado la locomoción o actividad general del animal a un nivel que pudiera impedirle o afectar su consumo. Curiosamente, los animales E-Hal mostraron un incremento de la latencia en los ensayos posteriores a la aplicación de la droga. Si bien es un dato inesperado, podría relacionarse con un efecto desmotivador del fármaco sobre el reforzador.
Los resultados más relevantes de este experimento muestran que los sujetos con AA a los que se les administró una dosis de haloperidol durante los ensayos que recibieron 32% de solución azucarada, 24 hs después de recibir 4%, no expresaron contraste positivo al compararlos con sujetos con AA controles que siempre recibieron 32% en las mismas condiciones. Por su parte, los sujetos con AA a los cuales se les administró salina en los mismos ensayos tuvieron un aumento de la respuesta respecto de sus controles, aunque el efecto de contraste positivo se expresó en un ensayo. Estas diferencias no pueden explicarse por discrepancias en los niveles generales de consumo ni tampoco por un efecto de sedación de la droga al momento de la prueba, puesto que los grupos C-Hal y C-Sal no difirieron en ningún ensayo ni tampoco se encontraron diferencias en las latencias en los días de incremento del refuerzo y administración de la droga.
Estos datos confirman la hipótesis acerca de los posibles mecanismos neurobiológicos involucrados en el efecto incrementado del CSPc hallado previamente en los animales expuestos a AA. Sin embargo, estas conclusiones se deben tomar con precaución ya que en el estudio previo de Cuenya et al. (2015) se encontró que el CSPc en animales con AA se expresó en cinco ensayos antes de igualarse con los controles, a diferencia de los animales sin AA, quienes lo tuvieron solamente en los dos primeros ensayos, como en otros trabajos previos (e.g., Flaherty et al., 1983). Una interpretación simple de la hipótesis dopaminérgica predice que en este experimento los sujetos tratados con salina deberían comportarse de igual manera que los sujetos con AA de aquel estudio, mientras que los tratados con haloperidol deberían aproximarse en su comportamiento a los sujetos sin AA. Se desconocen las razones por las cuales los resultados de los experimentos difieren. Una posible explicación podría residir en el estrés generado por las inyecciones, aunque no se encuentran diferencias en los controles salina 32%. Futuros experimentos podrían controlar esta interpretación realizando un protocolo de habituación a las inyecciones previo al primer día de prueba (i.e., ensayo 3). La otra explicación, quizá más plausible, es que el CSPc es un fenómeno elusivo y muy sensible a las variaciones de los parámetros experimentales y entre experimentos, razón por la cual se ha estudiado en menor medida que el contraste sucesivo negativo (Flaherty, 1996). Otra limitación de este estudio es que no se compararon estos resultados con un grupo control con animales no expuestos a AA. En el caso de contar con sujetos no expuestos a AA podría evaluarse si la administración del fármaco en animales con AA revierte el efecto a tal punto de emparejar su respuesta a los controles sin el tratamiento de aislamiento. A pesar de estas limitaciones, la hipótesis propuesta muestra validez interna, lo que es promisorio e invita a futuras indagaciones sobre el tema.
Los estudios previos mostraron que el AA produce hiperactividad dopaminérgica en el sistema mesolímbico, lo cual se propone como correlato neuroquímico de las alteraciones en las respuestas a los reforzadores, pero también el modelo genera hipoactividad en la corteza prefrontal (ver Fone & Porkess, 2008). El AA genera distintas alteraciones neuroquímicas, entre las que se observó un aumento de la función presináptica de las neuronas dopaminérgicas y disminución de los receptores D2 postsinápticos en el núcleo accumbens, aunque no así de los receptores D1 (ver Lapiz et al., 2003). A la luz de estos trabajos, podría pensarse que los sujetos con AA responden de un modo aumentado en el CSPc dada la respuesta exacerbada de liberación dopaminérgica ante el incremento del refuerzo, razón por la cual el haloperidol revirtió este efecto. En este estudio un antagonista dopaminérgico de los receptores D2 se administró de modo sistémico. Los futuros experimentos podrían profundizar y corroborar la hipótesis planteada con administraciones localizadas en las estructuras cerebrales implicadas en el sistema de refuerzo, sin bloquear la actividad dopaminérgica cortical.
En resumen, en este trabajo se exploró el posible correlato neuroquímico de un fenómeno conductual reportado por nuestro equipo anteriormente: el aumento de la respuesta ante el incremento del refuerzo en sujetos con AA (Cuenya et al., 2015). Se propuso la hipótesis dopaminérgica, según la cual la hiperactividad de este circuito estaría asociada al fenómeno, prediciendo una merma o eliminación del mismo por la administración de un antagonista de los receptores D2 como el haloperidol. Los datos apoyan la hipótesis planteada ya que las diferencias entre los grupos fueron en la dirección aventurada. No obstante, las limitaciones del estudio hacen que el mismo posea un carácter exploratorio y que sea necesario realizar nuevos experimentos, por ejemplo habituando a los animales a las inyecciones de modo previo al entrenamiento, administrando el fármaco de modo localizado y agregando grupos controles sin AA para establecer la especificidad del fármaco sobre animales con AA.
Agradecimientos
Este artículo fue parcialmente financiado por subsidios otorgados por la Agencia de Promoción y Desarrollo de la Secretaría de Ciencia y Técnica, por el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) y por la Universidad de Buenos Aires – Proyecto UBACyT 20020130300017BA.
Bayer, H. M., & Glimcher, P. W. (2005). Midbrain dopamine neurons encode a quantitative reward prediction error signal. Neuron, 47, 129-41.
Chen, P., & Jacobson, K. C. (2012). Developmental Trajectories of Substance Use from Early Adolescence to Young Adulthood: Gender and Racial/Ethnic Difference. Journal of Adolescent Health, 50, 154-63.
Chin Wei Huang, A., Shyu, B., & Hsiao, S. (2010). Dose-dependent dissociable effects of haloperidol on locomotion appetitive responses, and consummatory behavior in water-deprived rats. Pharmacology Biochemistry and Behavior, 95, 285-291. [ Links ]
Cuenya, L. (2006). Estresores ocupacionales, soporte social y consumo de alcohol en jóvenes. Anuario de Investigaciones, 14, 211-20. [ Links ]
Cuenya, L., Fosacheca, S., Mustaca, A., & Kamenetzky, G. (2011). Efectos del aislamiento en la adultez sobre el dolor y la frustración.Psicológica, 32, 49-63. [ Links ]
Cuenya, L., Fosacheca, S., Mustaca, A., & Kamenetzky, G. (2012). Effects of isolation in adulthood on frustration and anxiety. Behavioural Processes, 90, 155-60.
Cuenya, L., Mustaca, A. & Kamenetzky, G. (2015). Postweaning isolation affects responses to incentive contrast in adulthood. Developmental Psychobiology. Recuperado de http://www.ncbi.nlm.nih.gov/pubmed/25604460
Douglas, [ Links ] L. A., Varlinskaya, E. I., & Spear, L. P. (2003). Novel-object place conditioning in adolescent and adult male and female rats: effects of social isolation. Physiology & Behavior, 80, 317-25.
Ernst, M., Romeo, R. D., & Andersen, S. L. (2009). Neurobiology of the development of motivated behaviors in adolescence: A window into a neural systems model. Pharmacology Biochemistry & Behavior, 93, 199-211. [ Links ]
Ettenberg, A. (1990). Haloperidol prevents the reinstatement of amphetamine-rewarded runway responding in rats. Pharmacology Biochemistry and Behavior, 36, 635-638. [ Links ]
Fabricius, K., Steiniger-Brach, B., Helboe, L., Fink-Jensen, A., & Wörtwein, G. (2011). Socially isolated rats exhibit changes in dopamine homeostasis pertinent to schizophrenia. International Journal of Developmental Neuroscience, 29, 347-50.
Fiala, B., Snow, F. M., & Greenough, W. T. (1977). Impoverished rats weigh more than enriched rats because they eat more. Developmental Psychobiology, 10, 537-41.
Flaherty, C. F. (1996). Incentive relativity. Cambridge: Cambridge University Press. [ Links ]
Flaherty, C. F., Becker, H. C., & Checke, S. (1983). Repeated successive contrast in consummatory behavior with repeated shifts in sucrose concentration. Animal Learning & Behavior, 11, 407-14.
Fone, K. C. F., & Porkess, M. P. (2008). Behavioural and neurochemical effects of post weaning social isolation in rodents-Relevance to developmental neuropsychiatric disorders. Neuroscience & Biobehavioral Reviews, 32, 1087-102. [ Links ]
Fox, F. M., Sterling, R. C., & Van Bockstaele, E. J. (2009). Cannabinoids and novelty investigation: Influence of age and duration of exposure. Behavioural Brain Research, 196, 248-53.
Hall, F. S., Humby, T., Wilkinson, L. S., & Robbins, T. W. (1997). The Effects of Isolation-Rearing on Sucrose Consumption in Rats. Physiology & Behavior, 62, 291-297. [ Links ]
Hall, H., Sedvall, G., Magnusson, O., Kopp, J., Halldin, C., & Farde, L. (1994). Distribution of D1- and D2-Dopamine Receptors, and Dopamine and Its Metabolites in the Human Brain. Neuropsychopharmacology, 11, 245-56.
Hellemans, K. G. C., Benge, L. C., & Olmstead, M. C. (2004). Adolescent enrichment partially reverses the social isolation syndrome. Developmental Brain Research, 150, 103-15.
Hong, S., Flashner, B., Chiu, M., ver Hoeve, E., Luz, S., & Bhatnagar, S. (2012). Social isolation in adolescence alters behaviors in the forced swim and sucrose preference test in female but not in male rats. Physiology & Behavior, 105, 269-75.
Institute of Laboratory Animal Resources (1996). Guide for the care and use of laboratory animals. Washington DC: National Academic Press. [ Links ]
Jahng, J. W., Yoo, S. B., Ryu, V., & Lee, J. (2012). Hyperphagia and depression-like behavior by adolescence social isolation in female rats. International Journal of Developmental Neuroscience, 30, 47-53. [ Links ]
Krank, M., Stewart, S. H., O’Connor, R., Woicik, P. B., Wall, A., & Conrod, P. J. (2011). Structural, concurrent, and predictive validity of the Substance Use Risk Profile Scale in early adolescence. Addictive Behaviors, 36, 37-46.
Lapiz, M. D. S., Fulford, A., Muchimapura, S., Mason, R., Parker, T., & Marsden, C. A. (2003). Influence of Postweaning Social Isolation in the Rat on Brain Development, Conditioned Behavior, and Neurotransmission. Neuroscience and Behavioral Physiology, 33, 13-29. [ Links ]
Morgan, K. N., & Tromborg, C. T. (2007). Sources of stress in captivity. Applied Animal Behaviour Science, 102, 262-302. [ Links ]
Mustaca, A. E., Freidin, E., & Papini, M. R. (2002). Extinction of consummatory behavior in rats. International Journal of Comparative Psychology, 15, 1-10. [ Links ]
Neumark-Sztainer, D., Wall, M., Gou, J., Story, M., Haines, J., & Eisenberg, M. (2006). Obesity, Disordered Eating, and Eating Disorders in a Longitudinal Study of Adolescents: How Do Dieters Fare 5 Years Later? Journal of the American Dietetic Association, 106, 559-68.
Patton, G. C., Coffey, C., & Sawyer, S. M. (2003). The outcome of adolescent eating disorders: findings from the Victorian Adolescent Health Cohort Study. European Child & Adolescent Psychiatry, 12, 25-9.
Phillips, A. G., Vacca, G., & Ahn, S. (2008). A top-down perspective on dopamine, motivation and memory. Pharmacology Biochemistry & Behavior, 90, 236-49.
Schultz, W. (2002). Getting Formal with Review Dopamine and Reward. Neuron, 36, 241-63.
Shanab, M. E., & Ralph, L. (1979). Negative contrast and partial reinforcement effects as a function of crowded rearing conditions in the rat. The Journal of General Psychology, 100, 13-26. [ Links ]
Simon, V. M., Parra, A., Minarro, J., Arenas, M. C., Vinader-Caerols, C., & Aguilar, M. A. (2000). Predicting how equipotent doses of chlorpromazine, haloperidol, sulpiride, raclopride and clozapine reduce locomotor activity in mice. European Neuropsychopharmacology, 10, 159-164. [ Links ]
Sisk, C. L., & Foster, D. L. (2004). The neural basis of puberty and adolescence. Nature Neuroscience, 7, 1040-7. [ Links ]
Spear, L. P. (2000). The adolescent brain and age-related behavioral manifestation. Neuroscience & Biobehavioral Reviews, 24, 417-63. [ Links ]
van Strien, T., van der Zwalum, C. S., & Engels, R. C. (2010). Emotional eating in adolescents: A gene (SLC6A4/5-HTT) – depressive feelings interaction analysis. Journal of Psychiatric Research, 44, 1035-42.
Vanderschuren, L. J. M. J., Niesink, R. J. M., & Van Ree, J. M. (1996). The Neurobiology of Social Play Behavior in Rats. Neuroscience & Biobehavioral Reviews, 21, 309-26.
Wahlstrom, D., Collins, P. White, T., & Luciana, M. (2010). Developmental changes in dopamine neurotransmission in adolescence: Behavioral implications and issues in assessment. Brain and Cognition, 72, 146-59.
Weiss, I. C., Domeney, A. M., Heidbreder, C. A., Moreau, J., & Feldon, J. (2001). Early social isolation, but not maternal separation, affects behavioral sensitization to amphetamine in male and female adult rats. Pharmacology Biochemistry & Behavior, 70, 397-409. [ Links ]
Wiley, J. L., & Evans, R. L. (2008). Evaluation of age and sex differences in locomotion and catalepsy during repeated administration of haloperidol and clozapine in adolescent and adult rats. Pharmacological Research, 58, 240-46.
Citar este artículo como: Cuenya, L., Serafini, M., Mustaca, A. E. & Kamenetzky, G. (2015). Efecto del haloperidol sobre el contraste sucesivo positivo consumatorio en ratas adultas con aislamiento adolescente. Revista Argentina de Ciencias del Comportamiento, 7(2), 30-37.














