Introducción
La alimentación basada en plantas (ABP) se define como un patrón alimentario caracterizado por un elevado consumo de frutas y vegetales, cereales integrales, legumbres, semillas y frutos secos, excluyendo de manera total o parcial el consumo de alimentos de origen animal. En este concepto se incluyen patrones como la alimentación vegana, vegetariana, flexitariana, ovovegetariana, ovolactovegetariana, la dieta DASH (Dietary Approaches to Stop Hypertension) y la dieta Mediterránea, entre otros (1,2).
En Argentina, en el año 2019 el 9% de la población adulta llevaba adelante una alimentación de tipo vegana o vegetariana, aumentando esta cifra al 12% en el año 2020. Además, se destaca que para el año 2020, se sumó otro 12% de la población que refirió tener una alimentación flexitariana (3). Son múltiples las entidades científicas que avalan este tipo de patrón alimentario tanto en la niñez como en la adolescencia, asociándolo a un menor riesgo de desarrollar enfermedades crónicas como sobrepeso y obesidad (4-7).
La enfermedad renal crónica (ERC) en edad pediátrica ha reportado una incidencia de entre 10 a 12 pacientes por millón de habitantes a nivel mundial (8). Entre sus causas más frecuentes se encuentran las anomalías estructurales como la hipodisplasia renal y las uropatías obstructivas (9). En Argentina, el síndrome urémico hemolítico se identifica como la primera causa de insuficiencia renal aguda y la segunda causa de ERC en niños (10).
En lo que respecta a las complicaciones asociadas a la ERC, cabe destacar que de no ser identificadas y abordadas de manera oportuna, pueden impactar de manera negativa en la progresión de la enfermedad (11). Paralelamente, el compromiso renal en sí mismo se asocia con alteraciones en la absorción y/o excreción de nutrientes esenciales para el normal crecimiento y desarrollo de niños, niñas y adolescentes. Sumado a esto, el estado nutricional de las personas con ERC puede estar afectado por factores como la pérdida del apetito, la disbiosis intestinal, la motilidad gastrointestinal alterada, las anomalías urémicas, la acidosis metabólica, entre otros. Por este motivo, evaluar la adecuación de la alimentación y el estado nutricional de estos pacientes es una tarea dinámica, que requiere un adecuado seguimiento y adaptación conforme progresa la enfermedad (12-14).
La evidencia actual sugiere que en población adulta con ERC una ABP podría contribuir a mejorar los parámetros clínicos y disminuir la progresión de la enfermedad (15,16). A pesar de esto, algunos lineamientos de la guía de práctica clínica nutricional “Kidney Disease Outcomes Quality Initiative” KDOQI orientada al abordaje de la ERC en niños, dificultan la adopción de una ABP completa y variada. En este sentido, una de las principales barreras se relaciona con la restricción en el consumo de alimentos incluidos en la ABP por su elevado contenido de potasio (K). Entre ellos se mencionan algunos vegetales, frutas y legumbres (17). Frente a esto surge como interrogante si el realizar restricciones severas en estos grupos alimentarios con el objetivo de tratar o prevenir la hiperpotasemia, podría asociarse a déficits nutricionales que pongan en riesgo el adecuado crecimiento y desarrollo de niños con ERC.
Es por este motivo que la presente revisión plantea como objetivo describir la evidencia de la ABP y su aporte de K en el abordaje nutricional de pacientes pediátricos con ERC.
Materiales y método
Se realizó una revisión narrativa, utilizando como fuente de búsqueda PUBMED, Scielo y el buscador Google Académico. Se incluyeron artículos realizados con diferentes metodologías entre ellos estudios observacionales, estudios controlados aleatorizados (ECA), revisiones sistemáticas y metaanálisis, documentos de posición y guías de práctica clínica. Se contemplaron aquellos que fueron publicados desde el año 2013 a 2023, en idioma español e inglés. Se consideraron los realizados en menores de 18 años, con excepción de aquellos ejes temáticos para los cuales no se encontraron estudios llevados a cabo en población pediátrica. Así, se incluyeron investigaciones realizadas en población adulta, también. Se excluyeron los que fueron realizados en pacientes bajo terapia de reemplazo renal.
Los descriptores utilizados fueron: enfermedad renal crónica; tratamiento nutricional; pediatría; alimentación basada en plantas; vegano; vegetariano; dieta dash; dieta mediterránea; potasio; hiperpotasemia; desmineralización; lixiviación; chronic kidney disease; nutritional treatment; pediatrics; plant based diet; vegan; vegetarian; dash diet; mediterranean diet; potassium; hyperkalemia; demineralization; leaching.
Resultados
Abordaje nutricional en la ERC
Los objetivos de la intervención nutricional en personas con ERC son disminuir la progresión de la patología, la incidencia de sus complicaciones y mejorar la calidad de vida (18,19). En la población pediátrica otro objetivo de relevancia es lograr un adecuado crecimiento y desarrollo. El retraso en el crecimiento lineal es frecuente y se encuentra vinculado con alteraciones electrolíticas, deficiencias nutricionales, acidosis metabólica, uremia, anemia e inflamación crónica, entre otras causas (13). Tradicionalmente, el abordaje nutricional en esta patología se enfoca en el control del aporte de nutrientes como el sodio (Na), fósforo (P), K y en algunos casos, la restricción de líquidos (11). En este sentido la ABP cobra relevancia, ya que gran parte de los alimentos en los que se basa son considerados con un elevado contenido de estos minerales y agua.
Regulación del K corporal
Aproximadamente el 98% del K corporal se encuentra a nivel intracelular (12). Como consecuencia de esa desigual distribución compartimental y la gran capacidad del K para desplazarse entre ambos espacios, pequeñas variaciones pueden llevar a alteraciones en su concentración sérica. Asimismo, y teniendo en cuenta que el K controla el potencial de reposo de las membranas celulares, la hiperpotasemia se presenta como una alteración clínica de gravedad que se asocia a complicaciones como debilidad muscular, parálisis, parestesias y arritmias que pueden llevar a la muerte. Esto evidencia la importancia de mantener un equilibrio en las concentraciones séricas de dicho mineral, lo cual depende de la interacción entre el compartimiento intra y extracelular y de la capacidad de excreción del K del cuerpo.
En cuanto a su eliminación, en personas sanas, el 90% ocurre a nivel renal. Ante una disminución en la cantidad de nefronas funcionantes o alteración en su función, se produce un aumento adaptativo en la secreción de K en las nefronas restantes, para mantener la homeostasis (20). Paralelamente, otro proceso vinculado a la regulación de la potasemia es su eliminación a través del colon. En situaciones fisiológicas, el 10% del K que se absorbe es eliminado a través de la materia fecal.
Por su parte, en personas con ERC este mecanismo cobra relevancia ya que la capacidad del colon para eliminar K es inversamente proporcional a la función renal residual. La evidencia disponible establece que esto sería consecuencia de una mayor secreción de K por parte del intestino y no de una disminución en su absorción. Por este motivo se sugiere que el estreñimiento, es el principal determinante de la hiperpotasemia en personas con ERC y no así la carga dietética de K (21, 22). A su vez, la secreción de insulina juega un papel de relevancia ya que estimula la entrada de este mineral al espacio intracelular, a través de la actividad de la bomba de Na/K ATPasa. Es como consecuencia de este mecanismo que alimentos como frutas, vegetales y legumbres favorecen la entrada de K a la célula ya que generan un mayor estímulo para la secreción de insulina al compararlo con alimentos de otros grupos como las carnes (22).
Recomendación en la ingesta de K y biodisponibilidad
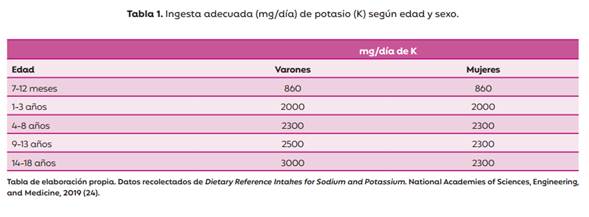
En el año 2019, la Academia Nacional de Ciencias, Ingeniería y Medicina de Estados Unidos actualizó los niveles de Ingesta Adecuada (IA) para algunos nutrientes, entre los que se incluyó al K. Se destaca que estas recomendaciones están dirigidas a la población sana (23). La IA establecida para el K se presenta en la Tabla 1.
No se encontraron recomendaciones para pacientes con ERC en edad pediátrica, con hiperpotasemia o en riesgo de desarrollarla. Por un lado, las guías de práctica clínica (GPC) plantean que hasta la actualidad, no existen datos certeros que permitan establecer de manera precisa cuales son los niveles máximos o mínimos de ingesta de K recomendados para niños con ERC en estadios 2 a 5. Esto se vincula con que dichos valores podrían variar en relación a múltiples factores como la edad y la etapa de crecimiento en la que se encuentre, el estadio de la enfermedad, el peso corporal, las pérdidas de K renales, extrarrenales y la ingesta de medicamentos, entre otros (24).
Si bien las GPC KDOQI 2008 (17) establecen que no hay evidencia que sustente una recomendación específica de ingesta de K en niños; un aporte de 1 a 3 mmol/kg/día permitiría mantener una concentración sérica normal en esta población.
En lo referido a la biodisponibilidad del K, es preciso considerar que los alimentos de origen vegetal no poseen la misma biodisponibilidad que los de origen animal. Esto se debe a que los componentes parcial o completamente indigeribles que conforman las paredes de las células vegetales dificultan la liberación y posterior absorción del K, disminuyendo como consecuencia, su biodisponibilidad. Entre dichos componentes se encuentran la lignina, la pectina, la celulosa y algunos tipos de hemicelulosa. Esto no ocurre en las células animales, motivo por el cual, la biodisponibilidad del K es mayor. A partir de esto, la evidencia actual coincide en estimar la absorción de K de los alimentos de origen vegetal entre el 50 y 60% de su contenido total, el 80% en los de origen animal y el 100% en los aditivos alimentarios (24-27).
En lo que respecta al K inorgánico, su aporte a través de los alimentos se encuentra asociado fundamentalmente al consumo de aditivos alimentarios. Existe una amplia variedad de alimentos y productos ultraprocesados (PUP), que contienen aditivos de K agregado con múltiples funciones como edulcorante, acidulante, espesante, estabilizante y conservante. Entre ellos se mencionan: acesulfame K, cloruro de K, fosfato di o tripotásico, sorbato de K, propionato de K, alginato de K, cremor tártaro. El Código Alimentario Argentino establece la obligatoriedad de declarar su uso de manera cualitativa, pero no cuantitativa. Esto dificulta la posibilidad de conocer con exactitud la cantidad neta de K que se incorpora a través de los alimentos. A pesar de esto, la bibliografía señala que los productos alimentarios que implicarían un mayor aporte de K son aquellos en los que se reduce el contenido total de Na y PUP. Esto se debe a que una de las principales estrategias aplicadas por la industria alimentaria consiste en reemplazar el cloruro de Na, por cloruro de K. En este sentido, un estudio llevado a cabo en Estados Unidos evidenció que los productos reducidos en Na contienen un 44% más de K que sus versiones originales (28). Por ello, las guías KDOQI 2008 desalientan el consumo de sales de K en reemplazo de sal de mesa (cloruro de sodio) o de productos que contengan sales de K, en personas que padezcan ERC (17).
A partir de lo expuesto y teniendo en cuenta las diferencias en la biodisponibilidad del K, no sería conveniente restringir el consumo de alimentos frescos como vegetales, frutas y legumbres como primera medida para la prevención y/o tratamiento de la hiperkalemia. Por el contrario, se debe considerar en primer lugar las variables no alimentarias mencionadas y por último realizar una adecuada selección de alimentos (25). En este punto se destaca la importancia de fomentar el consumo de alimentos frescos y preparaciones caseras y desalentar el de PUP.
Alteraciones del equilibrio ácido-base en ERC
Los riñones cumplen una importante función en el mantenimiento del equilibrio ácido-base a través de la regeneración de iones de bicarbonato y eliminación del exceso de iones de hidrógeno. En personas con ERC, esta capacidad disminuye de manera progresiva a medida que avanza la enfermedad, aumentando el riesgo de desarrollar acidosis metabólica (29). Las consecuencias asociadas a esta complicación incluyen enfermedad ósea, aumento en el catabolismo de proteínas musculares y procesos inflamatorios y disminución de la síntesis de albúmina. También puede llevar a un desplazamiento del K fuera de las células, aumentando los niveles séricos y la probabilidad de desarrollar hiperpotasemia (30).
Osuna Padilla IA, y col. (31) plantean la hipótesis de disminuir la producción endógena de ácidos a través de intervenciones nutricionales ya que los alimentos, una vez metabolizados a nivel hepático, condicionan la formación de compuestos básicos o ácidos. La diferencia entre ambos determina la carga ácida de la dieta.
Los alimentos de origen animal favorecen la formación de compuestos ácidos fundamentalmente por su aporte de lisina, arginina e histidina que son precursores de ácido clorhídrico. Por otro lado, la cisteína y metionina, debido a su contenido en azufre, dan lugar a la producción de ácido sulfúrico (32). Otro compuesto de relevancia en la carga ácida es el P que se encuentra presente en elevadas cantidades en alimentos como carnes, leche y derivados. Sin embargo, la leche y los quesos, a diferencia de las carnes, presentan un importante contenido de calcio (Ca). Este nutriente es precursor de álcalis, por lo que se generaría un efecto compensador.
Por otro lado, los alimentos ricos en K, magnesio y Ca, como frutas, vegetales y legumbres, son precursores de compuestos alcalinos. Las sales de K (citrato y malato) contenidas en frutas y verduras, al ser metabolizadas llevan al consumo de iones de hidrógeno, generando un efecto alcalinizante. El contenido de P de los alimentos de origen vegetal se encuentra asociado al fitato, lo que reduce su biodisponibilidad y en consecuencia el efecto acidificante. A su vez, los alimentos ricos en glutamato requieren de la utilización de iones de hidrógeno para su metabolización, lo que podría generar un efecto neutralizante de la carga ácida. Es por esto que llevar a cabo una ABP se asocia con una carga ácida menor (30).
La carga ácida renal potencial (CARP) permite estimar la producción endógena de ácido en exceso en relación al nivel de álcali producido por una cantidad determinada de alimentos ingeridos. Los valores negativos indican un exceso de formadores de bases y los positivos de formadores de ácidos (33). No se hallaron estudios realizados en niños en los que se compare la CARP de una alimentación omnívora con la de una ABP. En población adulta, los resultados obtenidos por Müller A, et al. (34) reflejan un valor de mediana de CARP de -22,7 (RIC: 21; 25) mEq/día para una dieta vegana y de 15,47 (RIC: 13; 51) mEq/día en una dieta omnívora, siendo esta diferencia estadísticamente significativa (p<0,001). Estos resultados concuerdan con lo planteado por Storz M, et al. (35).
En cuanto a población pediátrica, estudios realizados tanto en niños sanos como en quienes padecen ERC coinciden en sus hallazgos. El consumo de proteínas superior a los valores recomendados para la edad se asoció con valores de CARP positivos. Asimismo, se evidenció una correlación positiva estadísticamente significativa entre el consumo de carne y una CARP ácida (r=0,41; p≤0,01), así como con el consumo de proteínas (r=0,54; p≤0,01), energía (r=0,32; p≤0,01) y grasas (r=0,42 p≤0,01) (36). Este patrón alimentario se caracterizó también, por un consumo bajo de frutas y vegetales al compararlo con las recomendaciones actuales. Estos resultados concuerdan con los reportados por Moreno G, y cols. (37). Por último, la ingesta de vegetales se correlacionó de manera negativa y estadísticamente significativa con la CARP (r=-0,405; p≤0,032) (37).
La evidencia demuestra que una elevada carga ácida lleva a un aumento en la producción de amonio por parte de las células tubulares, lo que se acompaña de un aumento en la secreción de compuestos como endotelina-1, angiotensina II y aldosterona. Estas sustancias estimulan la producción de factores profibróticos. Es por esto que llevar a cabo dietas con una elevada carga ácida de manera prolongada en el tiempo, se asocia con una progresión más acelerada de la ERC (31). Si bien los mecanismos fisiológicos implicados podrían replicarse en población pediátrica, no hay estudios realizados que permitan extrapolar estos resultados, por lo que se requieren más investigaciones en esta área.
Alteraciones en la microbiota intestinal en ERC
Los cambios en la composición del microbioma intestinal en la ERC son frecuentes y se encuentran asociadas al consumo prolongado de antibióticos, la toxicidad urémica, la propia pérdida de la función renal y al consumo disminuido de fibra alimentaria, entre otras variables. En estos pacientes, se produce una alteración cuali y cuantitativa del microbioma desde estadios precoces de la enfermedad, caracterizada por un aumento en el número de bacterias proteolíticas (Clostridium y Bacteroides) y una disminución de las sacarolíticas (Bifidobacterias y Lactobacillus) (38, 39). Estas últimas generan ácidos grasos de cadena corta (AGCC) como el propionato, butirato y acetato que tienen un importante efecto trófico e inmunomodulador sobre el epitelio intestinal. En contraposición, las bacterias proteolíticas, dan lugar a la formación de sustancias como amonio, tioles, fenoles e indoles que son precursores de toxinas urémicas. Son compuestos generados a partir de precursores presentes en la dieta, luego de ser absorbidos y metabolizados a nivel hepático.
A su vez, las concentraciones elevadas de urea en sangre y de bacterias con actividad ureasa, agotan los constituyentes proteicos de las uniones estrechas del epitelio intestinal aumentando la permeabilidad. Esto favorece la translocación de productos bacterianos de origen intestinal (toxinas urémicas) que activa la inmunidad innata. Como consecuencia, se exacerba el estado inflamatorio asociado a la ERC, aumenta la disfunción orgánica, la incidencia de enfermedad cardiovascular (ECV) y la mortalidad (31). Al menos cinco toxinas urémicas se han asociado con ECV y mortalidad en la ERC: sulfato de indoxilo (IS), ácido indol-3 acético, sulfato de p-cresilo (PCS), óxido de trimetilamina y fenilacetilglutamina. En lo que respecta a su formación, el PCS se produce a partir de un precursor que se obtiene del metabolismo de la fenilalanina y la tirosina por parte de las bacterias anaeróbicas del intestino. Por su parte, el óxido de trimetilamina se obtiene a partir del metabolismo a nivel intestinal de aminas cuaternarias presentes en las carnes rojas, yema de huevo, hígado, productos lácteos y pescados de agua salada. Entre los efectos en la salud, la evidencia establece que tanto el PCS como el IS presentan asociación con mayor progresión de la ERC, procesos de fibrosis y daño de las células del túbulo renal. El aumento en la concentración de IS también se asoció con un aumento de la rigidez arterial y calcificaciones en la arteria aorta (40). Por su parte el ácido indol-3 acético se asoció a mayor estrés oxidativo e inflamación (41).
La disponibilidad de nutrientes en la luz intestinal es uno de los principales mecanismos moduladores de la microbiota, fundamentalmente la relación entre nitrógeno/carbohidratos. Es por esto que una ABP, debido a su aporte de fibra, tendría un efecto beneficioso para el crecimiento de las bacterias sacarolíticas y una consecuente disminución en la producción de toxinas urémicas por parte de las bacterias proteolíticas. En este sentido, en el estudio realizado por Rossi M, et al. (42), el índice proteína/fibra se correlacionó de manera estadísticamente significativa con menores concentraciones de IS (r=0,4; p=0,012) y PCS (r=0,43; p=0,005).
Relación entre el K ingerido y la concentración sérica
La disminución en el aporte de K alimentario, a través de la restricción y selección de alimentos fuentes, es una de las prácticas más difundidas y sugeridas entre las principales GPC para tratar la hiperpotasemia en personas con ERC (17). A pesar de esto, pocos son los estudios que investigaron el impacto de la reducción de K alimentario en la concentración sérica del mismo, mostrando una débil asociación entre dichas variables (23). Hasta la actualidad, es escasa la información sobre esta relación en población pediátrica. El Amouri A, et al. (25) llevaron a cabo un estudio en niños con ERC en estadíos 1-5 a través del cual no se encontró asociación entre la ingesta dietética de K y la concentración sérica del mismo (p=0,40). Paralelamente se evidenció que, ante una disminución de 1 g de K diario a través de alimentos, la ingesta media diaria de fibra disminuyó 5,1 g en relación a su valor inicial (IC 95% 4,3-5,9 g/día; p<0,001). Esto podría tener un impacto nutricional relevante, debido a los beneficios a los que se asocia el adecuado consumo de fibra.
Por otro lado, los resultados del estudio CKiD realizado en pacientes pediátricos con ERC reflejaron que la ingesta media de K para todos los grupos de edad fue inferior a la IA establecida por el Instituto de Medicina de Estados Unidos (IOM) para personas sanas. Finalmente, los autores destacaron que, si bien se recomienda una restricción en la ingesta de K para los niños con ERC estadíos 1-5D, no existe evidencia suficiente para establecer de manera concreta dicha restricción (43).
Selección de alimentos: contenido total de K vs relación K/fibra
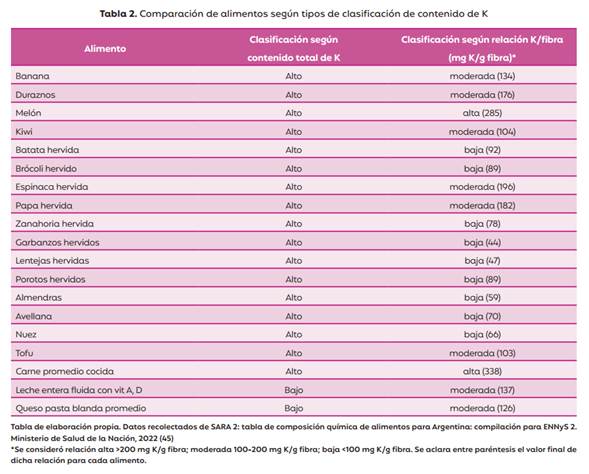
Tradicionalmente se clasifica a los alimentos según su contenido neto de K. Las GPC los categorizan en alimentos de bajo contenido a los que aportan menos de 200 mg por porción o menos del 3% del valor diario (VD) del requerimiento de K y de alto contenido, a aquellos que contienen 200 mg por porción o más o cantidades superiores al 6% del VD (17, 44). Sin embargo, en los últimos años se propone una nueva forma de clasificación, considerando la relación entre los mg de K aportados por cada g de fibra. En función de este criterio, se pueden establecer 3 categorías: alimentos con una relación <100 mg K/g fibra, entre 100-200 mg K/g fibra y >200 mg K/g fibra (21) (Tabla 2).
Este enfoque permite hacer una valoración global de los alimentos ya que contempla la presencia de compuestos como la fibra, la cual afecta de manera considerable su biodisponibilidad. Esto explica por qué alimentos como las frutas secas cambiarían su clasificación. Por otro lado, alimentos ampliamente aceptados por los niños como la papa y banana si bien son de alto contenido en K, tienen una relación K/fibra moderada. De manera opuesta, los de bajo contenido en fibra como el melón, no modifican su clasificación. La leche y los quesos carecen de fibra. Esto hace que cambien hacia una categoría mayor; pasando de tener un bajo contenido total de K a una relación k/fibra moderada. Contar con esta información resulta relevante para repensar las estrategias de intervención nutricional, disponer de instrumentos para valorar la ingesta de alimentos y su frecuencia de consumo, priorizando aquellos con una relación K/fibra baja y moderada. Esto favorece la inclusión de una mayor variedad de alimentos, al mismo tiempo que garantiza un adecuado aporte de fibra manteniendo los beneficios de su consumo.
Paralelamente, se plantea intervenir sobre las potenciales causas no alimentarias de hiperpotasemia como primera medida antes de realizar modificaciones dietéticas. Luego, comenzar con la restricción de PUP y por último, en aquellos niños con hiperpotasemia persistente, reducir el consumo de alimentos ricos en K, iniciando por aquellos con una bajo valor nutricional (23). En esta instancia, se propone considerar la relación mg de K/g de fibra como criterio de selección de los mismos.
Efecto de las diferentes técnicas de cocción sobre el contenido de K de los alimentos
Una de las técnicas culinarias más difundidas y utilizadas para reducir el contenido total de K de los alimentos, es la lixiviación. Se trata de un proceso mediante el cual se transfieren sustancias de un componente sólido hacia una fase líquida con la que se encuentra en contacto. Como consecuencia de este proceso, ambas fases cambian su composición química. En lo que respecta a los alimentos, ocurre durante la cocción en medios acuosos o en el remojo en agua.
Si bien esta técnica permitiría reducir el contenido de K, es necesario tener en cuenta que también pueden ocurrir pérdidas significativas de otros nutrientes hidrosolubles, por lo que es relevante contar con el asesoramiento de un licenciado en Nutrición que indique cómo realizarlo y cuáles son los alimentos que se van a someter a este proceso.
A su vez, el porcentaje de pérdida a través de la lixiviación está condicionado por múltiples variables, entre ellas por la cantidad total del nutriente del alimento, la matriz en la que se encuentra contenido, el área de exposición y de contacto con el agua, el volumen de líquido, la temperatura y las características químicas de éste y el tiempo de contacto.
Por lo expuesto, los resultados referidos a la pérdida por lixiviación de K en los alimentos resultan poco concluyentes, incluso contradictorios reportándose porcentajes de pérdida variables entre 16 y 75% (17,46). Estas diferencias podrían relacionarse, además, con la amplia variedad de alimentos evaluados, cada uno de ellos con una composición y estructura celular diferente. Sin embargo, la aplicación del remojo fundamentalmente en vegetales de alto contenido en K, es una de las técnicas más difundidas para la reducción del contenido del mismo. Parte de la evidencia la posiciona como una técnica eficaz (17). La realización de cambios del agua de remojo durante el proceso no implicaría una pérdida extra.
También, se destacan los resultados encontrados en relación a las pérdidas de K a través de la congelación de los alimentos. Esta técnica lleva a la formación de cristales de agua que rompen la estructura celular favoreciendo la lixiviación de K durante la cocción posterior a la descongelación. Es por esto que se lograrían pérdidas significativas en el contenido de K de los alimentos. Paralelamente, las legumbres enlatadas presentan un bajo contenido de K debido al proceso de cocción previo, posicionándose como una alternativa de gran utilidad por su alto valor nutricional y practicidad para su consumo (47-50).
Otro punto a considerar es la falta de estudios en donde se valore la aceptación de los alimentos luego de aplicar las diferentes técnicas culinarias descritas, ya que podrían afectar las características organolépticas y en consecuencia, su palatabilidad y adherencia al tratamiento.
Conclusiones
La ERC es un importante problema de salud por la elevada prevalencia y morbimortalidad a la que está asociada. El diagnóstico precoz permite iniciar un tratamiento oportuno y disminuir su progresión. Uno de los pilares de su abordaje es el tratamiento nutricional, mediante la restricción en el aporte de nutrientes críticos como el K. En contrapartida, este tipo de medidas se traduce en una disminución de la variedad de alimentos ingeridos, fundamentalmente los de origen vegetal. Esto tendría un impacto negativo sobre todo, en quienes realizan una ABP.
En relación a la ingesta de K, se destaca que no existen en la actualidad recomendaciones de ingesta específicas para niños con ERC. Lo cual, refuerza la importancia de realizar un seguimiento individualizado y una evaluación conjunta tanto del consumo de alimentos con un elevado contenido en K como de la fluctuación de los valores sanguíneos de quienes padecen ERC. En este punto, la evidencia que asocia de manera significativa la ingesta de K y su concentración sérica, es escasa. Por lo que es de relevancia considerar los factores no alimentarios que puedan alterar los valores en sangre antes de realizar intervenciones nutricionales que limiten la variedad y la calidad de alimentos incluidos por los pacientes.
En lo que respecta a la selección de alimentos, se recomienda como primera medida disminuir el consumo de PUP. Luego, se sugiere clasificarlos según la relación K/fibra ya que permitiría incluir una mayor variedad de alimentos en la dieta de niños con ERC con hiperpotasemia, considerando la frecuencia de consumo de éstos para evitar restricciones que no lleven a cambios clínicamente significativos. Por último, cabe mencionar que en cuanto a las pérdidas de K a través de diferentes técnicas culinarias, los datos no son concluyentes.
A modo de conclusión, llevar a cabo una ABP tendría importantes efectos beneficiosos entre los que se destaca disminuir la carga ácida de la dieta, favorecer la pérdida de K a través de las heces y contribuir al crecimiento de bacterias sacarolíticas que ayuden a mantener la integridad de la barrera intestinal. Lo expuesto, refleja el desafío que representa para los licenciados en Nutrición el abordaje nutricional de niños con ERC contribuyendo al control de la patología sin afectar el crecimiento y desarrollo.