Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Argentina de Ortopedia y Traumatología
versión On-line ISSN 1852-7434
Rev. Asoc. Argent. Ortop. Traumatol. vol.76 no.1 Ciudad Autónoma de Buenos Aires ene./mar. 2011
INSTRUCCIÓN ORTOPÉDICA DE POSGRADO
Ingeniería de tejidos en el aparato musculoesquelético
Horacio Alberto Caviglia, Ana Douglas Price, María Eulalia Landro y Jorge Romanelli
División de Ortopedia y Traumatología, Centro de Cultivo Celular , Hospital General de Agudos Dr . Juan A. Fernández
Recibido el 3-2-2011.
Correspondencia: Dr. HORACIO ALBERTO CAVIGLIA jfernandezortopedia@hotmail.com
Los principios básicos de la ingeniería se han aplicado en la ortopedia desde el comienzo de la práctica de la especialidad, con el fin de corregir deformidades congénitas o adquiridas. Los egipcios fueron los primeros que sustituyeron los tejidos musculoesqueléticos perdidos por medio de una prótesis de madera (Fig. 1).

Figura 1. El Mundo. Descubren en Egipto la prótesis más antigüa del mundo. [en línea]. El Cairo / Madrid. 2007. [Citado el de julio de 2007] [1 pantalla]. Disponible en: <http://www.historiaclasica.com/2007/07/descubren-en-egipto-la-protesis-ms.html>
Según cuenta la historia, en la Edad Media, los hermanos Cosme y Damián reimplantaron los miembros de un moro a un cristiano (Fig. 2). Eran gemelos, hijos de madre cristiana, nacidos en Egea (Arabia Saudita) e instruidos en Siria. Como no cobraban honorarios, recibieron el apelativo de deanargiras, palabra griega que significa "sin plata". Decapitados el 27 de septiembre de 287, en la ciudad de Ciro, Siria, durante la persecución desatada por el emperador Diocleciano, fueron santificados por la Iglesia varios siglos después.

Figura 2. Milagro de los santos Cosme y Damián (1547) del escultor español Isidro de Villoldo, Museo de escultura de Valladolid, España.
Los primeros implantes para colocar dentro del cuerpo a fin de remplazar los tejidos dañados o perdidos datan del siglo XIX. En 1890, Themistocles Gluck realizó el primer reemplazo total de cadera, con una prótesis de marfil, que fijó al hueso con piedra, yeso y colofonia. Es interesante conocer que en los Anales de la Sociedad Germana deMedicina consta que allí se discutió si la prótesis debía o no cementarse.20 Cuatro años más tarde, Pean en la Gazeta, del Hospital de París, observó que en los pacientes que recibían este tratamiento se producía la resorción ósea; esta fue la primera descripción de la lisis.45
Siempre se pensó en reemplazar los tejidos dañados, perdidos o degenerados por tejidos vivos, lo cual podría realizarse en tres formas:
a) trasladando tejidos sanos del propio paciente a la zona afectada, ya sea mediante colgajos rotatorios o libres; b) estimulando in situ los tejidos dañados con el fin de obtener respuestas de reparación y regeneración, o c) mediante la producción de los tejidos in vitro y el posterior trasplante al paciente.
El primer punto no será tratado en este artículo, que se centrará en la posible regeneración del tejido, ya sea in vivo o in vitro.
El concepto de medicina regenerativa se basa en el desarrollo de tecnologías o procedimientos invasivos o no invasivos para la regeneración del tejido in vivo. Para estimular las respuestas de reparación y regeneración, se han utilizado diferentes técnicas de distinta complejidad, como la aplicación de estímulos mecánicos, de ultrasonido o electromagnéticos, o procedimientos más sofisticados, como la utilización de factores de crecimiento, trasplantes celulares, terapia génica y matrices de hueso desmineralizado, entre otros.32
La ingeniería de tejidos (IT) puede definirse como la utilización combinada de células, biomateriales y factores químicos para reparar tejidos lesionados o enfermos. Actualmente combina el aporte de células que se colocan sobre una malla, a las cuales se les pueden añadir factores que aceleran su proliferación, para trasplantarlas después al lugar de la lesión y conseguir su regeneración.18
El punto crítico de las estrategias que usa la IT es la expansión de células en cultivo para poder generar mayor número de células, ya sea para la producción de un tejido in vitro, o para la implantación de células en suspensión o en matrices para la regeneración del tejido in vivo.56
Una de las ventajas de sintetizar tejido in vitro es que se lo puede medir mientras se está formando, así como evaluar su capacidad funcional antes de la implantación.
La principal desventaja, en particular en la producción de tejidos musculoesqueléticos, es la ausencia de los estímulos fisiológicos y mecánicos durante su formación, lo cual impide una adecuada regulación celular y el desarrollo espacial del tejido, con la consiguiente disminución de su calidad mecánica.
Otra desventaja de la formación de tejido fuera del cuerpo es lograr su incorporación después del implante. La unión del tejido implantado con el órgano requiere remodelación, degradación y formación de tejido nuevo. La remodelación del tejido implantado es esencial para la funcionalidad de este.56
Cuando se intenta regenerar un tejido in vivo, la gran ventaja en el sistema musculoesquelético es que el tejido en formación está expuesto a todos los estímulos fisio-mecánicos que permiten su desarrollo con la estructura espacial y mecánica necesaria. Sin embargo, el problema radica en que dicho tejido en regeneración puede ser dañado por las fuerzas mecánicas que actúan normalmente en el lugar, antes de que se forme e incorpore por completo.56
Existen cuatro antecedentes en el siglo pasado que fueron fundamentales para el desarrollo de la ingeniería tisular: las experiencias de Urist, en 1965, que observó la regeneración del hueso por autoinducción, y de Green, en 1977, que obtuvo el desarrollo de células cartilaginosas en el conejo. En el trabajo de Amiel y cols. se investigó la respuesta de α-β FGF y TGF-β en el ligamento cruzado anterior (LCA) y en el ligamento cruzado medial (LCM) de los conejos. Ambos factores de crecimiento no ejercieron efectos significativos en la proliferación celular luego de 48 horas en cultivo.1,5,22,62
Los trabajos de Yanna aplicaron la ingeniería tisular usando una malla porosa de colágeno-glucosaminoglucano para la regeneración de la dermis in vivo. Este descubrimiento facilitó el diseño para la aplicación de esas matrices en forma tubular para la regeneración nerviosa.65,66
Mediante la combinación de células, factores de crecimiento o biomateriales, los principios de la ingeniería tisular pueden utilizarse para la formación de una amplia variedad de tejidos conectivos, como hueso, cartílago, ligamento o tendón, tanto in vitro como in vivo.37
El desafío es la óptima selección de la combinación de biomateriales, células, factores solubles, teniendo en cuenta la interacción entre ellos y con el huésped, para resolver un problema clínico particular.
En la última década se progresó mucho en el desarrollo y la expansión de las células en cultivo. La mayor dificultad consistía en evitar la dispersión de las células cultivadas una vez colocadas en el lugar de la lesión. Uno de los avances tecnológicos más importantes fue la producción de mallas porosas y reabsorbibles, necesarias para contener las células y favorecer así la formación del tejido, tanto in vitro como in vivo. Se diseñaron mallas de materiales naturales, de polímeros sintéticos y de fosfato de calcio para la ingeniería de tejidos blandos y duros.
Se define biomaterial a cualquier sustancia o combinación de sustancias, de origen natural o sintético, diseñadas para actuar en la interfaz con sistemas biológicos a fin de evaluar, tratar, aumentar o sustituir algún tejido, órgano o función del organismo humano.10 Según su origen, los biomateriales pueden ser naturales, como el colágeno o la seda; o sintéticos, como los metales, las cerámicas y los polímeros.
Una malla sirve como un molde temporal que puede mantener las células y mejorar la regeneración del tejido. El paso crítico de esta estrategia es imitar las características de la membrana extracelular (MEC), de modo que provea a las células de la estabilidad mecánica y del ambiente apropiados para el crecimiento y la migración del tejido.31
Las mallas cumplen diversas funciones. Su estructura permite la adhesión celular, tanto endógena como exógena, soportando la migración celular. Además, facilitan y regulan los procesos al interactuar con la matriz extracelular. También mantienen la forma del defecto del tejido dañado, previenen la distorsión del tejido circundante y actúan como una barrera para prevenir la infiltración de este, que dificultaría el proceso de regeneración.26
La malla ideal debe crear un espacio para que las células huésped puedan sobrevivir transportando nutrientes y metabolitos; además, actúa como soporte para los tejidos en crecimiento y orienta la respuesta biológica de los tejidos circundantes. Debe ser biodegradable para reducir al mínimo la toxicidad y su fabricación debe ser muy accesible para que su costo no sea una limitante para utilizarla en el procedimiento.
Es importante que los productos de ingeniería tisular sean seguros y eficaces. Seguros significa que no produzcan la contaminación del huésped por agentes virales ni bacterianos.26
Miot demostró que la composición y la arquitectura de la malla afectan el crecimiento de la célula en ella.41 También su conformación química afecta la expresión fenotípica y la adherencia de las células en crecimiento. La construcción de las mallas ha sido posible gracias al desarrollo de nuevas tecnologías.57
La matriz extracelular es el medio natural en el que las células proliferan, se diferencian y posteriormente migran, facilitando así el proceso reparador.8,40
La composición de la MEC está dada por un equilibrio dinámico entre la regeneración, diferenciación y muerte celular, y la formación y degradación de las proteínas que, junto con los polisacáridos, forman esta red.40
Las propiedades dinámicas de la MEC son controladas por los proteoglicanos y diversas moléculas de señalización, como los factores de crecimiento que median las interacciones entre células, y entre las células y la MEC.16,23,58
Un ejemplo clásico de señalización es lo que ocurre en el tejido óseo. Los osteocitos están bien posicionados (mecanorreceptores) para cumplir esta función, ya que serían objeto de recepción de fuerzas; luego la señal se transmite a través de los canalículos y llega a las células del endostio y al sistema vascular. Por lo tanto, la señal de las células del sensor llega a las células efectoras, es decir, a los osteoblastos para formar hueso y a los osteoclastos para la resorción ósea y, a medida que se requiera, forman o quitan la matriz ósea de acuerdo con la carga mecánica19,60 (Fig. 3).
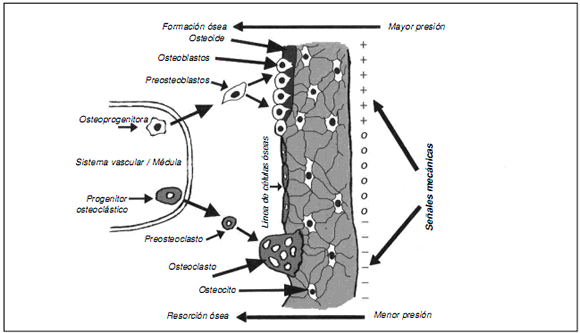
Figura 3. Señalización celular en el tejido óseo.
Los factores de crecimiento son proteínas específicas para la señalización celular, que controlan la proliferación, diferenciación y migración celular y, así, la formación del neotejido.
Con respecto a la fabricación de las mallas, en un principio se utilizaron productos orgánicos naturales, como el colágeno y el ácido hialurónico.7,9,44
El colágeno se usa principalmente para la regeneración de los tejidos blandos. Si bien los materiales naturales suelen presentar escasas propiedades mecánicas, son interesantes porque no generan la respuesta inmunitaria del huésped, mejoran el reconocimiento biológico del tejido en formación y fomentan el correcto funcionamiento de este.11
El ácido hialurónico modificado químicamente mejora las propiedades mecánicas, pero no es bien reconocido por las células, lo que perjudica su actividad biológica.9 Se han diseñado geles de ácido hialurónico y colágenos como mallas en IT, ya que estas estructuras se asemejan a la organización de la matriz extracelular en los tejidos blandos.64
Posteriormente, comenzaron a utilizarse diversos poliésteres biodegradables aprobados por la FDA (Food and Drug Administration) en seres humanos, como el ácido poliglicólico (PGA), el ácido poliláctico (PLA) y sus copolímeros, el ácido poliláctico-poliglicólico, ampliamente usados en la reparación de hueso y de cartílago.2,54,61
También se utilizaron para la fabricación de mallas materiales inorgánicos como la hidroxiapatita y el tricalcio fosfato, empleados en la reincorporación de tejidoóseo.53 En el proceso de morfogénesis del tejido, la presencia de factores de crecimiento en forma soluble ordena la actividad y controla la formación y organización del neotejido.16,58
La presencia de estos factores de crecimiento en las mallas genera señales biológicas relacionadas con los gradientes de quimiotaxis, que son los encargados de transformar un neotejido en un sustituto funcional del aparato musculoesquelético.6 El problema es que los factores de crecimiento in vivo son rápidamente digeridos por el medio y el crecimiento del tejido requiere un nivel constante de estos factores en el tiempo. Por eso, se diseñaron microesferas porosas que liberan los factores lentamente, de acuerdo con las necesidades de los tejidos y esto se debe a su conformación diseñada en el laboratorio con diferentes canales para la liberación del sustrato51 (Fig. 4).
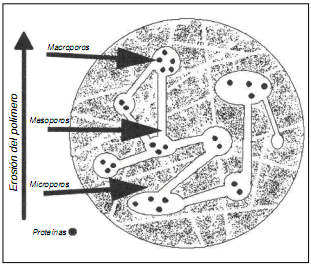
Figura 4. Microesferas para el transporte de Fc.
Las microesferas porosas se adhieren a la malla y pueden contener factor de crecimiento fibroblástico (TGF-β1) en microesferas de chitosan, o la combinación de factor de crecimiento vascular endotelial (VEGF) y factor de crecimiento derivado de plaquetas (PDGF) en microesferas de PLGA, por ejemplo.46,48
Otro método avanzado -el trasplante de genes- plantea el uso de genes con fines terapéuticos para diversas patologías que facilitan el proceso reparador. Esto puede llevarse a cabo de dos formas: in vitro, mediante transferencia génica a una célula que se cultiva in vitro para luego ser transferido; o in vivo, cuando el gen es transferido directamente al paciente mediante vectores virales.3,35 Una ventaja de las mallas y de la ingeniería tisular reside en que es posible transferir genes a las células para selectas citocinas y factores de crecimiento que pueden facilitar la reparación52,55 (Fig. 5).
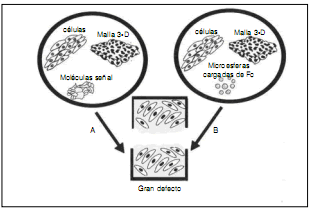
Figura 5. Conjunto de malla 3D, células, moléculas y microesferas para transporte de factor de crecimiento en los defectos tisulares.
Aplicaciones actuales
La reparación del daño del cartílago es una problemática todavía no resuelta y la ingeniería tisular brinda una de las mejores oportunidades para lograrlo. Se ha creado una nueva técnica que permite la combinación de las células (condrocitos o células madre) y mallas 3D para el trasplante de condrocitos al lugar del defecto condral. El biomaterial que se ha de utilizar es crucial para la estabilidad temporal del trasplante, ya que sirve como molde para el crecimiento celular de los condrocitos y garantiza la formación de tejido cartilaginoso a través de la síntesis de la MEC.49
Se aplicaron recientemente a la clínica diferentes trasplantes de condrocitos en matrices bioabsorbibles de colágeno,4 ácido hialurónico,38 y copolímeros de ácido poliláctico y glicólico (PLGA)43. La fijación depende de las propiedades mecánicas del implante, y del tamaño y la localización del defecto.15
Otra posibilidad es el implante de células madre mesenquimáticas (CMM) derivadas de otros tejidos del paciente, por su conocida capacidad de diferenciación a condrocitos, en solución42 o en matrices, pero los resultados son controvertidos.49
El uso de mallas en la reparación del cartílago simplifica el cultivo de células sembradas en la parte superior de una matriz cerámica, con buenos resultados. En una investigación se utilizaron condrocitos ovinos en una malla porosa de fosfato de calcio y se los cultivó durante 8 semanas in vitro antes de implantarlos en una oveja. Se generó tejido cartilaginoso integrado con el cartílago de los alrededores y creció tejido óseo en la malla 9 meses después de la implantación.29
También se probaron polímeros sintéticos (PLA, PGLA) para reparar el tejido osteocondral, cultivando una malla con CMM en un medio especial, a fin de mantener los fenotipos condrogénicos y osteogénicos hasta la implantación definitiva.59
La reparación de las fracturas y los defectos óseos podrá también efectuarse mediante procedimientos de ingeniería tisular.
Estudios recientes realizados en la Universidad de Columbia mostraron, en defectos óseos particulares, en este caso en la mandíbula, la posibilidad de fabricar piezas funcionales de hueso humano in vitro usando células madre mesenquimáticas y un sistema de malla-biorreactor, adaptando la pieza obtenida a las características específicas del paciente. El implante se realizó con éxito en un defecto mandibular. Esta práctica tiene gran potencial para la reconstrucción ósea después de defectos congénitos, cáncer, resecciones y traumas (Fig. 6).21
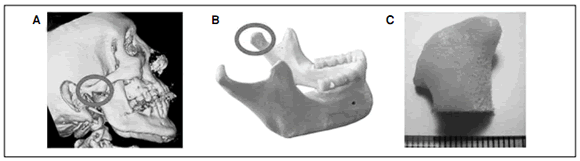
Figura 6. Injertos óseos realizados anatómicamente por ingeniería tisular (A-C). Grayson WL, Frohlich M, Yeager K, Bhumiratana S, Chan M, Cannizzaro C, Wan LQ, Liu XS , Guo E, Vunjak-Nvakovic G. Engineering anatomically shaped human bone grafts. PNAS, 2010: 107 (8): 3299-3304.
En un estudio clínico piloto se utilizó, para la reparación de un defecto óseo de gran tamaño, una combinación de CMM en una malla cerámica de hidroxiapatita que fueron trasplantadas en el lugar de la lesión. No hubo complicaciones y se observó la fusión completa entre el implante y el hueso del paciente entre los 5 y los 7 meses después de la cirugía.39
Probablemente, en el futuro, estas técnicas suplirán al injerto de banco cadavérico en los defectos estructurales. Consideramos que el secreto va a residir en el manejo del espacio tisular dañado. El cirujano deberá aplicar técnicas quirúrgicas para mantener el espacio tisular, esto es, impedir su ocupación por tejido fibroso y generar un tejido periespacio vascularizado. Esto se puede lograr con la colocación de un espaciador de cemento.
En los casos en que el espacio tisular dañado ya esté ocupado por tejido fibroso, este se debe resecar y colocar un expansor hasta que se logre el diámetro deseado. Posteriormente se coloca un espaciador de cemento para obtener un periespacio vascularizado y recién entonces se coloca la malla con las células cultivadas, debiendo utilizar un implante de fijación externa para la estabilización mecánica del hueso (Fig. 7).

Figura 7. Sustitución del defecto óseo por una malla.
También se han realizado progresos en ingeniería tisular para tratar de resolver las lesiones de los ligamentos y tendones.
La solución ideal sería la completa restauración del tendón o ligamento al estado de prelesión. El objetivo de este promisorio campo de la ingeniería tisular es incorporar tipos especiales de células en una matriz biodegradable que, cuando sean implantadas, regeneren gradualmente un tejido similar al original y se restaure su función.30
Como ya se dijo, las terapias de ingeniería de tejidos dependen de la estimulación de los factores de crecimiento para inducir la proliferación y diferenciación celular y permitir así la formación de tejido en el sitio requerido. Los estudios recientes mostraron la importancia de los factores de crecimiento en la reparación del tejido, tanto in vivo como in vitro.14
Está demostrado que el uso de estos factores favorece la recuperación de las lesiones de ligamento. Se utilizaron distintos factores de crecimiento, como el factor de crecimiento fibroblástico (FGF), el factor de crecimiento transformador β (TGF-β), el factor de crecimiento derivado de las plaquetas (PDGF), el factor de crecimiento epidérmico (EGF), el factor de crecimiento de tipo insulina (IGF), el factor de crecimiento y diferenciación (GDF) y el factor de crecimiento nervioso (NGF) para mejorar la vascularización y la formación del nuevo tejido.25
Murray y cols. evaluaron el tratamiento mediante un complejo bioactivo de colágeno-PRP (plasma rico en plaquetas) para la curación del ligamento cruzado anterior, con buenos resultados, ya que permitió la formación del tejido y mejoró las propiedades estructurales de complejo fémur-LCA-tibia después de la reparación primaria del ligamento en cerdos. Sin embrago, el uso de colágeno solo como malla no fue eficaz en la reparación del ligamento.17,27,50
La aplicación de células madre mesenquimáticas autólogas tiene un gran potencial en IT. Se implantaron CMM autólogas en ratas con lesión del LCA y se formó tejido sano. Las CMM sirven como vehículo para distintas moléculas; además, tienen la capacidad de transformarse en fibroblastos y promover por sí solas la reparación del ligamento.28
También se ha demostrado que las biomatrices derivadas de una membrana extracelular, como la de la mucosa intestinal del cerdo y de la membrana urinaria vesical, soportan bien la regeneración tisular y pueden permitir la reparación de ligamentos y tendones.33,34
La mucosa intestinal del cerdo está mayormente formada por colágeno; contiene, además, citocinas y factores de crecimiento, como FGF y TGF-β.25,27
Lu y cols. informaron sobre el diseño de una malla para la regeneración de la interfaz ligamento cruzado anterior-hueso in vivo, que consiste en tres fases continuas: una de PLGA para el cultivo de fibroblastos y la formación de tejido blando; la segunda fase, de esferas de PLGA, es la que intenta formar el fibrocartílago; la tercera fase está compuesta por PLGA y microesferas para el cultivo de osteoblastos y la formación de hueso. Se observó crecimiento celular a los 2 meses posteriores a la implantación.36,50
Los nervios periféricos tienen la capacidad de autorregenerarse; algunos no lo logran y deben ser restaurados quirúrgicamente. El implante de nervio autólogo ofrece material rico en células a partir de las cuales los axones pueden regenerarse, pero esta práctica no es recomendada por la morbilidad del sitio de donde se obtiene el implante.Avances recientes en IT introdujeron conductos nerviosos sintéticos, capaces de tender un puente en defectos pequeños de nervios periféricos, que protege al nervio del tejido circundante y de la formación de cicatrices, y sirve como guía para la regeneración axonal.63
La regeneración nerviosa requiere un complejo juego entre las células, la matriz extracelular y los factores de crecimiento. Estos últimos cumplen un papel importante al controlar la supervivencia, migración, proliferación y diferenciación de varios tipos celulares en ese proceso.47
Otra estrategia es el trasplante celular de células de Schwann, las cuales tienen una función central en la regeneración nerviosa; secretan distintos factores de crecimiento que garantizan la supervivencia y regeneración de las neuronas. Pueden aplicarse en los conductos nerviosos, en solución o en hidrogeles que pueden ser de colágeno, aligenato/fibronectina, gelatina o matrigel.47
Se observó una mejora en la regeneración del nervio periférico en un modelo experimental luego del implante de células madre cultivadas.
Las células madre son la mejor opción, pero su cultivo requiere varias semanas. El implante celular ideal sería aquel que tuviera rápida expansión en cultivo, sea inerte inmunológicamente, y mejore la sobrevida celular a largo plazo y la interacción con el huésped.24 Se implantaron CMM en una malla de matrigel con chitosan en el nervio ciático de una rata y se observó una mejora significativa en poco tiempo.
Si bien algunas se habían diferenciado a células de Schawnn, la mayoría se habían mantenido indiferenciadas, lo que llevó a la conclusión que las CMM contribuyen a la regeneración nerviosa secretando factores de crecimiento y componentes laminares basales.12,13
Conclusiones
Es indispensable la implementación de mecanismos adecuados de control de calidad en el desarrollo y comercialización de los productos de ingeniería tisular para su aplicación en el hombre.
Estos avances de las ciencias básicas son muy prometedores, pero deben ser certificados por estudios clínicos para que puedan aplicarse en el ser humano.
1. Amiel D, Nagineni CN, Choi SH, Lee J. Intrinsic properties of ACL and MCL cells and their responses to growth factors. Med Sci Sports Exerc 1995;27:844-51. [ Links ]
2. Athanasiou KA, Agrawal CM, Barber FA, Burkhart SS. Orthopaedic applications for PLA-PGA biodegradable polymers. Arthroscopy 1998;14:726-37. [ Links ]
3. Baltzer AW, Lattermann C,Whalen JD, et al. Genetic enhancement of fracture repair: healing of an experimental segmental defect by adenoviral transfer of the BMP-2 gene. Gene Ther. 2000;7(9):734-9. [ Links ]
4. Behrens P, Bitter T, Kurz B, Russlies M. Matrix-associated autologous chondrocyte transplantation/implantation (MACT/ MACI)- 5-year follow-up. Knee 2006;13:194-202. [ Links ]
5. Bonassar LJ, Vacanti CA. Tissue engineering: the first decade and beyond. J Cell Biochem 1998;(Suppl 31):297-303. [ Links ]
6. Boontheekul T, Mooney DJ. Protein-based signaling systems in tissue engineering. Curr Opin Biotechnol 2003;14:559-65. [ Links ]
7. Borzacchiello A, Netti PA, Ambrosio L, Nicolais L. Hyaluronic-acid-based semi-interpenetrating materials. J Biomater Sci Polym Ed 2004;15:1223-36. [ Links ]
8. Bosman FT, Stamenkovic I. Functional structure and composition of extracellular matrix. J Pathol 2003; 200:423-428. [ Links ]
9. Brun P, Cortivo R, Zavan B, Vecchiato N, Abatangelo G. In vitro reconstructed tissues on hyaluronan-based temporary scaffolding. J Mater Sci Mater Med 1999;10:683-8. [ Links ]
10. Camero, S, González, G, Barrios, I, Vásquez, M, Spadavecchia, U, Estudio comparativo de la bioactividad de diferentes materiales cerámicos sumergidos en fluido simulado del cuerpo Rev. LatinAm. Met. Mat. 2005;25(2). [ Links ]
11. Chaignaud B, Langer RS, Vacanti JP. Atala A, Langer RS, Mooney DJ, Vacanti JP, editors. The history of tissue engineering using synthetic biodegradable scaffolds and cells. Synthetic Biodegradable Polymer Scaffolds. Boston: Birkhauser; 1997. p. 1-14. [ Links ]
12. Cuevas P, Carceller F, Dujovny M, Garcia-Gomez I, Cuevas B, Gonzalez-Corochano R, Diaz-Gonzalez D, Reimers D. Peripheral nerve regeneration by bone marrow stroma cells. Neurol Res 2002;24:634-8. [ Links ]
13. Cuevas P, Carceller F, Garcia-Gomez I, Yen M Dujovny M. Bone marrow stromal cell implantation for peripheral nerve repair. Neurol Res 2004;26:230-2. [ Links ]
14. Chih-Hwa Chen. Graft healing in anterior cruciate ligament reconstruction. Sports Medicine, Arthroscopy, Rehabilitation, Therapy & Technology 2009;1:21. [ Links ]
15. Drobnic M, Radosavljevic D, Ravnik D, Pavlovcic V, Hribernik M. Comparison of four techniques for the fixation of a collagen scaffold in the human cadaveric knee. Osteoarthritis Cartilage 2006;14:337-44. [ Links ]
16. Flaumenhaft R, Rifkin DB. The extracellular regulation of growth factor action. Mol Biol Cell 1992;3:1057-65. [ Links ]
17. Fleming BC, Magarian EM, Harrison SL, Paller DJ, Murray MM. Collagen scaffold supplementation does not improve the functional properties of the repaired anterior cruciate ligament. J Orthop Res. 2010;28:703-9. [ Links ]
18. Forriol F, Esparza R. Ingeniería tisular: aplicación de las células troncales pluripotenciales en cirugía ortopédica traumatología. Trauma Fundación MAPFRE, 2008;19 (1-3):15-28. [ Links ]
19. Frost HM. From Wolff's Law to the mechanostat: A new "face" of hysiology. J Orthop Sci 1998;3:282-6. [ Links ]
20. Gluck T. Autoplastik- transplantation- implantation von Fremdkorpern. Klin. Wschr.1890 27:421-7. [ Links ]
21. GraysonWL, Frohlich M, Yeager K, Bhumiratana S, Chan M, Cannizzaro C,Wan LQ, Liu XS , Guo E, Vunjak-Nvakovic G. Engineering anatomically shaped human bone grafts. PNAS, 2010:107 (8):3299-304. [ Links ]
22. Green WT, Jr. Articular cartilage repair: Behavior of rabbit chondrocytes during tissue culture and subsequent allografting. Clin. Orthop. Relat. Res 1977;124:237-50. [ Links ]
23. Gumbiner BM. Cell adhesion: the molecular basis of tissue architecture and morphogenesis. Cell 1996;84:345-577. [ Links ]
24. Hu Jun, Qing-Tang Zhu, Xiao-Lin Lu, Yang-bin Xu, Jia-Kai Zhu. Repair of extended peripheral nerve lesions in Rhesus monkeys using acellular allogenic nerve grafts implanted with autologous mesenchymal stem cells. Exp Neurol 2007;204:658-66. [ Links ]
25. Hsu SL, Liang R,Woo SL. Functional tissue engineering of ligament healing. Sports Med Arthrosc Rehabil Ther Technol. 2010 May 21;2:12. [ Links ]
26. Húngaro F, Biondi M, Indolfi L, De Rosa G, La Rotonda MI, Quaglia F, NeTtP. eds. En Ashammakhi N, Reis RL. Topics in Tissue Engineering; 2005. [ Links ]
27. Joshi SM, Mastrangelo AN, Magarian EM, Fleming BC, Murray MM. Collagen-platelet composite enhances biomechanical and histologic healing of the porcine anterior cruciate ligament. Am J Sports Med 2009;37(12):2401-10. [ Links ]
28. Kanaya A, Deie M, Adachi N, Nishimori M, Yanada S, Ochi M. Intra-articular injection of mesenchymal stromal cells in partially torn anterior cruciate ligaments in a rat model. Arthroscopy 2007;23(6):610-7. [ Links ]
29. Kandel RA, Grynpas M, Pilliar R, Lee J,Wang J,Waldman S, Zalzal P, Hurtig M, and CIHR Bioengineering of Skeletal Tissues Team. Repair of osteochondral defects with biphasic cartilage-calcium polyphosphate constructs in a sheep model. Biomaterials 2006;27:4120. [ Links ]
30. Kuo CK, Marturano JE, Tuan RS. Novel strategies in tendon and ligament tissue engineering: Advanced biomaterials and regeneration motifs. Sports Med Arthrosc Rehabil Ther Technol. 2010;20;2:20. [ Links ]
31. Langer R. Tissue engineering. Mol Ther 2000;1:12-5. [ Links ]
32. Lanza R, Langer R, Vacanti J. Principles of tissue engineering. Elsevier; 2000. [ Links ]
33. Liang R, Woo SL, Nguyen TD, Liu PC, Almarza A. Effects of a bioscaffold on collagen fibrillogenesis in healing medial collateral ligament in rabbits. J Orthop Res 2008;26(8):1098-104. [ Links ]
34. Liang R, Woo SL, Takakura Y, Moon DK, Jia F, Abramowitch SD. Long-term effects of porcine small intestine submucosa on the healing of medial collateral ligament: a functional tissue engineering study. J Orthop Res 2006;24(4):811-9. [ Links ]
35. Lind M, Bünger C. Orthopaedic applications of gene therapy. Int Orthop 2005 Aug;29(4):205-9. [ Links ]
36. Lu HH, Spalazzi JP. Biomimetic stratified scaffold design for ligament-to-bone interface tissue engineering. Comb Chem High Throughput Screen. 2009;12:589-97. [ Links ]
37. Lu HH Subramony SD, Boushell K, Zhang X. Tissue engineering strategies for the regeneration of orthopaedic interfaces. Annals of Biomedics Engineering 2010;38:2142-54. [ Links ]
38. Marcacci M, Berruto M, Brocchetta D, Delcogliano A, Ghinelli D,Gobbi A, Kon E, Pederzini L, Rosa D, Sacchetti GL, Stefani G,Zanasi S. Articular cartilage engineering with Hyalograft C: 3-year clinical results. Clin Orthop Relat Res 2005; (435):96-105. [ Links ]
39. Marcacci M, Kon E, Moukhachev V, Lavroukov A, Kutepov S, Quarto R, Mastrogiacomo M, Cancedda R: Stem cells associated with macroporous bioceramics for long bone repair: 6- to 7-year outcome of a pilot clinical study. Tissue Eng 2007; 13:947-55. [ Links ]
40. Meredith JE, Fateli B, Schwartz MA. The extracellular matrix as a cell survival factor, Molecular Cellular Biology 1993;9: 953-61. [ Links ]
41. Miot S,Woodfield T, Daniels AU, Suetterlin R, Peterschmitt I, Heberer M, Van Litterswijk CA, Riesle J, Martin I. Effects of scaffold composition and architecture on human nasal chondrocyte differentiation and cartilaginous matrix deposition. Biomaterials. 2005 (15):2479-89. [ Links ]
42.Nejadnik H, Hui JH, Pei E Choong F, Tai B, Hin E. Implantation: an observational cohort study autologous bone marrowderived mesenchymal stem cells versus autologous chondrocyte lee. Am J Sports Med 2010;38. [ Links ]
43. Ossendorf C, Kaps C, Kreuz PC, Burmester GR, Sittinger M, Erggelet C. Treatment of posttraumatic and focal osteoarthritic cartilage defects of the knee with autologous polymer-based three-dimensional chondrocyte grafts: 2-year clinical results. Arthritis Res Ther 2007;9:R4. [ Links ]
44. Pachence JM. Collagen-based devices for soft tissue repair. J Biomed Mater Res 1996;33:35-40. [ Links ]
45. Péan JE. Des moyens prosthétiques destines a obtenir la réparation de parties osseuses. Gaz. de Hôp. Paris 67: 291-302, 1894. [ Links ] Reprinted in Clin Orthop Relat Res 1973;94:4-7.
46. Perets A, Baruch Y,Weisbuch F, Shoshany G, Neufeld G, Cohen S. Enhancing the vascularization of three-dimensional porous alginate scaffolds by incorporating controlled release basic fibroblast growth factor microspheres. J Biomed Mater Res A 2003;65:489-97. [ Links ]
47. Pfiser L, Papaloizos M, Merkfe H, Gander B. Nerve conduits and growth factor delivery in peripheral nerve repair. J Peripheral Nervous System 2007;12:65-2. [ Links ]
48. Richardson TP, Peters MC, Ennett AB, Mooney DJ. Polymeric system for dual growth factor delivery. Nat Biotechnol 2001; 19:1029-34. [ Links ]
49. Ringe J, Sittinger M, Kuo CK, LiWJ, Mauck RL, Tuan RS. Tissue engineering in the rheumatic diseases Cartilage tissue engineering: its potential and uses. Curr Opin Rheumatol 2006;18:64. [ Links ]
50. Rodeo SA, Delos D,Weber A, Ju X, Cunningham ME, Fortier L Maher S. What's New in Orthopaedic Research. J Bone Joint Surg Am. 2010;92:2491-501. [ Links ]
51. SaltzmanWM, OlbrichtWL. Building drug delivery into tissue engineering. Nat Rev Drug Discov 2002;1:177-86. [ Links ]
52. Samuel RE, Lee CR, Ghivizzani S, Evans CH, Yannas IV, Olsen BR, Spector M. Delivery of plasmid DNA to articular chondrocytes via novel collagen-glycosaminoglycan matrices. Human Gene Therapy 2002;13:791-802. [ Links ]
53. Sharma PP. Ceramic drug delivery: a perspective. J Biomater Appl 2003;17:253-64. [ Links ]
54. Sherwood JK, Riley SL, Palazzolo R, Brown SC, Monkhouse DC, Coates M, Griffith LG, Landeen LK, Ratcliffe A. A three-dimensional osteochondral composite scaffold for articular cartilage repair. Biomaterials 2002;23:4739-51. [ Links ]
55. Smith P, Shuler FD, Georgescu HI, Ghivizzani SC, Johnstone B, Niyibizi C, et al. Genetic enhancement of matrix synthesis by articular chondrocytes: comparison of different growth factor genes in the presence and absence of interleukin-1. Arthritis Rheum 2000;43:1156-64. [ Links ]
56. Spector M. Biomaterials-based tissue engineering and regenerative medicine solutions to musculoskeletal problems. Swiss Med WKLY 2008;136:293-301. [ Links ]
57. Sun W, Yan Y, Lin F, Spector M. Biomanufacturing: a US-China National Science Foundation-sponsored workshop. Tissue Eng 2006;12(5):1169-81. [ Links ]
58. Taipale J, Keski-Oja J. Growth factors in the extracellular matrix. FASEB J 1997;11:51-9. [ Links ]
59. Tuli R, Nandi S, LiWJ, Tuli S, Huang X, et al. Human mesenchymal progenitor cell-based tissue engineering of a single-unit osteochondral construct. Tissue Eng 2004;10:1169. [ Links ]
60. Turner CH, Pavalko FM. Mechanic transduction and functional responses of the skeleton to physical stress: The mechanisms and mechanics of bone adaptation. J Orthop Sci 1999;3;346-55. [ Links ]
61. Uematsu K, Hattori K, Ishimoto Y, Yamauchi J, Habata T, Takakura Y, Ohgushi H, Fukuchi T, Sato M. Cartilage regeneration using mesenchymal stem cells and a three-dimensional poly-lactic-glycolic acid (PLGA) scaffold. Biomaterials 2005;26: 4273-9. [ Links ]
62. Urist MR. Bone: formation by autoinduction. Science 1965;12;150(698):893-9. [ Links ]
63. Walsh S. Practical considerations concerning the use of stem cells for peripheral nerve repair. Neurosurg Fact 2002;26(2):E2. [ Links ]
64. Xin X, Borzacchiello A, Netti PA, Ambrosio L, Nicolais L. Hyaluronic-acid-based semi-interpenetrating materials. J Biomater Sci Polym Ed 2004;15:1223-36. [ Links ]
65. Yannas IV. Biologically active analogues of the extracellular matrix: artificial skin and nerves. Angew Chem Int Ed Eng 1990; 29:20-35. [ Links ]
66. Yannas IV, Lee E, Orgill DP, Skrabut EM, Murphy GF. Synthesis and characterization of a model extracellular matrix that induces partial regeneration of adult mammalian skin. Proc Natl Acad Sci USA 1989;86:933. [ Links ]














