I. A modo de prólogo
Este artículo está basado en el trabajo de Hasok Chang, investigador y filósofo de la ciencia en el Departamento de Historia y Filosofía de la Ciencia de la Universidad de Cambridge, a cuya postura filosófica respecto a la Historia de la Ciencia y su papel en su enseñanza adhiero en buena medida. En particular se ha tomado material del primer capítulo de su historia de la termometría Inventing Temperature: Measurement and Scientific Progress (Chang, 2004) y del artículo The myth of the boiling point (Chang, 2008). El propósito inmediato es llevar al conocimiento de la comunidad algunos de los hechos casi olvidados que Chang redescubrió al estudiar la historia de la termometría, que ejemplifican admirablemente, a mi entender, el tortuoso, complejo y largo camino de la construcción del conocimiento científico, y cómo en el proceso fueron aprendidos saberes que hasta cierto punto parecen haber sido desaprendidos más tarde; el propósito más amplio es llamar la atención sobre la obra de Chang en general, a la que considero digna de una divulgación más amplia. El tema particular se ha escogido, más allá de su interés intrínseco, porque los fenómenos involucrados pueden ser reproducidos con facilidad y con equipamiento extremadamente simple. Esto hace que tanto la exposición histórica como su ilustración experimental puedan ser llevadas sin gran esfuerzo al aula, y espero convencer al lector de que vale la pena hacerlo. El mérito es, en todo caso, del mencionado autor; los errores e inexactitudes, por otra parte, son todos de mi autoría.
II. Introducción
La ciencia es el antidogma. Al menos eso es lo que nos agrada creer y decirnos, a nosotros mismos y entre nosotros, a los que la practicamos o la enseñamos. Entonces, ¿por qué tantas veces en el aula no procedemos como si lo creyéramos? Demasiadas veces tendemos a enseñar un cúmulo de conocimientos sin dar siquiera un indicio de cómo se llegó a descubrirlos, y aún menos de qué motivó su búsqueda. Una notable cantidad de “hechos científicos” son hoy de “conocimiento común”, o al menos serán reconocidos, y dados por verdaderos, por cualquier persona moderadamente "educada"; y ello aunque muchas veces suenan verdaderamente fantásticos al enunciarlos: El Sol es una bola de gases incandescentes cien veces mayor que la Tierra, en cuyo centro presiones y temperaturas inimaginables transmutan el Hidrógeno en Helio, produciendo cada segundo millones de veces más energía que la generada por la Humanidad a lo largo de toda su existencia. En el núcleo de cada célula, tan pequeña que no podemos verla, hay una molécula, que desenrollada mediría varios metros, cuya estructura codifica toda la información necesaria para reproducir a ese ser viviente. Hay más estrellas en el Universo que granos de arena en todas las playas del mundo, cada una otro sol, tan lejano que a los pocos miles más cercanos los vemos apenas como puntos de luz, y al resto ni siquiera podemos verlos a ojo desnudo. La Tierra tiene más de cuatro mil millones de años de edad, y los continentes flotan como escoria sobre un mar de magma fluido, chocando entre sí, elevando montañas, y desgastándose luego hasta quedar lisos de nuevo. Si alguna vez hemos afirmado alguno de esos hechos, probablemente hemos tenido la satisfacción de ver cómo despiertan un sentimiento de asombro en nuestra audiencia. Y es que son portentosos: recordemos que, no hace tantos siglos, sostener públicamente cualquiera de ellos podría habernos llevado al ostracismo, o incluso a la hoguera.¿Por qué hoy los aceptamos sin cuestión? Si alguna vez lo discutimos en un aula, probablemente nos hayamos congratulado de lo estupendo que es que hayamos desechado viejos mitos y creencias oscurantistas sobre el funcionamiento del Universo a cambio de una iluminada comprensión de cómo funciona en realidad. Pero si le preguntamos a una persona al azar porqué los considera verdaderos, probablemente una breve discusión revele que simplemente cree en la ciencia; con tanto fervor (o falta de él) y con argumentos no muy diferentes de los que esgrimiría un antiguo ateniense para creer en Zeus. Así que, si realmente creemos que la ciencia es el antidogma, evidentemente estamos fracasando en transmitirlo. En mi opinión, esto no solo es lamentable sino evitable. No deberíamos dejar que la urgencia de transmitir lo que se sabe nos impida explicar cómo se llegó a saberlo. No sólo mostraríamos una visión de la ciencia tanto o más fascinante que sus meros resultados, sino que probablemente conseguiríamos despertar más vocaciones científicas, e incluso formar mejores científicos. Pero esto requiere conocer algo de historia de la ciencia, e introducirla en su enseñanza. Indudablemente, el camino que llevó a cualquiera de los hechos mencionados es largo y complicado, y sería casi imposible narrarlo por completo, y aún más presentar evidencia fáctica de sus pasos; aunque seguramente valdría la pena intentarlo. Así que intentaremos con un “hecho científico” reconocidamente menos glamoroso: “el agua hierve a 100°C”. Quizá sea muy poco espectacular, pero al menos en principio pareciera que puede ser demostrado por cualquiera: después de todo, la mayoría de nosotros hervimos agua en casa (al menos de vez en cuando), así que no parece tan difícil que lo hagamos en el aula.
III. Una demostración “fallida” del punto de ebullición
Digamos entonces que estamos preparando una clase sobre termometría, en particular sobre la definición de los puntos fijos termométricos. Por supuesto, queremos exponer que uno de ellos es el punto de ebullición del agua, elegido entre otras razones por ser fácilmente reproducible, y si parece factible intentaremos incluir una demostración experimental. Así que comenzamos con una búsqueda en la red, por ejemplo de “punto de ebullición”, y el primer resultado que encontramos es https://es.wikipedia.org/wiki/Punto_de_ebullición, que parece contener todo lo que necesitamos: la sucinta definición “El punto de ebullición de una sustancia es la temperatura a la cual la presión de vapor del líquido es igual a la presión que rodea al líquido y se transforma en vapor”, que nos proponemos utilizar; referencias abundantes; un recordatorio de la dependencia con la presión atmosférica, que seguramente ya habíamos decidido mencionar; una descripción de cómo impurezas solubles y no solubles alteran la temperatura del punto de ebullición; incluso contiene una simpática fotografía de agua hirviendo en una jarra de vidrio sobre una hornalla de gas, y una aún más simpática animación que muestra cómo el agua se calienta y hierve al alcanzar los 100°C. Parece estar claro, entonces, que para nuestra demostración en el aula bastará conseguir: • Agua sin impurezas; en principio agua desmineralizada, comprada en una estación de servicio, debería bastar. • Un recipiente transparente (para ver lo que ocurre); un vaso de precipitado o beaker de vidrio debería servir. • Un termómetro “de varilla” de mercurio (rango de -30°C a 110°C). • Una fuente de calor (hornalla de gas o mechero Bunsen). • Y, claro, un trípode con rejilla de amianto para apoyar el beaker y un pie universal para sujetar el termómetro. Nada de lo cual es extremadamente costoso, y si nuestra institución tiene un laboratorio o un pañol de instrumentos, aún uno pequeño, seguramente conseguiremos todo allí. Así que como docentes responsables que somos, un día hacemos un ensayo: montamos todo, con el bulbo del termómetro bien sumergido en el agua, encendemos el mechero, vemos cómo la temperatura va subiendo,1y entonces observamos que • Se forman burbujas diminutas ya a temperaturas bastante bajas, pero éstas son probablemente aire disuelto siendo expelido, dado que la solubilidad del aire en agua disminuye al aumentar la temperatura. Bueno, algo más que explicar, pero hasta aquí todo bien. • A temperaturas algo mayores comienzan a formarse burbujas de vapor que ascienden desde el fondo pero no llegan a la superficie. Sabemos que es vapor porque a medida que ascienden estas burbujas colapsan (siendo reabsorbidas por el líquido), generando un ruido muy característico: el agua sisea. Pero… la temperatura es recién de unos 93-94°C… ¿Cómo puede estarse formando vapor? • A unos 96-97°C las burbujas ya están rompiendo la superficie. Podríamos decir que el agua comienza a hervir. Esto no es lo que esperábamos… ¿qué está pasando? • Alrededor de los 98°C ya observamos una ebullición bien definida y reconocible como tal. Definitivamente, esto no es lo que esperábamos, ¡y va a ser difícil de explicar! • Poco después, la temperatura se estabiliza muy cerca de 100°C, y observamos lo que llamaríamos un hervor intenso y estable. ¡Esto sí es lo que esperábamos! ¡Por fin! • Pero mientras nos entretenemos alegrándonos de haber verificado la teoría, notamos para nuestro desmayo que, lentamente, la temperatura ¡vuelve a aumentar! Y mientras observamos con incredulidad sigue subiendo para acabar estabilizándose (esta vez sí) cerca de 101°C. ¡¿Cómo se supone que expliquemos esto?! Para aumentar nuestro desconcierto, si llevados por la meticulosidad decidimos repetir el experimento cambiando prácticamente lo único que podemos cambiar, que es el recipiente, hallaremos que la fenomenología es aproximadamente la misma, pero que la temperatura de la “ebullición estable” es de unos 99°C en uno recubierto de Teflón, unos 100°C en uno de acero inoxidable, y unos 102°C en uno de porcelana. En este punto es comprensible cierta incredulidad del lector. Sin embargo lo que acabo de describir puede ser observado en el video en http://www.sites.hps.cam.ac.uk/boiling/indef_desc.htm, que documenta precisamente el experimento descripto arriba, y en el video en http://www.sites.hps.cam.ac.uk/boiling/different_desc.htm, que muestra el efecto de recipientes de diferentes materiales. Hasok Chang realizó estos experimentos en persona porque tampoco podía creérselo; y debo agregar que los he reproducido también (porque tampoco yo conseguía creerlo) tanto en laboratorio como frente al público de algunas conferencias. Y para cuando el artículo acabe, espero poder revertir la probable reacción inicial, de que esto es un desastre imposible de ser explicado a los estudiantes y que no debería mostrarse en el aula, por la diametralmente opuesta.
IV. El punto no fijo
Descubrí los trabajos de Hasok Chang mientras recopilaba material para un curso de Historia de la Termodinámica, y él narra que se tropezó con estos hechos mientras recopilaba material para su libro Inventing Temperature (Chang, 2004), una historia de la termometría. Uno de los disparadores fue un objeto exhibido, bajo el N.o de catálogo 1927- 1945, en el Science Museum de Londres. Se trata de un termómetro de mercurio que data de alrededor de 1750. Si bien los tubos de vidrio se han roto y perdido, el armazón de madera está bien preservado y contiene cuatro escalas termométricas, una de ellas la conocida escala Fahrenheit; lo llamativo es que muestra también dos puntos de ebullición: uno a 212°F (100°C) etiquetado “water boyles vehemently” (hervor intenso), y otro a 204°F (~96°C) etiquetado “begins to boyle” (comienza a hervir). Y el termómetro no es obra de algún ignorante en cuestiones científicas sino de nada menos que George Adams, constructor oficial de instrumentos científicos del Rey Jorge III y considerado en su tiempo uno de los mejores artesanos de instrumentos; es más, la noción de dos “temperaturas de ebullición” viene directamente de Sir Isaac Newton, cuya escala de temperatura de 1701 es otra de la grabadas en el termómetro y que consignó haber medido las mismas temperaturas para esos puntos. Extrañado por esto, e intentando averiguar cuán ampliamente sabido era en esa época, Chang (2004) pronto dio con la figura de Jean-André De Luc. Aunque hoy poco conocido, De Luc gozaba en su tiempo de gran reputación como geólogo, meteorólogo y físico (además de ser montañista, teólogo y hombre de negocios), y era considerado la principal autoridad europea en termometría, en la que se había interesado mientras residía en Ginebra para mejorar sus mediciones barométricas de la altura de muchos picos alpinos (De Luc, 1772). Allí llevó a cabo numerosas investigaciones sobre la ebullición, con el objetivo de emplear la temperatura de este fenómeno como punto fijo termométrico, y fue encontrando todas las “anomalías” mencionadas hasta aquí, y muchas más, cuyo origen se propuso descubrir para poder erradicarlas. Por ejemplo, tuvo la idea de que la capa de agua en contacto con la superficie caliente, donde se formaba la mayoría de las burbujas de vapor, debía estar más caliente que el resto del agua, y se propuso medir la temperatura de la “verdadera ebullición” que ocurría allí (Chang, 2004); pero como sospechaba que esta capa era muy fina y sería imposible introducir el bulbo de un termómetro en ella, decidió poner el agua en un frasco de cuello angosto sumergido en un baño de aceite calentado muy gradualmente, de modo de llevar toda el agua a la vez a esa (supuesta) temperatura; este experimento se esquematiza en lafigura 1. Para su sorpresa, De Luc halló que bajo esas condiciones el agua hervía de un modo para nada “normal”: la temperatura variaba mucho, pero siempre manteniéndose varios grados por encima de los 100°C, y las burbujas eran pocas, grandes y se formaban a intervalos muy irregulares. Una versión moderna de este experimento se muestra en el video en http://www.sites.hps.cam.ac.uk/boiling/slow_desc.htm.
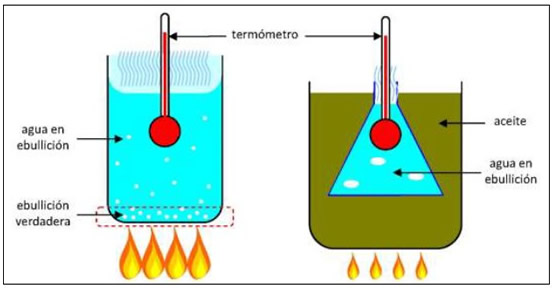
Figura 1: A la izquierda se ilustra la forma usual de medir el punto de ebullición a mitad del Siglo XVIII, aplicando un calor intenso en la base del recipiente; se muestra la estrecha capa donde De Luc especuló que debía producirse la “ebullición verdadera”. A la derecha se esquematiza el intento de De Luc de inducir “ebullición verdadera” en todo el volumen de agua, sumergiendo el recipiente con agua, de cuello estrecho, en un baño de aceite, y aplicando un calor suave que produzca un calentamiento gradual.
En otro experimento, sugerido por la observación de que el aire disuelto parecía inducir una “ebullición prematura” a temperatura notablemente menor que la “verdadera”, se propuso extraer todo el aire de una muestra de agua colocando agua previamente hervida (con termómetro y todo) en un frasco hermético y sacudiéndolo vigorosamente, de la misma forma en que hoy le quitamos el gas a una gaseosa. Por cuatro semanas De Luc sacudió su frasco en todo momento posible, en sus palabras “dejándolo sólo para dormir, hacer negocios en la ciudad, y hacer cosas que requerían ambas manos” (De Luc, 1772). El resultado fue realmente espectacular: el agua desgasificada alcanzó los 112.2°C sin hervir, y se evaporó de golpe con una fuerte explosión. El video en http://www.sites.hps.cam.ac.uk/boiling/degassed_desc.htm muestra una versión moderna de este experimento que entraña menos riesgos. En su versión histórica el experimento es peligroso y no recomiendo intentarlo (personalmente me he abstenido, no por falta de curiosidad sino por mera cobardía). Podemos darnos una idea de cuán peligroso si notamos que, dado el calor latente específico de vaporización del agua (540 cal/g a 100°C), su calor específico (1 cal/g) y el volumen específico del vapor a presión normal (1673 cm3/g), por cada grado de sobrecalentamiento el súbito enfriamiento a 100°C producirá un volumen de vapor superior al triple del volumen total de líquido. ¡De Luc debe haberse llevado un buen susto! Después de concluir largas series de experimentos, De Luc, que los había comenzado tratando de determinar la temperatura de la “verdadera ebullición”, ya no sabía siquiera qué era ésta; al menos había determinado que la ebullición distaba mucho de ser un fenómeno simple, estable y homogéneo, pero además había hallado una fenomenología fantásticamente variada (Chang, 2004): 1. Ebullición ordinaria: abundantes burbujas que alcanzan la superficie, con “vigorosidad” dependiente del calentamiento, pero temperatura razonablemente estable. 2. Siseo (hissing o sifflement): abundantes burbujas que no alcanzan la superficie, colapsando antes; temperatura apreciablemente menor a la de ebullición ordinaria; ruido característico (que cualquier buen cebador de mate de la actualidad reconocerá fácilmente). 3. Golpeteo (bumping o soubresaut): burbujas escasas, grandes y espaciadas a intervalos irregulares; temperatura muy variable que cae apreciablemente con cada burbuja y aumenta hasta la siguiente. 4. Explosión: una porción apreciable del líquido pasa súbitamente a vapor, derramando mucho (o todo) el líquido restante; temperatura por encima de la de ebullición ordinaria y creciente hasta el evento final. 5. Evaporación rápida: sin burbujas; abundante vapor escapando de la superficie libre; temperatura estable o no según las circunstancias; puede ocurrir a temperaturas inferiores o superiores a la de ebullición ordinaria. 6. Burbujeo (bubbling o bouillonement): apariencia de ebullición pero es sólo el escape de gases disueltos. ¿Cuál de todas estas variantes era la “verdadera ebullición”? No había una respuesta clara: las alternativas 2, 5 y 6 podían descartarse ya que no hay burbujas de vapor llegando a la superficie y la temperatura aún no se ha estabilizado; la 4 también se descartó, por razones obvias; la 3 era la que mejor se ajustaba a la idea original de De Luc de “ebullición verdadera”, en el sentido de un calentamiento uniforme de agua sin impurezas ni aire, pero es salvajemente diferente de las nociones previas (y actuales) sobre un “punto de ebullición”, y la temperatura no sólo supera ampliamente la de ebullición común sino que es altamente inestable, haciéndola inservible como punto fijo termométrico. La única alternativa viable parecía ser la 1, pero eso implicaba aceptar que el punto de ebullición es la temperatura a la que hierve agua impura y con aire disuelto… Pero al menos una cosa había quedo en claro: el sobrecalentamiento, es decir la situación en que el líquido está definidamente más caliente que el punto de ebullición, pero no hierve, no sólo era una posibilidad teórica, sino definitivamente (y espectacularmente) algo que ocurría en la práctica. En 1772, aproximadamente al mismo tiempo que publicaba su esperada obra Recherches sur les modifications de l’atmosphère (De Luc, 1772), su negocio en Ginebra quebró y De Luc se mudó a Londres. Casi de inmediato se unió a la Real Sociedad Británica por invitación de Henry Cavendish, y en 1776 fue invitado a integrar el comité de siete miembros ilustres, liderado por Cavendish, que ésta designó para “hacer recomendaciones definidas acerca de los puntos fijos termométricos” (Chang, 2004). El comité de inmediato convino en la conveniencia de usar los dos puntos fijos del agua, y se concentró en determinar cuán fijos eran, sobre todo el de ebullición. Dos problemas con éste fueron resueltos con facilidad: El primero fue la variación de la temperatura de ebullición con la presión atmosférica, bien conocida ya entonces; el comité recomendó una presión standard y una tabla de correcciones por apartamiento de ésta, tomada del trabajo de De Luc. El segundo fue la posible diferencia de temperatura entre el bulbo y la columna del termómetro; el comité recomendó sumergir completamente el termómetro en el agua, o más bien en el vapor proveniente de ella, punto al que volveremos enseguida. Quizá debido a las recientes experiencias de De Luc, que había realizado todos sus experimentos utilizando recipientes de vidrio, el comité probó con recipientes metálicos, y para su satisfacción la temperatura de ebullición en éstos resultó mucho más estable y reproducible. En particular no se producía sobrecalentamiento, y la temperatura del “hervor intenso” resultaba ser la máxima alcanzada, sin tendencia a volver a aumentar después, e independiente de cuán intenso era el hervor, un potencial problema ya estudiado por Cavendish con anterioridad. Los recipientes metálicos se incorporaron a las recomendaciones, aunque el comité no explicitó sus razones. Quedaba sin embargo un tercer y último problema a resolver, consistente en una multitud de variaciones no muy grandes, pero molestas y aparentemente intratables. La temperatura podía variar en más de 0,1°C dependiendo de si el bulbo del termómetro estaba sumergido más o menos profundamente, aunque el termómetro estuviera sumergido por completo, y parecía variar no sólo con la altura de agua por encima del bulbo (más allá de lo justificable por la variación de presión), sino también con la profundidad de agua bajo el bulbo. Calentar el recipiente sólo por la base o además por los lados también producía variaciones. Incluso había variaciones entre ensayos, por lo demás idénticos, realizados en días diferentes, aun corrigiendo por la variación de presión atmosférica. Tras muchos ensayos el comité concluyó que lo mejor era no sumergir el termómetro en absoluto en el líquido, sino en el vapor contenido en la parte superior del recipiente, ahora cerrado salvo por una pequeña abertura para permitir la salida de vapor y la igualación de presión con la atmósfera, arreglo ilustrado en lafigura 2.
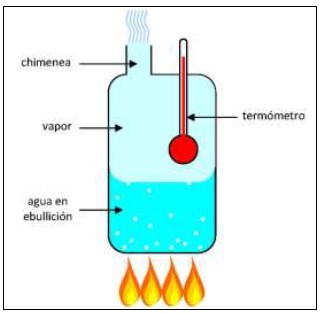
Figura 2: Esquema de la recomendación final del comité de la Real Sociedad Británica (Cavendish et al., 1777) para medir la temperatura de ebullición. El bulbo del termómetro se sumerge en el vapor, no en el agua; la chimenea en la parte superior del recipiente permite la igualación de la presión con la atmosférica.
Esta temperatura probó ser estable (dentro de la precisión alcanzable entonces) e independiente de todas las causas, conocidas o desconocidas, de las variaciones en la temperatura del agua en ebullición. Así que la recomendación final fue precisamente hacer esto (Cavendish et al., 1777), lo que en la práctica substituyo el “punto de ebullición” por el “punto de vapor”. Pero aunque la recomendación fue unánime, con todos los miembros del comité acordando en que este punto termométrico era en verdad fijo, había grandes discrepancias respecto de porqué lo era. En particular las discusiones entre Cavendish y De Luc fueron acaloradas. Cavendish propuso multitud de teorías, algunas más plausibles y otras menos, para argumentar que el vapor no podía estar a una temperatura diferente, ninguna de las cuales convenció a De Luc. Por su parte éste, “dolorosamente” consciente de que el sobrecalentamiento del agua era una realidad, insistió en que el vapor podía, y en las circunstancias adecuadas debía, enfriarse por debajo del “punto de vapor” sin condensarse, lo que Cavendish hallaba inaceptable. Y si bien ninguno convenció al otro, es testamento de su oficio como científicos experimentales el que ambos suscribieran el mismo documento, coincidiendo en la realidad y características del fenómeno aunque discreparan con vehemencia sobre sus causas. Para bien o para mal, los hallazgos de De Luc acerca de la indefinición del “punto de ebullición”, contenidos en un apéndice de quince capítulos agregado a último momento a su magna opera (De Luc, 1772), parecen haber sido poco conocidos o citados por la comunidad científica, a excepción presumiblemente del comité de la Real Sociedad (Chang, 2004). Sin embargo, pocos años más tarde Joseph-Luis Gay-Lussac reportó haber medido una temperatura de ebullición de 101,3°C en un recipiente de vidrio, y de 100,0°C en uno metálico; también reportó que arrojar vidrio finamente molido en el recipiente de vidrio bajaba la temperatura a 100.3°C, y arrojar limaduras de hierro la llevaba exactamente a 100,0°C (Gay-Lussac, 1812). Su reputación como uno de los más confiables experimentalistas de Europa, junto con la inclusión de estos resultados en el difundido texto de física deBiot (1816), hicieron que esta vez fueran ampliamente difundidos y aceptados. Parecía irse aclarando cómo evitar el sobrecalentamiento… o cómo favorecerlo. Treinta años después,Marcet (1842) consiguió sobrecalentar agua ordinaria a más de 105°C en un recipiente de vidrio tratado con ácido sulfúrico concentrado. En experimentos de creciente virtuosismo,Donny (1846) sobrecalentó agua desgasificada hasta 137°C en un instrumento especialmente diseñado;Dufour (1861) consiguió 178°C en gotas de agua suspendidas en otros líquidos; y en 1869 Krebs alcanzó unos 200°C modificando el aparato de Donny (Gemez, 1875). Hoy sabemos que el límite teórico es de 302°C (Avedisian, 1985), conocido como el límite termodinámico de nucleación homogénea, y si bien he sido incapaz de encontrar referencias a experimentos actuales al estilo de los mencionados arriba, trabajos como el deSkripov, Bar-Kohany, Antonov, Strizhak y Sazhin (2023) muestran no sólo que el área sigue activa, sino que es improbable que el récord de Krebs sea superado. Pero volviendo a mediados del Siglo XIX, la comunidad científica ahora coincidía en que calentar agua por encima del “punto de ebullición” no bastaba para asegurar que hirviera, y aunque seguían sin estar entendidas teóricamente las condiciones necesarias para que sí lo hiciera, eran conocidas en la práctica. Que a esas alturas el punto de ebullición pudiera ser utilizado como punto fijo termométrico pese a su comportamiento caprichoso, dependió de tres factores principales (Chang, 2004). El primero era el hecho de que había una gran diferencia entre la temperatura que el agua podía alcanzar sin hervir, y la temperatura que mantenía mientras hervía, aunque todavía las observaciones de De Luc, Gay-Lussac y Marcet mostraban que podían persistir excesos de un par de grados durante el hervor sostenido dependiendo del material del recipiente. Aquí entraba el segundo factor que, para consternación de los puristas, era esencialmente hacer cualquier cosa que previniera el sobrecalentamiento (usar recipientes metálicos, arrojar limaduras de metal u objetos porosos como carbón o tiza, etc.), pero sobre todo no ser demasiado cuidadoso: dejar el agua en su estado natural con aire disuelto, las paredes del recipiente algo sucias o rugosas, no hacer cosas raras como aislar el agua del contacto con superficies sólidas… en definitiva, ¡hervir el agua como, casualmente, siempre se había hervido! El reconocimiento de que confiar en la casualidad o el descuido no era el modo más robusto de lograr un estándar científico llevó al tercer factor, que fue la amplia aceptación del punto de vapor en remplazo del de ebullición.
V. La complejidad de la ebullición
El punto de vapor fue universalmente aceptado desde mediados del Siglo XIX, pero no había teorías plausibles que explicaran la robustez observada. Una primera pista la dio la observación, que data de mediados del siglo XVIII, de que un barómetro de Torricelli que contenga un poco de líquido fácilmente evaporable (por ejemplo agua) sobre el mercurio, alcanza la misma altura independientemente de cuánto se sumerja el tubo en el mercurio del recipiente inferior; este fenómeno se ilustra en lafigura 3.
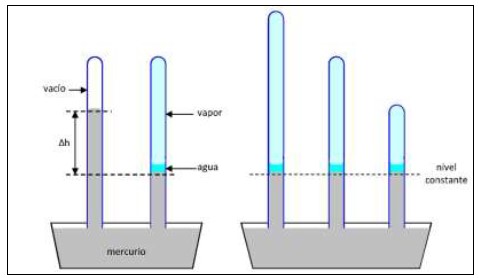
Figura 3: A la izquierda se muestran dos barómetros de Torricelli, uno con vacío por encima del mercurio y el otro con una delgada capa de agua líquida, y sobre ella vapor; la depresión Δh del mercurio corresponde a la presión del vapor en equilibrio con el líquido. A la derecha se ilustra cómo al levantar o bajar el tubo del barómetro manteniendo constante la temperatura, la altura de la columna de mercurio se mantiene constante; ello muestra que la presión de vapor depende sólo de la temperatura, y no, por ejemplo, del volumen.
La explicación universalmente aceptada era que el vacío que inicialmente había en la parte superior del tubo se llenaba rápidamente con todo el vapor posible (en términos modernos, alcanzaba la presión de vapor saturado); la depresión Δh (izquierda) de la columna de mercurio por debajo del nivel correspondiente a vacío en la parte superior del tubo correspondía, justamente, a la presión del vapor en equilibrio con su líquido. Si ahora el tubo se levantaba (derecha), al caer la presión se evaporaba más líquido, justo el suficiente para volver a esta “presión de equilibrio”; si el tubo se bajaba, al subir la presión se condensaba vapor, de nuevo justo el suficiente para restaurar el equilibrio. Lord Charles Cavendish, el padre de Henry, había mostrado que esta presión dependía sólo de la temperatura y, sorpresa, a 100°C alcanzaba el valor de la presión atmosférica normal, con lo cual el mercurio en el interior del tubo quedaba enrasado con el de la batea (no mostrado). La teoría que se formuló fue que el agua hervía cuando podía formar vapor con suficiente presión para vencer la de la atmósfera, y no sólo explicaba la dependencia del punto de ebullición con ésta, sino que justificaba usar el punto de vapor: la parte superior del recipiente (verfigura 2) estaba llena de vapor saturado, cuya temperatura dependía sólo de la presión y era de 100°C a una atmósfera standard (Chang, 2004). Sin embargo subsistían anomalías que esta teoría no explicaba, empezando por el hecho de que la temperatura de ebullición podía variar aún si la presión atmosférica era fija. Surgió entonces la idea de que igualar la presión de vapor a la externa era condición necesaria para la ebullición, pero no suficiente; otros factores podían dificultar o facilitar el paso de líquido a vapor. Ya Gay-Lussac (1818) había especulado que la ebullición podía ser dificultada por la “adhesión” del agua a las paredes del recipiente, o a sí misma, que sería otra fuerza a vencer además de la presión atmosférica. En base a esta idea, Marcet (1842) predijo que arrojar limaduras de hierro en un recipiente de vidrio bajaría la temperatura, pero no hasta los 100°C de un recipiente hecho completamente de metal (pese a la afirmación de Gay-Lussac), y lo probó experimentalmente alcanzando un mínimo de 100,2°C. También predijo que recubrir un recipiente con un material al que el agua se adhiriera menos que al metal (hidrófobo, en términos modernos) bajaría la temperatura aún más, y también lo probó experimentalmente al alcanzar 99,7°C utilizando goma laca (Chang, 2004). Podemos especular que de haber dispuesto de recipientes recubiertos de Teflón, material hidrófobo si los hay, hubiera conseguido los 99°C del experimento mostrado por Chang. La teoría del balance de presión, modificada por la adhesión, parecía a estas alturas sólida. Sin embargo poco despuésDufour (1861) hizo notar que, dado que gotas de agua suspendidas en otros líquidos podían sobrecalentarse enormemente sin evaporarse, la adhesión a superficies sólidas no podía ser la principal responsable del sobrecalentamiento. Por otro ladoGernez (1875), desarrollando ideas previas de Verdet, mostró experimentalmente que la inyección de una minúscula cantidad de aire en agua sobrecalentada bastaba para inducir la ebullición, e hizo notar que la segregación del aire disuelto produciría el mismo efecto; incluso los diminutos vacíos creados por la tensión superficial alrededor de irregularidades microscópicas deberían hacerlo. PeroTomlinson (1868) mostró experimentalmente que objetos de metal sometidos a limpieza química que removiera cualquier partícula de polvo, perdían la capacidad de inducir la ebullición, aún si acarreaban burbujas de aire con ellos. La larga controversia entre Gernez y Tomlinson nunca se resolvió realmente, según parece (Chang, 2004), lo que no es de extrañar porque toda evidencia empírica al respecto tendía a ser ambigua: el aire introducido en el agua seguramente contenía partículas de polvo, y cualquier objeto sólido introducido en el agua acarrearía inevitablemente algo de aire. Sin embargo, si bien la ebullición, o al menos su inicio, seguía sin ser entendida en todos sus detalles, esto no afectaba al punto de vapor: la relación presión-temperatura del vapor saturado garantizaba que éste no fuera afectado por cuáles fueran las causas de su producción, ni por el método empleado para producirlo; incluso el vapor que se elevaba de agua sobrecalentada, pero sin hervir, mostraba la misma temperatura. Más de un siglo de progreso parecía haber llevado a una conclusión notable: la ebullición, en sí misma, era irrelevante para definir o determinar el “punto de ebullición”. Con la adopción del punto de vapor aparentemente resolviendo todas las dificultades prácticas (e incluso teóricas) que plagaban el punto de ebullición, estaríamos tentados a pensar que esta larga y retorcida historia había llegado a su fin. Pero aunque nadie parecía recordarlas, las dudas de Luc acerca de si el vapor podía sobreenfriarse (o sobresaturarse) nunca habían sido respondidas; simplemente nadie había observado que ocurriera, y por consiguiente nadie especulaba ya con esa posibilidad. Pero resultó que, pese a Cavendish, De Luc tenía razón: aunque más de un siglo después, fue vindicado por el escocés John Aitken, por educación ingeniero y por vocación meteorólogo. Tratando de entender la formación de la niebla, y en especial de las brumas que asfixiaban a las ciudades industriales Victorianas, Aitken (1880) realizó un experimento simple pero revolucionario: introdujo vapor (que es invisible) de una caldera en un gran recipiente de vidrio lleno de aire; si el aire era común y corriente, al enfriarse el vapor se formaba casi instantáneamente una densa niebla; pero si se lo había filtrado con cuidado para eliminar el polvo (Aitken usó un filtro de algodón), al enfriarse el vapor ocurría… ¡nada! ¡El vapor se enfriaba sin condensarse! Aitken acababa de descubrir la nucleación heterogénea, de enorme importancia para la meteorología. Chang (2004) afirma que, pese a que la relevancia de este descubrimiento para el punto de vapor le resulta evidente, como me lo resulta a mí y seguramente a cualquier lector de esta revista, nadie pareció preocuparse por ello. Aunque si el vapor puede enfriarse por debajo del “punto de vapor” sin condensar, el “punto de vapor” no es, en principio, más fijo que el “punto de ebullición”. Lo más llamativo es que lo que permitió en la práctica usarlos como puntos fijos es precisamente la misma circunstancia casual: ni el agua ni el aire “ordinarios” utilizados en la mayoría de los experimentos están libres de impurezas. Aitken (1878) había reflexionado bastante sobre la aparente renuencia de ciertas transiciones de fase a ocurrir a la temperatura de equilibrio entre las fases, y había propuesto la idea de que es necesario algún “factor facilitador” para que la transición ocurra, llegando incluso a proponer que éste consistía en las “superficies libres”, que parecía concebir como superficies de contacto entre diferentes estados (sólido, líquido o gaseoso); pero no parece haber desarrollado este concepto en algo más preciso (Chang, 2004). Debió transcurrir buena parte de otro siglo para que se alcanzara una comprensión más detallada de los fenómenos involucrados, y ello recién fue posible gracias a tres avances clave, principalmente teóricos: el desarrollo de la termodinámica, con la introducción del concepto de entropía y sobre todo de la energía libre de Gibbs; la aceptación y uso de la teoría atómica de la materia y el consiguiente desarrollo de la mecánica estadística; y el desarrollo de la teoría de transiciones de fase. Acompañados, claro, por multitud de avances experimentales. Actualmente la explicación de buena parte de estos fenómenos es provista por las teorías de nucleación homogénea y de nucleación heterogénea. La nucleación homogénea es el proceso por el cual una fase termodinámica homogénea de una substancia sin impurezas, llevada más allá de la temperatura a la que un cambio de fase puede ocurrir, forma, en el volumen y espontáneamente, núcleos (pequeñas porciones o embriones) de la nueva fase; por ejemplo, agua líquida pura sobrecalentada formando pequeñas burbujas de vapor en el volumen. Es rara de observar en la naturaleza, pero relativamente fácil de producir en condiciones de laboratorio. Dos conceptos fundamentales son: primero, que al estar el agua sobrecalentada la fase vapor tiene una energía libre de Gibbs específica menor que la fase líquido, por lo que convertir agua en vapor libera energía; segundo, que por estar el líquido formado por átomos o moléculas constantemente ocurren, a escala microscópica, fluctuaciones espontáneas de densidad, tanto más frecuentes cuanto menor es su tamaño; así, espontáneamente se formarán burbujas de vapor (densidad muy baja), con sólo que su tamaño sea lo bastante pequeño. Pero si ocurre esto, ¿por qué esas burbujas vuelven a desaparecer, en vez de crecer hasta formar todo el vapor termodinámicamente posible? Aquí entra el tercer concepto fundamental: formar una burbuja donde antes no la había implica crear superficie de contacto (interfase) líquido-vapor, lo que en virtud de la tensión superficial requerirá energía. Esta energía es proporcional a la tensión superficial y al área de la burbuja, y para una burbuja de radio r, crece entones como r2; pero la energía disponible es la liberada por el agua transformada en vapor, que es proporcional a su calor latente específico de vaporización, al sobrecalentamiento ΔT y al volumen, por lo que crece como r3. El cambio ΔGhom en la energía libre de Gibbs necesario para formar el núcleo será la energía de la interfase menos la liberada por el vapor, y se ha graficado esquemáticamente en función de su radio en lafigura 4.
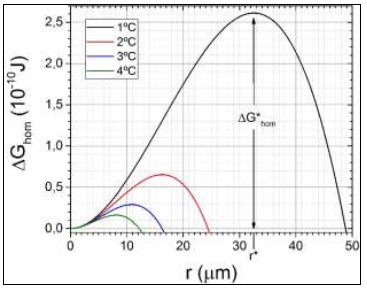
Figura 4: Cambio ΔGhom en la energía libre de Gibbs al formarse una burbuja de vapor de radio r en nucleación homogénea. Las diferentes curvas corresponden a los diferentes sobrecalentamientos ΔT del agua por encima de 100°C indicados en el cuadro inserto. Para ΔT = 1°C se indican el correspondiente radio crítico r* y la barrera de energía ΔG*hom. Todas las curvas corresponden a un proceso isobárico a presión atmosférica standard.
Podemos ver que para radios muy pequeños domina el término de superficie, y ΔGhom crece con el radio; mientras que para radios grandes domina el término de volumen, y ΔGhom decrece al aumentar el radio. También podemos ver que ΔGhom tiene un máximo de altura ΔG*hom (la barrera de energía o energía de activación) para un radio crítico r*. Así que si una fluctuación de densidad forma un núcleo con r < r*, será energéticamente favorable que r disminuya, y el núcleo se reducirá y desaparecerá; pero si r > r*, será energéticamente favorable que r crezca y se formará una burbuja de vapor macroscópica. También vemos que a medida que aumenta el sobrecalentamiento tanto r* comoΔG*hom disminuyen rápidamente, es decir, la nucleación homogénea se facilita: la barrera energética es más baja, y el menor radio crítico hace más probable que una fluctuación de densidad lo supere en tamaño (Kelton y Greer, 2010). La nucleación heterogénea, que es la que ocurre cuando el núcleo se forma sobre una superficie preexistente, es la que comúnmente ocurre en condiciones no controladas o bajo condiciones de laboratorio “descuidadas”, y puede entenderse en términos similares a la nucleación homogénea. Siguiendo con el ejemplo del agua sobrecalentada, supongamos que una diminuta burbuja de vapor de radio r se forma (o intenta formarse) sobre una superficie sólida, por ejemplo la pared o el fondo del recipiente, como se muestra en lafigura 5.
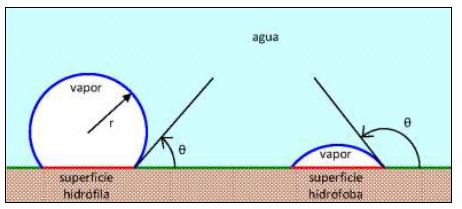
Figura 5: Burbuja de vapor formándose sobre una superficie sólida hidrófila (a la izquierda) o hidrófoba (a la derecha). El radio r de la burbuja es el mismo en ambos casos, pero el ángulo de contacto θ es menor para una superficie hidrófila que para una hidrófoba. Se muestran también las interfases líquido-vapor (azul), líquido-sólido (verde) y vapor-sólido (rojo).
La burbuja será ahora un casquete esférico; si la superficie es hidrófila, como se muestra a la izquierda, la tensión superficial hará que el agua tienda a mojar la superficie sólida, el ángulo de contacto θ será pequeño y la burbuja será casi una esfera; pero si la superficie es hidrófoba, como se muestra a la derecha, el agua tenderá a no mojarla, el ángulo de contacto será grande y la burbuja será un menisco bastante plano. El cambio ΔGhet en la energía libre contendrá ahora tres términos: uno proporcional al volumen del casquete que corresponde como antes a la energía liberada por la evaporación, el cual es negativo y proporcional a r3; uno proporcional al área de la interfase líquidovapor que corresponde a la energía necesaria para crearla, y es positivo y proporcional a r2; y uno proporcional al área de la interfase vapor-sólido, que corresponde a la diferencia entre las tensiones superficiales líquido-sólido (antes de formarse el núcleo) y vapor-sólido (después de formado), y es también proporcional a r2. Un cálculo detallado (Kelton y Greer, 2010) muestra que ΔGhet disminuirá respecto de ΔGhom en el llamado factor de mojado f(θ) como se muestra en lafigura 6; el factor de mojado en sí se grafica en lafigura 7; por consiguiente el radio crítico será igual al de la nucleación homogénea, pero la barrera de energía disminuirá en un factor f(θ). Esto es consistente con la fenomenología de la ebullición de agua limpia en recipientes de diferentes materiales: la nucleación será tanto más difícil, y mayor el sobrecalentamiento, cuanto más hidrófila sea la superficie del recipiente, y viceversa; en particular la ebullición a menos de 100°C en recipientes de superficie extremadamente hidrófoba (como el Teflón) se debe a que las burbujas se forman con tanta facilidad en la superficie calentada, que extraen el calor de ésta antes de que el agua en el volumen del recipiente pueda alcanzar los 100°C. Es interesante comparar lasfiguras 4y6y verificar que la barrera de energía ΔGhom para nucleación homogénea con un sobrecalentamiento ΔT de 4°C (figura 4) es aproximadamente de la misma altura que la barrera ΔGhet para nucleación heterogénea con un sobrecalentamiento de sólo 1°C, con sólo que la superficie sea moderadamente hidrófoba (θ = 135°); esto muestra claramente porqué la nucleación heterogénea es usualmente más fácil que la homogénea.
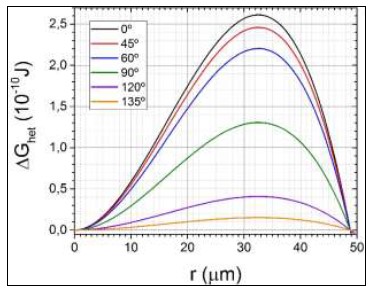
Figura 6: Cambio ΔGhet en la energía libre de Gibbs al formarse una burbuja de vapor de radio r en nucleación heterogénea. Las diferentes curvas corresponden a los diferentes ángulos de contacto del agua con la superficie sólida indicados en el cuadro inserto. Todas las curvas corresponden a un sobrecalentamiento ΔT del agua de 1°C por encima de los 100°C, y a un proceso isobárico a presión atmosférica standard.
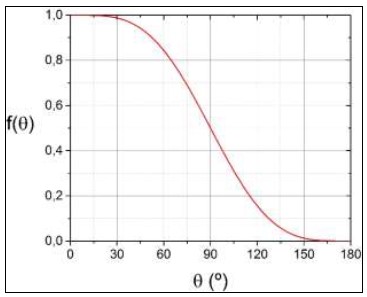
Figura 7: Factor de mojado f(θ) en función del ángulo de contacto θ entre el agua y una superficie sólida. El valor 1 para θ = 0° corresponde a una superficie perfectamente hidrófila; el valor cero para θ = 180° corresponde a una perfectamente hidrófoba.
Lo anterior no parece explicar el papel de las impurezas del agua. Sin embargo, recordemos que el aire disuelto formará burbujas (de aire) a una temperatura relativamente baja, mediante un mecanismo independiente de la nucleación de vapor que actúa al disminuir la solubilidad del aire en agua con la temperatura creciente; las burbujas de aire a su vez proveerán superficie de interfase líquido-gas que las moléculas de agua atravesarán con la misma facilidad que la superficie libre del agua, hasta que el aire en la burbuja se sature de vapor; y al acercarnos al punto de ebullición, esta presión de saturación tenderá a la atmosférica, y las burbujas serán esencialmente de vapor. Esto no sólo explica por qué el aire disuelto impide el sobrecalentamiento, sino también porqué en el experimento descripto en la Sección III la temperatura de ebullición en un recipiente de vidrio (que es hidrófilo), luego de estabilizarse transitoriamente a 100°C, vuelve a subir lentamente: simplemente, ¡se acabó el aire disuelto! En cuanto al papel de las impurezas sólidas, las irregularidades microscópicas de su superficie, y aún más los poros si los hay, permiten la formación de volúmenes llenos de vapor con un área de interfase líquido-vapor relativamente pequeña, lo que equivale a un factor de mojado casi nulo; además contienen por lo general aire atrapado, asemejándose en ese aspecto a las burbujas formadas por segregación de aire disuelto. El papel de las rugosidades microscópicas de las paredes del recipiente es similar. En definitiva, tanto las impurezas gaseosas y sólidas como la rugosidad del recipiente proveen de superficie de interfase líquido-vapor “gratis”, es decir que requiere muy poca energía para formarse; por ello son tan eficientes para inducir la ebullición sin sobrecalentamiento. Esto también coincide con la fenomenología observada históricamente. Pese a que la teoría moderna de la nucleación explica la mayoría de los caprichos de la ebullición que desconcertaron por más de un siglo a tantos investigadores, y a que la teoría de la nucleación heterogénea también se aplica a la condensación del vapor sobreenfriado descubierta por Aitken, que aún quedan muchos detalles por dilucidar se aprecia claramente al leer trabajos como los deGarai (2009),Quan, Chen y Cheng (2011), Skripov et al. (2023) y otros similares, o el mismo texto deKelton y Greer (2010). Alcanzada entonces la frontera del conocimiento actual, es tiempo, ahora sí, de cerrar la parte narrativa de este artículo.
VI. Bajando y subiendo la escalera epistémica
A lo largo del desarrollo de la empresa científica, establecer estándares ha sido parte integrante e indispensable de ella, aunque usualmente los científicos tienden a no preocuparse acerca de sus bases o implicaciones, sean éstas epistemológicas o, más ampliamente, filosóficas. Sin embargo la retrospectiva histórica muestra que el establecimiento de los primeros estándares en una dada disciplina procede a partir de estándares implícitos. Siguiendo en buena medida a Chang (2004) intentaré describir cómo ello ocurrió en el caso de los puntos fijos termométricos, en particular el punto de ebullición, y dar una interpretación de este desarrollo. El problema que enfrentamos queda en evidencia si resumimos la historia del punto de ebullición narrada en las Secciones IV y V, de manera colorista, como sigue: actualmente sabemos que el agua no hierve siempre a la misma temperatura; lo verificamos usando termómetros calibrados en base a la hipótesis de que el agua hierve siempre a la misma temperatura… ¿Cómo es siquiera posible la termometría? Bien, si nuestro propósito es hallar un punto fijo termométrico, es decir, un fenómeno que ocurra siempre a la misma temperatura, la primera cuestión es cómo podemos decir si un dado fenómeno ocurre siempre a la misma temperatura: en principio ello parece requerir la comparación con algún otro fenómeno del que sí sepamos que ocurre siempre a la misma temperatura, es decir, un estándar previo; pero en ese caso la justificación y validación de este estándar previo requiere de otro anterior, y así sucesivamente. ¿Podemos romper esta regresión infinita? Parece que no podemos calibrar un termómetro sin un punto fijo, y que no podemos hallar un punto fijo sin un termómetro calibrado. ¿Hay forma de romper el círculo? La respuesta es un sí, pero calificado: aunque nunca hayamos leído a Popper para que nos inspire, podemos reconocer, aún sin un termómetro, fenómenos que claramente no tienen la misma temperatura, es decir, es mucho más fácil falsificar la proposición de que algo sea un punto fijo. Indaguemos un poco más cómo. Si sumergimos la mano en agua hirviendo, nos quema; decimos que está (muy) caliente. Si la introducimos en hielo, nos congela; decimos que está (muy) frío. Nuestra noción inicial de “temperatura” proviene de la observación de que nuestros sentidos no sólo nos permiten distinguir muchos “grados de calor” (que fue el nombre previo de la temperatura) entre esos extremos, sino ordenarlos de manera creciente (más caliente) o decreciente (más frío, o menos caliente). Claro que la apelación a nuestros sentidos puede producir cierta “incomodidad filosófica”: después de todo, son “subjetivos”, y estamos buscando un estándar “objetivo”. Pero si rechazamos de plano que nuestras percepciones sensoriales contengan información sobre fenómenos externos a (e independientes de) nosotros mismos, tampoco tiene sentido hacer “ciencia”, entendida como comprensión de estos fenómenos externos, ya que en última instancia ninguna información sobre ellos será confiable; de hecho, ni siquiera podremos afirmar que existen. En definitiva, optamos por confiar (aunque sea provisionalmente) en nuestros sentidos porque no tenemos alternativa válida. Todo estándar moderno se justifica mediante uno previo, éste mediante otro y así sucesivamente. Pero esta cadena de justificaciones basadas en otra anterior, que Chang (2004) llama “descenso justificatorio”, se corta aquí, con la sensación humana como estándar a priori. A mi entender la incomodidad acerca del carácter subjetivo de la sensación puede ser aligerada. Por ejemplo, sabemos que el café que una persona encuentra intolerablemente caliente puede parecerle desagradablemente frío a otra, pero salvo afecciones fisiológicas serias, todas las personas coincidirán en que el café está más caliente que antes después de un rato sobre la hornalla. Esta “subjetividad concordante” nos sugiere que, en verdad, hay un hecho objetivo detrás del juicio subjetivo “más caliente que”. Y esto nos lleva a preguntarnos si podremos construir un instrumento que se comporte de la misma manera: que “diga” que algo que a todos nos parece más caliente que otra cosa está más caliente según el instrumento. Lo relevante es que el instrumento, por construcción, carecerá de subjetividad: será una “no persona”; y por ello nos permitirá objetivar el juicio “más caliente que”, al correlacionarlo con un fenómeno (por ejemplo la expansión de un gas) independiente de nuestro sentido de la temperatura (aunque no de la vista, pero eso es otra historia). Los instrumentos más primitivos fueron precisamente de este tipo, como ser, justamente, un termómetro de gas. Y no eran propiamente termómetros, sino termoscopios: no medían temperaturas, sólo permitían compararlas y ordenarlas (de menor a mayor, digamos). Y esto es exactamente lo que necesitamos para determinar si un candidato a punto fijo es un buen candidato. Tomemos por ejemplo el “calor de la sangre”, propuesto entre otros por Newton y Fahrenheit: nuestro termoscopio nos mostrará de inmediato que la sangre de un ser humano, aún uno saludable, está a veces más caliente y a veces menos, revelando que este no es un buen punto fijo (Chang, 2004). El punto epistémico importante aquí es que un termoscopio no se basa en puntos fijos, no necesita de puntos fijos en absoluto, pero aun así permite evaluar si algo es o no un punto fijo; con ello hemos roto el círculo, y hemos logrado lo que propongo llamar un “bootstrap22epistémico”. Creo digno de destacar que éste no se consigue objetivando una percepción subjetiva individual sino una colectiva pero concordante, es decir, una que surge de un consenso entre las subjetividades individuales. Ello es importante porque tenemos múltiples ejemplos de percepciones subjetivas individuales no concordantes con las del consenso, y por regla general no confiamos en ellas: si sólo yo veo elefantes rosados, todos (quizá incluso yo) concluiremos que no son “reales”; pero si todos vemos la Luna en el cielo, noche tras noche, concluiremos (aunque sea provisionalmente) que es “real”. Tenemos entonces un primer estándar objetivo: para considerar algo un punto fijo, el termoscopio debe indicar lo mismo cada vez que lo pongamos en contacto con ello. Ahora podemos incluso reevaluar la “bondad” (o falta de ella) de nuestro estándar previo (que era el estándar a priori, la sensación corporal) a la luz de nuestro nuevo estándar (en este caso nuestro primer estándar objetivo). Ello nos muestra que la sensación concordante es confiable en la mayoría de los casos, pero no en todos. Un buen ejemplo es el clásico experimento de introducir la mano izquierda en un recipiente con agua fría (digamos a 10°C) y la derecha en uno con agua caliente (digamos a 40°C) y, después de un rato, sumergir ambas manos en un tercer recipiente con agua a una temperatura intermedia (digamos a 25°C); nuestra mano izquierda nos indicará que esta agua está caliente, y la derecha que está fría, pero nuestro termoscopio mostrará que su temperatura es uniforme, e intermedia a la de los otros dos recipientes. (La experiencia es muy simple de llevar al aula, y es a la vez llamativa e instructiva. La razón fisiológica detrás del fenómeno es que nuestro sentido térmico mide temperatura relativa al cuerpo, o flujo de calor: si fluye hacia el interior del cuerpo sentimos calor, si fluye hacia fuera sentimos frío.) Notemos que esta “anomalía” afecta a la percepción subjetiva concordante, no sólo a la individual (todos experimentan lo mismo), por lo que es realmente una anomalía del estándar previo. Un poco de experimentación adicional da pie a preferir el nuevo estándar: por ejemplo, podemos pedirle a personas que no han sumergido previamente sus manos en agua fría y caliente, que sumerjan ambas en el agua tibia; como todas ellas dirán que su temperatura es uniforme, concluiremos que la inmersión previa en agua fría y caliente resulta en que el sentido de la temperatura (nuestro estándar previo) sea “engañado”; en cambio el termoscopio (nuestro nuevo estándar) no es engañado de la misma manera. También observamos que el nuevo estándar nos permite ordenar por“grados de calor” un espectro de fenómenos más amplio que el viejo: por ejemplo el termoscopio nos permite distinguir diferencias de temperatura demasiado pequeñas para los sentidos pero que la lógica indica que existen, como la obtenida al agregar un chorrito de agua caliente a una olla de agua fría; o diferenciar temperaturas demasiado altas para tolerarlas sensorial o fisiológicamente (p. ej. entre 90°C y 95°C). Concluimos entonces que es un estándar mejor que el previo, y lo adoptamos de preferencia a él. El siguiente estándar se construye utilizando el termoscopio para identificar algunos fenómenos cuya temperatura parece ser estable; aquí es donde descartamos el “calor de la sangre” y muchos otros y aceptamos, provisionalmente, el punto de congelación y el punto de ebullición del agua. En particular para este último, recordemos que si hervimos agua común (no limpia) en un recipiente común (ni limpio ni de materiales “raros”, sino de metal), como se hizo en los experimentos más antiguos, la temperatura de ebullición es estable con muy buena aproximación. Ahora podemos dividir el intervalo entre los puntos fijos y tener, por fin, una escala numérica de temperatura, y un instrumento que la mide: hemos convertido el termoscopio en nuestro primer termómetro. La cuantificación de la temperatura abre nuevas perspectivas: ahora podremos medir fácilmente (hasta cierto punto) temperaturas por encima de la de ebullición o por debajo de la de congelación, y asignar un significado a cuán por encima o por debajo de ellas están; ahora podremos aplicar ciertas operaciones matemáticas a los valores de temperatura, y éstas irán cobrando sentido físico a medida que se desarrolle la teoría e introduzcamos conceptos como el de capacidad calorífica (Chang, 2004). Debo agregar otro progreso que considero importante destacar: si bien el termoscopio permitía una cierta medida de reproducibilidad, ésta era principalmente “local”, en el sentido de que si dos investigadores querían comparar las observaciones de sus respectivos termoscopios, no tenían muchas veces más alternativa que reunirse en un mismo lugar físico para asegurarse que ambos los ponían en contacto con el mismo fenómeno; pero con la introducción de puntos fijos y su aceptación como “fenómenos universales”, ambos podrán ahora calibrar del mismo modo sus respectivos termómetros sin más ayuda que la del correo, consiguiendo así una reproducibilidad “no-local” cuya importancia para el avance de la ciencia es evidente. De nuevo, concluimos que el nuevo estándar es mejor que el previo. A estas alturas el siguiente paso ya salta a la vista: ahora queremos definir más precisamente los puntos fijos, por ejemplo trabajando con agua y recipientes limpios, y entonces sus “caprichos” comienzan a hacerse evidentes; en definitiva, si bien acabamos por resolver la mayoría de los problemas del punto de ebullición, la solución más simple terminó siendo cambiarlo por el punto de vapor, y volvimos a cambiar el estándar por otro mejor. Y podríamos seguir con una multitud de progresos posteriores, que fueron permitiendo medir temperaturas cada vez más extremas, cada vez con mayor precisión, definiendo mejor los puntos fijos, etc. Pero lo discutido es suficiente para ejemplificar lo que Chang (2004) llama “iteración epistémica”, el proceso por el cual cada estándar permite progreso que permite un estándar nuevo y mejor, y así sucesivamente. Esta iteración “ascendente” es la contracara de la iteración “descendente” que llamamos descenso justificatorio. Y habiendo bajado y vuelto a subir esta escalera epistémica, ahora entendemos cómo podemos saber que la temperatura de ebullición varía empleando termómetros calibrados en base al supuesto de que no varía.
VII. Reflexiones: la ciencia, la historia y la enseñanza
Repasando los hechos, experimentos y resultados narrados en la Sección IV, es inevitable hacernos ciertas preguntas: Si todos estos hechos eran bien conocidos por los investigadores de hace dos siglos, ¿acaso este conocimiento se perdió? Y si fue así, ¿cómo? ¿Cómo es posible que aún personas que hemos tenido una educación de buena calidad en ciencias nunca hayamos oído hablar de ellos? ¿Por qué aceptamos e incluso enseñamos afirmaciones como “el agua hierve a 100°C” o “el punto fijo superior de la escala Celsius es el punto de ebullición del agua”, sin realmente detenernos a cuestionar cómo lo sabemos, y mucho menos si es correcto? Una cosa es clara: en sentido estricto el conocimiento no se perdió; los documentos históricos e incluso muchos de los instrumentos aún están allí, para quien se tome la molestia de buscarlos, en museos y bibliotecas. Pero parece que pocos se toman la molestia. Para muchos estudiantes y docentes de ciencias contemporáneos, parece que este conocimiento “cayó por debajo del radar”. Lo que la mayoría aprendemos y luego enseñamos es que la frontera entre el estado líquido y el gaseoso está bien definida como, por ejemplo, la curva en un diagrama Presión-Temperatura sobre la que la presión de vapor iguala la presión externa; lo cual, claro, no permite variaciones en la temperatura si la presión está fija. Los que tuvimos la fortuna de tener un buen curso avanzado de Termodinámica habremos aprendido además sobre la energía libre de Gibbs y los estados metaestables, lo cual explica el sobrecalentamiento, y sobre las fluctuaciones de densidad; y en general, sólo si uno toma un curso de especialización en transiciones de fase oirá hablar de la nucleación, y a menudo será sólo de la homogénea, lo que ya es una gran mejora pero aún no basta para explicar, por ejemplo, la ebullición sostenida a temperatura dependiente del material del recipiente. Pero aún en un curso básico los caprichos de la ebullición podrían mencionarse, e incluso demostrarse, aún si ello implica aclarar que una explicación completa excede los alcances del curso. Entonces ¿por qué no hacerlo? ¿Por qué perpetuamos el mito? Otra cosa también es clara, a poco que se averigüe: los especialistas, es decir los científicos y profesionales que“viven” de la ebullición, sí que son muy conscientes de sus caprichos, aunque su enfoque varía mucho de una especialidad a otra (Chang, 2008). Los ingenieros mecánicos y químicos, por ejemplo, se preocupan bastante poco del diagrama de fases en equilibrio o de la definición precisa de ebullición; se concentran en cambio en la “curva de ebullición”, que grafica la velocidad con la que el líquido hirviente extrae calor del “elemento calefactor” como función de su “exceso de temperatura”; los motivos son claros si nos detenemos a pensar en las consecuencias para, digamos, un reactor nuclear, si esta extracción de calor no es lo bastante rápida. Los químicos y bioquímicos, que necesitan muchas veces hervir substancias puras en recipientes de vidrio extremadamente limpios, recurren a arrojar en el recipiente las llamadas boiling chips, pequeñas piezas irregulares de un material inerte (p. ej. Teflón) que no contaminan químicamente el líquido pero garantizan una ebullición suave a la “temperatura de ebullición”. Los químicos orgánicos, cuando necesitan determinar el “punto de ebullición” de una muestra, utilizan un “tubo de Thiele” (ver p. ej. http://www.chem.ucalgary.ca/courses/351/laboratory/boilingpoint.pdf), que necesita muy poco material, no lo contamina, y esencialmente provee un fenómeno fácilmente detectable visualmente (el ingreso del líquido a un capilar) que, por el diseño del instrumento, es forzado a ocurrir a la “temperatura de ebullición” definida por la termodinámica de equilibrio. Y si bien cada uno de estos especialistas presta atención a un aspecto diferente de la ebullición, todos ellos son perfectamente familiares con fenómenos como el sobrecalentamiento, el “golpeteo” (bumping), la variación de la temperatura con el material del recipiente, etc., y con las técnicas para promoverlos o inhibirlos. Evidentemente las lecciones aprendidas por De Luc y los demás pioneros no han sido olvidadas aquí. En cuanto a todos los demás, físicos incluidos, muchos parecemos haber olvidado estos hechos. Es comprensible que la creciente especialización haga que, cuando entrenamos a un futuro investigador, tendamos a utilizar el limitado tiempo disponible para impartirle conocimientos que lo lleven a la frontera de su especialidad, y nada más que ésos; pero no es disculpable. Conocimientos como los descriptos aquí requieren una cantidad de tiempo muy modesta para ser simplemente mencionados, y sin saber de su existencia, difícilmente pueda luego uno pensar en enseñarlos. No hacerlo implica que generación tras generación perpetuarán el olvido. Que ello tiene consecuencias, y que lleva tiempo ocurriendo, queda claro en el siguiente párrafo, que Chang (2004) cita de Aitken y traduzco aquí: Ahora, no deseo poner demasiado énfasis en declaraciones como éstas hechas por tales autoridades, sino que las miraría simplemente como la moneda corriente de la literatura científica que ha sido puesta en circulación con el sello de la autoridad, y ha sido recibida y pasada a otros por estos escritores sin cuestionar su valor. (Aitken, 1878, p. 252). ¿A qué se refería Aitken aquí? Pues nada menos que a enunciados patentemente incorrectos acerca de las temperaturas de ebullición y fusión, que acababa de citar de textos tan canónicos como Theory of Heat de James Clerk Maxwell y Heat A Mode of Motion de John Tyndall. Hay otro fragmento algo posterior de Aitken, donde comenta su trabajo sobre la niebla y la bruma, que Chang (2004) también cita y vale la pena leer: Mucho, muchísimo, queda aún por hacer. Como un viajero que acaba de desembarcar en un país desconocido, soy consciente de que mis vacilantes pasos se han extendido apenas más allá del punto de partida. Todo en derredor se extiende lo desconocido, y a la distancia el panorama se cierra en muchos picos Alpinos, cuyas cuestas requerirán pasos más vigorosos que los míos para escalarlas. (Aitken, 1880-81, p. 368) La reflexión de Chang, que comparto, es que casi siglo y medio después de este humilde pronunciamiento, no sólo no somos conscientes de que la ebullición, la evaporación y otros fenómenos similares alguna vez constituyeron verdaderos “picos Alpinos” para la ciencia, sino que, para muchos de nosotros, el “país desconocido” de Aitken ni siquiera figura en el atlas. Si lo que precede muestra lo deletéreo que resulta no incluir aunque sea mínimas notas históricas al enseñar ciencias a futuros investigadores, con mayor razón es inexcusable no hacerlo, aún con mayor extensión, cuando enseñamos a futuros profesores, o éstos a sus estudiantes; no tenemos aquí ni siquiera la débil coartada de que nuestro auditorio necesita llegar a la frontera de su especialidad en un tiempo breve. Además, este tipo de notas históricas ayudan a cambiar, aseguraría que para mejor, la mirada habitual de este público hacia la ciencia y los científicos: les mostrará que la empresa científica está lejos de la habitual imagen de “progreso lineal”, y es en cambio un proceso difícil, caótico y, muchas veces, desconcertante; y les mostrará también que los científicos son personajes pintorescos, complejos, muchas veces apasionados, con rasgos de carácter tanto admirables como lamentables, y definitivamente humanos. Creo sinceramente que ello contribuiría a una mejor formación en ciencias, y tendría un efecto profundamente motivador para su estudio. Y tendrá el beneficio adicional de ir erradicando de nosotros, los docentes de ciencias, esa “bipolaridad cognitiva” que hace que cuando calentamos agua para el mate sepamos que hay que apagar el fuego al primer hervor, pero en cuanto entramos al aula dejemos de ser conscientes de ello.
VIII. A modo de epílogo
Como científico que enseña mayormente a estudiantes universitarios de las ciencias “duras”, he tenido sobradas oportunidades de presenciar cómo, en la formación de futuros científicos, muchas veces les enseñamos el “estado del arte” de un área sin darles siquiera una pizca de contexto histórico, y pretendemos que luego sean capaces de producir nuevo conocimiento. Si nos limitamos a transmitir una masa de conocimientos sin darles el menor indicio de cómo a alguien se le ocurrió eso, porqué alguien pensó que eso que hoy “sabemos” era lo que había que buscar, la respuesta a una pregunta importante que había que contestar, ¿en qué momento y de qué manera los estamos entrenando para preguntarse? Por supuesto que el conocimiento en sí es indispensable, como es indispensable llegar a enseñar lo último que se sabe, para no intentar reinventar la rueda a cada paso. Pero si pretendemos formar un científico, una mente inquisitiva, debemos justamente enseñarle a inquirir. Y para eso nada mejor que el ejemplo: el de los que se fueron formulando las preguntas cuyas respuestas están hoy en los libros. Me gustaría exponer una metáfora que, creo, puede resultar ilustrativa de qué considero errado en cierta manera de enseñar ciencia. La comprensión de un teorema, un desarrollo, una ley, pueden en principio alcanzarse in abstracto, pero no basta con comprender si queremos producir. Imaginemos una persona que ve por primera vez un arco romano; y supongamos por añadidura que esa persona tiene alguna noción de estática, e incluso cierto sentido estético. Con cierta ayuda o incluso sin ella, esta persona acabará por entender cómo funciona el arco: cómo las cargas se transmiten de una piedra a otra hasta descargar en los pilares, el papel fundamental de la clave; probablemente incluso admire la sencillez y elegancia del arco como solución de un problema arquitectónico. Pero si intenta construir un arco, enfrentará un problema en apariencia insalvable: el arco sólo resiste si está completo, si ya está terminado. Si quitamos cualquier piedra la estructura completa colapsa. ¿Cómo, entonces, ir colocando las piedras sin que se caigan hasta que pongamos la clave en su sitio? Es que, claro, nunca vio el andamiaje; sí, esa humilde, desprolija y fea estructura de madera, provisoria y funcional, sin pretensión de ser más que eso, algo que sostiene las piedras a medida que el arco se completa. Tampoco vio a los carpinteros que la construyeron y después la desmontaron, una vez que el maestro albañil colocó la clave. Pero el andamiaje es el verdadero secreto del arco: sin andamiaje no hay arco. Y es que los arcos no se construyen terminados. Y el conocimiento tampoco. Me temo que muchas veces, en el apuro de mostrarle a nuestros estudiantes todas esas bellas construcciones, de inculcarles sus detalles y funcionamiento antes que su tiempo de aprendizaje se termine, hemos llenado nuestros textos y clases de arcos, cúpulas y otras elegantes estructuras, pero hemos eliminado los andamiajes. Y los carpinteros. Y muchas veces, incluso a los albañiles: los nombres propios en “ecuaciones de Maxwell”, “máquina de Carnot”, “entropía de Gibbs”, “primera ley de Newton”, etc., han devenido en meras etiquetas. Y si sólo pretendiéramos formar estetas, quizá sería suficiente. Pero si pretendemos formar constructores, es una educación claramente defectuosa. Muchas, demasiadas veces les enseñamos sólo el resultado final de un largo y complejo proceso, y cómo aplicarlo, convertirlo en herramienta para resolver problemas; y está bien y es necesario. Pero no alcanza. Al menos un poco, tenemos que enseñar también el proceso; ese que, como el del arco, suele ser largo y retorcido, pocas veces limpio y elegante, casi nunca definitivo. Porque el científico no es sólo un conocedor de muchos saberes, un resolvedor serial de problemas y un fabricante de respuestas; es además, y sobre todo, un constructor de saberes, un inventor de problemas, un compulsivo descubridor de preguntas, un aventurero del conocimiento más interesado en el viaje que en el destino. O debería serlo.