Introducción
El manejo del cáncer diferenciado de tiroides (CDT) de bajo riesgo continúa siendo motivo de controversia dada su naturaleza indolente y la dificultad en alcanzar un balance adecuado entre la morbilidad del tratamiento y el riesgo de progresión de la enfermedad. Durante las últimas décadas, el mejor conocimiento de la biología del cáncer de tiroides, así como la clasificación de acuerdo con el riesgo de recurrencia, han orientado su manejo hacia opciones terapéuticas más conservadoras y personalizadas1,2.
Con los trabajos de Mazzaferri y col.3, la tiroidectomía total con la indicación sistemática de yodo radiactivo pasó a ser el procedimiento de referencia (estándar de oro) durante casi 40 años. Aunque refrendado por el trabajo de Bilimoria y cols. en 2007, cuestionado a su vez por la falta de datos importantes4, este paradigma perdió sustento con el análisis de Adam y cols.5 sobre 62 000 pacientes, en el que ‒luego de ajustar por comorbilidades y variables propias del tumor‒ no se encontraron diferencias en sobrevida entre los tratados con lobectomía y con tiroidectomía total, y fue ratificado por numerosos trabajos retrospectivos posteriores6, 7,8, 9. Se modificó la postura frente a la administración de yodo radiactivo cuando algunos estudios retrospectivos no mostraron beneficio en recurrencia ni mortalidad en el grupo de bajo riesgo10. Un estudio prospectivo francés reciente (ESTIMBL 2), sobre 776 pacientes, no registró resultados inferiores en cuanto a sobrevida en los estadios I y II con y sin 30 mCi luego de tiroidectomía total11.
Considerando que la mayoría de los CDT de bajo riesgo tienen un pronóstico excelente, se ha observado en los últimos años una mayor aceptación de opciones de manejo minimalistas, que aseguran menor morbilidad con resultados oncológicos similares y mejor calidad de vida1)
Es en este contexto donde ha consolidado su papel la lobectomía tiroidea junto a otras opciones no quirúrgicas como la vigilancia activa12 o la ablación térmica percutánea13, para el tratamiento del CDT de bajo riesgo, en pacientes adecuadamente seleccionados.
El objetivo del presente trabajo fue describir los resultados del empleo de la lobectomía tiroidea como primera elección para el tratamiento quirúrgico del CDT de bajo riesgo.
Material y métodos
Se llevó a cabo un estudio observacional a partir del análisis retrospectivo de los datos obtenidos de las historias clínicas computarizadas de una cohorte de 114 pacientes con CDT de bajo riesgo tratados con lobectomía más itsmectomía entre enero de 2015 y abril de 2023. El estudio fue aprobado por la Unidad de Investigación Clínica.
Se incluyeron en esta cohorte pacientes adultos, con ausencia de comorbilidades significativas y con los siguientes requisitos: nódulos tiroideos con punción con aguja fina clase V y VI de la clasificación de Bethesda, tamaño ecográfico < 4 cm, unifocales, sin evidencia clínica o ecográfica de nódulos contralaterales y/o enfermedad ganglionar, sin extensión extratiroidea macroscópica ni enfermedad a distancia, así como aquellos que, con citología preoperatoria benigna o indeterminada, presentaron hallazgos intraoperatorios o posoperatorios que cumplían con los criterios previamente citados. Se excluyeron del estudio los pacientes menores de 18 años, con antecedentes de exposición a algún tipo de radiación o sin ellos.
Se registraron datos demográficos, características ecográficas, citología, tipo de abordaje y complicaciones, anatomía patológica, factores de riesgo histológicos, riesgo de recurrencia, tiroiditis asociada, estadificación según TNM, evolución alejada y requerimiento de terapia hormonal posoperatoria.
El tipo de cirugía realizada fue lobectomía tiroidea más itsmectomía, por cervicotomía convencional o por abordaje transoral; no se efectuaron linfadenectomías centrales profilácticas, en concordancia con la conducta del servicio y con las recomendaciones de las guías de práctica clínica vigentes. El compartimento central sí fue explorado sistemáticamente durante la lobectomía; frente al hallazgo de adenomegalias (no diagnosticadas preoperatoriamente por la ecografía), se realizó su biopsia por congelación. En caso de positividad, se completó la tiroidectomía total con linfadenectomía central, y el paciente se excluyó del presente estudio.
En el estudio anatomopatológico de la pieza quirúrgica, además de los aspectos morfológicos, se consignaron la invasión capsular mínima, la multifocalidad, la invasión vascular (menos de 4 vasos o 4 vasos o más), las metástasis ganglionares no diagnosticadas en la exploración intraoperatoria y el porcentaje de células con características de mayor riesgo en el caso de variantes agresivas (células altas).
El riesgo de recurrencia se clasificó de acuerdo con las categorías de la Asociación Americana de Tiroides (ATA). Se consideró de bajo riesgo al carcinoma papilar intratiroideo, < 4 cm, variante convencional, sin invasión vascular o < 4 vasos, clínicamente N0 o con < 5 micrometástasis, todas < 2 mm, y el carcinoma folicular con invasión capsular o invasión vascular mínima (< 4 vasos).
El riesgo intermedio correspondió al carcinoma papilar con invasión vascular, al folicular con invasión de 4 o más vasos, a la extensión extratiroidea microscópica, al N1 (> de 5 ganglios, todos < 3 cm) y a las histologías agresivas (células altas) cuando el porcentaje de células con dichas características fue mayor de 30%. La estadificación y el riesgo de mortalidad se evaluaron según TNM en su 8.a edición; ambas clasificaciones se basan en parámetros disponibles en el preoperatorio y en el intraoperatorio que permiten adecuar la extensión de la cirugía a las características de cada paciente y de cada tumor.
Para el análisis de los datos fue utilizado el paquete STATA BE 17.0® licencia perpetua del DDA (Departamento de Desarrollo Académico del Hospital Universitario Austral).
Para las variables continuas consideramos su informe en media y desvío estándar (DS) o mediana y rango intercuartílico (RIC 25%-75%), de acuerdo con su distribución normal o no normal, respectivamente. Para las variables dicotómicas o categóricas, utilizamos el informe de frecuencias y porcentajes.
Resultados
Nuestra experiencia con lobectomía tiroidea en el tratamiento del CDT se inició en 2015, con un aumento progresivo hasta alcanzar en la actualidad el 29,3% de los casos en 2022 (Fig. 1). Durante este período se realizaron 924 tiroidectomías, de las cuales 583 fueron tiroidectomías por CDT; de estas, 469 fueron tiroidectomías totales, 110 lobectomías con itsmectomías y 4 itsmectomías como única resección; el conjunto de lobectomías e itsmectomías totalizaron el 19,5% de la cirugía tiroidea por CDT en el período analizado. La media de edad fue de 44 años (DS ±12 años), 90 pacientes (79%) fueron mujeres; la mediana del tamaño tumoral fue de 9,4 mm (RIC 25-75% 7-13 mm) y el 103 de los nódulos (90%) fueron ecográficamente sólidos (Tabla 1).
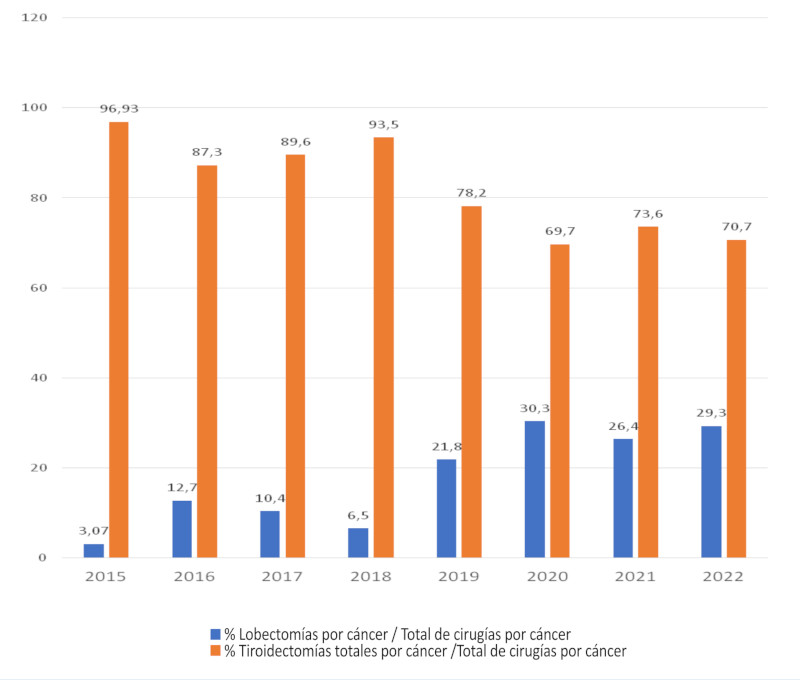
FIGURA 1 Lobectomías tiroideas por carcinoma diferenciado en relación con el total de tiroidectomías por cáncer entre 2015 y 2022
TABLA 1 Características ecográficas y citológicas de los tumores
| N = 114 | % | |
|---|---|---|
| Ecografía | ||
| Sólido | 103 | 90,35 |
| Quístico | 2 | 1,75 |
| Mixto | 9 | 7,89 |
| Categoría Bethesda | ||
| I | 2 | 1,75 |
| II | 8 | 7,02 |
| III | 6 | 5,26 |
| IV | 11 | 9,65 |
| V | 20 | 17,54 |
| VI | 67 | 58,77 |
La citología preoperatoria fue categoría V y VI de Bethesda en 87 pacientes (76%); los 27 pacientes con citología preoperatoria benigna o indeterminada se incluyeron en esta serie porque el diagnóstico de malignidad surgió en la biopsia por congelación o en la histología definitiva, y en los cuales no se completó la tiroidectomía total (véase Tabla 1).
El 65% de los pacientes (74/114) correspondió a microcarcinomas; solo 2 pacientes (1,7%) fueron T3 (por tamaño > 4 cm). En 13 pacientes (11.4%) se registraron micrometástasis en el compartimento central, el 95% (108/114) fue estadio I y solo 2 pacientes correspondieron al estadio II por ser mayores de 55 años con N1a (Tabla 2).
TABLA 2 Estadificación según TNM y riesgo de recurrencia según ATA
| Estadificación TNM | n | % |
|---|---|---|
| T1a | 74 | 64,91 |
| T1b | 31 | 27,19 |
| T2 | 7 | 6,14 |
| T3 | 2 | 1 |
| N0 | 60 | 52,63 |
| N1a | 13 | 11,40 |
| Nx | 41 | 35,96 |
| Estadios | ||
| I | 112 | 98,25 |
| II | 2 | 1,75 |
| Riesgo de recurrencia ATA | ||
| Bajo | 109 | 95,61 |
| Intermedio | 5 | 4,39 |
Las lobectomías e itsmectomías se realizaron por cervicotomía convencional en 93 casos (82%) y en 21 pacientes (18%) se utilizó el abordaje transo-ral (TOETVA: sigla en inglés de “Trans Oral Endoscopic Thyroidectomy Vestibular Approach”); se agregó algún tipo de linfadenectomía central en 48 pacientes (42%), con una mediana de ganglios resecados de 2 (RIC 25-75% 1-3 ganglios). Se completó la tiroidectomía total diferida en dos pacientes (1,8%) con diagnóstico de carcinoma folicular con invasión vascular mayor de 4 vasos. No hubo hallazgos tumorales en los lóbulos residuales resecados en los dos casos; en uno, con abordaje transoral previo, la tiroidectomía total también se completó por TOETVA.
Los resultados anatomopatológicos definitivos se muestran en la Tabla 3.
TABLA 3 Hallazgos anatomopatológicos en 114 pacientes
| n | % | |
|---|---|---|
| Tipos histológicos | ||
| Papilar | 85 | 74,56 |
| Folicular | 5 | 4,39 |
| Variante folicular de carcinoma papilar | 14 | 12,28 |
| Carcinoma de células de Hürtle | 1 | 0,88 |
| Variantes con características de mayor riesgo | 8 | 7,02 |
| NIFPT | 1 | 0,88 |
| Multifocalidad | 16 | 14,04 |
| Invasión vascular | ||
| Mínima (menos de 4 vasos) | 6 | 5,26 |
| Extensa (4 vasos o mayor) | 2 | 1,75 |
| Tiroiditis de Hashimoto | 47 | 41,22 |
NIFPT : Non Invasive Follicular Thyroid Neoplasm with Papillary-like nuclear features.
El 95,6% de los pacientes tuvieron riesgo de recurrencia bajo, y otros 5 fueron considerados de riesgo intermedio por hallazgos en la anatomía patológica diferida, pero no se les completó la tiroidectomía total por recomendación del equipo tratante y/o preferencia del paciente. Como complicaciones, en un caso existió una parálisis recurrencial transitoria, y equimosis leve en 15 de los 19 pacientes con abordaje transoral. No se registraron recurrencias en el lóbulo contralateral ni en la región central y lateral del cuello, ni metástasis a distancia, y permanecieron todos los pacientes sin evidencia de enfermedad hasta el cierre de la presente observación. El 60% de los pacientes operados requirieron suplemento de hormona tiroidea con dosis variables, de 50 a 150 μg/24 horas. El seguimiento promedio fue de 33,4 meses, con un rango de 2 a 101 meses.
Discusión
El manejo del CDT de bajo riesgo continúa evolucionando y generando incertidumbre, a medida que un mayor nivel de evidencia sustenta el empleo de estrategias terapéuticas menos invasivas con el objetivo de minimizar la morbilidad, evitar el sobretratamiento y prevenir intervenciones innecesarias14.
El presente estudio ofrece evidencia adicional sobre la eficacia de la lobectomía tiroidea en el tratamiento del CDT de bajo riesgo en pacientes apropiadamente seleccionados. Los resultados en términos de sobrevida libre de recurrencia han sido excelentes y coincidentes con los informados por otros centros de alto volumen9, 15,16. Es de destacar la ausencia de complicaciones mayores y de recurrencias de la enfermedad, sin dejar de reconocer el seguimiento insuficiente en un porcentaje de pacientes.
Durante el período de estudio se observó un marcado aumento en el número de lobectomías para el tratamiento del CDT; esta tendencia se reprodujo en el análisis de un grupo de hospitales generales norteamericanos que, luego de la aparición de las guías de la ATA (Asociación Americana de Tiroides), informan un 22% de lobectomías sobre el total de tiroidectomías realizadas en esos centros17. Untch y cols., en un centro de alto volumen, refieren un 15% de lobectomías en su serie de tiroidectomías por cáncer15, cifra similar al promedio de lobectomías realizadas por nuestro grupo (19%) durante el período analizado. Este porcentaje es relativamente bajo considerando que las guías habilitan la lobectomía hasta en tumores de 4 cm18; sin embargo, algunos grupos desaconsejan la lobectomía en tumores mayores de 2 cm porque estos registran mayor sobrevida si son tratados con tiroidectomía total; no así en los menores de 2 cm, en quienes no se habrían hallado diferencias en cuanto a sobrevida entre ambos procedimientos.19 En nuestra experiencia, la elección de candidatos para lobectomía ha sido muy restrictiva con respecto al tamaño: más del 90% fueron T1 (tumores menores de 2 cm) y solo el 6 % superaron los 2 cm (T2), correspondiendo el 96% a un riesgo bajo de recurrencia.
El hallazgo de características histológicas de mayor riesgo, no diagnosticadas preoperatoriamente, como histología agresiva, extensión extratiroidea, metástasis ganglionares, invasión vascular y multifocalidad son motivo de cuestionamiento de la lobectomía20.
Las micrometástasis ganglionares es un hallazgo relativamente frecuente (11% en nuestra experiencia), pero tienen poca significancia clínica, con un riesgo de recurrencia similar a los que no la presentan, dado que no todas las micrometástasis progresan a enfermedad estructural, por lo que no constituyen, por sí solas, indicación de tiroidectomía total21; por esta razón, no se completó la tiroidectomía en ninguno de los pacientes que las presentaron. La extensión extratiroidea mínima también se considera de bajo riesgo; en un metanálisis de 23 estudios22, el riesgo de recurrencia fue muy bajo (3,5%) y el AJCC (American Joint Committee on Cancer), en su 8.a edición, no la reconoce como un factor de riesgo que incremente el estadio23, de manera que su presencia tampoco modifica la indicación de lobectomía. La multifocalidad, que se presenta asociada al carcinoma papilar en el 13 al 71% de los casos24,25, es otro hallazgo que plantea dudas con respecto a la conveniencia de la lobectomía; en un metanálisis de 21 artículos de Joseph y cols. se la asocia a un mayor riesgo de recurrencia y progresión de la enfermedad y, en esos casos, se recomienda la tiroidectomía total26. Sin embargo, un estudio reciente de Harries y cols. no encontró diferencias en la probabilidad de enfermedad contralateral o de recurrencia regional y considera la lobectomía válida en carcinomas papilares T1-2N0M0, independientemente de la presencia de multifocalidad27. En coincidencia con este enfoque, en nuestro estudio, el hallazgo de multifocalidad no modificó la indicación de lobectomía.
Desde la publicación de las guías de ATA en 2015, varios trabajos refieren entre un 30-59% de pacientes que tendrían necesidad de completar la tiroidectomía total si hubieran sido tratados inicialmente con lobectomía, como consecuencia del hallazgo de características histológicas de mayor riesgo en la anatomía patológica de la pieza quirúrgica28; en nuestra casuística, este número fue muy bajo (1,8%), coincidente con la experiencia de Untch y cols., quienes solo reoperaron el 3% de sus lobectomías en un período de 10 años; y de estas, solo el 34% tenían tumor en el lóbulo contralateral, y el 90 % eran microcarcinomas, sin importancia pronóstica15) Solo hay dos indicaciones categóricas de completar la tiroidectomía total: la invasión vascular cuando es mayor de 4 vasos, y las histologías agresivas (células altas), cuando el porcentaje de células con estas características es mayor del 30%. La Organización Mundial de la Salud, en la 4.a edición de su clasificación de tumores endocrinos de 2017, requiere un porcentaje de células altas mayor del 30% para designar a un tumor como variante de células altas29. Estos hallazgos ocurren en no más del 3-4% de los casos y casi nunca se presentan en forma aislada, dado que habitualmente vienen asociados a extensión extratiroidea o ganglios positivos o a ambos, características que son identificables en el preoperatorio y que, de por sí, descartan la indicación de lobectomía.
Cabe consignar también que el grupo de Ganly y cols., del Memorial Sloan Kettering, recomienda tratar a los pacientes con menos del 30% de células altas como carcinomas papilares clásicos y evitar tratamientos agresivos en pacientes con estas características cuando no se acompañan de otras características de mayor riesgo30.
La decisión de completar la tiroidectomía total luego de una lobectomía también está estrechamente vinculada con la postura del equipo tratante respecto de la necesidad de administrar yodo radiactivo en el posoperatorio; en nuestro centro, la indicación de ablación con yodo131 es muy selectiva y está limitada a algunos pacientes de riesgo intermedio y a los de alto riesgo de recurrencia.
La obtención de buenos resultados con este enfoque minimalista está directamente relacionada con la selección preoperatoria de los pacientes1; se reconocen como ideales los microcarcinomas de ubicación favorable (centro del lóbulo), únicos, ecográficamente N0, sin evidencia de tiroiditis y los ubicados en el istmo tiroideo, preferentemente con TSH < 2 µIU/L. A su vez, se consideran apropiados, aunque no ideales, los carcinomas intratiroideos, de 1-4 cm, con presencia de anticuerpos y/o signos ecográficos de tiroiditis, con micrometástasis ganglionares si son menores de 2 mm y en número inferior a 5, los que presentan invasión vascular mínima si es menor de 4 vasos y las histologías agresivas cuando el porcentaje de células con características de mayor riesgo es inferior al 30%12. La ecografía permite diagnosticar la mayoría de las características inapropiadas para la lobectomía en el preoperatorio, salvo la invasión vascular y las histologías agresivas; nuestra baja incidencia de reintervenciones puede explicarse por el uso intensivo de esta herramienta que, junto a un ecografista experto, permitió una selección rigurosa de los candidatos a lobectomía. Un papel adicional lo cumplen la exploración intraoperatoria sistemática del compartimento central, y la biopsia por congelación frente al hallazgo de adenopatías sospechosas; en la experiencia de Raffaelli y cols.31, la biopsia intraoperatoria ofrece una sensibilidad del 81%, una especificidad del 100% y una exactitud del 90%, lo que permite modular la extensión de la cirugía y evitar lobectomías insuficientes, conducta que ha sido aplicada en esta serie. Los pacientes a quienes se les propone una lobectomía deben estar informados y aceptar un riesgo de recurrencia de hasta un 6%, con la posibilidad de tener que modificar el plan preoperatorio o de necesitar una eventual reintervención en caso de que los hallazgos histológicos posoperatorios la requieran16.
Recientemente, el interés en los aspectos cosméticos impulsó el desarrollo de técnicas mininvasivas con el objetivo de minimizar o invisibilizar las cicatrices, en particular el abordaje transoral, a partir de la comunicación del grupo de Anuwong en 2016 32.
A partir de nuestra experiencia con el abordaje transoral, 19% de las lobectomías de esta serie fueron realizadas por esta vía. Aunque la bibliografía comunicada es escasa y exiguo el número de pacientes, existe consenso en que el abordaje transoral es un método seguro con resultados similares a los del abordaje convencional, en pacientes muy seleccionados, preferentemente con microcarcinomas que cumplan con los mismos requisitos exigidos para la lobectomía por vía cervical33, 34, 35. Nuestra experiencia en lobectomías por TOETVA en CDT coincide con esta postura, pues todos los procedimientos se realizaron exitosamente, con excelentes resultados cosméticos, sin recurrencias ni complicaciones mayores, salvo una ligera equimosis en la región submentoniana en algunos pacientes36. Sin embargo, debe señalarse que se necesitan más estudios comparativos prospectivos que garanticen resultados equivalentes a los del abordaje convencional.
Como limitaciones de este trabajo reconocemos el acotado tamaño de la muestra, su carácter retrospectivo y un seguimiento incompleto en un porcentaje de pacientes; como fortalezas, una selección muy rigurosa de candidatos a lobectomía, operados por un mismo equipo y en un contexto multidisciplinario, donde los Servicios de Endocrinología y Cirugía, comparten un pensamiento uniforme sobre el manejo del carcinoma diferenciado de bajo riesgo. Para la obtención de buenos resultados con un enfoque de este tipo se considera esencial una discusión comprensiva sobre las características de la enfermedad, las opciones terapéuticas, la calidad de vida esperable y las preferencias del paciente; de esto de trata cuando hablamos de medicina de precisión, personalizada y centrada en el paciente.
En conclusión, los resultados del presente trabajo coinciden con lo publicado en la bibliografía internacional sobre la lobectomía tiroidea como alternativa válida a la tiroidectomía total para el tratamiento quirúrgico del CDT con bajo riesgo de recurrencia, en pacientes estrictamente seleccionados; esta opción ofrece resultados óptimos en sobrevida libre de recurrencia, así como en ausencia de complicaciones. También sugiere que el abordaje transoral es una técnica segura con resultados similares a los del abordaje convencional, aunque se requiere mayor experiencia y seguimiento para asegurar la eficacia oncológica de esta técnica.











 texto en
texto en 



