Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista agronómica del noroeste argentino
versión impresa ISSN 0080-2069versión On-line ISSN 2314-369X
Rev. agron. noroeste arg. vol.37 no.1 San Miguel de Tucumán jun. 2017
ARTÍCULO CIENTÍFICO
Evaluación de sustratos para la producción de esporas de Trichoderma y estudio del crecimiento en arroz de las cepas antagonistas TPT03, TPT02, MRT35 y MRT40
Substrate evaluation for Trichoderma spore production and rice growth study in TPT03, TPT02, MRT35 and MRT40 antagonist strains
E. Allori Stazzonelli1, 2*; M.G. Yasem de Romero1; L.D. Ploper1, 2, 3
1 Facultad de Agronomía y Zootecnia, Universidad Nacional de Tucumán. Florentino Ameghino S/N, El Manantial, (T4104AUD), Tucumán, Argentina.*E-mail: enzo_0387@hotmail.com
2 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina.
3 Estación Experimental Agroindustrial Obispo Colombres. Tucumán, Argentina.
Resumen
En el Noroeste Argentino, la producción de poroto (Phaseolus vulgaris L.) representa una importante actividad agrícola regional. Uno de los problemas sanitarios más complejos es provocado por el fitopatógeno Sclerotinia sclerotiorum. Las dificultades para el manejo de dicho pastógeno hacen al control biológico y a Trichoderma una interesante alternativa para la supresión del hongo. Existen múltiples antecedentes que ponen énfasis en la multiplicación de Trichoderma spp. en sustratos de bajo costo que se originan como subproductos de la industria. En la provincia de Tucumán, la industria azucarera, produce grandes cantidades de bagazo y melaza de caña de azúcar. El objetivo del presente trabajo fue evaluar la producción artesanal de esporas de Trichoderma en diferentes sustratos, mediante fermentación sólida así como el crecimiento de las cepas nativas TPT03, TPT02, MRT35 y MRT40 en arroz. Los sustratos donde se produjo mayor concentración de conidios por gramo, al décimo día de incubación, fueron el constituido por granos de arroz (17,8 x 108 conidios/g) y el conformado por bagazo humedecido con solución de melaza al 10 % (14,4 x 108 conidios/g). Las cepas de Trichoderma evaluadas en granos de arroz presentaron diferencias con respecto a su crecimiento y esporulación. La cepa TPT03 (T. afroharzianum) presentó la mayor producción de conidios y velocidad de crecimiento entre todas las cepas evaluadas al décimo día de incubación. Los resultados obtenidos demuestran que la producción por fermentación en sustrato solido es una alternativa factible para la obtención de inóculo de alta calidad de las cepas de Trichoderma nativas. Además, la implementación del sustrato a base de bagazo y melaza, subproductos de la industria azucarera en la provincia, constituye una alternativa a tener en cuenta por su bajo costo, alta disponibilidad y eficiencia en la producción de conidios.
Palabras clave: Arroz; Bagazo de caña de azúcar; Conidios; Fermentación sólida; Melaza; Agentes de control biológico.
Abstract
In Northwestern Argentina, bean production constitutes a major agricultural activity. One of the most complex phytosanitary problems is caused by Sclerotinia sclerotiorum. The difficulties to the management of this pastogen make the biological control and Trichoderma an interesting alternative for the suppression of the fungus. There are several records which highlight the multiplication of Trichoderma spp. in low-cost substrates originated as industry by-products. In the province of Tucumán, the sugar industry produces large amounts of sugar cane bagasse and molasses. The aim of this work was to evaluate the artisanal production of Trichoderma spores in different substrates by means of solid fermentation and the growth of native antagonist TPT03, TPT02, MRT35 and MRT40 strains in rice. The substrates with the greatest concentration of conidia per gram on the tenth incubation day were the ones grown in rice grains (17,8 x 108 conidia/g) and the one conformed by bagasse moistened in 10% molasses solution (14,4 x 108 conidia/g). The Trichoderma strains evaluated in rice grains showed differences in their growth and sporulation. TPT03 strain (T. afroharzianum) produced the greatest amount of conidia and presented the fastest growth among all the evaluated strains on the tenth incubation day. The results obtained reveal that the production by means of fermentation in a solid substrate is a feasible, rapid and low-cost alternative for obtaining high-quality inoculum of the selected native Trichoderma strains. In addition, the implementation of the substrate based on bagasse and molasses, by-products of the sugar industry in the province, is an alternative to be taken into account due to its low cost, high availability and efficiency in the production of conidia.
Keywords: Rice; Sugar cane bagasse; Conidia; Solid fermentation; Molassses; Biological control agents.
Recibido 08/06/17; Aceptado 23/06/17.
Los autores declaran no tener conflicto de intereses.
Introducción
En el Noroeste Argentino (NOA), la producción de poroto (Phaseolus vulgaris L.) representa una importante actividad agrícola regional, destinándose en su mayor parte a la exportación. Uno de los problemas sanitarios más complejos y que causa graves pérdidas en el cultivo es provocado por hongos fitopatógenos habitantes del suelo, los cuales producen estructuras de resistencia (esclerocios) en ausencia de los hospederos y/o en condiciones climáticas desfavorables. Entre ellos, se destaca Sclerotinia sclerotiorum (Lib.) de Bary (Ascomycotina), uno de los fitopatógenos fúngicos más desbastadores que causa enfermedad en un amplio rango de hospedantes (Boland y Hall 1994).
De acuerdo a las características del patógeno, las prácticas de manejo disponibles son escasas y en muchos casos difíciles de implementar. El uso de la rotación de cultivos es una práctica muy limitada debido a la sobrevivencia del esclerocio en el suelo por largos períodos de tiempo (Bueno et al.; 2007) y al amplio rango de hospederos de S. sclerotiorum. Otro método usado con poco éxito ha sido la solarización del suelo, limitada a pequeñas superficies. El control químico es la medida que se emplea actualmente, aunque puede generar problemas de resistencia del patógeno, desequilibrio de los ecosistemas por los efectos tóxicos de los residuos, riesgos para la salud humana y animal (Johnson y Atallah, 2006) sumado a su baja eficacia en la destrucción de esclerocios. Asimismo, las dificultades para obtener cultivares resistentes hacen al control biológico (CB) una interesante alternativa para la supresión del hongo (Inbar et al., 1996; Mitidieri et al., 2005; Martínez et al., 2007). Por lo tanto, es importantela búsqueda de microorganismos nativos capaces de controlar el desarrollo de enfermedades causadas por cepas locales de patógenos (Mondino y Vero, 2006). Entre los agentes de control biológico (ACB) citados, figuran Trichoderma spp., Aspergillus sp., Mucor sp., Gibberella baccata, Penicillium sp., Fusarium sp., Coniothyrium minitans, Gliocladium virens, Talaromyces flavus, Trichotecium roseum, Epicoccum purpurascens, Sporidesmium sclerotivorum y otros hongos de suelo, que colonizan esclerocios de S. sclerotiorum (Huang et al., 2000).
El género Trichoderma presenta diversos mecanismos de acción que regulan el desarrollo de los hongos fitopatógenos. Entre estos, los principales son la competencia por espacio y nutrientes, el micoparasitismo y la antibiosis, los que tienen una acción directa frente al hongo fitopatógeno. Otros autores han sugerido, además de los mencionados, la secreción de enzimas y la producción de compuestos inhibidores (Haram et al., (1996); Zimand el al., (1996).
Para poder utilizar las cepas de Trichoderma como ACB de hongos patógenos, se requiere, entre otros factores, que los mismos estén disponibles en grandes cantidades. Trichoderma spp. produce tres tipos de propágulos: hifas, clamidosporas y esporas (conidios) (Papavizas, 1985). Las esporas son los más viables de los propágulos empleados en programas de biocontrol (Elad et al., 1993). Estas se caracterizan por poseer una gruesa pared exterior, constituida por tres capas (endospora, epispora y perispora) que protegen su interior (protoplasto). Esta gruesa pared se diferencia de la pared de las células vegetativas del hongo, las cuales son mucho más delgadas y no está formadas por capas constitutivas como la de las esporas. Una pared celular gruesa permite que la espora o conidio pueda sobrevivir a condiciones adversas, manteniéndola en dormancia hasta que las condiciones sean propicias para la germinación.
Las necesidades nutricionales de Trichoderma spp. son bien conocidas; se trata de microorganismos aerobios capaces de degradar sustratos muy complejos como almidón, pectina y celulosa entre otros, y emplearlos para su crecimiento gracias al gran complejo enzimático que posee (enzimas hidrolíticas como amilasas, pectinasas, celulasas y quitinasas, entre otras) (Butcher, 1968; Danielson y Davey, 1973). Asimismo, Trichoderma utiliza como fuente de nitrógeno compuestos tales como aminoácidos, urea, nitritos, amoníaco y sulfato de amonio (Moore, 1996). Por otra parte, los microelementos, sales y vitaminas no son indispensables en grandes cantidades para el desarrollo de Trichoderma (Papavizas, 1985). Los elementos traza requeridos para el crecimiento del hongo en general, incluyen hierro, zinc, cobre, molibdeno y manganeso en concentraciones muy pequeñas. Dentro de las vitaminas necesarias se encuentran tiamina (B6), piridoxina (B6), ácido nicotínico (B3), ácido pantoténico (B5), riboflavina (B2), cianocobalina (B12) y ácido aminobenzoico (Moore, 1996).
Los métodos de producción de ACB microbianos varían considerablemente. Los hongos pueden ser producidos sobre tres tipos de medios artificiales: medio líquido, medios sólidos o semisólidos y fermentación bifásica (Alves y Pereira, 1998). Muchos de los métodos basados en fermentaciones sobre sustrato sólido utilizan granos de cereales (Romero et al., 2002). En Colombia, el arroz es el sustrato más utilizado para la producción de biopreparados de Trichoderma spp. a partir de procesos de fermentación artesanal e industrial (Fernández Larrea, 2001; Castro y Rivillas, 2003). Otros métodos de producción emplean cultivos líquidos estáticos donde se desarrollan los conidios en la superficie del mismo o la fermentación en tanques para obtener productos a base de micelio y conidios sumergidos.
El cultivo sobre soporte sólido o semisólido es una forma de producción donde se requiere menos equipamiento y se realizan muchas operaciones manuales pero se obtienen estructuras infectivas de alta calidad a concentraciones elevadas. La producción de hongos sobre medios sólidos es la forma de uso más común, motivado en parte, por los bajos costos de inversión en equipamiento, menor demanda energética, mayores productividades volumétricas y facilidad en la recuperación de esporas. Normalmente, los hongos son inoculados directamente sobre el medio sólido y el crecimiento se da continuamente sobre el mismo sustrato. Después del crecimiento y esporulación del hongo, los conidios se separan del medio de cultivo o el residuo del medio sólido puede ser utilizado conjuntamente con el hongo para la preparación de las formulaciones (Alves y Pereira, 1998). Asimismo, la utilización de subproductos agrícolas con altos contenidos celulósicos plantea la posibilidad de reemplazar los sustratos utilizados comúnmente como el arroz y el trigo, los cuales actualmente tienen un alto costo (Agamez Ramos et al., 2008).
Existen múltiples antecedentes que ponen énfasis en la multiplicación de Trichoderma spp. en sustratos de bajo costo que se originan en grandes cantidades como desechos de la producción agrícola o como subproductos de la industria. Los productos empleados como sustratos varían enormemente de acuerdo a las industrias o explotaciones agrícolas cercanas a cada lugar donde se desee multiplicar los ACB. En el departamento de Córdoba, Colombia, se evaluaron semillas de Artocarpus incisa (fruta de pan) y desechos agroindustriales como cascarilla de arroz y algodón como medios sólidos para la producción de esporas de Trichoderma spp. (Agamez Ramos et al., 2008). En Guerrero, México, se evaluaron 15 desechos agrícolas y observaron que el marlo del choclo fue el mejor sustrato, tanto en la producción como en la germinación de esporas de T. harzianum (Michel Aceves et al., 2008). En Curitiba, Brasil, se emplearon bagazo, melaza y compuestos ricos en nitrógeno como urea en la producción de esporas de T. harzianum (Rodríguez León et al., 1999). En Mérida, Venezuela se utilizaron como sustrato melaza de trapiche de caña de azúcar y levadura panadera granulada (Saccharomyces cerevisiaea) para la producción de biomasa de Trichoderma en fermentación líquida (García et al., 2006). En la provincia de Jujuy, Argentina, se evaluó la producción artesanal de conidios de una cepa local de Trichoderma sobre cinco sustratos (arroz, quinua, amaranto, trigo y avena) con resultados favorables (Sivila et al., 2017).
En la provincia de Tucumán, Argentina, se producen grandes cantidades de subproductos de la industria azucarera. Actualmente en la provincia existen en funcionamiento un total de 15 ingenios, los cuales generan grandes volúmenes de bagazo, como resultante del proceso de molienda de la caña de azúcar, y melaza, originada como el residuo que permanece en las cubas después de la extracción de la mayor parte del azúcar por cristalización y centrifugación. Estos subproductos podrían ser utilizados como soporte y fuente de nutrientes en la producción de esporas del hongo Trichoderma spp. empleando procesos de fermentación sólida artesanal.
El objetivo del presente trabajo fue el estudio de la producción artesanal de esporas de Trichoderma en diferentes sustratos, incluyendo subproductos de la industria azucarera, mediante fermentación sólida y la evaluación del crecimiento de las cepas nativas de Trichoderma TPT03, TPT02, MRT35 y MRT40 en arroz. Se discute la utilidad de los distintos sustratos evaluados para su multiplicación y posterior aplicación en parcelas experimentales de poroto para el control de S. sclerotiorum.
Materiales y métodos
Material biológico
En los ensayos de fermentación en medio sólido llevados a cabo en el presente trabajo, se emplearon las cepas TPT03 (T. afroharzianum) y TPT02, MRT40 y MRT35 (T. atroviride), previamente aisladas del suelo de zonas agrícolas de la provincia de Tucumán.
Preparación del inóculo
Las cepas de Trichoderma a evaluar fueron sembradas en cajas de Petri de 9 cm de diámetro con medio de cultivo APG al 2 % acidificado con ácido láctico (pH = 4 a 5) e incubadas durante 7 días a 25 ± 2 °C hasta que las colonias estuvieron totalmente esporuladas. Se rasparon las cajas con un ansa y se agregó 10 ml de agua destilada estéril para remover los conidios. Luego se realizaron diluciones hasta obtener una suspensión de 1 x 107 conidios/ml.
Preparación de los sustratos sólidos
Los sustratos sólidos empleados para la producción de conidios de Trichoderma se realizaron con subproductos de la industria azucarera (bagazo y melaza de caña de azúcar) provenientes del Ingenio La Florida situado en la provincia de Tucumán y con granos de trigo y arroz comercializados para el consumo humano. Los sustratos evaluados fueron: bagazo humedecido con agua destilada estéril (BH), bagazo humedecido con solución de melaza al 1 % (BM1 %), bagazo humedecido con solución de melaza al 5 % (BM5 %), bagazo humedecido con solución de melaza al 10 % (BM10 %), granos de arroz hervidos (GA) y granos de trigo hervidos (GT). Las fibras de bagazo fueron lavadas dos veces con agua corriente y cortadas en trozos de aproximadamente 1 cm de largo. Posteriormente el bagazo se sumergió en soluciones de agua destilada y melaza al 1 %, 5 % y 10 % (pH = 5,5 a 6,5) durante 2 h. Luego se eliminó el exceso de la solución de melaza, se colocó el sustrato en bolsas plásticas de alta densidad y se esterilizaron en autoclave a 121 °C y 1 atm durante 20 min. Los granos de arroz y de trigo fueron lavados dos veces con agua corriente y hervidos durante 5 min con el objeto de hidratarlos y ablandarlos para facilitar la colonización de las cepas nativas, posteriormente fueron colados, embolsados y esterilizados en autoclave a 121 °C y 1 atm durante 20 min.
Producción de conidios de la cepa TPT02 en diferentes sustratos sólidos
Con 5 ml de la suspensión de la cepa TPT02 (T. atroviride), la cual fue seleccionada por presentar elevada capacidad como ACB frente a S. sclerotiorum en anteriores ensayos, se inocularon los sustratos previamente esterilizados, en frascos de 250 ml. Los frascos fueron incubados en cámara de cría a 25 ± 2°C durante 10 días con luz continua para favorecer la esporulación (Chávez García et al., 2009). Durante la incubación se tomaron muestras de cada uno de los sustratos, iniciándose el muestreo a partir del cuarto día y posteriormente cada dos días durante toda la incubación, realizándose un total de cuatro muestreos.
Para determinar la concentración de conidios se pesó en balanza analítica 5 g de la muestra de cada sustrato esporulado, se suspendió en 100 ml de agua destilada estéril con una gota de Tween 80 al 0,01 % y se agitó vigorosamente hasta que los conidios se desprendieron de los sustratos. La suspensión posteriormente fue filtrada con cuatro capas de gasa estéril para separar los restos de sustrato suspendidos en el agua y se determinó el número de conidios por gramo de sustrato haciendo recuentos en cámara de Neubauer.
Con los resultados obtenidos se representó gráficamente la dinámica de producción de conidios de la cepa TPT02 en los diferentes sustratos sólidos evaluados a fin de determinar el tiempo óptimo de incubación para la obtención de la mayor concentración de conidios por gramo de sustrato. Posteriormente se realizó un análisis de la varianza y una prueba de DGC (α = 0,05), empleando el paquete InfoStat (Di Rienzo et al., 2013), para determinar las diferencias en las concentraciones de conidios por gramo en cada sustrato evaluado, al décimo día de incubación. Los datos cumplieron con los supuestos de normalidad y homogeneidad de varianza lo que permitió llevar a cabo el análisis mencionado anteriormente.
Crecimiento de las cepas nativas TPT03, TPT02, MRT35 y MRT40 en arroz
Con 5 ml de las suspensiones de las cepas TPT03, TPT02, MRT35 y MRT40 se inocularon bolsas de 200 g, 300 g y 400 g de arroz, previamente hervido e hidratado durante 5 min y esterilizado en autoclave a 121 °C y 1 atm durante 20 min. Las bolsas fueron incubadas durante 13 días a 25 ± 2°C con luz continua para favorecer la esporulación de Trichoderma (Chávez García et al., 2009). Las mismas fueron agitadas periódicamente para evitar las aglomeraciones del sustrato.
Para determinar la producción de conidios en arroz se tomaron muestras cada tres días durante los trece días de incubación. De cada muestra se tomaron 5 g de sustrato esporulado, se suspendió en 100 ml de agua destilada estéril con una gota de Tween 80 al 0,01 % y se agitó vigorosamente hasta que los conidios se desprendieron de los granos de arroz. La suspensión se filtró con cuatro capas de gasa estéril para separar los restos de arroz y se determinó el número de conidios por gramo de sustrato haciendo recuentos en cámara de Neubauer.
Para determinar la presencia de microorganismos saprófitos contaminantes que pudieran estar presentes junto a las cepas de Trichoderma, se tomaron muestras de arroz esporulado y seco de cada una de las cepas nativas y se sembraron cuatro granos de arroz por caja de Petri con medio de cultivo APG al 2 % acidificado con ácido láctico (pH = 4 a 5). Las cajas se sellaron y se incubaron en cámara de cría a 25 ± 2°C y fotoperiodo de 12 h durante 10 días. Luego de ese tiempo se observaron a simple vista y bajo lupa las características de las colonias de Trichodema que desarrollaron a partir del arroz.
Las concentraciones de conidios por gramo de sustrato obtenido en cada tratamiento fueron sometidos a un análisis de la varianza de dos factores y a una prueba de DGC (α = 0,05), empleando el paquete InfoStat (Di Rienzo et al., 2013), para determinar las diferencias en la producción de conidios entre las cepas y entre las cantidades de sustrato por bolsa evaluada. Los datos cumplieron con los supuestos de normalidad y homogeneidad de varianza lo que permitió llevar a cabo el análisis mencionado.
Resultados
Producción de conidios de Trichoderma en dife-rentes sustratos sólidos
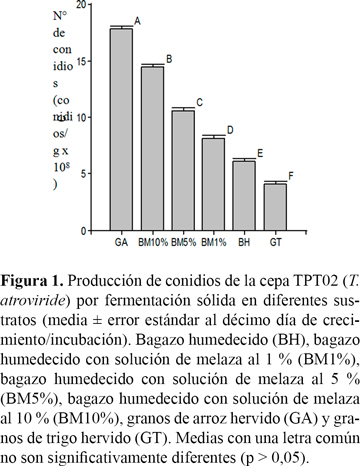
La cepa TPT02 (T. atroviride) creció y esporuló en todos los sustratos evaluados. El número de conidios por gramo de sustrato aumentó en todos los casos con el correr del tiempo de incubación. No hubo inhibición en el crecimiento de la cepa en ninguno de los sustratos y se observaron diferencias significativas en la producción de conidios (F = 425,12; g.l. = 5; p < 0,0001). El sustrato que mostró una mayor concentración de conidios por gramo fue el de arroz hervido, alcanzando valores promedios de 17,8 x 108 conidios/g de sustrato al décimo día de incubación. El bagazo humedecido con la solución de melaza al 10 % mostró una media de 14,4 x 108 conidios/g, lo cual fue significativamente superior a los sustratos de bagazo humedecidos con soluciones de concentraciones menores de melaza. El bagazo húmedo con agua destilada presentó la más baja producción de conidios, entre los sustratos que tuvieron bagazo (Figura 1).
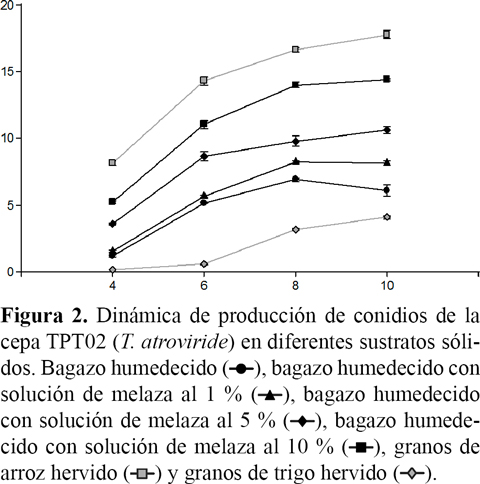
La máxima concentración de conidios por gramo de sustrato se alcanzó al décimo día de incubación en la mayoría de los tratamientos, mientras que en el bagazo húmedo se observó al octavo día. El sustrato a base de granos de trigo hervido produjo la menor concentración de conidios por gramo al décimo día (Figura 2).
El análisis visual de la dinámica de producción de conidios, mostró que para todos los sustratos evaluados la máxima velocidad de producción se obtuvo entre el cuarto y el sexto día. Con el correr del tiempo de incubación, las tasas de producción fueron decreciendo en todos los casos. Este descenso fue más pronunciado en los sustratos de bagazo sin melaza o con 1 % de melaza agregada. Los sustratos de granos de arroz hervido y de bagazo con melaza al 10 % mostraron una mayor velocidad en la producción de conidios durante la incubación (Figura 2).
Crecimiento en arroz de las cepas antagonistas TPT03, TPT02, MRT35 y MRT40
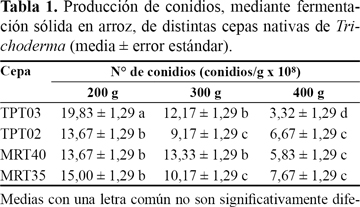
El crecimiento y la esporulación de los antagonistas presentaron diferencias con respecto a la cepa evaluada y a la cantidad de sustrato por bolsa (F = 1,21; g.l. = 3; p = 0,3271 para cepa; F = 55,87; g.l. = 2; p < 0,0001 para cantidad de arroz en la bolsa y F = 4,14; g.l. = 6; p = 0,0054 para la interacción entre ambos factores) (Tabla 1). El crecimiento del hongo sobre los granos de arroz se evidenció a simple vista a partir del tercer día de incubación, distinguiéndose micelio tenue e incipiente esporulación. Al décimo día de incubación se alcanzó la mayor concentración de conidios por gramo de sustrato en todas las cepas y en todas las cantidades de sustrato evaluadas (Figura 3).
La cantidad de sustrato en las bolsas influyó en la producción de conidios de todas las cepas evaluadas. A mayor cantidad de sustrato se observó una menor esporulación. La cepa TPT03 (T. afroharzianum) mostró la mayor producción de conidios entre todas las cepas en bolsas con 200 g, pero fue la cepa que menos conidios produjo en bolsas con 400 g de sustrato. Las cepas de la especie T. atroviride se comportaron de manera similar entre ellas, en las bolsas de 200 g y 400 g de sustrato, diferenciándose en bolsas de 300 g donde la cepa MRT40 fue la que más conidios produjo (Tabla 1).
El crecimiento de las cepas a partir de los granos de arroz esporulados sembrados en placa de Petri con medio APG al 2 % fue en forma concéntrica alrededor de los granos, la velocidad de crecimiento y la esporulación fue normal en todas las cepas. Se observó micelio hialino al inicio del crecimiento, el cual posteriormente se tornó verde al esporular. En las placas no se observaron hongos ni bacterias saprófitas.
Al observar la dinámica de producción de conidios de las cepas evaluadas en bolsas de 200 g en arroz hervido, se comprobó que la cepa TPT03 (T. afroharzianum) se diferenció de las cepas de T. atroviride por su mayor velocidad de crecimiento y mayor producción de conidios al décimo día de incubación (Figura 3).
Discusión
La cepa TPT02 (T. atroviride) creció y esporuló en todos los sustratos evaluados, observándose diferencias significativas en la producción de conidios en cada uno de ellos. El número de conidios por gramo en el sustrato de granos de arroz fue mayor a los demás sustratos en concordancia con los resultados observados por Fernández Larrea (2001) y Romero et al., (2007). El grano de arroz posee aproximadamente 62 % de almidón (Pomeranz y Ory, 1982), lo que lo convierte en una fuente de carbono de alta calidad para el crecimiento del hongo. Por sus características nutricionales el arroz es ampliamente empleado en Cuba y en Colombia para la multiplicación de Trichoderma en procesos de fermentación artesanal e industrial y en la fabricación de algunos productos comerciales (Castro y Rivillas, 2003; Fernández Larrea, 2004). Además de su efectivo uso en el formulado de cepas de Trichoderma, también es empleado para mejorar el porcentaje de viabilidad de las esporas en el periodo de almacenamiento (Gato et al., 2009).
La concentración de melaza fue un factor de importancia en la mayor o menor producción de conidios en los sustratos que tuvieron bagazo. Las mayores concentraciones de conidios estuvieron relacionadas con mayores concentraciones de melaza. Nutricionalmente la melaza presenta un alto contenido en azúcares e hidratos de carbono simples, además de vitaminas del grupo B y abundantes minerales, entre los que se destacan el hierro, el cobre y el magnesio, elementos esenciales para los requerimientos nutricionales de estos hongos como lo plantea Moore (1996). Asimismo, Trichoderma utiliza como fuente de nitrógeno compuestos tales como aminoácidos, nitritos y sulfatos (Moore 1996), los cuales también se encuentran presentes como componentes de la melaza. Los resultados en la producción de conidios en sustratos con bagazo y melaza fueron similares a los observados por Agamez Ramos et al. (2008) con cascarilla de algodón enriquecida con soluciones de melaza en concentraciones semejantes, lo que pone de manifiesto el valor de la melaza como fuente de nutrientes para complementar sustratos pobres para la multiplicación de cepas de Trichoderma.
El sustrato de bagazo sin melaza fue el que menos concentración de conidios presentó, lo que estaría asociado a la escasa disponibilidad de glucosa, fructosa, manosa, galactosa, xilosa y celobiosa, consideradas las mejores fuentes de carbono para los hongos del género Trichoderma (Danielson y Davey, 1973). En otros estudios, Tewari y Bhanu (2003) tuvieron buenos resultados en la producción de conidios de T. harzianum en bagazo de caña de azúcar comparado con otros sustratos celulósicos como residuos de papel, aserrín y cáscara de mazorca de maíz. Además, aunque Trichoderma es citado por su habilidad para degradar polisacáridos (celulosa, hemicelulosa) por las enzimas que produce, Danielson y Daver (1973) observaron que existe una considerable variación en la habilidad de los distintos aislamientos de Trichoderma spp. provenientes del suelo para degradar diferentes materiales vegetales. En cultivo puro muchos aislamientos de Trichoderma fueron relativamente ineficientes en la degradación de hojas de pino taeda, madera de haya y abedul mostrando una pobre habilidad para degradar madera (Butcher, 1968). A pesar de la baja producción de conidios obtenida en bagazo húmedo, este sustrato podría seguir siendo una alternativa aceptable debidos a su bajo costo y alta disponibilidad en la provincia.
En general el tiempo óptimo de incubación para la obtención de la máxima producción de conidios por gramo de sustrato, la cual fue superior a 1 x 109 conidios/g en los sustratos de granos de arroz y bagazo enriquecido con soluciones de melaza al 10 % y al 5 %, fue de diez días. Estos resultados coinciden con lo reportado por Sivila et al. (2017) quienes empleando sustratos a base de granos de quinua y granos de arroz obtuvieron concentraciones de conidios similares en el mismo periodo de tiempo, lo que demostraría que si el sustrato le provee al hongo los nutrientes necesarios, este continuará creciendo y esporulando hasta el décimo día de incubación. En el caso del bagazo húmedo, la producción alcanzó un máximo de 5 x 108 conidios/g aproximadamente al octavo día de incubación y posteriormente la producción de conidios se redujo, lo que podría estar asociado a la falta de nutrientes disponibles para el crecimiento del hongo y a la presencia de una gran cantidad de carbohidratos de tipo estructural de difícil degradación en este sustrato.
La cantidad de sustrato por bolsa en la fermentación sólida influyó significativamente en la mayor o menor esporulación de las cepas en arroz. Esto puede deberse al hecho que una menor cantidad de sustrato pudo haber facilitado la circulación del aire entre los granos cuando se realizaron las agitaciones manuales de las bolsas para disgregar el sustrato y facilitar la colonización de los Trichoderma. El dióxido de carbono resultante de la oxidación de las fuentes de carbono, puede acumularse en los medios sólidos dependiendo del pH y la temperatura, inhibiendo el crecimiento de muchas especies de Trichoderma (Danielson y Davey, 1973). Otros autores observaron en Trichoderma reesei que los niveles subóptimos de oxígeno podrían favorecer la síntesis de celulasas (Abrahao Neto et al., 1995), mientras que Agamez Ramos et al. (2008) describieron que la aireación aplicada a un proceso semi-industrial de producción de conidios no tuvo incidencia relevante para mejorar la esporulación con respecto al proceso artesanal.
Conclusiones
Las concentraciones de conidios obtenida en el presente trabajo confirman que la producción de tipo artesanal por fermentación en sustrato sólido es una alternativa factible, rápida y de bajo costo para la obtención de inóculo de alta calidad de las cepas de Trichoderma nativas seleccionadas.
El sustrato a base de granos de arroz fue el más eficiente en la producción de conidios mientras que los sustratos a base de bagazo enriquecidos con melaza o de bagazo húmedo demostraron ser una alternativa de importancia ya que fueron eficientes en la producción de conidios y además en la provincia se encuentran disponibles en grandes cantidades y a un bajo costo, lo que permitiría una producción de conidios a mayor escala para el control de S. sclerotiorum en campo.
Las cepas nativas TPT03, TPT02, MRT35 y MRT40 fueron capaces de crecer y esporular sobre el sustrato a base de arroz sin presentar inhibición ni contaminaciones por hongos o bacterias saprófitas. Además se determinó que la cantidad de sustrato por bolsa es determinante al momento optimizar la producción de conidios de las mismas.
El tiempo óptimo de incubación para este tipo de producción de conidios sobre sustratos ricos en nutrientes es de diez días ya que al cabo de dicho periodo se obtuvo la mayor concentración de conidios por gramo de sustrato, la cual decreció posteriormente.
Agradecimientos
Agradecemos al Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), a la Secretaría de Ciencia, Arte e Innovación Tecnológica de la UNT (SCAIT) y a la Cátedra de Fitopatología de la Facultad de Agronomía y Zootecnia de la UNT.
Referencias bibliográficas
1. Abrahao N.J., Rossini C.H., Elgogary S., Henrique Silva F., Chivelaro O., El Dorry H. (1995). Mitochondrial functions mediate cellulase gene expression Trichoderma reesei. Biochemistry 34: 10456-10462. [ Links ]
2. Agamez Ramos E.Y., Zapata Navarro R.I., Oviedo Zumaqué L.E., Barrera Violeth J.L. (2008). Evaluating solid fermentation processes and substrates for producing Trichoderma sp. spores. Revista Colombiana de Biotecnología 10: 23-34. [ Links ]
3. Alves S.B., Pereira R.M. (1998). Producâo de fungos entomopatogênicos. En: Controle Microbiano de Insectos, Alves, S.B. (Ed.). Fundación de Estudios Agrarios Luiz de Queiroz-FEALQ. Brasil. Pp. 845-867. [ Links ]
4. Boland G.J., Hall R. (1994). Index of plant hosts of Sclerotinia sclerotiorum. Canadian Journal of Plant Pathology 16: 93-108. [ Links ]
5. Bueno C.J., Michelle de Queiroz Ambrosio M., Souza N.L. (2007). Production and evaluation of survival of resistance structures of soilborne phytopathogenic. Summa Phytopathologica 33 (1): 47-55. [ Links ]
6. Butcher J.A. (1968). The ecology of fungi infecting untrated sapwood of Pinus radiata. Canadian Journal Botechnology 46: 1557-1589. [ Links ]
7. Castro A., Rivillas C. (2003). Manejo sostenible de la llaga macana en cafetales renovados por zoca. Avances Técnicos Cenicafé 312: 2-7. [ Links ]
8. Chávez García M., Montaña Lara J.S., Martínez Salgado M.M., Mercado Reyes M., Rodríguez M.X., Quevedo Hidalgo B. (2009). Efecto del sustrato y la exposición a la luz en la producción de una cepa de Trichoderma sp. Universitas Scientiarum 13 (3): 245-251. [ Links ]
9. Danielson R.M., Davey C.B. (1973). Carbon and nitrogen nutrition in Trichoderma. Soil Biology and Biochemistry 5: 506- 515. [ Links ]
10. Di Rienzo J.A., Casanoves F., Balzarini M.G., Gonzalez L., Tablada M., Robledo C.W. InfoStat versión 2013. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. En: http://www.infostat.com.ar [ Links ]
11. Elad I., Zimand G., Zaqs I., Zuriel S., Chet I. (1993). Use of Trichoderma harzianum in combination or alternation with fungicides to control cucumber grey mould (Botrytis cinerea) under commercial greenhouse conditions. Plant Pathology 42: 324-332. [ Links ]
12. Fernández Larrea V.O. (2001). Microorganismos antagonistas para el control fitosanitario. Revista Manejo Integrado de Plagas Costa Rica 62: 96-100. [ Links ]
13. Fernández Larrea V.O. (2004). Tecnologías para la producción de biopesticidas a base de hongos entomopatógenos y su control de la calidad. Laboratorio de Hongos Entomopatógenos, Instituto de Investigaciones de Sanidad Vegetal (INISAV). Cuba. [ Links ]
14. García R., Durán M.A., Riera R. (2006). Producción de biomasa de Trichoderma harzianum por fermentación líquida. Fitosanidad 10 (4): 295-298. [ Links ]
15. Gato Cárdeno Y. (2010). Métodos de conservación y formulación de Trichoderma harzianum rifai. Fitosanidad 14 (3): 189-195. [ Links ]
16. Haram S., Schickler H., Oppenheim A., Chet I. (1996). Differential expression of Trichoderma harzianum chitinases during mycoparasitism. Phytopathology 86: 980-985. [ Links ]
17. Huang H.C., Bremer E., Hynes R.K., Erikson R.S. (2000). Foliar aplicatión of fungal biocontrol agents for the control of White mold of dry vean caused by Sclerotinia sclerotiorum. Biological Control 12: 182-190. [ Links ]
18. Inbar J., Menendez A., Chet I. (1996). Hyphal interaction between Trichoderma harzianum and Sclerotinia sclerotiorum and its role in biological control. Soil Biology and Biochemistry 28 (6): 757-763. [ Links ]
19. Johnson D.A., Atallah Z.K. (2006). Timing fungicide applications for managing Sclerotinia stem rot of potato. Plant Disease 90: 755-758. [ Links ]
20. Michel Aceves A.C., Otero Sánchez M.A., Martínez Rojero R.D., Rodríguez Morán N.L., Ariza Flores R., Barrios Ayala A. (2008). Producción masiva de Trichoderma harzianum rifai en diferentes sustratos orgánicos. Revista Chapingo Serie Horticultura 14 (2): 185-191. [ Links ]
21. Martínez S., Mónaco C., Etchevers P. (2007). Efecto de Trichoderma harzianum (SM2007) sobre el rendimiento y sanidad en hortalizas de hoja bajo invernadero en el cinturón hortícola de La Plata. 30° Congreso Argentino de Horticultura. 28 de septiembre. La Plata, Argentina. [ Links ]
22. Mitidieri M., Brambilla V., Gabilondo J., Saliva V., Piris M. (2005). Efectos de la solarización y biofumigación sobre la incidencia de podredumbres radiculares en cultivo de tomate bajo cubierta. XIII Congreso Latinoamericano de Fitopatología. 19 al 22 de abril. Villa Carlos Paz, Argentina. [ Links ]
23. Mondino P., Vero S. (2006). Control biológico de patógenos de plantas. Facultad de Agronomía-Unidad de Educación Permanente, Uruguay. [ Links ]
24. Moore E. (1996). Fundamentals of the Fungi. Prentice Hall, EE.UU. [ Links ]
25. Papavizas G.C. (1985). Trichoderma and Gliocladium biology, ecology and potential for biocontrol. Annual Review of Phytopathology 23: 23-54. [ Links ]
26. Pomeranz Y., Ory R.L. (1982). Rice. En: Handbook of Processing and Utilizatión in Agriculture. Wolff I.A. (Ed.). Boca Raton, EE.UU. Pp. 139-155. [ Links ]
27. Rodríguez-León J.A., Domenech F., León M., Méndez T., Rodríguez T.E., Pandey A. (1999). Production of spores of Trichoderma harzianum on sugar cane molasses and bagasse pith in solid state fermentation for biocontrol. Brazilian Archives of Biology and Technology 42 (1) DOI: 10.1590/S1516-89131999000100010. [ Links ]
28. Romero J.I., Maza N., Jaldo A.M., Luján E., Minervini M., Cuezzo H., Duerte D., Varela L., Yasem M., Villagra E.L. (2002). Aislamiento y multiplicación masiva de aislamientos nativos de Trichoderma, probable estimulador del crecimiento en hortalizas - resultados preliminares. 30° Congreso Argentino de Horticultura. 25 al 28 de septiembre. Buenos Aires, Argentina. [ Links ]
29. Sivila N.F., Álvarez S.E., Bonillo M.C. (2017). Producción artesanal de Trichoderma spp. sobre diferentes sustratos y empleo de dos tipos de contenedores. 4° Congreso Argentino de Fitopatología. 19 al 21 de abril, Mendoza, Argentina. [ Links ]
30. Tewari L., Bhanu C. (2003). Screening of various substrates for sporulation and mass multiplication of bio-control agent Trichoderma harzianum through solid state fermentation. Indian Phytopathology 56 (4): 476-478. [ Links ]
31. Zimand G., Elad Y., Chet I. (1996). Effect of Trichoderma harzianum on Botrytis cinerea phatogenicity. Phytopathology 86: 125-126. [ Links ]