Introducción
La frutilla moderna (Fragaria x ananassa Duch.) es un híbrido octoploide, producto de la cruza entre F. virginiana D. proveniente de sotobosques y F. chiloensis L. originaria de playas y ambientes luminosos de Chile. Especies progenitoras de ambientes tan disímiles le confieren alta variabilidad y capacidad de adaptación (Larson, 1994). Es un cultivo hortícola, incorporado al grupo de frutas finas y de importancia mundial. Las frutas finas, constituyen uno de los grupos de productos más dinámicos del comercio alimentario de la última década y de importancia en las regiones templadas de producción (Von Bernard y Obschatko, 2003). Según estadísticas de la FAO (Food and Agriculture Organization of the United Nations), el 80 % de la producción mundial se concentra en China, Estados Unidos, México, Egipto, Turquía, España, Corea y Polonia y el 20 % restante, se distribuye en más de 60 países, entre los cuales, se encuentra Argentina, ocupando el 34vo lugar como productor y 17vo como exportador mundial de frutilla (FAO, 2015). Argentina es el tercer productor de Sudamérica, con aproximadamente 1.300 hectáreas y una producción de 45.500 t. Las provincias con mayores superficies y producción de frutilla son Buenos Aires, Tucumán, Santa Fe, Jujuy y Corrientes. Las tres primeras, representan alrededor del 70 % de la producción nacional. Cerca del 60 % de la fruta se consume fresca y el 40 % se procesa (Ministerio de Agricultura, Ganadería y Pesca de la República Argentina, 2018). Esta distribución posibilita que el consumidor se abastezca de frutos frescos prácticamente todo el año. La mayor producción se realiza en época invernal, con cosechas periódicas de junio a noviembre (Kirschbaum y Mamana, 2008). Las preferencias del consumidor y los rendimientos en frutos, generan que los cultivares de días cortos e indiferentes al fotoperíodo, sean los más usados en el país (Rodríguez et al., 2009; Undurraga y Vargas, 2013; Kirschbaum et al., 2017). En el mercado global las exigencias de los consumidores en cuanto a calidad del producto, se incrementaron por el aumento de la información, nuevas variedades y ofertas variadas (Ministerio de Agricultura, Ganadería y Pesca de la República Argentina, 2018). En el año 2018, Tucumán tuvo muy buen desempeño productivo y comercial, así, el volumen de frutilla congelada provincial, representó el 85 % de la fruta exportada a nivel nacional. En tanto, ocupó el segundo lugar, en el volumen total de fruta ingresada al Mercado Central de Buenos Aires (MCBA) (Boletín de Frutas y Hortalizas y Corporación de Mercado Central de Buenos Aires, 2019; Rodríguez et al., 2020). En la provincia se implantaron 340 hectáreas de frutilla que produjeron 10000 t de fruta. El polo frutillero por excelencia se ubica en Lules, seguido por los departamentos de Famaillá, Monteros, Chicligasta y Tafí del Valle, siendo esta última, la zona de producción estival, en contra estación (Kirschbaum, 2020). El cultivo de frutilla reviste importancia en Tucumán, por su valor económico-social, desde el punto de vista de generación de ingresos y por el carácter intensivo en el uso de mano de obra para la producción de frutos, con destino a mercados de consumo en fresco y/o procesados. Al ser una provincia exportadora de frutilla, debe usar adecuadamente los agroquímicos, a fin de mantener la calidad del producto. El uso inadecuado no sólo puede afectar la salud humana, sino también el futuro provincial como proveedora de fruta fresca y congelada, tanto para el mercado nacional, como para exportación.
La agricultura actual, evidencia la tendencia mundial y la necesidad de disminuir la contaminación ambiental causada por agroquímicos; estos insumos pueden incrementar los costos de producción, con el consiguiente encarecimiento y a veces, menor disponibilidad de alimentos y pérdidas en los ingresos de los productores (Tan et al., 2005; Adesemoye et al., 2009; Camelo et al., 2011; Choudhary et al., 2011; Palencia et al., 2013; FAO, 2015; Vejan et al., 2016; Olanrewaju et al., 2017). El cultivo convencional de frutilla es dependiente de insumos externos, fundamentalmente agro insumos de síntesis (pesticidas, herbicidas y fertilizantes). De esta manera, el desbalance en los fertilizantes sintéticos empleados, puede generar un impacto ambiental negativo por contaminación de suelos, agua, ambiente y calidad agroalimentaria de los frutos (Armada et al., 2014; Lovaisa et al.; 2016; Vejan et al., 2016; Kirschbaum et al., 2019). Es por ello, que se planteó la necesidad de incorporar modificaciones en cuanto a manejo agronómico e insumos, a fin de lograr un sistema productivo sustentable en los aspectos ambientales, económicos, sociales y que, a la vez, sea sostenible en el tiempo. Argentina muestra una tendencia creciente a reducir el uso de agroquímicos e incorporar bioinsumos en la producción de alimentos tales como, cereales y legumbres, entre otros cultivos (Díaz-Zorita et al., 2015). En este marco, la FAO promovió la construcción de una visión común entre los países, para la producción de alimentos a partir de una agricultura sostenible y planteó el uso de microorganismos para el reciclaje de nutrientes (FAO, 2015). Por lo que, una alternativa para la disminución del uso de los fertilizantes de síntesis, lo constituye la utilización de bacterias promotoras del crecimiento vegetal o PGPB (por su sigla en inglés Plant Growth Promoting Bacteria), como Azospirillum, entre otros géneros bacterianos, que colonizan la zona radicular (rizósfera) y/u otros tejidos de la planta huésped y poseen capacidad para estimular o promover su crecimiento (Bashan, 1998; Bashan y de‐Bashan 2010; Bashan et al., 2014). Los mecanismos y efectos de estas bacterias en el crecimiento de las plantas y en la productividad son directos, por ejemplo: fijación biológica de nitrógeno, solubilización de fósforo, aumento en la disponibilidad de nutrientes (Dobbelaere et al., 2003; Tortora et al., 2011; Salazar et al., 2012; Glick, 2012; Guerrero-Molina et al., 2013; Olanrewaju et al., 2017; Pedraza et al., 2020) o indirectos, por ejemplo: biocontrol de patógenos o competición (Bashan y Holguin, 1998; Tortora et al., 2011; Pedraza et al., 2020). Su distribución es generalizada en el medio ambiente, tanto en las regiones tropicales, subtropicales, como templadas y coloniza más de 100 especies vegetales (Pedraza et al., 2020). Esto genera que estas bacterias sean capaces de mejorar el rendimiento de cultivos de importancia agronómica y constituyan una alternativa que posibilite la utilización de un proceso amigable con el ambiente y la eliminación y/o disminución de severos problemas de contaminación. Numerosos estudios realizados en condiciones controladas de laboratorio, en invernadero y en campo, demostraron que Azospirillum puede promover el crecimiento de las plantas y mejorar el rendimiento de los cultivos, incluida la asociación con frutilla (Bellone et al., 1995; Kirschbaum, 1999; Pedraza et al., 2010; Calvo et al., 2014; Lovaisa et al., 2016; Pedraza et al., 2020). En la provincia de Tucumán, A. brasilense fue aislado de distintos tejidos de plantas de frutilla (Pedraza et al., 2007) y de plantas ornamentales como Petunia sp. (Toffoli et al., 2021). En el trabajo con frutilla, se demostró la ocurrencia y colonización natural de diferentes partes de las plantas por A. brasilense en el área de cultivo provincial. Los aislamientos se llevaron a cabo en el cultivar ‘Camarosa’, del cual se aislaron diferentes cepas bacterianas, de la superficie de las raíces (RLC), de tejidos radiculares internos (REC), así como de pecíolos y estolones del cultivar (PEC). Luego de la caracterización microbiológica y molecular (ARDRA) se determinó que los aislamientos pertenecían a la especie A. brasilense. Las cepas locales mostraron tres características importantes dentro del grupo PGPB: fijación de nitrógeno, producción de sideróforos e indoles (Pedraza et al., 2007). En el caso de la planta ornamental, para evaluar la presencia natural de A. brasilense en plantas de petunia y la capacidad para mejorar el crecimiento y floración, se aislaron cepas locales y se caracterizaron por métodos bioquímicos y moleculares. Se evaluaron tres cepas en condiciones de invernadero 2A1, 2A2 y 2E1, las cuales fueron inoculadas independientemente, por inmersión radicular en una suspensión bacteriana (~106UFC·ml−1). Se trabajó con plantas testigo y con plantas con fertilización química. Como resultado, cinco aislados fueron caracterizados como A. brasilense, mostrando capacidad para producir indoles y sideróforos, solubilizar fosfato, actividad nitrogenasa y la amplificación de nifH-PCR. En general, todos los parámetros del cultivo fueron mejorados en las plantas inoculadas, con variaciones entre las cepas, en comparación con las plantas no inoculadas o fertilizadas (Toffoli et al., 2021). Por otro lado, se destaca que fue secuenciado el genoma completo de la cepa denominada REC3 de A. brasilense, utilizando la plataforma Illumina HiSeq (Fontana et al., 2018). Entre otras experiencias con A. brasilense, en un estudio realizado en México, se evaluó el efecto de la fertilización química y de la bacteria, sobre los parámetros crecimiento, desarrollo, rendimiento y calidad de frutos de frutilla. Se emplearon los tratamientos: A. brasilense a una concentración de log 109 unidades formadoras de colonias (UFC)/planta; A. brasilense (109 UFC/planta) + fertilización química; fertilización química y un testigo o control. La concentración de A. brasilense empleada, no tuvo efectos o inhibió el crecimiento y rendimiento de la frutilla, hubo baja producción de biomasa, reducción de tamaño y del peso de frutos. Se observó que la bacteria fue superada por la fertilización química, e incluso hubo valores inferiores al testigo. Por lo cual, los autores sugirieron emplear una concentración inferior en futuras investigaciones, sin precisar cuál (Castañeda-Saucedo et al., 2013). Sin embargo, otras investigaciones demostraron que la incorporación de biofertilizantes o bioinsumos, puede mejorar los rendimientos del cultivo de frutilla (Pešaković et al., 2013). Así, en ensayos realizados en Tucumán, se encontró que la inoculación con bacterias promotoras del crecimiento en frutilla, cultivar ‘Camarosa’, produjo aumentos en los volúmenes de rendimientos de frutos totales y frutos comerciales, aunque no significativos desde un punto de vista estadístico. En este ensayo, se trabajó con cepas aisladas de raíces de frutilla (RLC1-rizosférica y REC3-endofítica) y de estolón (PEC5), las cuales fueron inoculadas independientemente, por inmersión radicular. Los rendimientos (g/planta) fueron con la cepa RLC1: 560; con REC3: 501; con PEC5: 564 y con el Testigo: 489 (Salazar et al., 2011). En otro estudio, se demostró que las plantas tratadas con A. brasilense (cepas RLC1 y REC3, de manera independiente) incrementaron el rendimiento total de fruta en el primer año, aunque las plantas no exhibieron un crecimiento vegetativo excesivo (Salazar et al., 2012). Kirschbaum y colaboradores (2019), establecieron que los bioestimulantes podrían reducir el uso de fertilizantes químicos en frutilla, contribuyendo a la sostenibilidad del agro-ecosistema, aunque destacó la necesidad de nuevos estudios para validar estas observaciones, en condiciones de campo. Por lo expuesto, resulta evidente la abundante información sobre el cultivo, las PGPB y diferentes cepas de A. brasilense aisladas y caracterizadas a nivel local y empleadas en trabajos ya sea, bajo condiciones controladas o no y, sobre todo, junto con insumos de síntesis para la producción de frutos. En este estudio en particular, no se emplearon insumos de síntesis química y surge a fin de evaluar el crecimiento vegetal y el desempeño productivo de frutilla cultivar ‘Camino Real’, inoculado con dos cepas nativas de A. brasilense, como alternativa para promover crecimiento vegetal, producción de frutos y una nutrición amigable con el medio ambiente.
Materiales y métodos
Ubicación
El ensayo se realizó en el predio de la Cátedra Horticultura de la Facultad de Agronomía y Zootecnia-UNT en Finca El Manantial; Departamento Lules, en la provincia de Tucumán, Argentina (26º55’ S, 65º20’ W y 426 m de altitud). Se ubica en la zona agroecológica de la Llanura Chaco Pampeana sub húmeda-húmeda, con evapotranspiración de 800-900 mm aproximadamente y con balance hídrico positivo. La temperatura media anual es de 18,9º C con suelo Argiudol típico y drenaje moderado a bueno. El suelo posee buen contenido de materia orgánica y fertilidad, con resistencia al planchado y buen drenaje (Zuccardi y Fadda, 1985). Constituye una de las principales áreas de producción de cultivos hortícolas y frutales menores, entre los cuales se encuentra la frutilla.
Material vegetal
Se trabajó con plantines frescos estándar -sin hojas y con raíz desnuda- provenientes de viveros comerciales del sur del país, de la variedad ‘Camino Real’ (cultivar de día corto, que precisa fotoperíodo inferior a 14 horas de luz para la inducción floral y fructificación y catalogado como “tardío” para la producción de fruta).
Inóculo
Para la etapa pre-plantación se utilizaron dos cepas de A. brasilense (Figura 1a): cepa 1: REC3 (cepa endofítica de frutilla) que fue aislada y caracterizada en la provincia (Pedraza et al., 2007) y cepa 2: denominada 2A1, aislada a partir de raíces en plantas de Petunia sp.; también aislada y caracterizada en Tucumán (Toffoli et al., 2021). El inóculo se preparó a partir de un cultivo puro de las cepas REC3 y 2A1 de A. brasilense, sembrando una unidad formadora de colonia (UFC) de cada cepa en medio de cultivo malato semisólido libre de N (NFb) (Baldani et al., 2014) e incubado 36-72 h a 30° C. Se ajustó la concentración final del inóculo a una DO560=0,2 que corresponde aproximadamente a 106 UFC·ml-1 (Toffoli et al., 2021).

Figura 1 Ensayo de inoculación de plantas de frutilla cv. ‘Camino Real’ con Azospirillum brasilense REC3 o A. brasilense 2A1. a: inoculantes líquidos de ambas cepas. b: inoculación por inmersión de raíces en una suspensión de 6 UFC.ml-1. c: implantación del ensayo (02/05/2018) y tratamientos aplicados; A, T1 (control sin inoculación); B, T2 (inoculado con REC3); C, inoculado con 2A1. d: planta a los 4 días de su implantación. e: plantas inoculadas con REC3 a los 14 días de implantación. f: planta inoculada con 2A1 a los 77 días de implantación. g: fructificación en plantas inoculadas con 2A1 (inicio de agosto).
Inoculación
Los plantines fueron inoculados sumergiendo las raíces en cada una de las suspensiones bacterianas de A. brasilense (106 UFC·ml-1) durante 30 minutos (Figura 1b). Luego, las raíces fueron escurridas durante 10 segundos e inmediatamente se efectuó la plantación en macetas. Para el tratamiento T1 (testigo o control) sin inoculación, las raíces de los plantines fueron sumergidas en agua destilada igual tiempo, escurridas y de inmediato se realizó la plantación.
Plantación
Previo a la implantación, se efectuó el análisis físico-químico del suelo que se utilizó en la preparación del sustrato. El muestreo de suelo consistió en dividir en cinco puntos el terreno (extremos y centro) y extraer muestras individuales hasta una profundidad de 0,30 m. Las determinaciones se realizaron en el Laboratorio de la Cátedra Edafología de FAZ-UNT. Los resultados se muestran en la Tabla 1. El ensayo se condujo en contenedores y al aire libre, en condiciones naturales. En la etapa previa y posterior a la plantación no se aplicaron agro-insumos de síntesis química (no se practicó desinfección de suelo, aplicación de fertilizantes ni biocidas). La plantación se realizó el 02 de mayo de 2018, en macetas de plástico soplado comerciales, número 12 (2 l). El sustrato para el llenado de los contenedores estuvo compuesto por una mezcla de suelo de El Manantial (Tabla 1), arena y perlita agrícola en una proporción de 2:0,5:0,5 respectivamente. Las macetas o contenedores se colocaron sobre tres mesones cubiertos con plástico negro, de 1 m de ancho por 1,5 m de largo cada uno. La frecuencia de riego fue de tres a cinco veces/semana, para mantener la humedad a capacidad de campo del sustrato; para ello, se aplicó una lámina casi constante de 0,02 m de altura por mesón donde se encontraban las macetas. Entre el 30 de mayo y el 04 de setiembre de 2018, el ensayo se cubrió́ con microtúneles de polietileno cristal de 100μ de espesor, para proteger al cultivo de posibles heladas.
Tabla 1 Análisis de suelo. Determinación cuali y cuantitativa de la muestra obtenida en El Manantial, Tucumán, Argentina (2018).
| Parámetro | Valor |
|---|---|
| pH | 6,6 |
| CE (dS/m) | 0,2 |
| MO (%) | 2,13 |
| N Total (%) | 0,1 |
| CIC (cmolc/kg) | 13,9 |
| Ca (cmolc/kg) | 6 |
| Mg (cmolc/kg) | 0,6 |
| K (cmolc/kg) | 1,3 |
| Na (cmolc/kg) | 0,3 |
CE: conductividad eléctrica del extracto de saturación
MO: materia orgánica (método de Walkley - Black)
N Total: nitrógeno total (método de Kjehldal)
CIC: capacidad de intercambio de catiónico.
Diseño estadístico
El diseño experimental del ensayo fue completamente aleatorizado (DCA). Se emplearon 40 plantas/tratamiento. Los tratamientos (T), como se muestra en la Figura 1c, fueron: T1: Plantas sin inocular (Testigo o control); T2: Plantas inoculadas con cepa 1: REC3; T3: Plantas inoculadas con cepa 2: 2A1.
Parámetros morfo-fisiológicos de crecimiento y desarrollo
Las variables evaluadas fueron: número de hojas por planta (NH), inicio de floración (IF), inicio de cosecha (IC), número de frutos por planta (NF), peso medio de frutos comerciales (PMFC), diámetro medio de frutos comerciales (DMFC), porcentaje de frutos eliminados o podridos (% FP) y peso total de frutos/planta (rendimiento total, incluyendo descarte y frutos con valor comercial). El NH se obtuvo por conteo cada 10 días. Para IF e IC, se registraron las fechas, considerando días desde plantación como referencia. El NF se obtuvo por conteo de todos los frutos cosechados por planta (inoculadas o no). Para el PMFC, indicador de calidad de fruta, se estableció como comercial a todo fruto con ≥75 % de superficie color rojo, peso ≥10 g, sano y sin deformaciones; el PMFC se obtuvo al dividir el peso de los frutos comerciales cosechados en cada tratamiento respecto al número total de esos frutos/T. Para el DMFC se clasificaron los frutos según el diámetro ecuatorial en: tamaño chico: < 18 mm; mediano: 18 a 24 mm o grande: > 24 mm. Se midió con calibre. El diámetro medio se obtuvo dividiendo el diámetro de todos los frutos comerciales cosechados en cada T, en la cantidad de esos frutos. El % FP se calculó dividiendo el número de éstos en NF. El rendimiento (expresado en gramos por planta) se obtuvo dividiendo el peso de todos los frutos cosechados/T, en el número de plantas de ese T (Kirschbaum et al., 2014). La frecuencia de cosecha fue de 3 a 4 pasadas por semana entre fines de julio y principios de noviembre. En cada cosecha, se recolectaron todos los frutos maduros de cada T. En cada evaluación se registró́ el número de plantas o pérdidas por T.
Análisis estadístico de los datos
El análisis de los datos se realizó mediante un análisis de la varianza con posterior test de Tukey con el procesamiento estadístico mediante el programa Infostat (Di Rienzo et al., 2018).
Resultados y discusión
Durante el período de ensayo, se efectuaron determinaciones morfo-fisiológicas para evaluar el crecimiento vegetal y desempeño productivo de plantas de frutilla inoculadas con dos cepas nativas de A. brasilense, en comparación con las plantas no inoculadas. A continuación, se detallan los valores obtenidos según las variables analizadas:
Número de hojas (NH)
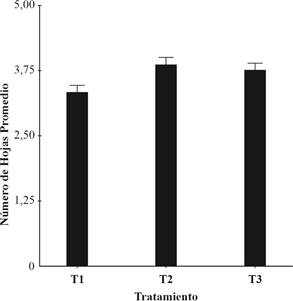
Para esta variable se hicieron seis conteos cada 10 días (Figura 2) y se determinó que hubo diferencias significativas entre tratamientos (Tabla 2). El T2 fue el que presentó el mayor valor, el T1 el menor y el T3 valores intermedios (Figura 3). Desde el punto de vista fenológico, la mayor diferencia en cuanto a número de hojas se evidenció entre los 30 y 40 días de implantación del ensayo (Figuras 1d,1e y 2). Estos resultados muestran un efecto promotor del crecimiento vegetal en plantas inoculadas con A. brasilense con respecto a las plantas sin inocular e indican los efectos benéficos de la bacteria en las condiciones ensayadas.
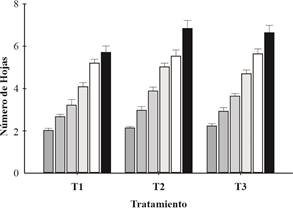
Figura 2 Valores medios resultantes del conteo de número de hojas (NH) por planta/T del cv. ‘Camino Real’ en seis fechas (60 días) en El Manantial, Tucumán, Argentina (2018).
Tabla 2 Análisis de la varianza de las variables consideradas para el cultivo de frutilla cv. ‘Camino Real’ inoculada con dos cepas de A. brasilense en comparación con las plantas control no inoculadas para el período de evaluación en El Manantial, Tucumán, Argentina (2018).
| FV | SC | CM | F | p-valor |
|---|---|---|---|---|
| Número de hojas (NH) por plantas/T | 3,19 | 1,59 | 4,21 | 0,0192 |
| Inicio de floración (IF) | 1126,45 | 563,23 | 8,64 | 0,0005 |
| Inicio de cosecha (IC) | 60,21 | 30,11 | 0,29 | 0,7504 |
| Número de frutos por planta (NF) | 40,21 | 20,11 | 3,83 | 0,0268 |
| Peso promedio de frutos comerciales -PMFC | 2,30 | 1,15 | 0,99 | 0,3766 |
| Diámetro medio de frutos comerciales (DMFC) | 1,47 | 0,73 | 0,56 | 0,5743 |
Inicio de floración (IF)
Los tratamientos inoculados T3 (Figura 1f) y T2 iniciaron floración al cabo de 77 y 79 días desde la plantación respectivamente y mostraron diferencias significativas con respecto a las plantas sin inocular correspondientes al T1 (Tabla 2), cuyo inicio de floración se produjo a los 87 días de la plantación (Figura 4). Estos resultados explican la incidencia de la inoculación sobre el desarrollo y precocidad del cultivo.
Inicio de cosecha (IC)
Desde la implantación del ensayo hasta el inicio de la cosecha de frutos, transcurrieron entre 112 hasta 114 días y no se observaron diferencias estadísticamente significativas entre los tratamientos (Tabla 2). Sin embargo, en algunas plantas de T2 y T3 -inoculadas- se inició la cosecha a los 78 días, siendo las más precoces desde el punto de vista fenológico y si bien, estadísticamente no arrojaron diferencias (Tabla 2 y Figura 1g), se sugiere una asociación positiva bacteria-planta para precocidad en producción de fruta.
Número de frutos/planta (NF)
El número de frutos cosechados con valor comercial en los tratamientos ensayados, tuvo numerosas variaciones. En el análisis de los valores medios se pudo observar que hubo diferencias estadísticamente significativas entre los tratamientos (Tabla 2). Las plantas de T2 (REC3) produjeron mayor cantidad de frutos comerciales, mostrando diferencias significativas con respecto a T3 (2A1) e igual comportamiento respecto del (T1) (Figura 5). La diferencia significativa entre el número de frutos en T2 indicaría una asociación genotipo de frutilla - cepa bacteriana (REC3) positiva.
Peso promedio de frutos comerciales (PMFC)
Esta variable es un importante indicador de calidad de fruta; se estableció como comercial a todo fruto con ≥75 % de su superficie de color rojo, ≥10 g, sano y sin deformaciones. En el análisis no se encontraron diferencias significativas entre T1, T2 y T3 (Tabla 2). Sin embargo, se pudo observar durante el período de cosecha evaluado, una alta variabilidad entre pesos de frutos/T, encontrándose desde frutos chicos hasta frutos de 19 g, correspondiendo los valores inferiores a T1, siendo intermedios los de T3 y los de mayor peso los de T2. Estos resultados reafirman la tendencia de la especificidad e influencia positiva de la asociación de la cepa bacteriana REC3 con el genotipo de la planta.
Diámetro promedio de frutos comerciales (DMFC)
En esta variable los mayores valores se encontraron en T2 = 20,18 mm y T3 = 20,24 mm comparado con T1 =19,90 mm, pero no hubo diferencias estadísticas significativas al comparar el diámetro promedio (Tabla 2). En los tres tratamientos, el diámetro ecuatorial promedio de los frutos comerciales fue de tamaño mediano (18 a 24 mm). Sin embargo, al igual que con los pesos medios de los frutos comerciales, hubo variabilidad en los valores, encontrándose desde frutos de tamaño chico (menor a 18 mm) hasta frutos grandes (mayores a 24 mm). En tanto, los mayores valores de DMFC se encontraron en T2 - T3 (inoculados) respecto a T1 o control.
Porcentaje de frutos podridos
No se encontraron diferencias significativas entre los tratamientos (Tabla 2); sin embargo, los mayores valores correspondieron a plantas inoculadas (T2 = 8,3 % y T3 = 8,5 %) respecto a T1 = 7,8 %).
Rendimiento total de frutos
El período de producción de frutos evaluado en el ensayo abarcó los meses de producción temprana o primicia y parte de estación (julio hasta inicios de noviembre). Los rendimientos expresados en gramos por planta, tanto de frutos con valor comercial como de producción total (comercial y descarte) se extrapolaron a Kg·ha-1. El análisis estadístico de los resultados mostró que existen diferencias significativas entre los rendimientos alcanzados por las plantas de frutilla que fueron inoculadas con la cepa REC3 respecto a las inoculadas con la cepa 2A1 (T3) y el control (T1), como se observa en la Figura 6.
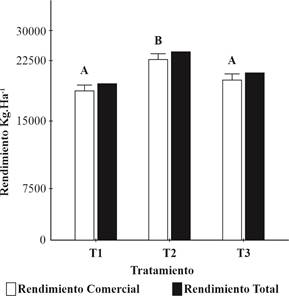
Figura 6 Rendimiento de frutos comerciales (RC) y rendimiento total de frutos (RT) de frutilla cv. ‘Camino Real’ inoculadas con cepas nativas REC3 (T2) y 2A1 (T3) o no (T1) en El Manantial, Tucumán, Argentina (2018). Valores medios con una letra común no son significativamente diferentes (p > 0,05).
Durante la evaluación realizada en el ensayo no se completaron los datos de rendimientos correspondientes al mes de noviembre (no se efectuó la cosecha), lo que probablemente habría generado incrementos productivos por tratarse de una variedad tardía; sin embargo, al contrastar con valores provinciales promedio, obtenidos en la campaña 2018, con el mismo cultivar, en campo y con manejo convencional (empleando agro-insumos), se obtuvieron los siguientes resultados “rendimiento total de frutos (RT) 23.200 Kg·ha-1 y comercial (RC): 21.370 Kg·ha-1” (valores no publicados por variedad, D. Kirschbaum comunicación personal, 2021). Estos niveles de rendimientos también son comparables a los alcanzados por Lovaisa y colaboradores (2016). Los volúmenes de RT y RC alcanzados en el presente estudio, sin empleo de insumos de síntesis, indicarían el efecto benéfico de la inoculación, la interacción y especificidad de la asociación de la cepa REC3 (aislada de frutilla) con el genotipo de la planta. Las plantas inoculadas con la cepa 2A1, quizás por su origen (aislada de petunia), alcanzaron niveles de rendimientos menores a REC3 y aunque logró mayor volumen de fruta que el testigo, no hubo diferencias estadísticas con el mismo. REC3 logró un RC 14 % por encima del alcanzado por las plantas inoculadas con 2A1 y 17 % más que el control. 2A1superó en 4 % el RC del control. De acuerdo con estos resultados y considerando algunas experiencias citadas en la introducción, en el presente trabajo se empleó una dosis de 106 UFC·ml-1 de A. brasilense, la cual demostró ser adecuada y causar efectos positivos sobre parámetros morfo-fisiológicos (de crecimiento) y desarrollo (floración y fructificación) en plantas de frutilla. De esta forma, se obtuvieron resultados contrapuestos a los de Castañeda y colaboradores (2013), quienes emplearon una concentración elevada (109 UFC.ml-1) y arribaron a resultados negativos para el cultivo.
En ensayos efectuados en Tucumán, Argentina, se estableció que la inoculación con bacterias promotoras del crecimiento en frutilla, los rendimientos no mostraron diferencias significativas entre las plantas del cv. ‘Camarosa’ inoculadas y las no inoculadas, o entre las cepas empleadas (Salazar et al., 2011). En otro estudio, las plantas tratadas con A. brasilense (cepa REC3) aumentaron el rendimiento total de fruta en el primer año (Salazar et al., 2012). Teniendo en cuenta estas experiencias locales, se coincide con el incremento en rendimientos de frutos totales (comerciales y descarte). En tanto, en este ensayo hubo diferencias significativas entre las plantas inoculadas y el testigo absoluto, tanto en la etapa de crecimiento, como en precocidad y producción de flores y frutos comerciales. La cepa nativa REC3 tuvo un desempeño diferencial con respecto a la cepa 2A1, lo cual evidencia la interacción tratamiento-cultivar y especificidad de la cepa REC3 con el genotipo de frutilla.
Conclusiones
La inoculación de plantines de frutilla con A. brasilense, sin empleo de insumos de síntesis química durante el ciclo de cultivo, mostró efectos positivos como bacteria promotora del crecimiento del cultivo.
En este estudio, se evidencia la asociación Azospirillum-planta y respuesta diferencial según el origen de las cepas, tanto en plantas (parámetros morfo-fisiológicos, de crecimiento) como en rendimiento de frutos totales y comerciales. Así, la cepa REC3 (endofítica y aislada de F. x ananassa) superó en cuanto a su desempeño, a la cepa nativa 2A1 (aislada de Petunia sp.). Esto evidencia interacción tratamiento-cultivar y especificidad de la asociación de la cepa REC3 con el genotipo de la planta.
Existen variaciones en los valores de peso y diámetro promedio de frutos comerciales, según el origen de las cepas.
Los niveles de rendimientos de frutos totales y comerciales resultan alentadores, sin embargo, se considera necesario realizar estudios que permitan profundizar los conocimientos sobre manejo y acción de las cepas locales de A. brasilense, para incrementar su efecto benéfico tanto para el suelo como para el cultivo en campo.