INTRODUCCIÓN
Las Sierras Chicas de Córdoba pertenecen a una región montañosa, que se caracteriza por la alternancia de cumbres, planicies y restos de la antigua superficie de erosión. Son ambientes heterogéneos en cuanto a sus características topográficas, edáficas y de vegetación, que se encuentran degradados y expuestos a un gran número de modificaciones causadas por el hombre que reducen cada vez más su biodiversidad (Cabido et al., 2010).
En este sentido, Verzino et al. (2005) mencionan al fuego como uno de los factores que más inciden sobre el ambiente de las sierras de Córdoba, siendo responsable de cambios en la composición florística, en la fisonomía del paisaje original, como así también de la pérdida de especies vegetales. Esto, sumado a las actividades extractivas, prácticas agrícolas, el sobrepastoreo y el turismo, condujeron a un marcado deterioro de la vegetación original (Ferri et al., 2009).
A partir de ello, las especies vegetales han desarrollado numerosas características morfológicas, histológicas y fisiológicas, para adaptarse a estos ambientes con limitadas precipitaciones, altas temperaturas y suelos empobrecidos, debido a perturbaciones externas (Dickson, 2000). La respuesta de las especies a estos desórdenes, depende de la forma de vida de cada una, la resistencia de los propágulos y las estrategias y habilidades adaptativas de las mismas (Karlin et al., 2016). En estos ambientes las Fabáceas son valiosos recursos forrajeros, ya que producen biomasa de excelente calidad y cantidad para los sistemas de producción ganaderos con pastoreo de poblaciones naturales (Vanni, 2001; Lovey et al., 2010; Carbone et. al., 2017). Evaluaciones florísticas en lugares perturbados de las Sierras Chicas demostraron que las especies herbáceas de esta familia poseen una rápida regeneración por rebrote basal a partir de yemas ubicadas en órganos subterráneos, como rizomas y xilopodios radicales y/o caulinares, que acumulan agua y nutrientes para soportar las épocas desfavorables (Weberling et al., 2002; Fuentes et al., 2011; Martinat, 2012; Carbone, 2017).
En relación a la anatomía de la vegetación de montaña, la bibliografía señala que los tallos pueden presentar cutícula gruesa, corteza con numerosos estratos celulares que protegen al sistema vascular, médula reducida y alta proporción de tejido asimilador (Fahn, 1990; Bianco et al., 2004; Beltramini y Zapata, 2020). Asimismo, otra característica anatómica que destacan Evert (2008) y Jáuregui (2011) para Centrosema venosum Mart. ex Benth. y Beltramini y Zapata (2020) en Ramorinoa girolae Speg., es la presencia de fibras gelatinosas en el tallo, también llamadas fibras de reacción, que se contraen durante el desarrollo de la planta y ayudan a incrementar la capacidad de absorber y retener agua.
Por otra parte, Jáuregui, et al. (2014) y Pérez Cuadrada y Cambi (2014) observaron en especies de otras familias, caracteres anatómicos típicos de adaptaciones a ambientes xéricos entre los que se señalan la alta densidad de tricomas en hojas y tallos jóvenes, gruesa cutícula, hipodermis, cambium y tejidos vasculares secundarios con crecimiento temprano y gran desarrollo de tejidos de sostén subepidérmico (colénquima y esclerénquima), confiriéndole una notable rigidez a los órganos.
En cuanto a la hoja, se conoce que los tricomas son importantes en los vegetales de estos hábitats porque mantienen la saturación de vapor de agua en la superficie foliar, reduciendo la transpiración e influenciando indirectamente en la economía de agua de las plantas (Fahn y Cutler, 1992; Bianco et al., 2004; Strasburger et al., 2004; Evert, 2008). Asimismo, algunos autores que estudiaron la anatomía foliar de las Fabáceas, como Scandaliaris et al. (2013), citan la presencia de abundantes tricomas en plántulas de Desmodium incanum DC. De Vargas et al. (2015) y Flores et al. (2018) señalaron y describieron tricomas glandulares y eglandulares en Rhynchosia sp. Por su parte Caro et al. (2016, 2018, 2020), quienes estudiaron Adesmia cytisoides Griseb. y Adesmia inflexa Griseb. y Mercado et al. (2013) en Zuccagnia punctata Cav., indicaron la presencia de idioblastos con contenido fenólicos en tallos y hojas, característica que le confiere mayor protección frente al estrés oxidativo causado por la exposición a ambientes xéricos.
En base a los antecedentes expuestos, se plantean como objetivos describir la morfoanatomía de órganos vegetativos de Crotalaria chaco-serranensis H. Bach & Fortunato, Desmodium incanum DC. y Rhynchosia edulis Griseb., Fabaceas nativas con potencial forrajero de las Sierras Chicas de Córdoba, e identificar caracteres adaptativos a condiciones xéricas que permiten su establecimiento y supervivencia en ambientes perturbados.
MATERIALES Y MÉTODOS
El material vegetal se recolectó a campo en un predio ubicado en el departamento Colón, La Estancita (31°6’23, 7”S; 64°23’0, 51”O, 983 m snm), en febrero de 2020. La extracción de los ejemplares enteros se realizó con una pala, descalzando suavemente para evitar el daño en el sistema radical. Las plantas se acondicionaron y etiquetaron debidamente en bolsas de polietileno hasta llegar al laboratorio. Las raíces fueron separadas y lavadas con agua corriente para eliminar el suelo adherido, luego parte de las muestras fueron almacenadas frescas en heladera para su inmediata utilización y el resto se conservó en solución fijadora FAA (10 % formaldehído, 50% alcohol etílico, 5% ácido acético y 35% de agua destilada), para posteriores comparaciones.
Crotalaria chaco-serranensis H. Bach & Fortunato, ARGENTINA. Prov. Córdoba, Dpto. Colón, Loc. La Estancita 31°6’23, 7”S; 64°23’0, 51”O, 983 m snm, 11-II2020, Beltramini 497 (ACOR).
Desmodium incanum DC. ARGENTINA. Prov. Córdoba, Dpto. Colón, Loc. La Estancita 31°6’23, 7”S; 64°23’0, 51”O, 983 m snm, 11II-2020, Beltramini 526 (ACOR).
Rhynchosia edulis Griseb. ARGENTINA. Prov. Córdoba, Dpto. Colón, Loc. La Estancita 31°6’23, 7”S; 64°23’0, 51”O, 983 m snm, 11-II-2020, Beltramini 525 (ACOR).
Para su evaluación, se seleccionaron 5 ejemplares de cada especie al azar. De cada uno se tomaron 10 hojas completas correspondientes al cuarto nudo desde el cuello de la raíz. Se seleccionaron también fragmentos de tallos correspondientes al primer o segundo entrenudo a 5 o 10 cm del ápice caulinar y fragmentos de raíces laterales a 4 cm del ápice. Para el análisis de la estructura anatómica de dichos órganos se realizaron cortes transversales a mano alzada aplicando las metodologías clásicas de histología vegetal y técnicas de elaboración de preparados temporarios para microscopía óptica descriptas por Zarlavsky (2014). Para teñir las secciones se empleó safranina (1 g de safranina diluida en 100 ml de etanol al 50 %). Para la detección de fenoles en folíolos y tallos se aplicó sulfato férrico (D’Ambrogio de Argüeso, 1986). La cutícula se analizó en transcortes temporarios de hojas, para caracterizar el espesor de la misma se utilizó la clasificación de Luque et al. (1999) que relacionan el grosor de la cutícula con la altura de las células epidérmicas; siendo muy gruesas cuando va de 1 a 2 veces la altura de la célula, gruesa de 1 a ¼ la altura y fina menora ¼.
Las observaciones y cuantificaciones se efectuaron con microscopio óptico binocular Modelo Primo Star Zeiss. Se realizaron fotomicrografías mediante cámara digital Nikon Coolpix S10.
RESULTADOS
En C. chaco-serranensis la sección transversal de la raíz presentó un marcado crecimiento secundario con peridermis bien desarrollada. El cortex representó un setenta por ciento de la raíz y estuvo compuesta por 16-20 estratos de células parenquimáticas de forma variable, con abundantes amiloplastos y grupos de fibras dispersos. El sistema vascular ocupó el treinta por ciento del órgano y se conformó por un anillo continuo de células floemáticas formando un anillo entorno al xilema, en el que predominan los miembros de vaso que oscilaron entre 20 y 50 µm de diámetro (Figs. 1A y B).
El tallo mostró contorno circular a subcircular, una eustela con haces colaterales abiertos de distribución concéntrica. A 5 cm del ápice se encontró crecimiento secundario temprano con epidermis uniestratificada; por debajo de la misma se observó hipodermis colenquimática uniestratatificada con células alargadas, luego 4 a 5 estratos de clorénquima cortical formando un anillo continuo seguido por casquetes de esclerénquima con fibras gelatinosas sobre el floema (Fig. 1 E). El xilema se dispone en forma circular delimitado internamente con una médula central parenquimática (Figs. 1 C y D).
El corte transversal por el folíolo hipostomático presentó epidermis uniestratificadas formadas por células cuadrangulares de paredes anticlinales rectas y tricomas unicelulares simples en la cara abaxial. El mesofilo es dorsiventral formado por 3 a 4 estratos de células de parénquima en empalizada y 3 de parénquima esponjoso. La nervadura central presentó contorno plano convexo, colénquima subepidérmico hacia la cara abaxial y parénquima fundamental hacia la cara adaxial y un haz colateral con casquetes de fibras por debajo del floema (Fig. 1 F).
Por su parte, en D. incanum, la raíz presentó un crecimiento secundario temprano con formación de peridermis, en la que se encontraron adheridos restos de rizodermis. El córtex parenquimático estuvo formado por 4 a 6 estratos celulares, inmediatamente por debajo se observó un estrato continuo de floema que rodeó en su totalidad al xilema secundario. Éste último ocupó dos tercios del total de la circunferencia radical, con vasos xilemáticos que presentaron medidas entre los 15 y 40 µm distribuidos de manera uniforme (Fig. 2 A).
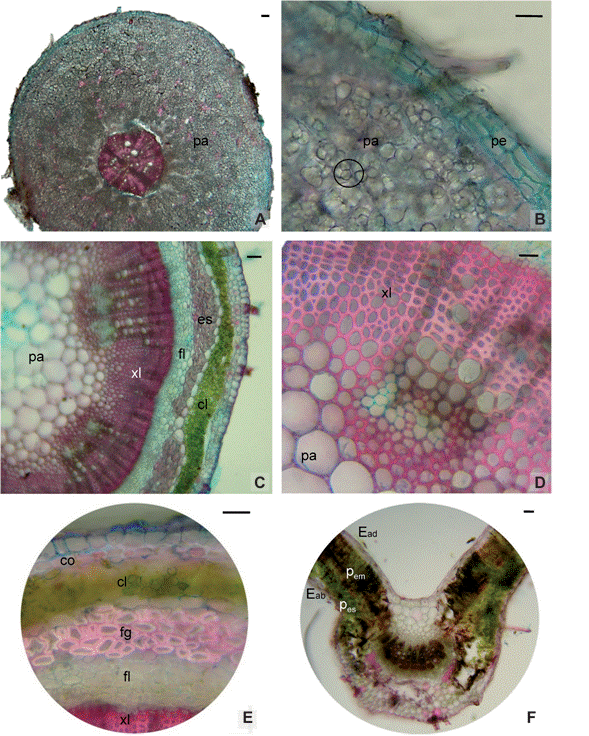
Fig. 1 Fig. 1 Anatomía Crotalaria chaco-serranensis. A-B) Anatomía de raíz A) Corte transversal a 2 cm del ápice radical. B) Detalle de parénquima cortical con abundantes amiloplastos. C-E) Anatomía de tallo. C) Corte transversal de tallo a 5 cm del ápice caulinar. D) Referencia del incipiente crecimiento secundario. E) Hipodermis colenquimática y fibras gelatinosas sobre floema. F) Corte transversal en la zona media del folíolo. Abreviaturas: cl, clorénquima; co, colénquima; Eab, epidermis abaxial; Ead, epidermis adaxial; es, esclerénquima; fg, fibras gelatinosas; fl, floema; pa, parénquima; pe, peridermis; pem, parénquima en empalizada; pes, parénquima esponjoso; xl, xilema; círculo indica amiloplastos. Escala = 50 µm. Crotalaria chaco-serranensis anatomy. A-B) Root anatomy A) Cross section 2 cm from the root apex. B) Detail of cortical parenchyma with abundant amyloplasts. C-E) Stem anatomy. C) Cross section of the stem 5 cm from the shoot apex. D) Reference of the incipient secondary growth. E) Collenchymatic hypodermis and gelatinous fibers on phloem. F) Cross section in the middle zone of the leaflet. Abbreviations: cl, chlorenchyma; co, collenchyma; Eab, abaxial epidermis; Ead, adaxial epidermis; es, sclerenchyma; fg, gelatinous fibers; fl, phloem; pa, parenchyma; pe, periderm; pem, palisade parenchyma; pes, spongy parenchyma; xl, xylem; circle indicates amyloplasts. Scale = 50 µm.
El tallo mostró un contorno subcircular con pequeñas costillas, epidermis uniestratificada con gruesa cutícula de 8,4 µm, células epidérmicas isodiamétricas y tricomas eglandulares unicelulares simples y glandulares. Por debajo se observaron 4 a 6 estratos de colénquima laminar continuo, seguido por casquetes de esclerénquima perivascular, conformados por numerosas fibras gelatinosas (Figs. 2 B y C). Tanto el floema como el xilema, formaron anillos continuos, en el primero se evidenciaron idioblastos fenólicos. En la médula se observaron células parenquimáticas e idioblastos fenólicos dispersos (Fig. 2 D).
La hoja anfistomática en sección transversal presentó una epidermis uniestratificada con células papilosas en la cara abaxial, con abundantes tricomas eglandulares uncinados cortos, glandulares cortos y largos, unicelulares y pluricelulares (Figs. 2 E y F). El mesofilo es dorsiventral con un único estrato de clorénquima en empalizada y dos de clorénquima esponjoso hacia la cara abaxial (Fig. 2 F). A nivel de la nervadura central, se encontró un haz colateral rodeado con un anillo de fibras esclerenquimáticas que se extendió hacia la epidermis adaxial. En el floema se encontraron idioblastos fenólicos (Fig. 2 G).
R. edulis presentó una raíz con estructura secundaria, peridermis de seis a ocho estratos celulares; corteza parenquimática de cinco a seis estratos y el floema se destacó por su gran desarrollo. El xilema ocupó todo el centro del órgano donde predominaron miembros de vaso con diámetros que oscilaron entre 20 a 45 µm, distribuidos uniformemente por todo el tejido. Se distinguieron cuatro radios parenquimáticos bien desarrollados que se ensanchan desde el eje hacia la periferia, posiblemente derivados de una raíz tetrarca (Fig. 3 A).
Cercano al cuello de la raíz principal, se observó un eje engrosado, que corresponde a un xilopodio, que en sección transversal muestra una médula parenquimática con amiloplastos en la posición central (Fig. 3 B). En la misma región, se evidenciaron rizomas filiformes amarillentos y delgados, que nacen junto con ramas aéreas trepadoras del cuello epicotiledonar, cuya anatomía se caracterizó por presentar un crecimiento totalmente secundario donde se destacó la presencia de abundantes amiloplastos en toda su estructura e idioblastos fenólicos dispersos principalmente en el cortex y médula (Fig. 3 C).
En transcorte el tallo mostró contorno circular con costillas poco pronunciadas (Fig. 3 D). La epidermis fue uniestratificada con cutícula gruesa de 7,5 µm, abundantes tricomas no glandulares, glandulares capitados esféricos o voluminosos y de base bulbosa (Figs. 3 D y E). En la corteza se observaron cinco a seis estratos de colénquima laminar subepidérmico de mayor desarrollo a nivel de las costillas, in mediatamente por debajo casquetes de fibras floemáticas con gruesa pared secundaria formando un incipiente anillo perivascular. En tallo, la actividad del cambium, condujo a la formación de un anillo completo de tejido vascular. Dispersos en el floema se observaron idioblastos fenólicos de gran tamaño en relación al resto de las células floemáticas (Figs. 3 F y G). El xilema presentó abundantes fibras e internamente en la posición central se observa una médula parénquimática con células de mayores dimensiones que las del cortex (Fig. 3 F).
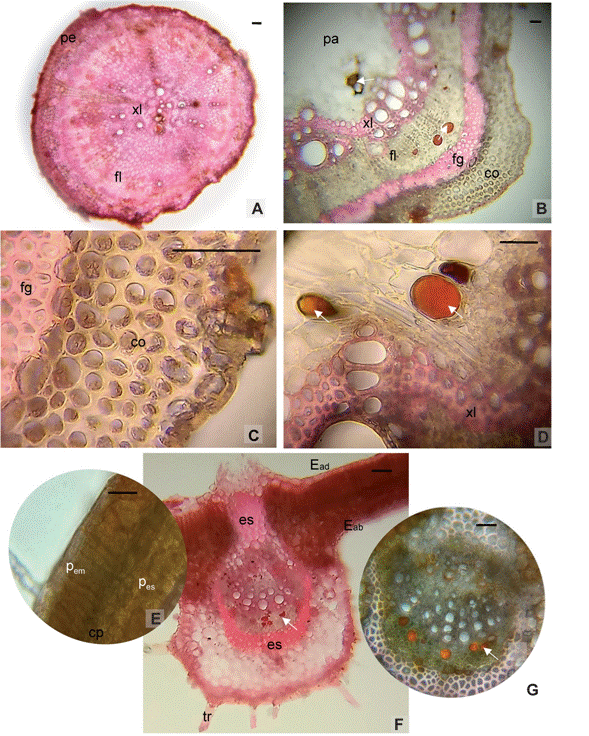
Fig. 2 Fig. 2 Anatomía Desmodium incanum. A) Corte transversal de raíz a 4 cm del ápice radical. B-C-D) Anatomía de tallo. B) Corte transversal a 10 cm del ápice caulinar. C) Detalle de colénquima laminar subepidérmico y fibras gelatinosas. D) Idioblastos fenólicos en floema. E-F-G) Anatomía de hoja. E) Corte transversal de un folíolo con presencia de tricomas. F) Detalle del mesofilo dorsiventral y células papilosas en la cara abaxial. G) Referencia del haz vascular central con idioblastos fenólicos. Abreviaturas: co, colénquima; cp, células papilosas; Eab, epidermis abaxial; Ead, epidermis adaxial; es, esclerénquima; fg, fibras gelatinosas; fl, floema; pa, parénquima; pem, parénquima en empalizada; pes, parénquima esponjoso; tr, tricomas; xl, xilema; flecha indica idioblastos fenólicos. Escala = 50 µm. Anatomy of Desmodium incanum. A) Cross section of the root 4 cm from the root apex. B-C-D) Stem anatomy. B) Cross section 10 cm from the shoot apex. C) Detail of subepidermal laminar collenchyma and gelatinous fibers. D) Phenolic idioblasts in phloem. E-F-G) Leaf anatomy. E) Cross section of a leaflet with the presence of trichomes. F) Detail of the dorsiventral mesophyll and papillose cells on the abaxial face. G) Reference of the central vascular bundle with phenolic idioblasts. Abbreviations: co, collenchyma; cp, papillose cells; Eab, abaxial epidermis; Ead, adaxial epidermis; es, sclerenchyma; fg, gelatinous fibers; fl, phloem; pa, parenchyma; pem, palisade parenchyma; pes, spongy parenchyma; tr, trichomes; xl, xylem; arrow indicates phenolic idioblasts. Scale = 50 µm.
mediatamente por debajo casquetes de fibras floemáticas con gruesa pared secundaria formando un incipiente anillo perivascular. En tallo, la actividad del cambium, condujo a la formación de un anillo completo de tejido vascular. Dispersos en el floema se observaron idioblastos fenólicos de gran tamaño en relación al resto de las células floemáticas (Figs. 3 F y G). El xilema presentó abundantes fibras e internamente en la posición central se observa una médula parénquimática con células de mayores dimensiones que las del cortex (Fig. 3 F).
En corte transversal el folíolo hipostomático, presentó epidermis uniestratificadas compuestas por células poligonales de paredes anticlinales rectas, heterogéneas en tamaño, con cutícula delgada de 2,4 µm, numerosos tricomas unicelulares, pluricelulares, glandulares y eglandulares como los descriptos en tallo. El mesofilo es dorsiventral, con dos estratos de células en empalizada y dos de parénquima esponjoso; entre ellas se dispone un estrato continuo de idioblastos fenólicos. La nervadura media exhibe contorno biconvexo, colénquima subepidérmico en la cara adaxial y el sistema vascular formado por un único haz colateral central con casquetes de esclerénquima hacia las dos caras. En el floema se evidencian idioblastos fenólicos (Figs. 3 H e I).
DISCUSIÓN
En C. chaco-serranensis la presencia de amiloplastos y crecimiento secundario temprano en raíz e hipodermis colenquimática en tallo, son características anatómicas que le permitirían adaptarse a condiciones xéricas, coincidiendo con lo señalado por Beltramini y Zapata (2020) para Ramorinoa girolae (Fabacea) y otras xerófitas (Jáuregui et al., 2014; Pérez Cuadrada y Cambi, 2014).
Las fibras gelatinosas en los tallos de D. incanum y C. chaco-serranensis, tienen la capacidad de incrementar la absorción y retención de agua. Carácter coincidente con lo señalado para otras Fabáceas por Jáuregui (2011) y Beltramini y Zapata (2020). Por su parte R. edulis presentó rizomas, igual que lo manifestado por Martinat (2012), sin embargo, esta última autora, señaló la presencia de una raíz axonomorfa, sin mencionar el xilopodio descripto en el presente trabajo, que muestra una médula rica en amiloplastos. Estas estructuras reservantes, fueron citadas por Fuentes et al. (2011) y Carbone (2017) quienes sostienen que les confieren a las especies una rápida regeneración vegetal.
Asimismo R. edulis y D. incanum presentaron idioblastos fenólicos asociados al floema y dispersos en todos sus órganos. Esta característica fue señalada por Caro et al. (2016, 2018, 2020) para Adesmia sp. sugiriendo la importancia de estas estructuras como caracteres de adaptación a ambientes xéricos. Asimismo, Mercado et al. (2013) señalan para Zuccagnia punctata (Fabaceae), la importancia de estos compuestos como metabolitos antioxidantes que cumplen función en la fotoprotección, actuando como pantalla frente a radiaciones nocivas y también evitan el daño causado por radicales libres.
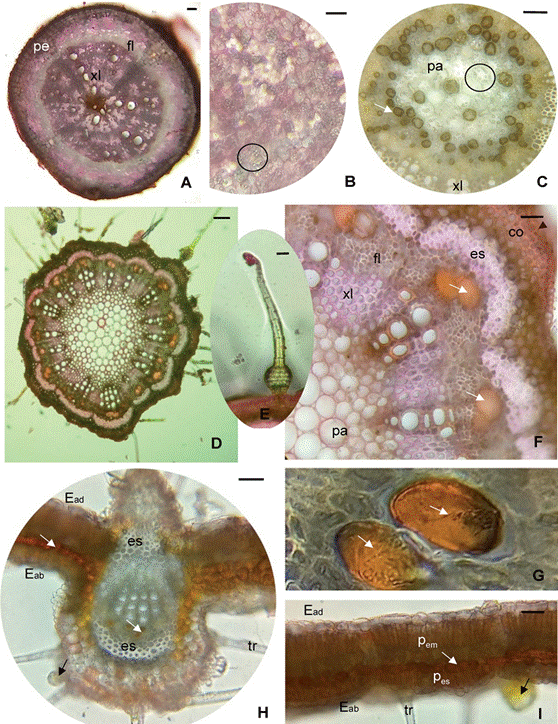
Fig. 3 Fig. 3 Anatomía Rhynchosia edulis. A) Corte transversal de raíz con estructura secundaria. B) Células parenquimáticas con amiloplastos en transcorte de xilopodio. C) Detalle de la médula parenquimática de un rizoma, con amiloplastos e idioblastos fenólicos. D-E-F-G) Anatomía de tallo. D) Corte transversal a 10 cm del ápice caulinar. E) Tricoma glandular de base bulbosa. F) Estratos celulares de colénquima subepidérmico, esclerénquima e idioblastos fenólicos asociados al floema. G) Detalle de idioblastos fenólicos. H-I) Anatomía de hoja H) Corte transversal de la nervadura central de un folíolo con presencia de abundantes tricomas. I) Mesofilo dorsiventral. Abreviaturas: co, colénquima; Eab, epidermis abaxial; Ead, epidermis adaxial; es, esclerénquima; fl, floema; pa, parénquima; pe, peridermis; pem, parénquima en empalizada; pes, parénquima esponjoso; tr, tricomas; xl, xilema; círculo indica amiloplastos; flecha blanca indica idioblastos fenólicos; flecha negra indica tricomas glandulares capitados esféricos o voluminosos. Escala = 50 µm. Rhynchosia edulis anatomy. A) Root cross section with secondary structure. B) Parenchyma cells with amyloplasts in cross section of xylopodium. C) Detail of the parenchymal pith of a rhizome, with amyloplasts and phenolic idioblasts. D-E-F-G) Stem anatomy. D) Cross section at 10 cm from the shoot apex. E) Bulbous based glandular trichome. F) Cellular layers of subepidermal collenchyma, sclerenchyma, and phloem associated phenolic idioblasts. G) Detail of phenolic idioblasts. H-I) Leaf anatomy. H) Cross section of the central rib of a leaflet with the presence of abundant trichomes. I) Dorsiventral mesophyll. Abbreviations: co, collenchyma; Eab, abaxial epidermis; Ead, adaxial epidermis; es, sclerenchyma; fl, phloem; pa, parenchyma; pe, periderm; pem, palisade parenchyma; pes, spongy parenchyma; tr, trichomes; xl, xylem; circle indicates amyloplasts; white arrow indicates phenolic idioblasts; black arrow indicates spherical or capitate glandular trichomes bulky. Scale = 50 µm.
Además, estas dos especies en el tallo mostraron una cutícula gruesa (Luque et al., 1999) y abundantes tricomas en sus partes aéreas, que le permiten ser eficientes en el uso del agua coincidiendo con lo expresado por Jáuregui et al. (2014) y Pérez Cuadrada y Cambi (2014). Estas características anatómicas se corresponden con lo estudiado por De Vargas et al. (2015) y Flores et. al. (2018) en el género Rhynchosia y, del mismo modo, en D. incanum por Scandaliaris et al. (2013).
Por último, una característica común en las tres especies es el gran desarrollo de tejidos de sostén subepidérmico (colénquima y esclerénquima) en el cortex del tallo, que protegen al sistema vascular y le confieren mayor resistencia como lo señalan Jáuregui et al. (2014) y Pérez Cuadrada y Cambi (2014) en sus estudios de especies adaptadas a ambientes xéricos.
CONCLUSIONES
De acuerdo a los resultados obtenidos las tres especies analizadas presentan caracteres morfológicos que permiten adaptarse a condiciones ambientales xerofíticas.
C. chaco-serranensis, presentó crecimiento secundario cercano al ápice, abundantes amiloplastos en raíz, hipodermis colenquimática y fibras gelatinosas en tallo. Por su parte, en D. incanum, se identificó un incipiente crecimiento secundario, tallo con cutícula gruesa, abundantes tricomas, numerosos estratos de colénquima y fibras gelatinosas. En los folíolos la epidermis presentó gran cantidad de tricomas y en estos órganos se identificaron idioblastos fenólicos. Asimismo, en R. edulis, se observaron rizomas y un xilopodio reservante con marcado crecimiento secundario. El tallo presentó cutícula gruesa e idioblastos fenólicos y características que se repitieron en los folíolos como numerosos tricomas e idioblastos fenólicos asociados al floema. Estos resultados sirven de base para futuros estudios que analicen características de especies autóctonas en ambientes xéricos.














