INTRODUCCIÓN
Las plantas exóticas representan una seria amenaza para los paisajes intensamente explotados por los humanos, la biodiversidad y el funcionamiento de los ecosistemas y pueden afectar la salud humana (Müllerová et al., 2013). Dentro de ellas están las especies ornamentales que recurrentemente se escapan de los jardines ya sea privados como públicos (Petřík et al., 2019), de allí la importancia de las ciudades como focos de invasiones biológicas.
El siglo XXI es considerado el siglo de la urbanización (Endlicher et al., 2007), por eso es importante el rol de las floras urbanas. En Europa (Godefroid, 2001), se ha considerado que las áreas urbanizadas contienen un gran número de especies vegetales exóticas distribuidas en diferentes hábitats. Por ejemplo, en Italia, el ma- yor número de especies no nativas se encuentra en áreas urbanas, seguido de sitios industriales y rutas (Celesti-Grapow et al., 2010). Asimismo, nuevos registros para las floras de algunos países americanos han sido coleccionados en las ciudades, por ejemplo, Polycarpon tetraphyllum (L.) L., nativa de la región Mediterránea, fue hallada creciendo entre el pavimento en Bogotá, Colombia (Fonseca-Cortés y Sandoval-Orte ga, 2022). En general, el número de especies exóticas se incrementa hacia el interior de la ciudad (Celesti-Grapow et al., 2006), aunque diferentes especies prefieren el centro de la ciudad o su periferia (Štajerová et al., 2017), e incluso suelen estar asocia- das con corredores biológicos como ríos, canales, caminos y vías férreas. Esto último facilita su expansión a considerables distancias, de modo tal que, en algunos casos, los centros urbanos actúan como foco de expansión hacia áreas más amplias en el ambiente rural (Botham et al., 2009; Štajerová et al., 2017; Potgieter y Cadotte, 2020). La invasión es un proceso que requiere que un taxón supere barreras bióticas y abióticas. Detectar focos de invasión es un dato relevante para el estudio y control de las invasiones biológicas (Celesti-Grapow et al., 2009), así como lo es establecer el estado de invasión. A las especies exóticas se las clasifica en casuales, naturalizadas e invasoras (Pyšek et al., 2004), de acuerdo con su estado en el proceso continuo de introducción-naturalización-invasión explicado por el modelo de barreras (Richard- son et al., 2000, Richardson et al., 2011, Richardson y Pyšek, 2012). Son consideradas casuales aquellas especies que superan la barrera geográfica, comenzando el proceso de introducción, donde los organismos son transferidos por el hombre (intencio- nalmente o no) hacia áreas alejadas de su rango natural de dispersión. Se define como naturalizadas al subconjunto de especies exóticas que pueden superar barreras ambientales a la supervivencia, al menos 10 años (Pyšek et al., 2004), y a la repro- ducción regular (por semillas o vegetativamente). Un subconjunto de las especies naturalizadas se constituye en invasoras si superan barreras a la dispersión en sitios
disturbados y barreras de resistencia en comunidades sucesionalmente maduras.
Otro modelo, el marco unificado de barreras y estados (Blackburn et al., 2011), reconoce que el proceso de invasión puede dividirse en una serie de etapas y que, en cada una de ellas, hay barreras que deben superarse para que una especie o pobla- ción pase a la siguiente etapa. Este modelo ha sido aplicado en ecosistemas urbanos (Potgieter y Cadotte, 2020).
La familia Urticaceae es una de las familias más representadas en las floras urbanas (Barrico et al., 2012; Celesti-Grapow et al., 2013; Figueroa et al., 2016). Com- prende alrededor de 1900 especies (Paiva, 1993); 53 para el Cono Sur y 26 para la flora argentina, entre nativas y adventicias (Anton y Zuloaga, 2023). Recientemente, se ha registrado una nueva maleza de esta familia en Tucumán, Laportea aestuans (L.) Chew, (Slanis y Bulacio, 2022). Asimismo, se cultivan en nuestro país al menos seis especies (Dimitri, 1987). La sistemática de esta familia para la Argentina ha sido tratada por Sorarú (1972), dentro de ella encontramos a la tribu Parietarieae Gau- dich, la cual se caracteriza por presentar hojas alternas, con borde entero, sin pelos urticantes, flores con perianto tetralobulado o tetradentado.
Una de las especies de la tribu Parietarieae, que habita en áreas urbanas y pe- riurbanas de diversos países, es Parietaria judaica L. Se trata de una hierba perenne, nativa del oeste y centro de Asia, sur y oeste de Europa y norte de África (Townsend, 1982); naturalizada en diversos países (Webb et al., 1988; Bass y Bass, 1990; Paiva, 1993; Entwisle y Gebauer, 1996; Boufford, 1997; Preston y Woodland, 2012; Rodri- guez et al., 2018; Zuloaga et al., 2019), entre ellos en Argentina (Martínez Carretero, 2015; Anton y Zuloaga, 2023). En la provincia de Buenos Aires ha sido mencionada solamente para los partidos de La Plata, San Isidro y Tigre (Dawson, 1967; Sora- rú, 1972; Anton y Zuloaga, 2023), sin embargo, ha sido registrada en numerosas ciudades. Dado que es una especie con polen alergógeno (Ford et. al., 1986; Bass y Bass, 1990; D’Amato et al., 1992; Paiva, 1993; Colombo et al., 2003), y que ha sido confundida con Parietaria officinalis L., una especie con uso medicinal (Orfila et al., 1980), es importante conocer su distribución geográfica, los hábitats que ocupa y sus características morfológicas.
Otro género de la tribu Parietarieae, Soleirolia Gaudich., comprende una única especie, Soleirolia soleirolii (Req.) Dandy, hierba perenne que ha sido cultivada desde hace décadas en la Argentina por su valor ornamental (Dimitri, 1987). Es originaria del Hemisferio Norte, de las islas del Mediterráneo occidental: Córcega, Cerdeña, Capraia y Mallorca (Paiva, 1993). Al igual que otras especies ornamentales (Deh- nen-Schmutz y Touza, 2008), como consecuencia de su cultivo, se ha naturalizado en numerosas regiones (Clapham et al., 1987; Webb et al., 1988; Paiva, 1993; Entwisle y Gebauer, 1996; Boufford, 1997; Preston y Woodland, 2012; Rodriguez et al., 2018; Zuloaga et al., 2019; Tropicos, 2023). Esta especie no ha sido citada como adventicia en Argentina (Anton y Zuloaga, 2023), aunque ha sido registrada en las ciudades de Azul, Olavarría y Mar del Plata, provincia de Buenos Aires, como parte de la flora urbana espontánea, en sitios muy localizados, que podrían constituirse en focos iniciales de naturalización.
Los objetivos del presente trabajo son actualizar el estado de invasión de P. ju- daica, con nuevas localidades y hábitats en Argentina, en particular en la provincia de Buenos Aires, como también hacer referencia a los focos iniciales de naturaliza- ción de S. soleirolii, especie aún no incluida en la flora argentina. Adicionalmente, se aporta una clave para diferenciar ambos géneros pertenecientes a la tribu Parietarieae.
MATERIALES Y MÉTODOS
El material estudiado correspondiente a P. judaica se coleccionó entre 1989 y 2022, durante todos los meses del año, en varias ciudades de la provincia de Buenos Aires y Ciudad Autónoma de Buenos Aires (Fig. 1A). El material analizado correspon- diente a S. soleirolii se recolectó en octubre de 1989, y de junio de 2021 a mayo de 2022 en la ciudad de Azul, y en diciembre de 2022 en Mar del Plata y Olavarría, provincia de Buenos Aires (Fig. 1B). Los ejemplares se depositaron en el herbario FAA (Thiers, 2023). El estudio morfológico se realizó con microscopio estereoscópico Olympus SZH10. Los ejemplares fueron determinados con floras de diversos países y otros trabajos sobre los géneros y especies (Dawson, 1967; Townsend, 1968, 1982; Sorarú, 1972; Orfila et al., 1980; Clapham et al., 1987; Dimitri, 1987; Webb et al., 1988; Paiva, 1993; Entwisle y Gebauer, 1996; Boufford, 1997; Preston y Woodland,
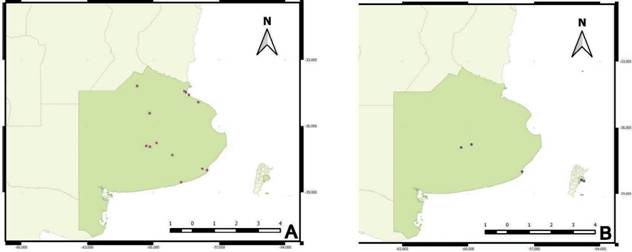
Fig. 1 Sitios de colección en la provincia de Buenos Aires, Argentina. A) Parietaria judaica. B) Solei- rolia soleirolii. Fig. 1. Collection sites in Buenos Aires province, Argentina. A) Parietaria judaica. B) Soleirolia solei- rolii.
2012). Asimismo, se cotejaron los ejemplares con imágenes digitales del tipo de P. judaica (LINN 1220.3 https://linnean-online.org/), del ejemplar tipo de S. soleirolii (https://www.gbif.org/occurrence/1057589098) y de isotipos (https://www.gbif.org/ species/5361810), además de otros materiales conservados en los herbarios MO y NY. Se realizaron observaciones sobre sus hábitats en las poblaciones naturalizadas.
Se hipotetizó sobre probables vías de ingreso y de dispersión entre ciudades. La distribución geográfica se determinó a partir de los ejemplares coleccionados, de la bibliografía citada para la descripción morfológica y también se consultaron catálogos y base de datos (Rodriguez et al., 2018; Zuloaga et al., 2019; Anton y Zuloaga, 2023; Tropicos, 2023; WFO Plant List, 2023). A partir de los ejemplares herborizados se identificaron períodos de floración y fructificación para las dos especies. Se deter- minaron los estados de invasión según Pyšek et al. (2004) y Blackburn et al. (2011). Además, se siguieron los criterios de Blackburn et al. (2014) para hacer referencia al impacto sobre el ambiente.
RESULTADOS
Parietaria judaica se registró en numerosas localidades y hábitats de la provincia de Buenos Aires, en ambientes urbanos y periurbanos, incluido serranos. Por el contra- rio, S. soleirolii, fue hallada sólo en sectores urbanos. A continuación, se presenta el tratamiento taxonómico de las dos especies donde se incluye su descripción morfo- lógica, iconografía, distribución y hábitat, usos, fenología, estado de invasión, entre otros aspectos. Adicionalmente, se aporta una clave para diferenciar los géneros de la tribu Parietarieae.
Parietaria judaica: novedades sobre la distribución geográfica y hábitats
Parietaria judaica L., Fl. Palaest. 32. 1756. Tipo: LINN 1220.3. Figs. 2-5.
Parietaria ramiflora Moench, Methodus 327. 1794.
Parietaria punctata Willd., Sp. Pl., ed. 4, 4: 953. 1806.
Parietaria pilosa Willd., Sp. Pl., ed. 4, 4: 954. 1806.
Parietaria diffusa Mert. ex W.D.J., Koch Deutschl. Fl. (ed. 3) 1: 827. 1823.
Parietaria maderensis Rchb., Flora 13: 131. 1830.
Parietaria multicaulis Boiss. & Heldr., Diagn. Pl. Orient. 12: 106. 1853.
Parietaria velutina Blume, Mus. Bot. 2: 251. 1857.
Parietaria tibethana Blume, Mus. Bot. 2: 251. 1857.
Parietaria thymifolia Stapf, Denkschr. Kaiserl. Akad. Wiss., Wien. Math.-Naturwiss.
Kl. 51: 4. 1886.
Parietaria officinalis var. judaica (L.) Hochr., Annuaire Conserv. Jard. Bot. Genève 7-8: 130. 1904.
Parietaria officinalis subsp. judaica (L.) Bég., Nuovo Giorn. Bot. Ital. 15: 342.2. 1908.
Parietaria littoralis Schchian, Zametki Sist. Geogr. Rast. 5: 13. 1939.
Parietaria jaxartica Pavlov Vestnik Akad. Nauk Kazak. SSR No. 4 (73): 87. 1951.
Parietaria officinalis auct. non L.
Hierba perenne, rizomatosa, densamente pubescente. Tallos rojizos, cilíndricos, hasta 80 cm de altura, muy ramificados. Hojas alternas, pecioladas, borde entero, con tres nervios basales, cara adaxial brillosa y la abaxial verde claro, lámina ovada o lanceo- lada, 10-70 x 5-35 mm, ápice obtuso, agudo o acuminado. Inflorescencias polígamas, flores rodeadas por pequeñas brácteas ovadas, dispuestas en glomérulos axilares. Flor femenina terminal, perianto con cuatro segmentos angostamente lanceolados; flores perfectas laterales, perianto 4-dentado, cuando fructifica tubular, cuatro estambres. Aquenio ovoide de 1,0-1,2 x 0,7 mm, castaño muy oscuro, muy brillante.
Iconografía.- Townsend, 1968: 369; Dawson, 1967: fig. 9 E-H; Sorarú, 1972: fig.
8 y 9; Orfila et al., 1980: fig. 1; Martinez Carretero, 2015: 12, fig. 5.
Nombres vulgares.- “Hierba del muro”, “albahaquilla del muro”, “albahaca de río”, “caracolera”, “hierba de las ruinas” (España); “parietaria”, “buscapina” (Argen- tina); “pellitory”, “pellitory of the wall” (inglés, Gran Bretaña, Australia); “spreading pellitory” (inglés, Estados Unidos de Norteamérica).
Distribución y hábitat.- Especie nativa del oeste y centro de Asia, sur y oeste de Europa y norte de África (Townsend, 1982). En Gran Bretaña, donde se la considera nativa (Clapham et al., 1987), crece en muros viejos, grietas en las rocas, cercos. Se ha naturalizado en numerosos países, entre ellos Argentina (Anton y Zuloaga, 2023), también en Chile, Uruguay (Rodriguez et al., 2018; Zuloaga et al., 2019), en la Pe- nínsula Ibérica e Islas Baleares, donde es ruderal y viaria, se la encuentra principal- mente en los muros (Paiva, 1993); en América del Norte (Boufford, 1997; Preston y Woodland, 2012) es frecuente en puertos y áreas costeras, en grietas en las veredas, depósitos de lastres, áreas de residuos. En Oceanía, particularmente en Australia, es una maleza de áreas urbanas, común en senderos, muros, terrenos baldíos y áreas rocosas en arroyos disturbados (Entwisle y Gebauer, 1996); en Nueva Zelanda se la encuentra en jardines, bordes de bosques, acantilados costeros (Webb et al., 1988). En Argentina se distribuye en Entre Ríos, Santa Fe y Ciudad Autónoma de Buenos Aires (Antón y Zuloaga, 2023), Mendoza (Martínez Carretero, 2015); en Buenos Aires ha sido coleccionada principalmente en los partidos de La Plata (Dawson, 1967), Tigre (Sorarú, 1972) y San Isidro (Anton y Zuloaga, 2023), ha sido hallada en jardines (Cabrera y Zardini, 1978), también en talares (Delucchi y Torres Robles, 2006). Se han mencionado antecedentes de su cultivo en el sur de la provincia de Buenos Aires (Sorarú, 1972; Orfila et al., 1980), aunque es dudoso afirmar si la especie cultivada era P. judaica o P. officinalis. Según Orfila et al. (1980) era común en la provincia de Buenos Aires en terrenos baldíos, junto a los muros y en las proximidades de las vías de ferrocarril, aunque no indicaron ninguna localidad en particular.

Fig. 2 Parietaria judaica. Diversos hábitats urbanos y periurbanos. A-B) En bóvedas de cementerio. C) En nicho de cementerio. D) En tumba de cementerio. E) En cantero de vereda. F) En gabinete de gas. G) Sobre corteza en arbolado de alineación. H) En vereda de edificio en construcción. Fig. 2. Parietaria judaica. Various urban and peri-urban habitats. A-B) In cemetery vaults. C) In a cemetery niche. D) In a grave in a cemetery. E) In a sidewalk planter. F) In a gas cabinet. G) On the bark of street trees. H) On the sidewalk of a building under construction.
En las últimas décadas ha sido hallada en varias ciudades y localidades de la pro- vincia de Buenos Aires, de diferente superficie urbanizada y población, presentando una amplia distribución, que incluye las localidades de Azul, Olavarría, Sierras Bayas, Tapalqué, Tandil, Necochea, Mar del Plata, Sierra de los Padres, Rojas y Veinticinco de Mayo. Al igual que en Australia, Grecia y otros países (Bass y Bass, 1990; Fotiou et al., 2011), la distribución de P. judaica en la provincia de Buenos Aires es antrópica, asociada generalmente a áreas habitadas por humanos o modificadas por ellos. Los ambientes urbanos y periurbanos adecuados para su establecimiento (Figs. 2 y 3) son muros viejos (en la base, en grietas y en la parte superior) y otras construcciones, como por ejemplo tumbas, nichos y bóvedas de cementerios; veredas, generalmente cerca de los muros y también dentro de los gabinetes para regulación y medición del gas; vías ferroviarias y sitios próximos; en las bases de los árboles de alineación; en jardines bajo arbustos, cerca de las paredes y otros lugares sombreados; planta- ciones de Eucalyptus sp. y otros árboles en áreas periurbanas; como epifitas sobre Melia azedarach L. y en otros árboles en cuya corteza agrietada se puedan refugiar los frutos y encontrar un sustrato que les permita germinar, también en los restos de vainas de hojas de palmeras como Phoenix canariensis Chabaud. En el sudeste del Sistema Orográfico de Tandilia, habita en rocas que forman aleros, en un sector muy disturbado. No ha sido observada en áreas rurales. Es probable que el avance de una ciudad a otra se deba a las vías del ferrocarril y desde allí ingrese a las ciudades, adherida a otros medios de transporte, animales, ropa o calzado. De hecho, en la ciudad de Azul, se la ha encontrado en diferentes puntos del tendido férreo, desde la zona centro donde se halla debajo de las vías en un cruce ferroviario urbano y al costado de las mismas en las proximidades de la Estación Ferroviaria, hasta en áreas periurbanas próximas a cursos de agua. En Olavarría también se la encuentra bajo un puente sobre el arroyo en zonas céntricas, cerca de desagües pluviales. Pro- bablemente el agua sea otra vía de dispersión. Es posible que se encuentre en otras localidades bonaerenses, dado que aparentemente ha sido registrada fotográficamente en plataformas de ciencia ciudadana en Trenque Lauquen (Argentinat, 2022), dato que debería documentarse con ejemplares de herbario.
En la Ciudad de Buenos Aires no sólo se la encuentra en edificaciones y vías
del ferrocarril, sino que también ha sido registrada en un bosque de Tessaria integri- folia Ruiz & Pav. en la Reserva Ecológica Costanera Sur (Sirolli y Kalesnik, 2015). En la provincia de Mendoza es maleza en viveros (Martínez Carretero, 2015), por lo que el transporte en contenedores de plantas podría ser otra vía de ingreso entre diferentes puntos del país.
Notas taxonómicas y morfológicas.- Tanto Dawson (1967), como Sorarú (1972) y Orfila et al. (1980) identificaron los materiales estudiados como P. officinalis L. Aun- que se ha diferenciado P. officinalis de P. judaica por el hábito de crecimiento y tamaño de las hojas, estas características son muy variables en P. judaica, por ello Townsend (1968, 1982) las diferenció por el tamaño de los aquenios y las características de los periantos de las flores femeninas y perfectas para ambas especies. Por la variabilidad de las hojas en cuanto a su tamaño, forma de la lámina y del ápice (Fig. 5), también puede ser confundida con Parietaria debilis G. Forst. En este caso, una característica diferencial es el color de los tallos, que en P. judaica son rojizos, mientras que en P. debilis son verdes. Sin embargo, esto es difícil de reconocer luego del secado de la planta, lo cual suma dificultad a la identificación de ejemplares herborizados. En este trabajo, las observaciones realizadas permiten concluir que los ejemplares estudiados corresponden a P. judaica, por el tamaño del aquenio y otras características. El nú- mero de flores femeninas y perfectas en las inflorescencias de P. judaica es variable. En los ejemplares examinados se observó que los glomérulos presentan entre una y dos flores femeninas, y dos a cinco flores perfectas. Según Townsend (1968), en su área de distribución nativa, el número de flores varía con la distribución geográfica.

Fig. 3 Parietaria judaica. Ambientes ferroviarios. A) Debajo de la vía del ferrocarril. B) Debajo de lavía en un cruce ferroviario. C-D) En bordes de muros de una edificación de la estación ferroviaria. Fig. 3. Parietaria judaica. Railway environments. A) Under the railroad tracks. B) Under the tracks at a railroad crossing. C-D) On the edges of the walls of a railway station building.
Usos.- En España se la utiliza como diurética y para afecciones respiratorias (Paiva, 1993). En los alrededores de Buenos Aires y La Plata se la comercializa en seco o fresco, en dietéticas y mercados (Puentes, 2017).
Fenología.- Según se ha podido observar en los ejemplares de herbario examinados, en la provincia de Buenos Aires el período de floración se extiende durante todo el año, con la consecuente exposición al polen por parte de la población. También su período de fructificación es extenso, y por lo tanto la presión de propágulos podría considerarse como alta. Además, en un mismo mes, pueden encontrarse ejemplares en distinto estado fenológico. Se observó que rebrota, cuando es cortada.
Estado de invasión.- En cuanto al tiempo de residencia en Argentina, ha sido cita- da para la ciudad de Buenos Aires desde 1898, en el Herbario Bettfreund; en 1910 era rara, muy escasa en algunas tumbas del cementerio de la Recoleta, en muros viejos de la Facultad de Ciencias y en otros edificios antiguos (Hicken, 1910). Más de 100 años después, aún se la encuentra en esa zona de la Ciudad Autónoma de Buenos Aires. En la provincia de Buenos Aires fue hallada en La Plata en un aserradero (Molfino, 1926), en los muros (Cabrera, 1949), en el bosque (Dawson, 1967). Actualmente, está ampliamente distribuida en la provincia de Buenos Aires, tanto en ciudades costeras, como serranas y de otras regiones de la provincia, aunque su distribución no es continua, sino en localidades dispersas, como se ha señalado para California (Boufford, 1997). Dado el tiempo de residencia y la distancia al supuesto foco de la invasión, se la clasifica como invasora según Pyšek et al. (2004). En la categorización de Blackburn et al. (2011), podría ser categorizada como E, dado que los individuos se dispersan, sobreviven y se reproducen en múltiples sitios en un amplio espectro de hábitats. En cuanto a la clasificación según impactos sobre el ambiente (Black- burn et al., 2014), no hay suficientes estudios para evaluar si afecta poblaciones de especies nativas, aunque se esperaría que fuera mínimo, ya que actualmente no se halla en ambientes rurales; no obstante, su presencia en áreas serranas indica que podría interferir con la flora nativa en un futuro.
Material examinado.- ARGENTINA. Prov. Buenos Aires, Pdo. Azul, Azul, 36°46’S 59°51’O, junto a pared, 14-X-1989 (fl y fr), Scaramuzzino s.n. (FAA 10148); cerca de vías del ferrocarril, 12-V-2005, D’Alfonso s.n. (FAA 12061); en patio interno, 19-IX- 2020 (fl), Goyenetche 2 (FAA 11236); en nicho de cementerio, 23-XII-2020 (fl y fr), Goyenetche 7 (FAA 11233); al costado de vías del ferrocarril y cerca de arroyo, 07-V- 2021 (fl y fr), Goyenetche 10 (FAA 11241). Pdo. General Pueyrredón, Mar del Plata (38°0’S 57°33’ O), junto a pared en estacionamiento, 31-I-2022 (fl), Goyenetche 12 (FAA 11229); Sierra de los Padres, 37° 56’ S; 57° 46’ O, bajo alero de rocas, 09-X-2022 (fl y fr), Scaramuzzino s.n. (FAA 12286). Pdo. Necochea, Necochea, 38°33’ S 58°44’ O, en jardín externo, 01-I-2021 (fr), Scaramuzzino s.n. (FAA 11043). Pdo. Olavarría, Olavarría, 36°54’S 60°19’O, en vereda, 17-III-2022 (fl y fr), Vercelli s.n. (FAA 12062); epífita en arbolado de alineación, 05-V-2022 (fl y fr), Vercelli s.n. (FAA 11935); Sierras Bayas, 36°56’S 60°09’O, bajo un vagón de tren en desuso, 08-VII-2019 (fl y fr), Sca- ramuzzino s.n. (FAA 10482). Pdo. Rojas, Rojas, 34°11’S 60°44’ O, en vereda, 03-VIII- 2019 (fl y fr), Scaramuzzino s.n. (FAA 10342). Pdo. Tandil, Tandil, 37°19’S 59°08’O, bajo un árbol en vereda, 27-VII-2019 (fl y fr), Scaramuzzino s.n. (FAA 10400). Pdo. Tapalqué, Tapalqué, 36º21’S 60º01’O, en pared, 20-VI-2023 (fl y fr), Scaramuzzino s.n. (FAA 12656). Pdo. Veinticinco de Mayo, Veinticinco de Mayo, 35°25’S 60°10’O, junto a pared, 22-XII-2021 (fl y fr), Scaramuzzino s.n. (FAA 11109). Ciudad Autónoma de Buenos Aires, 34°35’S 58°23’O, en grieta de pared edificio histórico Facultad de Ingeniería UBA, 03-IV-2022 (fr), Scaramuzzino s.n. (FAA 11763).

Fig. 4 Parietaria judaica. Características reproductivas. A-B) Inflorescencia (Goyenetche 2, FAA 11236). C) Perianto de flor perfecta (Goyenetche 11, FAA 11251). D-E) Perianto de flor femenina (Goyenetche 11, FAA 11251). F) Aquenio (Goyenetche 7, FAA 11233). Escala = A-C: 2 mm; D-F: 0,5 mm.. Fig. 4. Parietaria judaica. Reproductive characteristics. A-B) Inflorescence (Goyenetche 2, FAA 11236). C) Perfect-flowered perianth (Goyenetche 11, FAA 11251). D-E) Perianth of the female flower (Goyenetche 11, FAA 11251). F) Achene (Goyenetche 7, FAA 11233). Scale = A-C: 2 mm; D-F: 0.5 mm.
Notas sobre Soleirolia soleirolii
Soleirolia soleirolii (Req.) Dandy, Feddes Repert. Spec. Nov. Regni Veg. 70: 4. 1965.
Helxine soleirolii Req., Ann. Sci. Nat. (Paris) 5: 384. 1825. Tipo: “H. in locis humidis Corsicae” (tipo BM 000613036, isotipos NY 284324, MPU 017548, STU 12855).
Figs. 6-7.
Parietaria soleirolii Spreng., Syst. Veg. 4(2): 318. 1827.
Soleirolia corsica Gaudich., Voy. Uranie, Bot. 504. 1830.
Parietaria repens Soleirol ex Mutel, Fl. Franç. Herbor. 3: 172. 1836.
Soleirolia repens Kuntze, Revis. Gen. Pl. 2: 633. 1891.
Hierba perenne, pubescente. Tallos postrados, frágiles, filiformes, de 2-20 cm, radicantes en los nudos, formando matas. Hojas alternas, enteras, cortamente pecioladas, anchamente elípticas, con ápice redondeado y base oblicua, de 2-7 x 1,2-4 mm, bi o trinervadas, con cistolitos en el haz. Flores solitarias, axilares, pediceladas, unisexua- les, tetrámeras, actinomorfas. Flores masculinas con un involucro de tres brácteas estrechas de 0,7-1 mm, libres hasta casi la base; perianto campanulado de 1-1,3 mm, con cuatro segmentos unidos hasta la mitad; cuatro estambres. Flores femeninas rodeadas por un involucro formado por tres brácteas acuminadas, unidas en la parte inferior formando un tubo que rodea al perianto tubuloso, de 0,5-0,8 mm, con cuatro lóbulos muy cortos; ovario súpero, unilocular, uniovulado; estilo corto y estigma penicilado. Aquenios 0,7-1,0 x 0,6 mm, ovoideos, lisos, brillantes, de color castaño claro, incluidos en el perigonio, rodeado por el involucro, con pelos uncinados en la quilla de las brácteas.
Iconografía.- Paiva, 1993: lám. 76; Boufford, 1997; Preston y Woodland, 2012.
Nombres vulgares.- “Colchón de novia”, “lágrimas de ángel”, “lágrimas de bebé”, “musgo irlandés”, “Soleirolia” (Argentina, España); “lagrimitas” (México); “baby’s- tears”, “angel’s tears” (inglés, Estados Unidos de Norteamérica), “mother of thou- sands”, “mind your own business”, “Irish moss” (inglés, Gran Bretaña, Irlanda, Nueva Zelanda).
Distribución y hábitat.- Nativa de las islas del Mediterráneo occidental: Córcega, Cerdeña, Capraia y Mallorca (Paiva, 1993). Cultivada como ornamental en numero- sos países del mundo, en algunos naturalizada, en otros considerada casual o maleza (GCW, 2007). En Europa ha sido introducida en España y Portugal, Italia peninsular, Francia, Gran Bretaña, Irlanda y Holanda (Clapham et al., 1987; Paiva, 1993). En Gran Bretaña ha sido cultivada particularmente en el SO de Inglaterra y de Irlanda en rocallas y en invernáculos, naturalizada sobre muros y sitios húmedos (Clapham et al., 1987). En la Península Ibérica habita en entradas de cuevas, taludes, roquedales, etc. (Paiva, 1993). En Oceanía, ha sido comúnmente cultivada en Victoria (Australia) en rocallas y senderos, y ocasionalmente se escapa de cultivo (Entwisle y Gebauer, 1996); en Nueva Zelanda se la encuentra en jardines y céspedes y como maleza de viveros (Webb et al., 1988). En América del Norte ha sido registrada en California desde 1940, y también en Baja California, México (Boufford, 1997; Preston y Wood- land, 2012), donde es considerada maleza de céspedes, jardines, veredas, y otros sitios húmedos y sombreados. En América del Sur ha sido citada en Perú y Chile (Rodriguez et al., 2018; Zuloaga et al., 2019; Tropicos, 2023). En Argentina, donde es cultivada como ornamental, fue hallada en la provincia de Buenos Aires como espontánea. Desde 1989, en la ciudad de Azul, se tienen registros sobre su presencia habitando en muros, probablemente en proximidades de antiguos cultivos. En 2021 se observó que esta población se había mantenido pero el tamaño se incrementó muy poco, sin avanzar hacia otros sitios, aunque transcurrieron más de tres décadas (Fig. 6A-B). En Mar del Plata (Fig. 6C) se la encontró en paredes, entre mosaicos y en las entradas de edificios junto con Bellis perennis L., especie ornamental recientemente reportada como espontánea en la provincia de Buenos Aires (Vercelli et al., 2022). En Olavarría se la halló en el borde de un cantero (Fig. 6D).

Fig. 5 Parietaria judaica. Diversidad de formas y tamaños de hojas. A) Ovadas mayores de 4 cm de largo (Goyenetche 2, FAA 11236). B) Lanceoladas (Goyenetche 11, FAA 11251). C) Ovadas menores de 2 cm de largo (Goyenetche 7, FAA 11233). Escala = A-C: 2 cm. Fig. 5. Parietaria judaica. Diversity of leaf shapes and sizes. A) Ovates larger than 4 cm long (Goyen- etche 2, FAA 11236). B) Lanceolate (Goyenetche 11, FAA 11251). C) Ovates smaller than 2 cm long (Goyenetche 7, FAA 11233). Scale = A-C: 2 cm.
Usos.- Ornamental, cultivada en canteros como cubresuelos o en macetas (Dimitri, 1987).
Fenología.- Se realizó un seguimiento durante todo el año y se determinó que en Azul, provincia de Buenos Aires, florece solo en los meses de octubre y noviembre, y presenta frutos en noviembre y diciembre.
Observaciones.- Aunque fructifica, también es posible la reproducción vegetativa.
Estado de invasión.- Podría ser clasificada como casual, aunque en algunos sitios las pequeñas poblaciones persisten desde hace más de 30 años. Su avance es muy len- to desde la población inicial; no obstante, se observaron nuevos individuos. Es poco probable que su persistencia se deba a la intervención humana o a introducciones repetidas, debido a que algunos de los sitios donde se hallaron los ejemplares eran viviendas desocupadas desde hace años. Es posible que la población no se expanda debido al hábitat restringido espacialmente que generan los muros antiguos donde habita o incluso el hábitat requerido por la especie para prosperar. Por lo tanto, según los criterios de Pyšek et al. (2004) es dificultoso clasificarla como naturalizada o como casual, o podría tratarse de una naturalización reciente. Si se tiene en cuenta la clasificación de Blackburn et al. (2011), se la podría incluir en la categoría C3 “indi- viduos que sobreviven en las localidades donde fueron introducidos, se reproducen, y las poblaciones son autosustentables”. En cuanto a la clasificación sobre impactos sobre el ambiente (Blackburn et al., 2014), se categoriza como mínimo (no afecta poblaciones de especies nativas y se desconoce si interactúa con polinizadores, plagas o incide en enfermedades de especies nativas). Dado que se la cultiva desde hace décadas (Dimitri, 1987), es probable su naturalización en otras ciudades argentinas.

Fig. 6 Soleirolia soleirolii. Diversos hábitats urbanos. A) En pared (Azul). B) En gabinete de gas (Azul).C) En borde de cantero junto a Bellis perennis (Mar del Plata). D) En borde de pared (Olavarría).Fig. 6. Soleirolia soleirolii. Various urban habitats. A) On the wall (Azul). B) In gas cabinet (Azul). C) On the edge of the planter next to Bellis perennis (Mar del Plata). D) On the edge of the wall (Olavarría).
Material examinado.- ARGENTINA. Prov. Buenos Aires, Pdo. Azul, Azul, 36°46’S 59°51’W, en pared, 10-X-1989 (fl), Scaramuzzino s.n. (FAA 10150), 13-VI-2021, Scara muzzino s.n. (FAA 11882), 04-VII-2021, Scaramuzzino s.n. (FAA 11766), 21-X-2021 (fl), Scaramuzzino s.n. (FAA 10949), 30-XI-2021 (fr), Scaramuzzino s.n. (FAA 11250), 23-I- 2022, Scaramuzzino s.n. (FAA 10961), 21-IV-2022, Scaramuzzino s.n. (FAA 11761), 15- V-2022, Scaramuzzino s.n. (FAA 11916), 29-XII-2021, Scaramuzzino s.n. (FAA 11983). Pdo. Gral. Pueyrredón, Mar del Plata, 38°02’S 57°32’W, 11/XII/2022 (fr), Vercelli s.n. (FAA 12301). Pdo. Olavarría, Olavarría, 36°54’S 60°19’O, 19/XII/2022, Vercelli s.n. (FAA 12302).

Fig. 7 Soleirolia soleirolii. A) Hojas (Scaramuzzino s/n, FAA 11916). B) Flor (Scaramuzzino s/n, FAA 10150). C) Fruto (Scaramuzzino s/n, FAA 10961). Escala = A-B: 1 mm; C: 0,5 mm..Fig. 7. Soleirolia soleirolii. A) Leaves (Scaramuzzino s/n, FAA 11916). B) Flower (Scaramuzzino s/n, FAA 10150). C) Fruit (Scaramuzzino s/n, FAA 10961). Scale = A-B: 1 mm; C: 0.5 mm.
DISCUSIÓN Y CONCLUSIONES
Las distribuciones registradas de las dos especies estudiadas sugieren diferencias en el potencial invasor. S. soleirolii ha sido hallada sólo en ambientes restringidos de áreas urbanas. En las ciudades la alta fragmentación de hábitats reduce el tamaño e incrementa el aislamiento de las poblaciones, al limitar la expansión y la polini- zación; sin embargo, si la presión de propágulos es alta, este efecto puede reducirse (Potgieter y Cadotte, 2020). En este caso, los muros y escalinatas donde se hallaron las poblaciones naturalizadas están rodeados de otras construcciones que no favorecen el establecimiento de flora espontánea. Además, la presión de propágulos es baja, ya que en Azul sólo se ha observado fructificación durante dos meses por año. Por el contrario, P. judaica presenta un largo período de floración, que es coincidente con lo que ocurre en otros países como Grecia (Fotiou et al., 2011); sumado a que es anemófila y autocompatible (Fotiou et al., 2011), por lo tanto, con un largo período de fructificación y muy alta presión de propágulos. Asimismo, el transporte dentro de las ciudades y hacia su periferia se facilita por la variedad de agentes de dispersión de los aquenios: viento, agua, adhesión a ropas o pelaje de los animales (debido a los tricomas del perianto y de brácteas), calzado y maquinaria (Bass y Bass, 1990).
El tiempo de residencia es el tiempo desde la introducción de un taxón en una nueva región; cuanto más tiempo está presente una especie exótica en el territorio, es mayor la probabilidad de distribuirse en una superficie más grande (Richardson y Pyšek, 2006). Como generalmente no se conoce exactamente el año en que el taxón fue introducido, se emplea el “tiempo mínimo de residencia” que se determina a partir de ejemplares de herbario u otros datos confiables (Rejmánek et al., 2005). P. judaica está presente en Argentina desde fines del siglo XIX (Hicken, 1910), en el noreste de la provincia de Buenos Aires desde hace casi 100 años (Molfino, 1926) y en el centro de la provincia desde hace al menos 33 años. En este trabajo se confirmó su presencia en la provincia de Buenos Aires, distribución no considerada en Flora Argentina (Anton y Zuloaga, 2023), y además se incrementó el número de localidades tanto en el norte, centro y sur de la provincia. Por el contrario, S. soleirolii no había sido registrada como cultivada en la primera edición de la “Enciclopedia Argentina de Agricultura y Jardinería” (Parodi, 1959), por lo que aparentemente se ha introdu- cido en las últimas décadas, aunque en el centro de la provincia de Buenos Aires se ha hallado adventicia desde hace más de 30 años. Por lo tanto, podría asumirse que el tiempo de residencia de P. judaica en la Argentina es mayor que el de S. soleirolii. No sólo el tiempo de residencia y la distancia al foco de invasión (Pyšek et al., 2004) permiten considerar a P. judaica como invasora; el amplio espectro de hábitats en que se ha establecido hace que se la pueda calificar como E (especies completa- mente invasoras, Blackburn et al., 2011). Se sitúa en muros de numerosas construc- ciones (viviendas, tumbas, estacionamientos, etc.), tanto en la base como en la parte superior y en grietas, también en veredas y otras ubicaciones. Asimismo, ha sido observada en localidades serranas (Tandil, Sierras Bayas, Sierra de los Padres), muy próximas a los afloramientos rocosos y bajo aleros, lo que podría afectar a especies nativas del Sistema de Tandilia adaptadas a estos microambientes húmedos y som- bríos como Calceolaria parviflora Benth., Cheilanthes hieronymi Herter, Elaphoglossum gayanum (Fée) T. Moore y otros helechos (Frangi, 1975). En otros países, no sólo se ha establecido en muros, orillas de cursos de agua y sitios disturbados y áreas serra- nas, sino también en acantilados costeros, comunidades sombreadas y huertas (Bass y Bass, 1990; Fotiou et al., 2011; Preston y Woodland, 2012), y es posible que ocupe nuevos ambientes. La expansión de las áreas urbanas, como también los actuales procesos de lignificación en ambientes que naturalmente carecían o presentaban escasas especies arbóreas (Yansen y Biganzoli, 2022), probablemente serán factores que contribuirán a la expansión de esta especie en Buenos Aires y en otras provincias argentinas, si se tiene en cuenta que también se establecen bajo árboles, espontáneos o cultivados (Dawson, 1967; Delucchi y Torres Robles, 2006; Sirolli y Kalesnik, 2015), en cercos y jardines, o como epífitas según se ha observado en este trabajo. Además, Fotiou et al. (2011) concluyeron que el aumento de temperaturas debido al cambio climático podría favorecer un período de floración aún más amplio y por lo tanto mayor cantidad de polen en el aire, y mayor habilidad para expandirse hacia nuevos ambientes.
Tanto en la provincia de Buenos Aires como en California (Boufford, 1997), la distribución de P. judaica no es continua, sino en localidades dispersas, que actuarían como sitios de propagación hacia áreas periurbanas y rurales (Potgieter y Cadotte, 2020), pero probablemente las localidades estén interconectadas por las vías férreas, dado las observaciones efectuadas en la ciudad de Azul y en otras ciudades. Estas vías de ingreso, combinadas con los numerosos agentes de dispersión de los aquenios (Bass y Bass, 1990), asegurarían el avance hacia nuevos sitios. Hacia ciudades más alejadas, el transporte en contenedores de plantas podría ser otra vía de ingreso, ya que en la provincia de Mendoza se la ha registrado en viveros (Martínez Carretero, 2015).
En Argentina se han efectuado algunos estudios sobre esta especie. Orfila et al. (1980) realizaron una descripción detallada de caracteres morfológicos externos, anatomía de la hoja y del tallo, como también análisis químico para valorar el con- tenido de nitratos con material coleccionado en la Ciudad Autónoma de Buenos Aires. Asimismo, Fernandez Honaine et al. (2018) analizaron la morfología de los silicofitolitos de P. judaica, demostrando asociaciones con otras especies de Urtica- ceae, y contribuyendo así a la interpretación del registro fitolítico. Sin embargo, no se ha hecho referencia a la relación de su polen con alergias, tal vez por desconoci- miento de la distribución geográfica de la especie o por haber sido confundida con
P. officinalis. Esto se ha mencionado para la familia Urticaceae en general (Nitiu et al., 2019), pero no se cuenta con investigaciones en particular sobre la especie. Por lo tanto, es importante conocer su distribución geográfica actual en la Argentina y los hábitats que ocupa, que en su mayoría son ambientes urbanos. Podría afectar la salud de un gran número de personas, dado que el 92% de la población de la Argen- tina es urbana (DNP, 2022).
Las dos especies difieren también en sus usos. Mientras que P. judaica tiene uso medicinal (Paiva, 1993; Puentes, 2017), S. soleirolii es ornamental, generalmente utilizada en canteros. Para otras regiones se han documentado las plantas cultivadas con este fin que son invasoras o potencialmente invasoras (Rovere, 2022). Si bien actualmente ese riesgo es bajo, es conveniente monitorear sus poblaciones, dado que son numerosas las plantas ornamentales que se han naturalizado recientemente en Argentina o que han ampliado su distribución a partir de nuevos focos de invasión (Hurrell et al., 2012; Delucchi et al., 2016; Jocou et al., 2019; Scaramuzzino, 2019; Scaramuzzino et al., 2019; Keller et al., 2021; Carbone et al., 2022; Vercelli et al., 2022).
Es importante dar a conocer los focos iniciales de naturalización de Soleirolia soleirolii en la Argentina y, si bien la presión de propágulos y sus requerimientos de hábitat hacen que probablemente no sea una especie con alto potencial invasor, su presencia incrementa el número de especies exóticas ornamentales en vías de natu- ralizarse. Por el contrario, P. judaica presenta una alta presión de propágulos, ocupa diversos hábitats, se la halla en numerosas ciudades de la provincia de Buenos Aires y avanza probablemente por las vías del ferrocarril, por lo tanto, su potencial invasor es alto. Teniendo en cuenta que monitorear la propagación de especies previamente reportadas puede ser una herramienta útil para establecer medidas de erradicación antes de que se vuelvan invasoras y dañinas (Arana et al., 2020), se considera que los aportes de este trabajo son de relevancia en especial para esta especie que potencial- mente afecta la salud humana. Se recomienda su inclusión en el listado de especies invasoras de la Argentina (Resolución 109/2021, Ministerio de Ambiente y Desarrollo Sostenible), donde aún no ha sido mencionada, tal vez por el desconocimiento de su distribución y de su polen alergógeno.














