Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. vol.1 no.1 Ciudad Autónoma de Buenos Aires ene./mar. 2006
INTERCONSULTAS EN INSUFICIENCIA CARDIACA
Insuficiencia cardíaca relacionada a quimioterapia
Nuevo enfoque
Alfredo D'Ortencio* y Alfredo Navigante**
* Jefe de Cardiología y Director de la UDH del Instituto "Dr. Angel Roffo". Facultad de Medicina, UBA, Buenos Aires, Argentina.
Coordinador del Dpto. de Insuficiencia Cardíaca y Trasplante Cardíaco del Sanatorio Güemes. Ciudad de Buenos Aires. Rep. Argentina.
** Médico clínico oncólogo del Instituto "Dr. Angel Roffo", Facultad de Medicina, UBA. Ciudad de Buenos Aires. Rep. Argentina.
Correspondencia: Dr. Alfredo D'Ortencio
Instituto Dr. Angel Roffo. Av. San Martín 5481 (1417) Ciudad de Buenos Aires. Rep. Argentina.
E-mail: adortencio@intramed.net; udh@institutoroffo.com.ar
Trabajo recibido: 20/02/06
Trabajo aprobado: 29/03/06
Introducción
El cáncer es una enfermedad que ha tenido una expansión correlativa al desarrollo tecnológico en occidente; la curación de una amplia gama de enfermedades infecciosas conjuntamente con el control de enfermedades cardiovasculares, la multiplicidad de agentes físicos y químicos con potencial carcinogenético durante las eras industrial y postindustrial, sumado a la campaña agresiva de la industria tabacalera luego de la Segunda Gran Guerra dejando subsumida a la adicción al cigarrillo a amplios segmentos poblacionales, son factores que determinaron un aumento de la tasa de prevalencia1. Si bien las enfermedades cardiovasculares se consideran la primera causa de muerte en occidente, en estudios donde se exige que la palabra cáncer figure en los certificados de defunción, ésta es la principal causa de muerte2. Si bien la tasa de curabilidad no ha variado significativamente en los últimos veinte años, actualmente, las personas con cáncer tienen mayor expectativa de sobrevida y control de su enfermedad, esto más que por el descubrimiento de nuevas drogas se debe a un mejor conocimiento de las estrategias terapéuticas: empleo de quimioterapia (QT) y radioterapia (RT) concurrente, poliquimioterapia en vez de monoquimioterapia y mejor soporte clínico de estos tratamientos. Trayendo aparejado nuevas perspectivas en la planificación de tratamientos. En este tema, el rol del cardiólogo es esencial para la valoración basal, valoración durante el tratamiento y posterior al mismo, de los pacientes con esquemas de poliquimioterapia que tengan potencial cardiotoxicidad.
Historia
Las antraciclinas son las principales drogas que causan insuficiencia cardíaca (IC). Las pobladas tablas de drogas que producen cardiotoxicidad tienen escasa aplicación, no son conceptuales y confunden más que lo que aclaran; hay que tener en cuenta que la Administración de Alimentos y Drogas (FDA) de Estados Unidos (EUA), por ley, indica que el prospecto del medicamento debe llevar aún las toxicidades inusuales e infrecuentes (1%) posiblemente relacionadas a la droga, por otro lado hay toxicidades no descriptas para programas de tres drogas en relación a cada droga por separado, y cuando aparecen al combinarlas se las adjudican a las tres (ej.: síndrome de Raynaud para vinblastina (Vb) + cisplatino + bleomicina en cáncer no seminomatoso de testículo). Por ello, nos abocaremos a las drogas que producen IC con determinada acumulación de dosis a más del 10% de la población tratada. La primera antraciclina utilizada fue la daunorrubicina, una de las principales drogas en la fase de inducción del tratamiento de la leucemia mieloide aguda, desarrollada durante la segunda parte de la década del sesenta, dosis acumulativa entre 800-1200 mg/m2 de superficie corporal desarrollaba IC en el 10% pacientes tratados. Si la modalidad era aguda, el patrón era de cardiomiopatía restrictiva en niños; si se presentaba luego del año era miocardiopatía dilatada (especialmente en adultos, ya sea aguda como crónica). En la década de los setenta se desarrolló e implementó en el terreno clínico la 4-hidroxidaunorrubicina.La hidroxilación del C4 del anillo central de semiquinona trajo aparejado un cambio en el espectro antitumoral, siendo efectiva en tumores sólidos, esta droga se conoce como adriamicina o doxorrubicina3, 4.
La prueba clínica donde la adriamicina producía IC fue al desarrollarse el esquema CYVADIC (ciclofosfamida, vincristina, adriamicina, DTIC) para sarcoma de partes blandas, en 1979. La mayoría de los pacientes eran adolescentes y adultos jóvenes y la dosis acumulativa de adriamicina era de 1200 mg/m2. Aproximadamente, el 17% de la población tratada desarrolló IC; implementándose a partir de allí la fracción de eyección ventricular izquierda (FEVI) medida por centellografía para predecir y evaluar cardiotoxicidad, en base a ello se determinó como dosis limitante acumulativa 550 mg/m2, donde se esperaba que un 10% de los pacientes desarrollaran IC5 al acumular esta dosis.
Adriamicina como paradigma de insuficiencia cardíaca y antineoplásicos
La adriamicina es un antineoplásico de amplio espectro, su rol es central en la probabilidad de curación de linfoma no Hodgkin (LNH) de alto grado -esquemas: CHOP; MACOP-B, COPBLAM, HiperCHOP-, enfermedad de Hodgkin (EH) -esquemas: ABVD, COPP-ABVD, BEACOP-, cáncer de mama -esquemas: adriamicina como monoquimioterapia, FAC, AC, AT, secuencial CMF-AC, secuencial AC-T-, sarcomas óseos -esquemas: AP, VAC, VACA-, sarcoma de partes blandas -esquema: adriamicina como monodroga-; cáncer de pulmón a células pequeñas - esquema: VAC-; carcinoma nasofaríngeo indiferenciado (asociado al virus de Epstein Barr) -esquemas: VAC, VAP-.
Lo más relevante de este espectro de acción es que no se ha podido reemplazar a la adriamicina por otra droga sin que disminuya la efectividad del esquema o una neoplasia potencialmente curable se torne incurable, esto es categórico en particular para el cáncer de mama y linfomas6, 7. Esto lleva a que la ecuación costo/ beneficio sea insoslayable a la hora de indicar adriamicina.
Factores a tener en cuenta al evaluar cardiotoxicidad
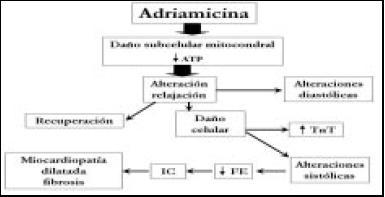
1) Mecanismo de Acción. La adriamicina tiene un núcleo central similar a la estructura pentano-per-hidrofenantreno, denominado semiquinona, el metabolismo del mismo por el sistema de la monooxigenasa de función mixta del hígado (citocromo P-450 oxidasa/reductasa) lleva a la formación de radicales libres: peróxido de hidrógeno que se unen a complejos estables de adriamicina-hierro que a su vez son antagonizados por enzimas del tipo de superóxido dismutasa y catalasas. El miocardio carece de catalasas por 1o cual es débil ante la adriamicina, tampoco la fibra miocárdica expresa (como otros tejidos normales tales como el túbulo contorneado proximal del riñón o las microvellosidades del intestino delgado) la glicoproteína P-170, una glicoproteína de 12 subunidades que funciona mediante una ATPasa Ca/ Mg dependiente (tipo supercassete: modulada por calmodulina) que extruye adriamicina de la célula alterando la ecuación C x T (C: concentración; T: tiempo) y liberándose rápidamente de la droga (éste es uno de los principales mecanismos de resistencia de la célula del cáncer de mama); por ende va a producir daño orgánico en el miocardio. Daño que primero es subcelular (daño mitocondrial y de miofibrillas) y luego celular, afectando la función de bomba del corazón. No se conoce cuando las alteraciones histológicas tienen un correlato clínico, la biopsia endomiocárdica se quiso tomar como método seguro para predecir cardiotoxicidad, pero los cambios de alteraciones en la mitocondria a nivel de microscopia electrónica y el edema de miofibrillas no correlacionaban con la IC. También, a partir de estudios en ratas donde se observó que la IC se producía cuando la adriamicina presentaba daño denervatorio cardíaco, llevó a que se utilizara en clínica las pruebas denervatorias para pacientes diabéticos en pacientes con cáncer de mama que recibían esquemas con adriamicina, sin resultados trascendentes8, 9.
2) Tratamientos concurrentes. a) La radioterapia en el caso de pacientes con EH que efectúen tratamiento secuencial de RT tipo Manto + ABVD, conlleva un mayor riesgo de desarrollo de IC, disminuyendo la dosis límite de adriamicina a 400-450 mg/m2. No obstante la dosis total recibida por estos esquemas está entre 100 y 200 mg/m2 total de adriamicina. La RT depende de la dosis, el volumen y tiempo de irradiación, cuando como este caso se irradia mediastino, la porción sensible del corazón es la embocadura de las arterias coronarias en las válvulas sigmoideas, el daño coronario que produce coadyuva como factor de IC, por el daño a la fibra cardíaca producida por adriamicina10.
b) El empleo conjunto de otros quimioterápicos: consideramos destacar en este ítem:
i) Ciclofosfamida. A dosis convencionales entre 600 mg/m2 y 750 mg/m2 no produce IC como con altas dosis en el contexto de transplante autólogo de Médula Osea (TAMO)= 3 grs/m2. No obstante el empleo de dosis convencionales en cáncer de mama, y linfomas tanto no Hodgkin como Hodgkin están comprendidas en regímenes de poliquimioterapia con adriamicina, esto hace que aumente la cardiotoxicidad y se reduzca al igual que RT, la dosis acumulativa a 400-450 mg/m2, una vez más referimos que en la actualidad en cáncer de mama la dosis acumulativa es de 240 mg/m2 y de 300 rag/m2 en linfomas, es decir lejos de 400- 450 mg/m2 que se tomaría como cifra de seguridad de dosis acumulativa. No es diferente el caso de los otros tumores señalados que se utiliza adriamicina, y que son mucho menos frecuentes11.
ii) Taxanos. Tanto el paclitaxel o taxol -nombre dado por el National Cancer Institute (NCI) cuando lo descubrió de la raíz de la Taxus brevifolia en 1961- (taxol es el nombre comercial) como el docetaxel no producen IC "per se", como tantas drogas al interactuar con el ritmo cardíaco -puede producir bloqueo auriculoventricular de 2º grado- se trasladó a signarlo como capaz de producir IC cuando no hay ninguna base científico-clínica al respecto. El paclitaxel es ampliamente utilizado junto con la adriamicina en el cáncer de mama. Cuando el paclitazel se infunde antes que la adriamicina bloquea los pasos metabólicos de detoxificación de ésta, logrando un mayor steady state en su cinética con el consiguiente mayor tiempo de exposición del miocardio, por ello la indicación es administrar primero la antraciclina y luego la infusión de paclitaxel12.
iii) Trastuzumab. Se trata de un anticuerpo monoclonal quimérico dirigido contra una proteína de membrana de la célula de cáncer de mama codificada por el oncogen Her/neu 2 que cumple un rol en la expansión del clon tumoral. La administración por vía endovenosa del anticuerpo en aquellas pacientes que tienen elevada expresión de la proteína conjuntamente con quimioterapia ha llevado a una notoria mejoría en la tasa de control y sobrevida de esos pacientes con cáncer de mama. En un primer momento se consideraba al anticuerpo potencialmente cardiotóxico, luego de dos principales ensayos clínicos se ha clarificado que la cardiotoxicidad manifestada como IC se produce hasta en un 17% de pacientes que reciben trastuzumab asociado a poliquimioterapia que incluye adriamicina. Cuando el trastuzumab se administra sin adriamicina, la cardiotoxicidad global (no solo IC.) es menor al 4%13.
Clínica de la miocardiopatía asociada a adriamicina
La presentación clínica de la cardiotoxicidad asociada a antraciclinas, míocardiopatía, puede presentar tres formas14:
A- Toxicidad aguda: muy poco frecuente, se manifiesta como taquicardia sinusal, supraventricular, extrasístoles ventriculares, miopericarditis, alteraciones agudas en el ECG, IC diastólica y/o sistólica o muerte súbita15.
B- Miocardiopatía subaguda: aparece generalmente entre los 3 a 8 meses de la última dosis y en forma de IC congestiva por míocardiopatía dilatada.
C- Míocardiopatía tardía o crónica: se presenta clínicamente luego de 5 años de finalizado el tratamiento, como una míocardiopatía dilatada difícil de diferenciar de las otras etiologías y con signos de IC congestiva.
Los mecanismos de producción de estas 3 formas deben ser diferentes. La ruptura de la membrana del miocito con el pasaje de las proteínas intracelulares a la sangre, traducida como elevación de tropononina T e I se presenta más frecuentemente en la forma aguda, su rol en la crónica no está bien establecido16.
Se ha visto una buena correlación de la elevación enzimática con las alteraciones de la función diastólica del VI medida por ecocardiografía Doppler y esta última con los signos clínicos de IC (disnea, rales, R4.e hipertensión venosa en Rx.)17.
La disfunción diastólica se produce como consecuencia del aumento de la rigidez de la pared ventricular, esto hace que aumente la presión de fin de diástole del ventrículo izquierdo (PFDVI), la presión media de AI y la presión media del capilar pulmonar con la consecuente congestión pulmonar.
Las etiologías más frecuentes de la disfunción diastólica son la hipertensión arterial y la enfermedad coronaria, pero también se presenta en las miocardiopatías: hipertrófica, restrictiva, isquémica, dilatada o por toxicidad por antraciclina.
Se deben mencionar las valvulopatías con dificultad al vaciamiento auricular como estenosis mitral y tricuspídea y a las sobrecargas de volumen como insuficiencia aórtica, mitral, fístulas A-V y por último a la pericarditis constrictiva como otra dificultad al llenado ventricular.
La disfunción diastólica se sospecha cuando aparecen síntomas o signos de IC (disnea, taquicardia sinusal sin causa aparente) en pacientes con FE mayor del 40%18. Es un fenómeno extremadamente complejo porque depende de la carga, la frecuencia cardíaca, es difícil de evaluar en pacientes con fibrilación auricular o trastornos de conducción y además sus parámetros se superponen con los de sujetos normales y sanos.
La ecocardiografía Doppler color se presenta como el único método de uso práctico que ofrece un importante número de índices de función diastólica19.
Definimos a la disfunción diastólica con la medición del tiempo de relajación isovolúmica (TRIV), tiempo de desaceleración del llenado ventricular rápido (TDLLVR) y la relación entre la velocidad máxima del lleno ventricular rápido y la velocidad máxima de la sístole auricular (Rel E/A):
1- Patrón de relajación prolongada: TRIV mayor a 90 mseg. TDLLVR mayor a 240 mseg. Relación E / A menor a 1.
2- Patrón normal o pseudonormal: TRIV 55 a 90 mseg. TDLLVR 150 a 240 mseg. Relación E/A mayor a 1.
3- Patrón restrictivo: TRIV menor a 55 mseg.
TDLLVR menor a 150 mseg. Relación E/A mayor a 1,6.
El tratamiento incluye antagonistas cálcicos, beta bloqueantes y diuréticos a bajas dosis, la digital puede ser deletérea por disminuir la complacencia del VI, la diuresis excesiva y los vasodilatadores pueden ser perjudiciales.
Debemos tener en cuenta, sobre todo durante la administración, que la cardiotoxicidad puede manifestarse en sus inicios, tanto en forma asintomática como sintomática, y que lleva con el tiempo a un progresivo deterioro de la función ventricular que comienza siendo diastólica por rigidez de la pared, luego sistólica, terminando en IC congestiva por una míocardiopatía dilatada. Junto a los signos de congestión pueden asociarse severas arritmias como taquicardia ventricular, fibrilación ventricular o muerte súbita.
El seguimiento se debe realizar con:
1- Historia clínica.
2- ECG.
3- Rx de tórax.
4- Ventriculograma radioisotópico.
5- Ecocardiografía con Doppler.
6- Dosaje de troponina T.
7- Biopsia endomiocárdica.
Fisiopatología de la contracción-relajación cardíaca
El proceso se inicia con la activación de los receptores beta 1 y beta 2 del sarcolema por sus agonistas adrenalina y noradrenalina20.
La contracción cardíaca (fenómeno mecánico) se inicia luego de la despolarización del potencial de acción (fenómeno eléctrico), por la entrada de una pequeña cantidad de calcio a través del sarcolema a través de los canales lentos, desencadenando la liberación del calcio de los depósitos intracelulares en el retículo sarcoplásmico. La concentración del calcio ionizado aumenta con rapidez.
El acoplamiento excitación-contracción está modulado por el AMP cíclico o segundo mensajero, nucleótido que activa una serie de proteinquinasas que producen la fosforilación de las proteínas en varios sitios subcelulares, incluidos el sarcolema, el retículo sarcoplásmico y el complejo troponina-tropomiosina, regulador de los miofilamentos.
Otros segundos mensajeros que pueden modular el acoplamiento excitación-contracción son el trifosfato de inositol (libera calcio del retículo sarcoplámico) y el diacilglicerol (activa varios procesos enzimáticos como la fosforilación de la miosina de cadena liviana y el intercambio sodio-hidrógeno).
El resultado final es un cambio de conformación en las proteínas reguladoras de los miofilamentos, que en presencia de niveles adecuados de ATP, producen la activación de los puentes de intercambio metabólico entre actina y miosina para dar origen a la contracción.
La relajación también demanda energía, requiere de un bombeo de calcio en contra de un gradiente de concentración del citoplasma al retículo sarcoplásmico y consume del 15 al 30% del total de la energía requerida.
La Ca++ ATPasa del retículo sarcoplásmico es responsable de la hidrólisis del ATP y de la provisión de energía necesaria para retener el calcio en este almacenamiento. Si se deprime esta enzima, la velocidad de absorción del calcio por parte de retículo sarcoplásmico se reduce y se afecta la relajación del miocardio. Los antraciclínicos actúan sobre la cadena respiratoria mitocondrial con menor producción de energía21.
Es lo que se conoce como daño subcelular y es lo que provoca la dificultad de la relajación con la consiguiente alteración de la función diastólica (Esquema 1).
Los mecanismos por los cuales esta disfunción diastólica puede retrogradar o transformarse en sistólica no están bien establecidos, como tampoco se sabe como llega a establecerse la dilatación tardía ventricular.
En nuestro Instituto definimos a la disfunción sistólica cuando:
1- Se produce una caída de la FE mayor de un 10 % de la medición basal en reposo previa al inicio de la administración.
2- O disminución de la FE a menos del 50 % en cualquier momento de su utilización.
El tratamiento de la IC sistólica y congestiva de la míocardiopatía dilatada en sus distintos grados es, por todos conocida, no difiere de lo habitual y excede los motivos de la presentación por lo que se omite desarrollar.
Demostrada la míocardiopatía se pueden utilizar diuréticos, IECA, beta bloqueantes, espirinolactonas, y digital. Si hay curación o estabilidad de la enfermedad oncológica y la míocardiopatía se encuentra en su etapa terminal se puede considerar el trasplante cardíaco22, 23.
Valoración y seguimiento cardiológico
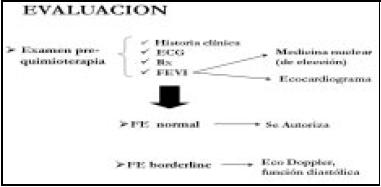
En la valoración cardiológica previa al inicio de la quimioterapia se debe establecer no sólo si el paciente está en condiciones de recibir antraciclinas; sino además, que grado de riesgo tiene para cardiotoxicidad, estableciendo las categorías de pacientes sin factores de riesgo (FR) y con factores de riesgo y estos últimos en bajo, moderado o alto riesgo.
Los factores de riesgo para cardiotoxicidad son:
A- Dosis dependiente del quimioterápico.
B- Esquema de administración.
C- Presencia de cardiopatía previa.
D- Edad (mayor riesgo en niños y ancianos).
E- Irradiación mediastinal previa.
F- Asociación de quimioterápicos.
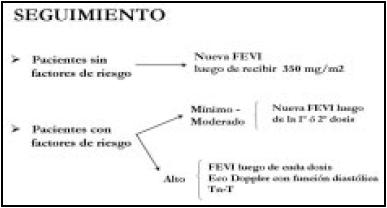
Como se observa en los Esquemas 2 y 3, se propone a los pacientes sin FR realizar el seguimiento con una medición de la FEVI realizada en medicina nuclear24, luego de haber recibido 350 mg/ m2 de dosis de adriamicina. La FE medida por ecografía suele presentar la dificultad técnica de no tener el paciente una buena ventana.
La FE medida en esfuerzo no demostró utilidad en medir riesgo de toxicidad.
En los pacientes con FR de grado leve y moderado se sugiere realizar la evaluación de la FEVI, luego de una o dos dosis. En pacientes de alto riesgo, se recomienda realizarla, luego de cada dosis, midiendo además función diastólica por ecocardiografía Doppler color y dosando troponina-T.
Esta estrategia basada en los FR incluye la realización de biopsia endomiocárdica en pacientes en riesgo que necesitan en forma excluyente la utilización de adriamicina25, 26.
También para este grupo se acepta la utilización de dexrazoxane. En la valoración de estos pacientes además del dosaje de troponina T (Tn T) se puede medir los péptidos natriuréticos como marcadores de injuria e IC.
La troponina T se asocia a cambios histopatológicos de la toxicidad, también de severidad y demostró ser predictivo de dilatación del VI27, 28, 29. Sirve además para monitorear la utilidad en la protección del dexrazoxane30, 31.
En general, la Tn T se eleva luego de dosis altas.
Tanto el péptido natriurético cerebral como el auricular están elevados en casos de míocardiopatía por antraciclinas, pero es posterior a la disminución de la función sistólica del VI32.
Intentos farmacológicos de disminuir la toxicidad cardíaca por antraciclinas
1) Desarrollo de antineoplásicos alternativos. Como hemos mencionado anteriormente, ninguna de estas drogas ha demostrado ser superior e igual que la adriamicina para el espectro antitumoral de ésta, por lo que no consideramos de interés extendernos. Mencionaremos las que se utilizaron en mayor número de clinical trials: epiadriamicina, mitoxantrona; mitomicina C. Marcelomicina33.
2) Nuevas formulaciones y ritmos de administración de adriamicina. La formulación liposomal parecería producir menos cardiotoxicidad, no obstante, su elevado costo y la ausencia de menor toxicidad estadísticamente significativa hace que sea utilizado en sarcoma de kaposi por sida donde además dicha formulación tiene mayor efecto antineoplásico y no en el amplio espectro de cáncer de mama y LNH34.
Las infusiones de adriamicina de 96-120 horas muestran una tendencia a menor toxicidad cardíaca pero la probabilidad de mayor riesgo de extravasación hace que en la práctica no haya sido difundida esta modalidad.
3) Recolectores de radicales libres. Partiremos de lo siguiente: si en un sistema de ensayo in vitro se pretende demostrar que una droga recolecta radicales libres, no es improbable hallar el sistema que "pruebe" que la droga recolecta radicales (de aquí la numerosa lista de drogas ensayadas para disminuir la cardiotoxicidad por antraciclina sin ningún beneficio clínico, desde la coenzima Q al tamoxifeno pasando por la vitamina C35,36). La única salvedad puede hacerse con el dexrazoxane, que ha sido aprobada por la FDA en pacientes pediátricos con leucemias agudas y factores de riesgo para cardiotoxicidad. No obstante no se ha podido demostrar, como se creía, notables secuelas cardiopulmonares en pacientes pediátricos sobrevivientes a leucemias y linfomas37. En adultos los resultados de estudios comparados y randomizados son contradictorios y no está totalmente descartado que dexrazoxane tenga potencial de inducir el crecimiento tumoral38.
Experiencia en el Instituto "Dr. Angel H. Roffo"
Nos referiremos aquí a una situación particular que nos devela que la estructuración del saber médico en torno a la cardiotoxicidad por drogas antineoplásicas no tiene aplicación en situaciones originales. Señalamos la asociación de 5 fluoruracilo (5FU) y cisplatino (CDDP) en los cánceres epidermoides de cabeza y cuello. La 5FU ha sido señalada como droga cardiotóxica pero referida principalmente a espasmo coronario o arritmias, no a IC. La CDDP no es considerada una droga potencialmente cardiotóxica.
No obstante el empleo en la población de pacientes señalados conlleva potencial cardiotoxicidad, principalmente por la utilización de hiperhidratación con solución fisiológica y manitol al 15% en la aplicación de CDDP para disminuir la potencial nefrotoxicidad. Estos, en general son pacientes con enfermedad pulmonar obstructiva crónica e IC derecha, por lo que la evaluación y seguimiento cardiológicos son esenciales.
Agradecimientos
Los autores agradecen a los Dres. Ricardo Cortés, Aída Nuñez y a la Srta. Ticiana D'Ortencio por su ayuda en la elaboración y corrección del trabajo.
1. Navigante A. Bioética de la terminalidad en los enfermos de cáncer en la República Argentina. Tesis Doctoral. Facultad de Medicina. UBA. 5-42, Mayo 2000. [ Links ]
2. Angell M. The supreme court and physician-assisted. The ultimate right? N Engl J Med 1996; 335:1676-8. [ Links ]
3. Floyd J, Nguyen D, Lobins R et al. Cardiotoxicity of cancer therapy. J Clin Oncol 2005; 23: 7685-96. [ Links ]
4. Doll D, List A, Greco A, et al. Acute vascular ischemic events after cisplatinbased combination chemotherapy for germ-cell tumors of the testis. Ann Int Med 1986; 105:48-5l. [ Links ]
5. Yang J, Rosenberg S, Glatstein E. et al. Sarcomas of the tissue. In De Vita V. Fleltman S, Rosenberg S. Cancer: Principles & Practice of Oncology. Ed. Lippincott. 4th edition. 1993; 2: 42: 1470-80. [ Links ]
6. Piccart M, Goldhirch A, Gelbet R. Controversies in adjuvant systemic therapy of breast cancer. Educational Book. ASCO. 2002; 138-43. [ Links ]
7. Emmanouilides C, Casciato D, Rosen P. Linfomas Hodgkin y no- Hodgkin. En Casciato D, Lewitz B. Oncología Clínica. Ed Marbin. 4ª edición. 2001; 21: 399-442. [ Links ]
8. Bristow M. Early anthracyclinecardiotoxicity. Am J Med 1978; 65: 823-32. [ Links ]
9. Viniegra M, Marchetti M, Navigante A, et al. Cardiovascular autonomic function in anthracycline-treated breast cancer patients. Cancer Chemother Pharmacol 1990; 26: 227-31. [ Links ]
10. Fischer D, Knobf M, Durivage H, et al. Cardiopulmonary toxicity. The Cancer Chemotherapy Handbook. 6th edition. 2003; I 1:.504-7. [ Links ]
11. Vont Hoff D. Risk factors for doxorubicin-induced congestive heart failure. Ann Int Med 1979; 91: 710-17. [ Links ]
12. Fisher D, Knobf M, Durivage H, et al. Chemotherapy drugs and drugs used in the treatment of cancer. The Cancer Chemotherapy Handbook. 6th edition. 2003; 4: 188-91. [ Links ]
13. Piccart M, Procter M, Leyland-Jones B, et al. Trastuztunab after adjuvant chemotherapy in her-2 positive breast cancer. N Engl J Med. 2005; 353: 6; 1659-72. [ Links ]
14. Floyd J D, Nguyen D T, Lobins R L, Bashire Q,, Doll D C, Perri M C. Cardiotoxicity of cancer therapy. J Clin Oncol 2005; 23: 7685-7696. [ Links ]
15. Bristow MR. Early anthracicline cardiotoxicity. Am J Med 1978; 65: 823-832. [ Links ]
16. Herman E, Lipshultz S, Riffai L, et al. Use of cardiac troponin T levels as an indicator of doxorubicin- induced cardiotoxicity. Cancer Res 1998; 58: 195-197. [ Links ]
17. Cortés R. Cardiotoxicidad por antraciclínas. Tesis doctoral. Universidad Nacional de Córdoba. 2000. [ Links ]
18. Segundo Consenso Uruguayo de Insuficiencia Cardíaca. Sociedad Uruguaya de Cardiología. Suplemento de la Revista Noticias. Organo oficial del Sindicato Médico del Uruguay. Septiembre 2004, 1-16. [ Links ]
19. Rakowski H, Appleton C, Chan K L, Dumesnil J G, et al. Canadian Consensus Recommendations for the measurement and reporting of diastolic dysfunction by echocardiography; from the investigators of Consensus on Diastolic Dysfunction by Echocardiography. J Am Soc Echocardiogr 1996; 9: 736-760. [ Links ]
20. Hosenpud J, Greenberg B. Congestive Heart Failure. Pathophisiology, diagnosis, and comprehensive approach to management. Lippincott Williams & Wilkins, Philadelphia. 2000; 33: 615-627. [ Links ]
21. Feenstra J, Grobbee D E, Remme W J, Stricker B H. Drug- induced Heart Failure. J Am Coll Cardiol 1999; 33 (5): 1152-1162. [ Links ]
22. Armitage J M, Kormos R L, Griffith P P, et al. Heart Transplantation in patients with malignant diseases. J Heart Transplant 1990; 9: 627-629. [ Links ]
23. D'Ortencio AO, Boullon FJ. El Trasplante Cardíaco. 1ª Ed. Arg: Ed Medrano, 1989. [ Links ]
24. Druck M M, Gullenchyn K Y, Evans W K. Radionuclide Angiography and Endomyocardial Biopsy in the assessment of doxorubicin cardiotoxicity. Cancer 1984; 53: 1667-1674. [ Links ]
25. Ferrans V J, Roberts W C. Myocardial biopsy: A useful diagnostic procedure or only a research tool? Am J Cardiol 1978; 41: 965-967. [ Links ]
26. D'Ortencio AO, San Martino J, Berruno L, y col. Hallazgos patológicos en 118 biopsias endomiocárdicas. Rev Arg de Cardiología 1985; 53: 30-35. [ Links ]
27. Lipshultz S, Ottlinger M, Lipsitz S, et al. Predictive value of cardiac troponin- T (cTnT) in pediatric patients at risk for myocardial injury. J Am Coll Cardiol. 1997 (suppl); 29:429A. [ Links ]
28. Cardinale D, Teresa M, Martinoni A, et al. Left ventricular dysfunction predicted by earlie troponin I release after high- dose chemotherapy. J Am Coll Cardiol 2000; 36: 517-522. [ Links ]
29. Cardinale D, Sandri M, Martinoni A, et al. Myocardial injury revealed by plasma troponin I breast cancer treated with high- dose chemotherapy. Ann Oncol. 2002; 13: 710-715 [ Links ]
30. Herman E H, Zhang J, Rifai N, et al. The use of serum levels of cardiac troponin T to compare the protective activity of dexrazoxane against doxorubicin- and mitoxantrone- induced cardiotoxicity. Cancer Chemother Pharmacol 2001; 48: 297-304. [ Links ]
31. Hayakagwa H, Komada Y, Hirayama M, et al. Plasma levels of natriuretic peptides in relation to doxorubicin- induced cardiotoxicity and cardiac function in children with cancer. Med Pediatr Oncol 2001; 37: 4-9. [ Links ]
32. Nousiainen T, Jantunen E, Vanninen E, et al. Natriuretic peptides as markers of cardiotoxicity during doxorubicin treatment for non- Hodgkin's lymphopma. Eur J Haematol 1999; 62: 135-141. [ Links ]
33. Reid J, Perckergrass T, Kraiko M, et al. Plasma pharmacokinetics and cerebrospinal fluid concentrations of idambicin and idarubicinol in pediatric leukemia patients. Cancer Res 1990; 50: 6525-28. [ Links ]
34. Hams L, Batist G, Belt R, et al. Liposome-encapsulated doxorubicin compared with conventional doxorubicin in a randomized multicenter trial as first-line therapy of metastatic breast cancer. Cancer 2002; 94: 25-36. [ Links ]
35. Came D, Winklet C. In vitro assays of chemotherapy sensitivity. En De Vita V, Hellman S, Rosenberg S. Important advanced in oncolop. Ed Lippincott. 6: 78-%, 1985. [ Links ]
36. J Rothenberg M, Ling V. Multidrug resistance: molecular biology and clinical relevance. J Nail Cancer lnst 1989; 81: 907-13. [ Links ]
37. Ganz P. Late effects of cancer in adult survivors: What are they and what is the oncologist's role in folow up and prevention? Educational Book. ASCO 2005; 721-30. [ Links ]
38. Swaim S, Whales F, Gerber M, et al. Cardioprotection with dexrazoxane for doxorubicin containing therapy in advanced breast cancer. J Clin Oncol 1997; 15:1318-32. [ Links ]