INTRODUCCIÓN
El xilema secundario forma el leño de una planta y está estructurado principalmente por tres tipos celulares: vasos, parénquima y fibras, los que poseen diferentes funciones (Tyree & Sperry, 1989; Baas et al., 2004; Martínez-Cabrera et al., 2009; Pratt & Jacobsen, 2017). Los vasos están relacionados con la conducción del agua, las células parenquimáticas con el almacenamiento de agua y nutrientes y las fibras con el soporte y la resistencia mecánica a la aridez (Kozlowski, 1992; Hacke & Sperry, 2001; Sperry, 2003; Tyree & Zimmermann, 2013). La disposición y el área que ocupan cada uno de estos tipos celulares están relacionadas a las que ocupan los demás tipos celulares que componen al xilema secundario (Baas et al., 2004), asimismo la variación del área que ocupa cada tipo celular en respuesta a variables ambientales, permite incrementar o disminuir la tolerancia de las plantas frente a la aridez (Pratt & Jacobsen, 2017).
Las especies de plantas que poseen amplias distribuciones geográficas a lo largo de gradientes ambientales, suelen reflejar modificaciones morfológicas o estructurales (Carlquist, 1977; Baas et al., 2004; Martínez-Cabrera et al., 2009) que permiten su supervivencia en los diferentes ambientes donde viven. Estos ajustes (plasticidad fenotípica) pueden ser estudiados a través de la variación conjunta de rasgos funcionales. Un rasgo funcional es cualquier característica morfo-fisiológica de un organismo que influye sobre su rendimiento y su adaptabilidad relativa o “fitness” (Violle et al., 2007). El grosor de pared de las fibras, el tipo de distribución, tamaño y número de vasos, y la proporción de fibras en relación a vasos y parénquima, son rasgos del xilema secundario (leño) que se pueden observar bajo cortes histológicos transversales y que son importantes para la supervivencia de plantas en ambientes áridos (Martínez-Cabrera et al., 2009). En este sentido, la variación conjunta de rasgos del xilema secundario a lo largo de un gradiente ambiental permitiría comprender el grado de plasticidad que presentan los rasgos leñosos de una planta y su potencial uso como predictores de tolerancia a la sequía o de distribución geográfica potencial.
Las plantas de zonas áridas presentan plasticidad fenotípica en varias estructuras y órganos relacionados con cambios en la disponibilidad de agua. Para el xilema secundario puede mencionarse la disminución del área y diámetro de vasos (Sperry et al., 2008; Hacke et al., 2017), y/o el aumento del grosor de pared y del área de fibras (Jacobsen et al., 2005; Martínez-Cabrera et al., 2009). El análisis del área del tipo celular parenquimático resulta más complejo, debido a que se han observado comportamientos diferentes de los parénquimas axial y radial frente a la aridez (Martínez-Cabrera et al., 2009), aumentando principalmente el parénquima axial con el incremento de la temperatura (Morris et al., 2016; Morris et al., 2018). La densidad del leño, por otra parte, es una propiedad clave en las plantas leñosas y es consecuencia de modificaciones de los rasgos mencionados anteriormente (Chave et al., 2009). Por otro lado, el índice de vulnerabilidad propuesto por Carlquist (1977), relaciona el diámetro medio del lumen de los vasos con el número de vasos. La densidad del leño y el índice de vulnerabilidad, generalmente son indicadores de la seguridad del xilema para conducir agua en ambientes con elevada aridez.
La variación de rasgos del xilema en gradientes de aridez ha sido ampliamente estudiada en plantas, entre especies (Martínez-Cabrera et al., 2009; Ziemińska et al., 2013), y dentro de una misma especie (García-Cervigón et al., 2018; Rosas et al., 2019), registrándose una relación entre el flujo de agua que puede ser transportado y la configuración del sistema hidráulico, lo que es influenciado por las condiciones ambientales (Tyree & Zimmermann, 2013). La seguridad hidráulica del xilema explica el mantenimiento de la conductividad a medida que aumenta la aridez, disminuyendo la probabilidad de ocurrencia de cavitación. Por otro lado, la eficiencia hidráulica está determinada por la conductividad del xilema, que básicamente representa la inversión en vasos por unidad de área (Sperry et al., 2008). Eficiencia y seguridad son consideradas condiciones fundamentales en el funcionamiento del sistema hidráulico de la planta, y se ha observado que variaciones en las condiciones de aridez pueden producir cambios en la estructura del xilema de las plantas leñosas (Lindorf, 1994; Pratt & Jacobsen, 2017; García-Cervigón et al., 2018), produciendo un incremento en la inversión de un tipo celular en detrimento de otro.
Bulnesia retama (Gillies ex Hook. et Arn.) Griseb. (retamo) pertenece a la familia Zygophyllaceae y se distribuye en una amplia región árida de Argentina (Porter, 1974), en las Provincias Fitogeográficas del Monte y del Chaco Árido (Cabrera, 1994). Ocupa hábitats muy secos tales como laderas pedregosas en zonas con precipitaciones menores a los 100 mm anuales en el N de Mendoza y S de San Juan. Es un elemento característico de las provincias de Catamarca, La Rioja, San Juan, Mendoza, oeste de Córdoba, Santiago del Estero, San Luis y La Pampa, entre 500 y 2500 m s.m. (Hunziker, 1994). Se encuentra formando matorrales puros, dominando arbustales junto a bosques bajos de algarrobo dulce (Prosopis flexuosa DC.), o formando parte de arbustales mixtos junto a especies del género Larrea (Morello, 1958). También abunda en un reducido enclave en los semidesiertos de Ica, Ingenio y Nazca en Perú, encontrándosela a lo largo de conos de deyección, torrentes secos y riachos subterráneos que bajan de la cordillera, en una zona en la que prácticamente no hay precipitaciones; esto sugiere que en ciertos ambientes podría comportarse como una especie freatófita (Palacios & Hunziker, 1984).
El retamo es un arbusto o pequeño árbol multicaulinar, de 1,5 a 3 metros de altura, si bien en algunos casos puede alcanzar los 6 metros y desarrollar tallos de hasta 35 cm de diámetro o mayores (Tortorelli, 1956). Los tallos y ramas están cubiertos por ceras que les dan color verde grisáceo, mientras que las hojas son efímeras (Palacios & Hunziker, 1984). Su madera es extremadamente dura y su porción más interna está infiltrada con una resina de goma perfumada que le da a la madera un aspecto y tacto aceitosos (Record, 1921). Los retamales se usaron históricamente como recurso forestal, para confeccionar postes de viñedos, corrales, también para tornería y extracción de cera (Dalmasso & Llera, 1996; Sosa & Fernández, 1998).
Bulnesia retama es una especie que se ha adaptado al aumento progresivo de las condiciones de aridez en el continente, hacia fines del Oligoceno, principios del Mioceno (Godoy-Bürki et al., 2018). Como especie de ambientes áridos es altamente tolerante a la sequía (Gatica et al., 2017), presentando valores de potenciales agua en un rango entre -4 y -7,5 MPa (Ribas-Fernández, 2016).
Se han estudiado aspectos taxonómicos y evolutivos de la especie B. retama (Crisci et al., 1979; Comas & Hunziker, 1996; Godoy-Bürki et al., 2018), su biología reproductiva (Debandi et al., 2002), la fisiología de la germinación (Rodríguez-Rivera et al., 2007), el destino de sus semillas desde la dispersión primaria hasta la emergencia de plántulas y el establecimiento (Ribas-Fernández et al., 2009), sin embargo existen escasos trabajos disponibles (Record, 1921; Böcher & Lyshede, 1968), y otros de difícil acceso (Cozzo, 1948; Tortorelli, 1956), sobre los rasgos del xilema secundario que presenta esta especie. Asimismo, no existen trabajos que estudien variaciones en rasgos del xilema secundario a lo largo de gradientes de aridez para esta especie. Los objetivos de este trabajo son: i) describir anatómicamente, a través de cortes histológicos transversales, el xilema secundario de B. retama; ii) analizar la variación del porcentaje de vasos, fibras y parénquima, y grosor de la pared de fibra; iii) analizar si la modificación en el área que ocupa un tipo celular dentro del xilema secundario implica la reducción o aumento del área de otro tipo celular; y iv) analizar la seguridad hidráulica de la madera de B. retama frente a la aridez a través del valor de densidad específica del leño y del índice de vulnerabilidad de Carlquist (1977), a lo largo de un amplio gradiente de aridez en la zona central-oeste de Argentina.
MATERIALES Y MÉTODOS
Sitios de estudio
Los cuatro sitios de estudio se ubicaron a lo largo de un gradiente de precipitaciones con sentido Oeste-Este de más de 200 mm anuales, entre las provincias de San Juan (Médanos Grandes, Bermejo y Marayes) y La Rioja (Chepes), abarcando poco más de 200 km (Fig. 1).
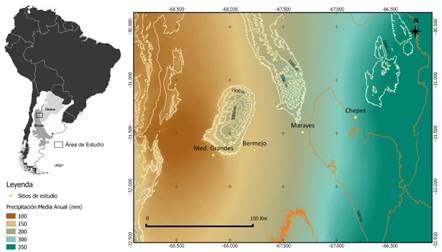
Fig. 1 Localización de los sitios estudiados que conforman el gradiente de aridez en el centro-oeste de Argentina, Médanos Grandes, Bermejo y Marayes (San Juan) y Chepes (La Rioja). Imagen realizada mediante el programa QGIS (QGIS Development team, 2020). Datos de precipitación media anual tomados de la base de datos global WorldClim (Hijmans et al., 2005). Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/929/1215
La temperatura media anual se mantiene prácticamente estable en todo el gradiente, con alrededor de 18 ºC. Las características climáticas de los cuatro sitios varían desde muy áridas al oeste, con una precipitación media anual (desde ahora PMA) de 130 mm en la zona de Médanos Grandes, hasta semiáridas al este, con PMA de 357 mm en la localidad de Chepes (Tabla 1). Desde el punto de vista fisonómico-florístico, el gradiente comprende las Provincias Fitogeográficas del Monte, en el extremo occidental, y del Chaco Árido, en el extremo más oriental (Abraham et al., 2009). En los sitios más áridos (Médanos Grandes y Bermejo) la vegetación es típica de matorrales abiertos, dominados por arbustos del género Larrea (L. divaricata Cav. y L. cuneifolia Cav.), acompañados por B. retama y Atamisquea emarginata Miers ex Hook. & Arn.; mientras que en los sitios que se encuentran dentro de la Provincia Fitogeográfica del Chaco Árido (Marayes y Chepes), la vegetación es un algarrobal abierto, con individuos dispersos de Prosopis flexuosa, menor abundancia de B. retama, Parkinsonia praecox (Ruiz & Pav. ex Hook.) Hawkins y Aspidosperma quebracho-blanco Schltdl. (Gatica, 2015).
Obtención y preparación de las muestras
Para cada sitio se seleccionaron 10 individuos adultos, aparentemente sanos y similares en tamaño (2,5 m de altura en promedio). A partir de una rama primaria de cada individuo (≥ 5 cm de diámetro), se extrajo una muestra de aproximadamente 10 cm de largo para analizar en el laboratorio (10 individuos x 4 sitios = 40 muestras). Para la selección de las ramas no se tuvo en cuenta su orientación. De cada muestra se obtuvo una submuestra de 2,5 cm de largo, la cual se cortó longitudinalmente en dos mitades, una para realizar los preparados histológicos y otra para estimar la densidad del leño.
Para la obtención de los preparados histológicos, se colocaron cubos de leño de 1 cm3 en FAA (10% formaldehído, 5% ácido acético glacial, 50% etanol y 35% agua destilada) con la finalidad de ablandar los tejidos y fijar las muestras. Luego, los cubos se llevaron a punto de ebullición, alrededor de 10 horas diarias durante una semana, en recipientes con agua y dos gotas de detergente. Con un micrótomo de deslizamiento Leica SM2000R se realizaron cortes transversales de 5µm de espesor. Se seleccionaron los mejores cortes, se deshidrataron mediante una serie de etanol (70%, 90% y 100%), se clarificaron con hipoclorito de sodio al 10% y se tiñeron bajo la técnica de tinción sucesiva doble de Safranina-Fast Green. El montaje de los preparados se realizó con Bálsamo de Canadá (D´ambrogio de Argüeso, 1986; Ruzin, 1999). Sobre la base de estudios previos, se realizaron solamente cortes transversales ya que este tipo de corte es el óptimo para estudiar cambios frente a condiciones ambientales en las áreas que ocupan los distintos tipos celulares que forman el xilema secundario, como así también cambios en el diámetro de vasos y paredes de fibras (Carlquist, 1988; Villar-Salvador et al., 1997; Martínez Cabrera et al., 2009; Ziemińska et al., 2013; Hajek et al., 2014; Ziemińska et al., 2015; Morris et al., 2016; Pratt & Jacobsen 2017). Los preparados histológicos se realizaron en el laboratorio de anatomía vegetal del Instituto Argentino de Nivología, Glaciología y Ciencias Ambientales (IANIGLA-CONICET), Provincia de Mendoza y se encuentran resguardados en el laboratorio del Grupo de Ecología del Desierto (GEDes), del Departamento de Biología de la Facultad de Ciencias Exactas, Físicas y Naturales de la Universidad Nacional de San Juan, Argentina.
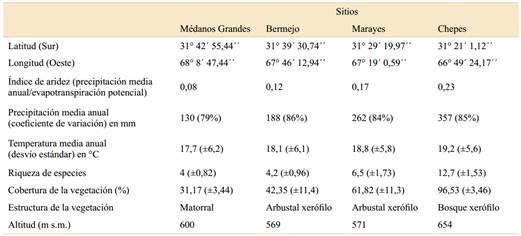
Tabla 1 Características ambientales y bióticas de cuatro sitios analizados a lo largo de un gradiente de aridez en el centro- oeste de Argentina. Para el cálculo de índice de aridez junto con la evapotranspiración potencial, se utilizó la base de datos global CGIAR-CSI (https://cgiarcsi.community/data/global-aridity-and-pet-database/). La precipitación media anual y la temperatura media anual de cada sitio se obtuvieron de la base de datos global WorldClim para el período 1950-2000 (Hijmans et al., 2005). La riqueza de especies y la cobertura de la vegetación se calcularon a partir de Gatica (2015).
Se obtuvieron imágenes a diferentes aumentos (40x, 100x y 400x) mediante microscopio con cámara incorporada (digital biological microscope model DMWB1-223). Se tomaron 5 imágenes de cada corte transversal en diferentes sectores de los anillos de crecimiento más externos (Martínez-Cabrera et al., 2009). Para cada corte transversal, se registró tipo de anillo de crecimiento, disposición de vasos, diámetro medio de lumen de vasos, tipo de fibras según la comparación del diámetro de lumen con el grosor de la pared, grosor de la pared de fibra y tipo de parénquima axial. Para la descripción de estas variables del xilema secundario, se siguió la terminología del comité de Nomenclatura de IAWA (IAWA, 1989). El diámetro de los vasos se consideró muy pequeño (<50 μm, categoría I), pequeño (51≤100 μm, categoría II), mediano (101≤ 200 μm, categoría III) y grande (>201 μm, categoría IV), según lo establecido por el comité de IAWA (1989) y por Wheeler & Baas (1998).
Para analizar el porcentaje ocupado por cada tipo celular que forma el xilema secundario (parénquima, vasos y fibras) se utilizó el método de estimación de la cobertura porcentual por puntos de muestreo pro- puesto por Smith (1967), con algunas modificaciones. Esto consiste en instalar una grilla aleatoria sobre la imagen en donde la totalidad de los puntos re- presentan el 100% y luego se cuenta la cantidad de puntos que caen sobre cada tipo celular. Posterior- mente se obtiene el porcentaje de cada tipo celular multiplicando la cantidad de puntos afectados por 100 y dividiéndolo por la totalidad de puntos de la imagen. Para el tipo celular parenquimático se analizaron en conjunto el parénquima axial y los radios parenquimáticos. Todos los análisis se rea- lizaron mediante el software libre ImageJ 1.52a (Rasband, 2018).
La densidad específica del leño se obtuvo según el protocolo de Pérez-Harguindeguy et al. (2013), la cual se define como el peso seco de la muestra de un tallo o rama sin la corteza (secada a 100 °C durante 72hs), dividido por el volumen de la misma sección, cuando aún permanece fresco. El procedimiento para la obtención del volumen en fresco consiste en sumergir la muestra completamente en agua destilada en un vaso de precipitación con la ayuda de una aguja o pinza. Al sumergir la muestra, el nivel de agua aumenta incrementando el peso que es registrado por la balanza (el peso del agua desplazada), que equivale al volumen de la muestra en cm3 (ya que el agua tiene una densidad de 1g.cm-3). Si bien la densidad de leño varía dentro de cada parte de la planta (Chave et al., 2009), existen antecedentes de que las ramas presentan una densidad menor de aproximadamente 9% del valor de densidad del leño del tallo (Chave, 2005; Sarmiento et al., 2011). También diversos trabajos han mostrado que, si bien existen algunas diferencias con el tallo, las ramas son de utilidad para estudios sobre características y variación de los tipos celulares que forman el xilema frente a condiciones climáticas (Villar-Salvador et al., 1997; Davis et al., 1999; Ziemińska et al., 2013, 2015; Hajek et al., 2014; Morris et al., 2016; Pratt & Jacobsen, 2017; Kiorapostolou et al., 2019).
Se calculó el índice de vulnerabilidad de Carlquist (1977) para determinar el grado de xeromorfismo de la madera de B. retama. Este índice se basa en la relación diámetro medio del lumen de vasos sobre el número de vasos por área (mm2). Valores mayores a 1 de este índice, indican una madera mesomórfica, y valores menores 1 indican una madera xeromórfica, con características relacionadas a una conducción más segura del agua en condiciones de elevada aridez.
Para calcular el índice de aridez junto con la evapotranspiración potencial, se utilizó la base de datos global de índice de aridez y evapotranspiración CGIAR-CSI (https://cgiarcsi. community/data/global-aridity-and-pet-database/). Para evaluar el efecto de la aridez (índice de aridez, variable regresora) sobre las variaciones que presentan los porcentajes de área de vasos, parénquima y fibras, además del grosor de pared de fibra, densidad de leño e índice de vulnerabilidad (variables respuesta), se ajustaron modelos de regresión lineal (lm), considerando todas las variables respuesta transformadas a logaritmo para cumplir supuestos de normalidad (evaluado a través del paquete fitdistrplus, Delignette-Muller & Dutang, 2015). Por otro lado, se evaluó la existencia de compromisos (la pérdida o ganancia de un tipo celular respecto de otro) entre los rasgos de área de los tipos celulares que conforman al leño (vasos, parénquima y fibras) por medio de correlaciones de Pearson. Se consideraron compromisos sólo cuando los valores de correlación fueran negativos y significativos. Para la totalidad de las pruebas estadísticas utilizamos el programa estadístico R versión 3.5.1 (R CoreTeam, 2018).
RESULTADOS
En el xilema secundario de B. retama se observaron anillos visibles, caracterizados por presentar cambios anatómicos graduales, debido a que los vasos pueden continuar a través de dos o tres anillos. Su porosidad es de tipo semi-circular, con vasos predominantemente solitarios (en ocasiones agrupados) con disposición de tipo dendrítica (Fig. 2A). El análisis de los tipos celulares mostró que las fibras presentan paredes gruesas, de 1,8-5,7 μm de espesor (valor medio
3,13 μm), con un diámetro del lumen pequeño en relación a la pared, por lo que forman parte de la categoría de fibras de paredes muy gruesas (Tabla 2). Por otro lado, B. retama presentó un parénquima axial de tipo apotraqueal difuso, en ocasiones formando hebras de parénquima único o pares de hebras distribuidos entre los elementos fibrosos del leño, sugiriendo la presencia de parénquima apotraqueal difuso en agregados (Fig. 2B). El diámetro de los vasos registró un valor de 19,55-40,34 µm (valor medio de 27,34 µm), correspondiente a la clasificación de vasos muy pequeños (categoría I de IAWA). Los vasos ocuparon un promedio del 18,13% (9,5-33,3%) del xilema secundario. El parénquima (axial+radial) ocupó un promedio del 30,19% (13,3-51,4%). Las fibras ocuparon, en promedio, un 51,68% (28,6-73,3%). En la Tabla 3 se indica la estadística descriptiva de las variables estudiadas.

Fig. 2 Cortes transversales de leño de Bulnesia retama de individuos colectados a lo largo de un gradiente de aridez del centro- oeste de Argentina. A, porosidad semi-circular y disposición dendrítica de vasos. B, detalle de vasos, fibras de paredes muy gruesas y parénquima axial apotraqueal. C, leño de un ejemplar del sitio más árido (Médanos Grandes), con gran predominio de fibras. D, leño de un ejemplar perteneciente del sitio menos árido (Chepes), con mayor predominio de células de parénquima. Abreviaturas: f, fibras; r, radios parenquimáticos; v, vasos; p, parénquima axial. Escalas: A, 500 µm; B, 50 µm; C, 50 µm; D, 50 µm. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/929/1215
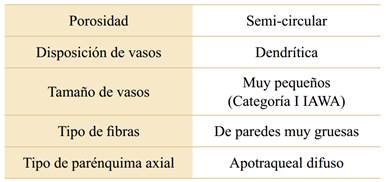
Tabla 2 Listado de rasgos anatómicos del xilema secundario observados en individuos de B. retama colectados en cuatro sitios a lo largo de un gradiente de aridez en el centro-oeste de Argentina.
En relación con el gradiente de aridez, si bien se observó una leve disminución en la media de los porcentajes de área de vasos (conducción) en relación a la aridez, esta variación no fue significativa (p=0,16; R2=0,02; Fig. 3A), presentando una gran variabilidad entre los individuos de cada sitio. Por otro lado, se registraron cambios significativos en el área del xilema secundario ocupada por las fibras (soporte y resistencia) y el parénquima (almacenamiento) (Fig. 3B y C). El área ocupada por fibras mostró un fuerte aumento hacia el sector más árido del gradiente (p<0,0001; R2=0,70; Fig. 3B), mientras que el área de parénquima disminuyó con la aridez (p<0,0001; R2=0,71; Fig. 3C). Además, si bien no se encontró un buen ajuste entre el grosor de la pared de fibras y la aridez, éste presentó un aumento significativo hacia la porción más árida del gradiente (p=0,04; R2=0,07; Fig. 3D).
Se registraron compromisos significativos mediante el análisis de correlaciones de Pearson entre los rasgos de área de fibras-parénquima y fibras-vasos para todo el gradiente. Según los valores de correlación, se observó que el compromiso en la inversión de fibras aumenta hacia la porción más árida del gradiente en detrimento de los vasos y del parénquima, siendo más pronunciado el compromiso entre vasos y fibras en los sitios de mayor aridez. No se observaron compromisos entre vasos y parénquima en ningún sitio a lo largo del gradiente (Tabla 4).
En relación a los indicadores de seguridad hidráulica del xilema secundario de B. retama, no se registraron variaciones significativas en la densidad del leño (p=0,42), como tampoco en el índice de vulnerabilidad de Carlquist (p=0,74) a lo largo del gradiente. A pesar de no presentar variaciones significativas, la propiedad de densidad específica de leño registró un elevado valor promedio de 0,929 gr/cm3. Por otro lado, el índice de vulnerabilidad de Carlquist (1977) presentó un valor promedio de 0,7; este valor es característico de leños xeromórficos, seguros en la conducción de agua.
DISCUSIÓN
La porosidad semi-circular que se registró en B. retama concuerda con lo registrado para la misma especie por Tortorelli (1956) y con la especie cercana Larrea nitida Cav. (Andreoni, 2014). Por otro lado, B. retama difiere de la porosidad difusa que presenta Bulnesia sarmientoi Lorentz ex Griseb. (Giménez et al. 2007), pero comparte el patrón dendrítico de los vasos. La porosidad semi-circular coincide además con lo observado en especies de grupos taxonómicos distantes con las que B. retama comparte hábitat en el Monte, como Prosopis alba Griseb. y Geoffroea decorticans (Gillies ex Hook. & Arn.) Burkart (Barañao et al., 2008). Finalmente, se observó que B. retama presenta la peculiar disposición de los vasos registrada por Böcher & Lyshede (1968), esto es, que los vasos no se limitan a anillos anuales únicos, sino que pueden continuar a través de dos o tres anillos.
El análisis del xilema secundario de B. retama observado en cortes histológicos transversales mostró que presenta gran cantidad de fibras de paredes gruesas y vasos principalmente solitarios, coincidiendo estas características con las especies cercanas L. divaricata, L. cuneifolia y L. nítida (Andreoni, 2014), y solamente se asemeja en el tipo de fibras con Bulnesia sarmientoi (Burgerstein, 1912). Además, se registraron características del xilema secundario coincidentes con lo observado por Tortorelli (1956), como vasos muy pequeños y numerosos dispuestos de manera dendrítica y un parénquima axial de tipo apotraqueal difuso y probablemente de tipo difuso en agregados.
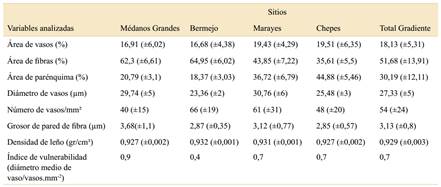
Tabla 3 Valor promedio y desvío estándar (entre paréntesis) de rasgos del leño, densidad de leño e índice de vulnerabilidad (Carlquist, 1977), estudiados en individuos (n=10) de B. retama en cuatro sitios a lo largo de un gradiente de aridez en el centro-oeste de Argentina.
Del análisis de vasos, se infiere que B. retama presenta un sistema hidráulico con vasos numerosos y pequeños, característica típica de especies adaptadas a la aridez, donde el caudal es restringido, asegurando el transporte del agua escasa (Carlquist, 1988; Rosell et al., 2017). Debido a que a este tipo de leño se relaciona con la prevención del colapso bajo tensiones muy negativas o temperaturas muy bajas, se considera como una estrategia que poseen ciertas plantas leñosas para una conducción segura del agua en zonas áridas (Tyree & Zimmermann, 2013). Esto se observó en especies cercanas a B. retama como Larrea nitida y Larrea tridentata (DC.) Coville (Medeiros & Pockman, 2014).
En este trabajo no se registraron cambios evidentes en el área de vasos asociados con el aumento de la aridez, si bien esto podría ser considerado un patrón general en plantas de zonas áridas (Maherali et al., 2004; Martínez-Cabrera et al., 2009), es posible que su probable condición de planta freatófita en ciertos ambientes esté influyendo sobre la falta de variación de este rasgo, como lo sugiere Hunziker (1994). En cambio, sí se registró una gran variabilidad en el área de vasos entre individuos dentro de un mismo sitio. Esto podría ser explicado por la distinta orientación de las ramas que fueron analizadas en cada individuo, ya que se ha observado en especies de arbustos de ambientes áridos que el transporte del agua está segmentado dentro de la misma planta (Schenk et al., 2008), pudiendo tener influencia la pendiente, cercanía a un curso de agua, etc.
El leve aumento del grosor de la pared de fibras registrado hacia los sitios más áridos se puede interpretar como un aumento en la resistencia mecánica frente a los efectos de la aridez, en concordancia con lo que observaron Jacobsen y colaboradores (2005) en seis especies de arbustos de las familias Rosaceae, Rhamnaceae y Anacardiaceae del sur de California. Además, es probable que las fibras compensen la disminución de parénquima en los sitios más áridos, debido a que se ha observado que éstas pueden almacenar carbohidratos sin comprometer su capacidad mecánica (Pratt & Jacobsen, 2017).
El parénquima, el segundo tipo celular más abundante en el leño de B. retama, probablemente compense el bajo porcentaje ocupado por los vasos, sobre todo en el extremo más árido del gradiente, debido a que el parénquima puede cumplir funciones de almacenamiento de agua, además de recuperación de vasos afectados por embolia (Morris et al., 2016; Klein et al., 2018). La seguridad del xilema secundario es de gran interés debido a su papel en la resistencia a la aridez de las plantas (Choat et al., 2012; Sperry & Love, 2015). Junto con la seguridad, la eficiencia y las compensaciones mecánicas, el almacenamiento es una función crítica del leño y está asociado con muchos de los aspectos dinámicos de su función (Pratt & Jacobsen, 2017).
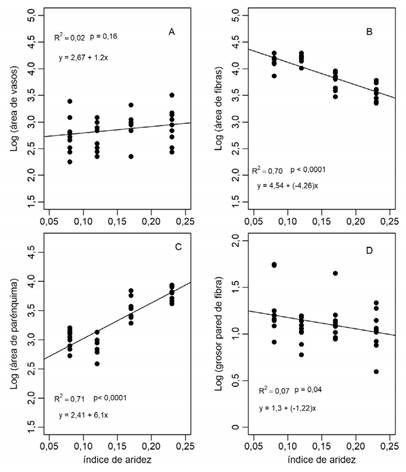
Fig. 3 Variación de rasgos del leño de Bulnesia retama a lo largo de un gradiente de aridez, en el centro-oeste de Argentina. A, disminución no significativa del área de vasos hacia el sector más árido del gradiente. B, aumento significativo del área de fibras hacia el sector más árido del gradiente. C, disminución significativa del área de parénquima hacia el sector más árido del gradiente. D, aumento marginalmente significativo del grosor de la pared de fibra hacia el sector más árido del gradiente. Para analizar la variación de estos rasgos a lo largo del gradiente de aridez se ajustaron modelos de regresión lineal (lm), considerando todas las variables respuesta transformadas a logaritmo para cumplir supuestos de normalidad.
Los compromisos asociados con el almacenamiento de carbohidratos pueden estar relacionados con el empaquetamiento espacial, ya que si el leño está ocupado con mayor número de células parenquimáticas, entonces tendrá menos volumen para las fibras y vasos. Se ha observado que el aumento en el contenido de parénquima se asocia negativamente con el contenido de fibras pero es independiente del contenido de vasos, como registraron Ziemińska y colaboradores (2015) en 69 especies de árboles y arbustos de Australia. Probablemente esto explica que el compromiso entre vasos y parénquima no sea significativo en nuestro análisis. También las fibras resultaron ser más abundantes en los sitios más áridos del gradiente. Esto podría interpretarse como un reflejo de las elevadas tensiones a la que estaría sometido el xilema de B. retama en las épocas más secas, debido a que son un tipo celular relacionado con el soporte y la resistencia mecánica del xilema a la sequía. Las características de las fibras adyacentes a los vasos son importantes para prevenir su colapso bajo tensiones muy negativas (Jacobsen et al., 2005).
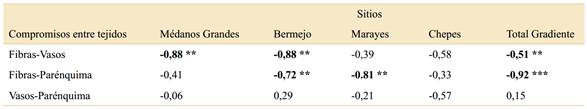
Tabla 4 Correlaciones de Pearson (r) entre las áreas de vasos, fibras y parénquima por sitios y valores medios totales del gradiente para analizar compromisos (pérdida o ganancia de un tejido respecto de otro) dentro del xilema secundario de B. retama, a lo largo de un gradiente de aridez en el centro-oeste de Argentina (Tabla 1). En negrita las correlaciones significativas * p=0,05; ** p<0,05; *** p<0.0001.
La densidad promedio del leño de B. retama (0,929 gr/cm3) registrada en este estudio es ligeramente mayor a los 0,800 a 0,900 gr/cm3 descriptos por Bertonatti (1997) para esta misma especie. Este resultado indica que el leño de B. retama es de alta densidad si se tiene en cuenta que los valores de especies de ambientes áridos generalmente oscilan entre 0,600-1 g/cm3, y que se consideran maderas de alta densidad aquéllas que superan los 0,751 gr/cm3 (Giménez & Moglia, 2003). Comparando con otras especies que habitan las Provincias Fitogeográficas del Monte y del Chaco Árido, también muy utilizadas por su densa madera, los valores de densidad de leño encontrados en B. retama fueron superiores a Geoffroea decorticans (0,600gr/cm3), Prosopis alba (0,800gr/cm3), Celtis tala Gillies ex Planch. (0,800gr/cm3) y Vachellia caven (Molina) Seigler & Ebinger (0,890gr/cm3) (Giménez & Moglia, 2003). Posiblemente, estos elevados valores estén relacionados con sus vasos pequeños y la gran cantidad de fibra con paredes gruesas que se estructuran en la madera de B. retama, junto a las resinas y aceites que posee. La madera de B. retama no presenta problemas con su uso en comparación con otra especie muy utilizada por la dureza de su madera, el quebracho blanco (Aspidosperma quebracho-blanco). Esta última especie nativa, muy utilizada como recurso forestal, comparte la Provincia Fitogeográfica del Chaco Árido con B. retama, posee una densidad de leño de 0,885gr/cm3 y, aunque puede responder bien al curvado y golpes, tiene tendencia a sufrir contracciones, deformaciones y roturas (Moglia et al., 2009). Estos problemas no fueron detectados en la madera de B. retama (Dalmasso et al., 2014) lo que la hace también apropiada para su utilización como arbolado.
Los valores registrados del índice de vulnerabilidad confirman que es una especie con elevada seguridad en la conducción hidráulica (valor promedio de 0,7) y que su leño posee características xeromórficas (Carlquist, 1977). Eso concuerda con el valor de diámetro de lumen muy pequeño, junto al gran número de vasos que registramos en este trabajo. Para otras especies de ambientes áridos subtropicales, se sugirió que la presencia de raíces profundas (plantas freatófitas, como posiblemente sea B. retama según Palacios & Hunziker, 1984) puede derivar en características mesomórficas en el leño (Lindorf, 1994); sin embargo en B. retama registramos un leño de características xeromórficas. Bulnesia retama presentó un índice de vulnerabilidad menor a otra especie con cierto grado de afinidad taxonómica como es Guaiacum officinale L. (3,16) (Lindorf, 1994). Por otro lado, comparando con otras especies con las que comparte su distribución, B. retama presentó valores del índice de vulnerabilidad menores a Vachellia aroma (Gillies ex Hook. & Arn.) Seigler & Ebinger (5,8), Parkinsonia praecox (2), Geoffroea decorticans (1,2); y mayores a Jodina rhombifolia (Hook. & Arn.) Reissek (0,2) y Maytenus viscifolia Griseb. (0,4) (Giménez & Moglia, 2017).
CONCLUSIONES
Bulnesia retama es un arbusto que posee un leño xeromórfico muy denso y con características relacionadas con la resistencia a condiciones de aridez de los ambientes donde se distribuye. Presenta la combinación de rasgos anatómicos como vasos numerosos, pequeños y principalmente solitarios, fibras con paredes gruesas y parénquima axial apotraqueal. El incremento del área de fibras registrado en detrimento del área de parénquima y vasos, a medida que se incrementa la aridez, podría ayudar a predecir con este tipo de análisis, si un individuo de B. retama se encuentra en un sitio sumamente xérico (aportando mayor seguridad a la conducción de agua), o mésico (similar abundancia de parénquima y fibras, y mayor presencia de vasos). Esto permite considerar a la especie como altamente plástica frente a las condiciones de aridez, lo que podría explicar la amplitud del área de distribución de B. retama dentro de las Provincias Fitogeográficas del Monte y del Chaco Árido.












 uBio
uBio 

