INTRODUCCIÓN
Las actividades antrópicas han modelado los ecosistemas terrestres, condicionando su composición y funcionamiento (Klein Goldewijk et al., 2011; Ellis et al., 2013). En los paisajes transformados por las actividades productivas se dan múltiples procesos que afectan la estructura de la vegetación, como el reemplazo de comunidades naturales por grandes extensiones de cultivos (Ellis et al., 2010), la alteración en frecuencia e intensidad de los regímenes de disturbio naturales como incendios, herbivoría o inundaciones (Archibald, 2016; Lobo et al., 2019; Öllerer et al., 2019) o la generación de nuevos tipos de disturbios como la extracción selectiva de ejemplares (Poudyal et al., 2018). Por otra parte, el movimiento de especies a escala global desencadena múltiples procesos de invasión que modifican la composición y estructura de las comunidades originarias (Levine & D’Antonio, 2003). A escala de paisaje, la variedad de elementos se ve ampliada tanto por la incorporación de aquellos propios de la actividad antrópica (cultivos, construcciones, caminos, etc.) como por los de formación espontánea en sitios disturbados (bordes de caminos, zonas de pastoreo, etc.), lo cual genera situaciones de contraste e interacciones novedosas entre los elementos. Al mismo tiempo, en determinados sitios tienen lugar procesos de restauración pasiva de la vegetación, dando lugar a ecosistemas secundarios (Rey Benayas et al., 2007; Arroyo-Rodríguez et al., 2017). Entre los sistemas afectados por transformaciones antrópicas durante el último siglo se encuentran los deltas. Los deltas han experimentado un considerable incremento demográfico, albergando actualmente al 7% de la población mundial. Entre las actividades antrópicas que más influyen sobre la dinámica de los deltas se encuentra la intensificación agropecuaria y la urbanización ya que modifican la dinámica hídrica y sedimentaria mediante dragado y polderización del terreno (Nicholls et al., 2020). El régimen hidrológico es el principal condicionante de la composición y funcionamiento de los ecosistemas de humedal, en particular aquellos que conforman los sistemas deltaicos, y su alteración puede afectarlos fuertemente. La vegetación es particularmente sensible a los cambios ambientales dados por la antropización de los sistemas deltaicos (Mitsch & Gosselink, 2015) y, por lo tanto, su estudio es importante para generar estrategias de conservación y desarrollo sustentable en estos sistemas.
El Delta del Paraná es una región que se ubica en el sector terminal del Río Paraná (Malvárez, 1999) y conforma una unidad dentro de la ecorregión Delta e Islas de los ríos Paraná y Uruguay (Mateucci, 2012). El Complejo Fluvio-Litoral del Bajo Paraná abarca la extensión del Delta del Paraná y recientemente ha sido regionalizado en base a los humedales que lo constituyen dividiéndolo en unidades de paisajes (Kandus et al., 2019). Una de estas unidades es el Delta Frontal (Fig. 1A) que se ubica en un sector próximo al Río de la Plata. Está surcado por distributarios del Río Paraná conformando islas cubetiformes, con un albardón perimetral, un centro deprimido y posiciones intermedias denominadas media loma. El régimen hidrológico está determinado tanto por el régimen semidiurno micromareal del Río de la Plata, como por las mareas eólicas producidas por el viento sudeste, existiendo una conectividad hídrica entre el centro de las islas y los arroyos principales mediante canales ciegos y zanjas artificiales (Kandus et al., 2019).
En la primera caracterización exhaustiva de las comunidades de la zona, Burkart (1957) describe tres comunidades típicas para las islas consolidadas: el Pajonal, el Ceibal y el Monte Blanco. Estas serán consideradas las comunidades naturales de referencia para la región en este trabajo. Los pajonales se encuentran dominados por Cyperus byssaceus (= Scirpus giganteus), con especies acompañantes herbáceas (Ludwigia sp. y Schoenoplectus californicus) y eventualmente leñosas (Erythrina crista-galli o Raulinoreitzia tremula y Baccharis penningtoni); ocupan grandes extensiones (55%) del Delta Frontal encontrándose en las posiciones topográficas más deprimidas (Kandus et al., 2003).
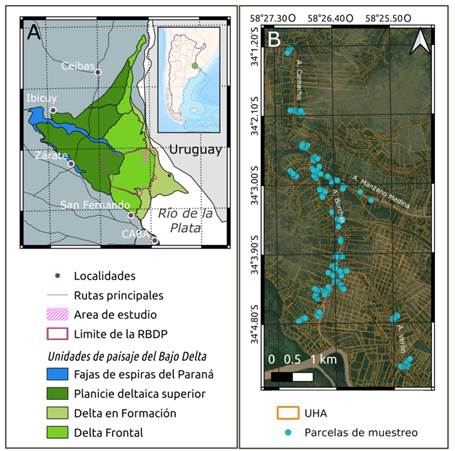
Fig. 1 Área de estudio. A, Regionalización del Bajo Delta del Río Paraná basada en Kandus (2019). B, Detalle del área de estudio en el contexto de la reserva de biosfera Delta del Paraná (RBDP) y ubicación de las parcelas de muestreo instaladas para el estudio de la vegetación. La imagen de base utilizada fue provista por Google Earth V 7.3.3.7786. (21 de julio, 2020). San Fernando, Argentina 34° 04’ 05” S, 58° 26’ 23” O, Altura de ojo: 10,27 km. CNES / Airbus 2022. http://www.earth.google.com [Consulta Junio 27, 2022]. Abreviaturas: RBDP: Reserva de Biosfera Delta del Paraná, UHA: Unidades Homogéneas con Evidencias de Antropización. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/1041/1265
Los ceibales constituyen bosques abiertos con dominancia de Erythrina crista-galli en el estrato superior y Cyperus byssaceus en el inferior; ocupan el 31% de la superficie de la unidad, y se encuentran en las medias lomas (Kandus et al., 2003). Por su parte, el Monte Blanco se dispone sobre los albardones (Burkart, 1957) y en la actualidad sólo se halla en fragmentos remanentes de pequeño tamaño (Kalesnik et al., 2008). Esta comunidad está constituida por una gran diversidad de especies leñosas y enredaderas, entre las cuales se destacan Blepharocalyx salicifolius, Myrsine parvula, Pouteria salicifolia, Allophylus edulis, Terminalia australis y Syagrus romanzoffiana, así como Galianthe brasiliensis en el sotobosque. Además, en estos bosques remanentes se observa un proceso de invasión por ligustrina (Ligustrum sinense) y madreselva (Lonicera japonica) (Vallés et al., 2006; Kalesnik et al., 2008).
Estas comunidades han sido fuertemente transformadas por las actividades humanas a lo largo de la historia. Según Galafassi (2005) se pueden identificar tres periodos de transformaciones previos al siglo XXI. Durante el período colonial (desde finales del siglo XVI hasta comienzos del siglo XIX), se degradaban los bosques por extracción de leña. A partir de la mitad del siglo XIX se dio un incremento de la población la cual se asentó en pequeñas unidades productivas (10-50 ha). En los albardones se realizaron plantaciones de frutales, reemplazando los bosques preexistentes. Por otro lado, las tierras inundables comenzaron a ser incorporadas a la producción a partir de intervenciones tendientes a controlar el régimen hidrológico, en particular, a disminuir la duración, frecuencia o intensidad de las inundaciones. Estas intervenciones, a las que nos referiremos como sistematización, se dieron en esta etapa utilizando la técnica de “zanja abierta” la cual consiste en la construcción de una red de zanjas que conectan el interior de las islas con los cursos fluviales facilitando el drenaje. La principal actividad desarrollada en estos sectores fue la forestación de salicáceas (géneros Salix y Populus). En la segunda mitad del siglo XX, la fruticultura disminuyó y la forestación se consolidó como la principal actividad productiva, a la vez que la población isleña emigró de manera masiva, quedando abandonadas múltiples unidades productivas.
La superficie sistematizada aumentó y se incorporaron nuevas técnicas de sistematización basadas en el control del ingreso de agua mediante la elevación de la altura perimetral del terreno (“atajarepuntes” y diques) (Donadille et al., 2010, Kandus & Minotti, 2010). En el siglo XXI la actividad forestal se mantiene como la principal actividad productiva, desarrollándose en el Delta Frontal principalmente sobre albardones y terrenos sistematizados con la técnica de zanja abierta (Kandus & Minotti, 2010; Kandus et al., 2019). Además, esta actividad se acompaña de otras como fruticultura, horticultura y cultivo de pecán, de plantas ornamentales, de caña y de mimbre, a la vez que muchas parcelas permanecen abandonadas (González, 2015).
Las actividades productivas implicaron la disminución de la vegetación originaria, la introducción de cultivos y, en los ambientes más deprimidos, la sistematización del terreno con el consecuente cambio en el régimen hidrológico. Esto dio lugar a la conformación de comunidades secundarias, que en algunos casos coexisten con las actividades productivas y, en otros, se desarrollan luego del abandono de las mismas. En el Delta Frontal, dentro de los ambientes posproductivos, los únicos estudiados fueron los ambientes posforestales (comunidades desarrolladas bajo forestaciones abandonadas o con falta de mantenimiento). En los ecosistemas de albardón, Kalesnik et al. (2011) reportaron, tras el abandono de las actividades productivas, la formación de comunidades dominadas por exóticas (Ligustrum sinense, Ligustrum lucidum, Lonicera japonica, Acer negundo, Fraxinus pennsylvanica y Rubus sp.) con acompañantes nativas (Blepharocalyx salicifolius, Myrsine parvula y Allophylus edulis). Además, estos autores observaron cierta variación en el ensamble de especies conforme aumenta el tiempo de abandono. Por su parte, Sirolli et al. (2021) registraron la presencia de bosques posforestales tanto dominados por exóticas como con codominancia de exóticas y nativas, mostrando que se pueden formar comunidades ricas en nativas en condiciones posforestales. Las forestaciones ubicadas en los sectores más inundables de las islas no fueron estudiadas en el Delta Frontal. En la Planicie Deltaica Superior, unidad de paisaje adyacente, Valli & Adámoli (1990) analizaron las forestaciones abandonadas de Salix sp. ubicadas en estos sectores. Estos autores reportaron que la regeneración del pajonal aumenta conforme se incrementa el tiempo de abandono, debido al restablecimiento del régimen hidrológico natural. Otras comunidades secundarias, como las que se desarrollan en plantaciones de mimbre, formio o frutales, si bien fueron mencionadas en las descripciones generales de la región (Burkart, 1957), no fueron estudiadas en detalle posteriormente.
En el presente trabajo se describe la flora y se caracterizan las comunidades vegetales presentes en sitios con uso antrópico actual o pasado. En particular se consideran sitios con evidencias de sistematización, forestación, fruticultura y otras actividades desarrolladas en la región a lo largo de su historia reciente. Además, se compara la riqueza, composición y grado de invasión de estas comunidades.
MATERIALES Y MÉTODOS
Área de estudio
El área de estudio se encuentra ubicada en la tercera sección de islas bonaerenses, dentro del partido de San Fernando, sobre los terrenos aledaños a los arroyos Borches, Manzano Medina, Camacho y Verón. El área se localiza dentro de la Reserva de Biósfera Delta del Paraná, ocupando el sector occidental de la zona núcleo y sectores contiguos de la zona buffer. Por su parte, en el marco del Inventario Nacional de Humedales, se encuentra en la unidad del Delta Frontal, más precisamente en la subunidad Paraná Guazú (Kandus et al., 2019) (Fig. 1A). El clima de la zona es subtropical húmedo con una temperatura anual media de 17ºC y una precipitación anual media de 1132 mm (Servicio Meteorológico Nacional, 2018).
Delimitación de las áreas con evidencias de antropización
La superficie sujeta a actividades productivas fue identificada mediante la visualización de imágenes satelitales provistas por CNES/Airbus (tamaño de píxel de 0,5 m; fecha de colección: 13/9/2019), disponibles en Google Earth Pro V 7.3.3, a una altura de ojo de 600 m (escala 1:2000).
En estas imágenes se buscaron elementos (vegetación, suelo desnudo, zanjas, viviendas, terraplenes) con disposición regular, cuya presencia se interpretó como evidencia de antropización (uso actual o pasado). Se digitalizaron polígonos delimitando sectores con textura y color homogéneos, definiendo así unidades homogéneas con evidencias de antropización (UHA). Estas UHA cubrieron el 83% del área de estudio (Fig. 1B). Si bien no se realizó una clasificación de las clases de textura y color de las UHA, se observó una marcada variabilidad en estas características. El trabajo se realizó con el software QGIS 2.18 (QGIS Development Team, 2018).
Muestreo de vegetación
Se identificaron potenciales sitios de desembarco a lo largo de los cursos fluviales presentes en el área de estudio (arroyos Borches, Manzano Medina, Verón y Camacho). De ellos, se seleccionaron 40 sitios, priorizando aquellos cercanos a UHA con diferentes patrones de coloración y textura, de manera de incluir en el muestreo diversas situaciones de usos y coberturas del suelo. En cada sitio de desembarco se seleccionó la UHA lindante al curso fluvial y, cuando el acceso resultaba posible, también aquellas ubicadas hacia el interior de la isla. De esta manera se trabajó en UHA ubicadas en las distintas posiciones del gradiente topográfico natural (albardón, media loma y bajo). Por sitio de desembarco se seleccionaron entre 1 y 7 UHA, en cada una de ellas se ubicaron al azar dos puntos en los que se montaron parcelas de muestreo cuadradas de 25 m2. En total, se instalaron 202 parcelas en 101 UHA ubicadas a una distancia de entre 5 y 300 metros del curso fluvial más cercano.
En cada una de las parcelas se registraron todas las especies de plantas vasculares presentes y se estimó su cobertura mediante la escala de Braun- Blanquet, considerando los siguientes porcentajes de cobertura: r (<0.1%), + (0.1-1%), 1 (1-5%), 2 (5-25%), 3 (25-50%), 4 (50-75%) y 5 (75-100%) (Westhoff & van der Maarel, 1978). Se registraron también las especies que, no habiendo quedado incluidas dentro de las parcelas, fueron observadas en los recorridos hacia y entre las mismas. Las especies (o taxones) fueron determinadas utilizando guías de campo y floras regionales (Cabrera, 1953; Cabrera et al., 1965, 1967; Burkart et al., 1969, 1974; Lahitte et al., 1997, 2004). La nomenclatura, el hábito (Árbol, Arbusto, Enredadera, Epífita, Herbácea, Herbácea Subleñosa, Liana, Palmera o Subarbusto) y origen (Nativo o Exótico) de las especies se determinaron siguiendo a Anton & Zuloaga (2022). Las especies exóticas fueron clasificadas como cultivadas o de crecimiento espontáneo, de acuerdo con los antecedentes mencionados en la bibliografía (Galafassi, 2005; González, 2015). Los muestreos fueron realizados durante los años 2018 y 2019.
Análisis de los datos de vegetación
Se realizó una caracterización de la flora con la totalidad de los taxones registrados. Se procuró determinar la identidad de los taxones a nivel de especie y cuando esto no fue posible se los incorporó al análisis a nivel de género. Se determinó el número de taxones encontrados, así como la cantidad por familia y por hábito. Para aquellos taxones identificados a nivel de especie se cuantificó la proporción de nativas y exóticas, en tanto aquellos que no fueron identificados a nivel de especie se incorporaron como taxones de “origen no determinado”.
Se estimó la riqueza total mediante un método de extrapolación de la curva de rarefacción (Chao et al., 2014), para lo cual se utilizó el paquete ‘iNEXT’ (Chao et al., 2016). Por otro lado, se realizó un análisis de agrupamiento de las parcelas de muestreo. Para ello la variable categórica de cobertura fue reemplazada por el valor medio del rango del porcentaje, y se le aplicó la raíz cuadrada a cada valor (Borcard et al., 2011). Para este análisis se utilizó el paquete ‘vegan’ (Oksanen et al., 2019). Se elaboró una matriz de distancias euclídeas entre las parcelas de muestreo, realizando el agrupamiento mediante el método de Ward (1963). Se utilizaron dos niveles de corte para caracterizar los agrupamientos. En primer término, las comunidades fueron definidas mediante el índice “C” que se define como [dw - min(dw)] / [max(dw) - min(dw)], donde dw es la suma de las distancias en el grupo. El índice actúa seleccionando, entre todos los posibles agrupamientos dados los datos, aquel agrupamiento para el cual la sumatoria de los valores de C es mínima (Hubert & Levin, 1976). En segundo término, y para facilitar la interpretación y el análisis de las comunidades, éstas fueron agrupadas en clases de mayor jerarquía mediante el índice de “Hartigan” (Hartigan, 1975). De modo similar al índice “C”, el índice de “Hartigan” está basado en la suma de las distancias en el grupo (dw) y, además, considera su cambio al aumentar la cantidad de grupos. Se define como HK = [(dwk /dwk+1) - 1] (n - k - 1), donde “n” es la cantidad de parcelas y “k” la cantidad de clases propuestas. La cantidad de clases óptima es la mínima cantidad de clases bajo la cual se cumple que HK ≤ 10 (Walesiak & Dudek, 2010; de Amorim & Hennig, 2015). Ambos índices (“C” y “Hartigan”) son ampliamente utilizados en el análisis de agrupamientos (Aho et al., 2008; Chouikhi et al., 2015). Todos los análisis estadísticos se realizaron con el software R 4.0.2 (R Core Team, 2020).
Para cada una de las comunidades determinadas se cuantificó la cobertura media de cada especie. La constancia por especie correspondió a la cantidad de parcelas en las que la especie estuvo presente en relación con el total de parcelas. Para comparar entre comunidades se calculó la cobertura media estandarizada como la cobertura media dividida por la suma de las coberturas de todas las especies integrantes de la comunidad. El grado de invasión de cada comunidad se estimó mediante el índice de invasión medio por parcela. Este índice se define como la división entre cantidad de especies exóticas y la cantidad total de especies. Sus valores se encuentran comprendidos entre 0, cuando no se encuentran especies exóticas, y 1, cuando todas las especies son exóticas (Bridgewater & Backshall, 1981). La comparación de la riqueza por hábitos se realizó agrupando los hábitos en las siguientes categorías: a) Árboles y Palmeras; b) Herbáceas; c) Enredaderas, Lianas y Epifitas y d) Arbustos, Subarbustos y Hierbas subleñosas. Para contrastar los valores de índice de invasión, riqueza total, y riqueza por grupo de hábitos entre las comunidades se utilizaron modelos lineales generalizados, utilizando la comunidad como única variable explicativa. Para los valores de riqueza total se asumió una distribución de probabilidades Poisson (Quinn & Keough, 2002) mientras que para los distintos grupos de hábitos, al presentar sobredispersión significativa, se asumió una distribución Conway-Maxwell-Poisson (Sellers, 2021). En todos los casos en los que se encontraron diferencias significativas se realizaron comparaciones de a pares por el método de Tukey utilizando un nivel de significancia de 0,05.
RESULTADOS
Flora
Se registraron 167 taxones de plantas vasculares, de los cuales 153 se identificaron a nivel de especie y 14 a nivel de género. La riqueza total estimada fue de 183 ± 10 especies con una confianza del 95%. Los taxones identificados pertenecen a 69 familias y 139 géneros. Las familias más representadas fueron Asteraceae, Fabaceae, Cyperaceae y Poaceae (Tabla 1), abarcando en conjunto el 34% de las especies. El género más rico fue Baccharis, con siete especies, seguido por Ipomoea, Hydrocotyle, Ludwigia, Polygonum y Solanum, que estuvieron representados por tres especies cada uno. El 81% de las especies son nativas de Argentina; la mayoría de las familias presentó un predominio de especies nativas, a excepción de Rosaceae que estuvo representada en su totalidad por exóticas (Tabla 1). El nombre, la familia, el hábito y el origen de cada especie se detallan en el Apéndice.
El hábito más representado fue el herbáceo (42%), seguido por el arbóreo (21%) y el arbustivo (13%) (Tabla 2). Por su parte los hábitos de las Herbáceas subleñosas y de las Palmeras, con dos especies cada uno, fueron los menos representados. La mayoría de las especies exóticas fueron Árboles, mientras que entre las nativas el de las Herbáceas fue el hábito más representado.
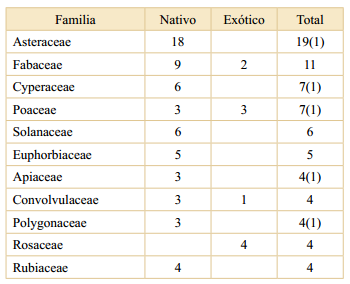
Tabla 1 Taxones por familia según origen. Entre parén- tesis, el número de especies con origen no determinado. Se incluyen las familias con más de tres taxones.
Entre las especies arbóreas y las palmeras se encontró una proporción similar de nativas y exóticas, las únicas dos especies con hábito subleñoso fueron exóticas, en tanto en el resto de los hábitos se observó una mayor proporción de especies nativas (Tabla 2).
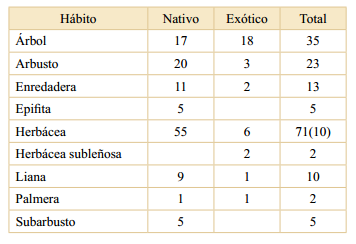
Tabla 2 Taxones por hábito según el origen. Entre parén- tesis, el número de especies con origen no determinado.
Vegetación
El análisis de agrupamiento permitió definir 17 comunidades que se agruparon en 5 clases (Fig. 2, Tabla 3):
Clase I: Está constituida por comunidades con alta constancia y cobertura de Cyperus byssaceus y una baja representatividad de especies exóticas, se diferencian entre sí por la presencia y composición de las especies arbóreas.
a: Bosque de sauce forestal con cortadera: Presenta un estrato herbáceo dominado por Cyperus byssaceus y un estrato arbóreo dominado por sauce forestal (Salix sp.); está asociada a posiciones topográficas bajas del interior de las islas.
b: Pajonal de cortadera: Presenta el estrato herbáceo dominado por Cyperus byssaceus, con Ludwigia elegans como acompañante frecuente y, con menor constancia, Cyclosorus interruptus e Hymenachne grumosa. Además, se pueden encontrar en forma dispersa ejemplares de árboles, principalmente cultivados. También se encuentra asociada a posiciones topográficas bajas.
c: Ceibal: Presenta el estrato herbáceo dominado por Cyperus byssaceus acompañada frecuentemente por Mikania periplocifolia y Ludwigia elegans y, con menor constancia, por Cyclosorus interruptus. Además, presenta un estrato arbóreo abierto dominado por Erythrina crista-galli y, con menor frecuencia, codominancia de esta especie con Salix sp. Asociadas a estas especies arbóreas se encuentran algunas lianas (Cissus palmata), enredaderas (Lonicera japonica, Orthosia virgata) y epifitas (Microgramma sp., Pleopeltis mínima y Rhipsalis lumbricoides). A diferencia de las comunidades anteriores, se encuentra en posiciones topográficas intermedias.
Clase II: Está constituida por bosques dominados por especies de crecimiento espontáneo siendo las más comunes Ligustrum sinense, Lonicera japonica y Myrsine parvula. Se diferencian por la proporción relativa de nativas y exóticas. Son comunidades que se encuentran asociadas a posiciones topográficas altas (albardones).
d: Monte Blanco: Presenta un estrato superior con codominancia de Ligustrum sinense, Lonicera japonica, Myrsine parvula, Allophylus edulis, Blepharocalyx salicifolius y Ocotea acutifolia, con presencia de Orthosia virgata e Ipomoea cairica. Por debajo del estrato arbóreo se encuentran arbustos, representados principalmente por Cyrtocymura scorpioides, Galianthe brasiliensis y, con menor constancia, Varronia dichotoma.
e: Bosque de nogales y glicina: Presenta un estrato superior de Carya illinoinensis y Wisteria sinensis por debajo del cual encontramos Ligustrum sinense y Lonicera japonica. Dado que esta comunidad quedó representada sólo por dos parcelas de muestreo, no se consideró que se pueda hacer una descripción adecuada de la misma y se la excluyó de los análisis cuantitativos y comparativos.
f: Bosque de ligustrina: Se caracteriza por presentar una alta cobertura de Ligustrum sinense, acompañada en la mayoría de las parcelas con Myrsine parvula, Lonicera japonica y Erythrina crista-galli. Los arbustos, lianas y enredaderas presentan una cobertura apreciable, destacándose entre los primeros Amorpha fruticosa, y en menor medida Varronia dichotoma y Cyrtocymura scorpioides.
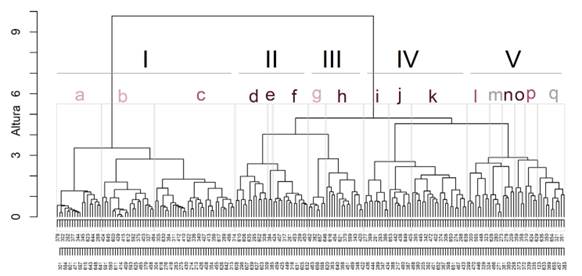
Fig. 2 Dendrograma obtenido del análisis de agrupamiento de la vegetación de sitios con evidencias de antropización actual o pasada en el Delta Frontal. Las llaves delimitan las comunidades. Abreviaturas: a: Bosque de sauce con cortadera. b: Pajonal de cortadera. c: Ceibal. d: Monte Blanco. f: Bosque de ligustrina. g: Bosque de sauce con Rhynchospora. h: Bosque de sauce forestal, ligustrina y canelón. i: Bosque de álamo forestal, ligustro y mora. j: Bosque de álamo forestal, ligustrina, falso índigo y madreselva. k: Bosque de álamo forestal, ligustrina y canelón. l: Bosque de álamo forestal con carrizo. m: Forestación de álamo con formio. n: Bosque mixto con zarzamora y formio. o: Cañaveral de caña de mata. p: Ceibal al con zarzamora. q: Cañaverales, forestaciones de sauce y sitios con suelo desnudo. Los colores representan posiciones topográficas típicas: - Baja; - Media; - Alta; - Indefinida. Los números romanos refieren a las Clases. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index. php/darwiniana/article/view/1041/1265
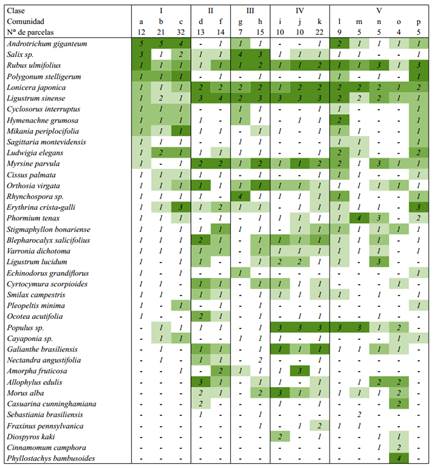
Tabla 3 Comunidades vegetales del Delta Frontal en sitios con evidencias de antropización. Se indica el número de parcelas comprendidas en cada comunidad, cobertura media (considerando los “ceros” de las parcelas en las que la especie estaba ausente) y constancia de las especies. Se incluyen sólo las especies que en alguna comunidad presentaron un valor de cobertura media o constancia mayores a 5% y 40% respectivamente. Abreviaturas: Coberturas: “-”, 0; 1, 0-5%; 2, 5-25%; 3, 25-50%; 4, 50-75% y 5, 75-100%. Constancias: ( ): 0-20%; ( ): 20% - 40%; ( ): 40% - 60%; ( ): 60% - 80%; ( ): 80% - 100%. Comunidades: a: Bosque de sauce forestal con cortadera. b: Pajonal de cortadera. c: Ceibal. d: Monte Blanco. f: Bosque de ligustrina. g: Bosque de sauce forestal con Rhynchospora. h: Bosque de sauce forestal, ligustrina y canelón. i: Bosque de álamo forestal, ligustro y mora. j: Bosque de álamo forestal, ligustrina, falso índigo y madreselva. k: Bosque de álamo forestal, ligustrina y canelón. l: Bosque de álamo forestal con carrizo. m: Bosque de álamo forestal con formio. n: Bosque mixto con zarzamora y formio. o: Cañaveral de caña de mata. p: Ceibal con zarzamora. Los grupos e y q se excluyeron del análisis (ver texto). Los números romanos refieren a las Clases.
Clase III: Está constituida por comunidades con una elevada cobertura de sauce forestal (Salix sp.). Se diferencian en el hábito de las especies acompañantes y en el grado de invasión por especies exóticas.
g: Bosque de sauce forestal con Rhynchospora: Se caracteriza por presentar por debajo del estrato de sauce forestal (Salix sp.) un estrato herbáceo dominado por Rhynchospora sp. acompañada frecuentemente por Rubus ulmifolius. Entre estos estratos se suele encontrar un estrato intermedio de Ligustrum sinense y Lonicera japonica, presentes con una baja cobertura. Fue observada en posiciones topográficas bajas e intermedias.
h: Bosque de sauce forestal, ligustrina y canelón: Se caracteriza por presentar por debajo del estrato de sauce forestal (Salix sp.) un estrato con codominancia de especies arbóreas. En todas las parcelas encontramos Ligustrum sinense y Myrsine parvula y, con una menor constancia, Morus alba y Nectandra angustifolia. Estas especies están acompañadas por Rubus ulmifolius, Lonicera japonica, Orthosia virgata y con menor constancia Varronia dichotoma. Típicamente se encuentra en posiciones topográficas altas.
Clase IV: Está constituida por comunidades con una elevada cobertura de álamo forestal (Populus sp.) y Ligustrum sinense, diferenciándose entre ellas por las especies arbóreas acompañantes. Se encuentran asociadas a posiciones topográficas elevadas (albardón) y presentan una alta representatividad de especies exóticas.
i: Bosque de álamo forestal, ligustro y mora: Se caracteriza por presentar por debajo del estrato superior compuesto por álamo forestal (Populus sp.) otro estrato arbóreo con codominancia de Morus alba, Ligustrum sinense y, con menor constancia, Diospyros kaki y/o Ligustrum lucidum. Estas especies se encuentran acompañadas en la mayoría de los casos por enredaderas, siendo las más constantes Lonicera japonica y Orthosia virgata. En el estrato inferior encontramos a Galianthe brasiliensis acompañada con Rubus ulmifolius.
j: Bosque de álamo forestal, ligustrina, falso índigo y madreselva: Se caracteriza por presentar por debajo del estrato de álamo forestal, un estrato con codominancia de Amorpha fruticosa, Lonicera japonica y Ligustrum sinense. Estas especies se encuentran frecuentemente acompañadas por Myrsine parvula, Rubus ulmifolius y Orthosia virgata.
k: Bosque de álamo forestal, ligustrina y canelón: Se caracteriza por presentar por debajo del estrato de álamo forestal un estrato intermedio con codominancia de Ligustrum sinense, Lonicera japonica y Myrsine parvula. En el estrato inferior encontramos frecuentemente a Rubus ulmifolius, acompañada de Galianthe brasiliensis y menos frecuentemente Blepharocalyx salicifolius.
Clase V: Está constituida por comunidades marcadamente diferentes entre sí en su composición y grado de invasión. Como rasgo común se destaca que constituyen bosques abiertos.
l: Bosque de álamo forestal con carrizo: Se caracteriza por presentar un estrato de álamo forestal (Populus sp.) por debajo del cual encontramos codominancia de Hymenachne grumosa, Cyperus byssaceus y Rubus ulmifolius acompañadas de Lonicera japonica, Ligustrum sinense y Myrsine parvula. Se encuentra en posiciones topográficas intermedias.
m: Bosque de álamo forestal con formio: Se caracteriza por presentar un estrato de álamo forestal y un estrato herbáceo alto dominado por Phormium tenax. Estas especies están acompañadas por Lonicera japonica y Rubus ulmifolius, presentes con bajas coberturas. Fue observada en posiciones topográficas altas e intermedias.
n: Bosque mixto con zarzamora y formio: Está constituido por un ensamble de especies arbóreas con codominancia de Ligustrum lucidum, Myrsine parvula, Ligustrum sinense y Allophylus edulis. Por debajo del dosel arbóreo, encontramos un sotobosque dominado por Rubus ulmifolius o con codominancia de esta especie y Phormium tenax. Fue observada en posiciones topográficas altas.
o: Cañaveral de caña de mata: Se caracteriza por la dominancia de Phyllostachys bambusoides, con un dosel abierto de Casuarina cunninghamiana, Populus sp. o Morus alba y se encuentra en posiciones topográficas altas.
p: Ceibal con zarzamora: Se caracteriza por presentar un estrato arbóreo abierto dominado por Erythrina crista-galli por debajo del cual encontramos codominancia de Rubus ulmifolius, Polygonum stelligerum y Ludwigia elegans. Estas especies se encuentran acompañadas frecuentemente por Cyperus byssaceus, Stigmaphyllon montevidensis, Rhynchospora sp, Cyclosorus interruptus, Ligustrum sinense y/o Myrsine parvula, todas ellas con baja cobertura. Típicamente se encuentra en posiciones topográficas intermedias.
q: Cañaverales, forestaciones de sauce y sitios con suelo desnudo: Este grupo está constituido por pequeños subgrupos con marcadas diferencias en composición y estructura entre ellos. En particular, incluye algunos sitios dominados por Bambusa vulgaris, otros en los que recientemente se cosechó madera, con una elevada proporción de suelo desnudo y sitios con alta cobertura de Salix sp. y alta constancia de Echinodorus grandiflorus. Por lo tanto, no sería correcto considerarlo una única comunidad ni describirlo a través de índices medios de estructura o diversidad como los aquí utilizados. Debido a esto se lo excluyó de los análisis cuantitativos y comparativos de las comunidades. Las posiciones topográficas en las que se encontraron estas parcelas fueron muy variables.
Análisis comparativo de comunidades
El hábito Arbóreo fue el de mayor cobertura en ocho de las 15 comunidades analizadas (Fig. 3A). Entre estas ocho comunidades, la mayoría conforma bosques cerrados con una apreciable cobertura de Lianas y Enredaderas, como son los casos del “Monte Blanco” (d), “Bosque de ligustrina” (f), “Bosque de sauce forestal, ligustrina y canelón” (h) y los bosques de álamo forestal (i, j y k) pertenecientes a la clase IV. El hábito Herbáceo presentó una mayor cobertura en cuatro de las comunidades. En una de ellas, el “Pajonal de cortadera” (b), la cobertura del resto de los hábitos es mínima. Mientras que las tres restantes conforman bosques abiertos, “Ceibal” (c), “Bosque de sauce forestal con cortadera” (a) y “Bosque de álamo forestal con formio” (m). Por su parte, el “Cañaveral de caña de mata” (o) se destaca por presentar una elevada cobertura de Hierbas subleñosas. Las dos comunidades restantes, “Bosque de álamo forestal con carrizo” (l) y “Ceibal con zarzamora” (p) presentan una mayor diversidad de hábitos.
No se encontraron evidencias de cultivo de especies nativas, de modo que todas éstas fueron tratadas como de crecimiento espontáneo. En 13 de las 15 comunidades, la mayor parte de la cobertura fue aportada por especies de crecimiento espontáneo (Fig. 3B). La proporción de exóticas varió de 0,14 hasta 0,95. Las comunidades presentaron diferencias significativas en el valor del índice de invasión (valor p < 0,0001, F[14,174] = 16,36, R2 = 0,56). El “Pajonal de cortadera” (b) y el “Ceibal” (c) presentaron los valores medios más bajos (0,15 y 0,17 respectivamente) mientras que el “Bosque de álamo forestal, ligustro y mora” (i) y el “Bosque de álamo forestal con ligustrina, falso índigo y madreselva” (j) presentaron los valores más elevados (0,49 y 0,6 respectivamente) (Fig. 4A).
En cuanto a la riqueza de las comunidades, su valor medio por parcela osciló entre 9,25 y 17,0 especies según la comunidad (Fig. 4B), siendo 1 y 32 los valores extremos encontrados. La riqueza entre las comunidades resultó significativamente diferente (valor p < 0,0001, χ2 = 68,084, gl modelo nulo = 188, gl modelo ajustado = 174, Devianza explicada = 0,26). Se destacan, por sus bajos valores medios de riqueza el "Bosque de sauce forestal con cortadera” (a), el "Pajonal de cortadera" (b), el "Bosque de sauce forestal con Rhynchospora" (g), el "Bosque de álamo forestal con formio" (m) y el "Cañaveral de caña de mata" (o), aunque no en todos los casos las diferencias con el resto de las comunidades fueron estadísticamente significativas. Al comparar la riqueza de especies de distintos grupos de hábitos, los contrastes entre las comunidades son más marcados y encontramos diferencias significativas para los 4 grupos de hábitos [Árboles y Palmeras: valor p < 0,0001, χ2 = 286,44, gl modelo nulo = 187, gl modelo ajustado = 173, Devianza explicada = 0,22; Lianas, Enredaderas y Epifitas: valor p < 0,0001, χ2 = 55,819, gl modelo nulo = 187, gl modelo ajustado = 173, Devianza explicada = 0,07; Herbáceas: valor p <0,0001, χ2 = 183,28, gl modelo nulo = 187, gl modelo ajustado = 173, Devianza explicada = 0,2); Arbustos, Subarbustos y Hierbas Subleñosas: valor p < 0,0001, χ2 = 45,635, gl modelo nulo = 187, gl modelo ajustado = 173, Devianza explicada = 0,08]. El “Monte Blanco” (d) es la comunidad con mayor riqueza de arbóreas, el “Bosque de álamo forestal con carrizo” (l) y el “Ceibal con zarzamora” (p) presentaron la mayor riqueza de Herbáceas, en tanto el “Ceibal” (c) presentó la mayor riqueza de Enredaderas, Lianas y Epífitas. El grupo de Arbustos, Subarbustos y Hierbas subleñosas presentó una mayor homogeneidad de valores de riqueza (Fig. 4C).
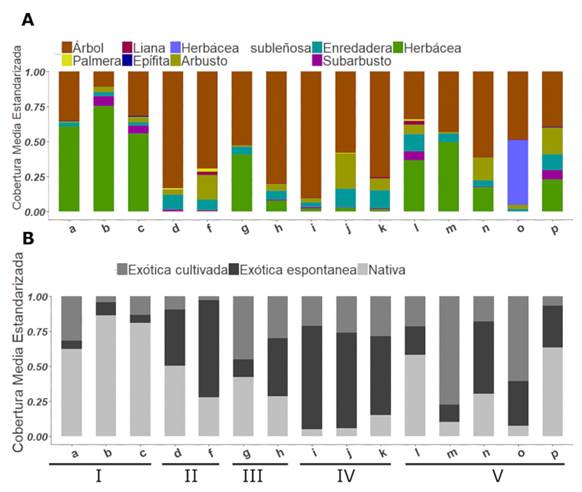
Fig. 3 A, Proporción de la cobertura media dada por cada hábito para las comunidades descritas exceptuando e y q. B, Proporción de la cobertura media dada por especies exóticas cultivadas, espontáneas exóticas y nativas (espontáneas). Abreviaturas: a: Bosque de sauce forestal con cortadera. b: Pajonal de cortadera. c: Ceibal. d: Monte Blanco. f: Bosque de ligustrina. g: Bosque de sauce forestal con Rhynchospora. h: Bosque de sauce forestal, ligustrina y canelón. i: Bosque de álamo forestal, ligustro y mora. j: Bosque de álamo forestal, ligustrina, falso índigo y madreselva. k: Bosque de álamo forestal, ligustrina y canelón. l: Bosque de álamo forestal con carrizo. m: Bosque de álamo forestal con formio. n: Bosque mixto con zarzamora y formio. o: Cañaveral de caña de mata. p: Ceibal con zarzamora. Los números romanos refieren a las Clases. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index. php/darwiniana/article/view/1041/1265
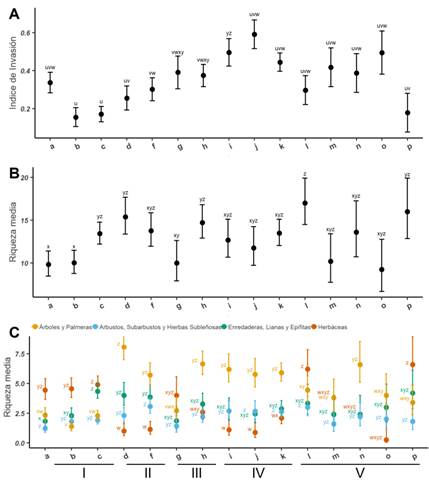
Fig. 4 Comparación entre las comunidades. A, Índice de invasión. B, Riqueza por parcela (Devianza explicada = 0.25). C, Riqueza por parcela para distintos grupos de hábitos, las barras representan, el intervalo de confianza (95%) de la media. Abreviaturas: a: Bosque de sauce forestal con cortadera. b: Pajonal de cortadera. c: Ceibal. d: Monte Blanco. f: Bosque de ligustrina. g: Bosque de sauce forestal con Rhynchospora. h: Bosque de sauce forestal, ligustrina y canelón. i: Bosque de álamo forestal, ligustro y mora. j: Bosque de álamo forestal, ligustrina, falso índigo y madreselva. k: Bosque de álamo forestal, ligustrina y canelón. l: Bosque de álamo forestal con carrizo. m: Bosque de álamo forestal con formio. n: Bosque mixto con zarzamora y formio. o: Cañaveral de caña de mata. p: Ceibal con zarzamora. Los números romanos refieren a las Clases. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index. php/darwiniana/article/view/1041/1265
DISCUSIÓN
Flora registrada
Los 167 taxones registrados ya habían sido documentados para el Delta del Paraná y representan el 24% del total de especies documentadas para esta región (Burkart, 1957; Madanes et al., 2015). Esto es una proporción elevada si se tiene en cuenta que el área de estudio es pequeña (32,2 km2) en relación con la extensión regional (17500 km2), aunque por otro lado es esperable dado que la unidad de paisaje en la cual se realizó el estudio presentaba, originalmente, las comunidades con mayor diversidad específica de la región (Malvárez, 1999). A escala de unidad de paisaje, en el presente trabajo se registró el 83% del total de las especies documentadas para el Delta Frontal en trabajos sobre comunidades vegetales (Kandus et al., 2003; Kandus & Malvárez, 2004; Vallés et al., 2006; Kalesnik et al., 2008, 2011; Valle, 2013; Ramello, 2014; Sirolli et al., 2021); y se registraron
60 especies nuevas, de manera que el listado para esta unidad asciende de 141 a 201 especies.
La mayoría de las especies registradas son nativas de la Argentina de acuerdo con la base de datos de Anton & Zuloaga (2022). Respecto de las especies exóticas, su porcentaje (19%) supera lo reportado por Kalesnik & Malvárez (2004) para el Bajo Delta (16%). En particular, en algunas familias, como Rosaceae, Rutaceae y Salicaceae, la cantidad de especies exóticas registrada en este estudio supera a la totalidad de las nativas registradas para la región (Burkart, 1957; Madanes et al., 2015). Este resultado es consistente con la historia de uso e introducción de especies exóticas en el territorio, en particular de especies de frutales pertenecientes a Rosaceae (géneros Malus, Pyrus, Prunus, Cydonia) y Rutaceae (géneros Citrus, Poncirus) así como forestales de la familia Salicaceae (géneros Populus, Salix) (Galafassi, 2005). Por otra parte, muchas de las especies exóticas registradas son especies muy utilizadas en parquizaciones (Fraxinus, Acer, Platanus, Casuarina, Cinnamommum, Ligustrum) (Burkart, 1957). Muchas de estas especies arbóreas se han naturali- zado, explicando los resultados obtenidos de mayor representatividad de especies exóticas en este hábito.
Vegetación
En esta sección se discuten en primer término las comunidades que presentaron una gran similitud con comunidades descritas en detalle en la literatura especializada (Kandus et al., 2003; Kandus & Malvárez, 2004; Vallés et al., 2006; Kalesnik et al., 2008, 2011; Valle, 2013; Ramello, 2014; Sirolli et al., 2021), luego aquellas que han sido mencionadas aunque no descritas en profundidad en el Delta Frontal y por último, situaciones novedosas no descritas previamente.
Entre los bosques de albardón, aquellos que pertenecen a la Clase IV (i, j, k), presentaron una gran similitud en composición e índice de invasión, tanto con los “neoecosistemas de albardón” de mediano a alto tiempo de abandono descritos por Kalesnik & Aceñolaza (2008) y Kalesnik et al. (2011) como con los bosques “posforestales” de mayor xenodiversidad caracterizados por Sirolli et al. (2021). Algunas diferencias en la importancia relativa de las especies constituyentes, en relación con los trabajos previos, son la baja cobertura y constancia de Acer negundo y Fraxinus pennsylvanica y la mayor cobertura y constancia de Amorpha fruticosa y Morus alba.
Por otro lado, el “Monte Blanco” (d) descrito en este trabajo presentó una gran similitud con el “Monte Blanco” descrito para el Delta Frontal por Vallés et al., 2006, Kalesnik et al., 2008 y Sirolli et al., 2021, siendo sus especies arbóreas más comunes Blepharocalyx salicifolius, Myrsine parvula, Allophyllus edulis, Ocotea acutifolia, Nectandra angustifolia y Ligustrum sinense. El índice de invasión de esta comunidad fue el más bajo entre las comunidades de bosque estudiadas y se encuentra en el rango de valores reportados por Kalesnik et al. (2008) para los remanentes de Monte Blanco. También encontramos diferencias respecto de los trabajos previos. Inga uraguensis, Ligustrum lucidum y Daphnopsis racemosa han sido mencionadas como componentes comunes de esta comunidad, pero fueron muy poco constantes en este estudio y, por el contrario, se encontró con alta constancia a Varronia dichotoma, que no fue mencionada en los trabajos de caracterización de bosques de albardón del Delta Frontal.
Por último, entre las comunidades de albardón, también encontramos bosques con características intermedias entre el “Monte Blanco” y Bosques de álamo forestal que, si bien poseen una elevada cobertura de especies exóticas tanto espontáneas como cultivadas, también presentan una cobertura apreciable de especies nativas, como el “Bosque de ligustrina” (f), el “Bosque de sauce forestal, ligustrina y canelón” (h) y el “Bosque mixto con zarzamora y formio” (n). Sirolli et al. (2021) describieron la existencia de un gradiente de importancia relativa de especies nativas y exóticas en los bosques de albardón. Este gradiente está asociado al tiempo de abandono de las actividades productivas de manera que, en los sitios usados recientemente predominan especies exóticas, mientras que en los sitios con uso lejano lo hacen las especies nativas. Las diferencias entre los tres grupos de bosques descritos anteriormente pueden ubicarse a lo largo de este gradiente: los bosques de álamo forestal (i, j, k) de la clase IV corresponderían a los sitios con menor tiempo de abandono, mientras que el Monte Blanco (d) correspondería a los sitios con mayor tiempo de abandono. El resto de los bosques (f, h, n) corresponderían a situaciones intermedias.
El “Pajonal de cortadera” (b) y el “Ceibal” (c) también corresponden a comunidades ya descritas en la región (Kandus et al., 2003; Kandus & Malvárez, 2004). En los pajonales del delta las especies acompañantes suelen ser buenos indicadores de diferencias en el grado de inundabilidad del sistema (Kandus et al., 2003). En comparación con los pajonales descritos previamente, en este trabajo se encontró una menor constancia de Senecio bonariensis y Schoenoplectus californicus, especies asociadas a ambientes más inundables, y una mayor constancia de Rubus ulmifolius y especies arbóreas, asociadas a ambientes menos inundables. En conjunto, estas diferencias indican que estos pajonales serían menos inundables que los descritos en la bibliografía (Kandus et al. 2003). Considerando que la sistematización restringe la inundabilidad del terreno, las diferencias observadas podrían deberse a la persistencia de este efecto en los sitios estudiados.
Por su parte, en el “Ceibal” (c), a diferencia de los estudios previos realizados en ambientes naturales del Delta Frontal, encontramos en múltiples parcelas de muestreo la codominancia de ceibo con sauce forestal. Esta diferencia es esperable dado el uso antrópico pasado de las parcelas, aunque la representatividad de especies exóticas fue baja y el valor del índice de invasión fue de los más bajos encontrados. Por otro lado, la principal diferencia con el “Pajonal de cortadera” (b), comunidad con la que comparte la composición del estrato inferior, se da en que el “Ceibal” presenta una mayor riqueza.
Esto se explica por la gran cantidad de enredaderas, lianas y epífitas que se desarrollan sobre los ceibos. En otras regiones ya se ha reportado que el ceibo se caracteriza por portar una gran cantidad de especies pertenecientes a estos hábitos (Eggli et al., 2008; Silva et al., 2010; Machado et al., 2016). En relación con los bosques de albardón (comunidades d, h, i, j, k, n), la riqueza del “Ceibal” (c) no difirió significativamente, aunque se observó que los primeros presentaron una mayor riqueza arbórea en tanto el segundo una mayor riqueza de herbáceas.
Por otra parte, el “Ceibal con zarzamora” (p) no presentó Cyperus byssaceus como especie dominante dentro del grupo de las herbáceas, siendo esta una situación no descrita previamente para el Delta Frontal. En el Delta en Formación, Kandus & Malvárez (2004) describieron ceibales con un estrato herbáceo mixto de composición similar al de esta comunidad, aunque con menor representatividad de Rubus ulmifolius y sin especies arbóreas ni especies cultivadas como el formio.
El “Bosque de sauce forestal con cortadera” (a) y el “Bosque de sauce forestal con Rhynchospora” (g) se caracterizaron por ser comunidades asociadas a forestaciones, pero con la particularidad de estar ubicadas por fuera de los albardones. Comunidades con estas características, si bien son mencionadas en las descripciones generales de la región (Burkart, 1957), fueron poco analizadas en trabajos previos en el Delta Frontal. Valli & Adámoli (1990) caracterizaron la vegetación asociada a forestaciones de sauce con distintos tiempos de abandono en la Planicie Deltaica Superior. Los autores encontraron que tanto la cobertura de salicáceas como la riqueza y la diversidad decaen conforme incrementa el tiempo de abandono de la actividad productiva, debido a la regeneración del régimen hidrológico original por la colmatación del sistema de drenaje. Dada la similitud estructural entre las comunidades descritas en el presente trabajo y las reportadas por estos autores, es posible entonces que este proceso explique las diferencias entre el “Bosque de sauce forestal con cortadera” y el “Bosque de sauce forestal con Rhynchospora”. En este caso, el “Bosque de sauce forestal con cortadera” correspondería a una comunidad de mayor tiempo de abandono que el “Bosque de sauce forestal con Rhynchospora”, ya que esta última es una comunidad más diversa y presenta una cobertura mayor de sauce forestal.
El “Bosque de álamo forestal con carrizo” (l) coincide con la descripción de Burkart (1957) cuando menciona que elementos propios de los carrizales persisten en forestaciones de álamo y sauce. Su característica más destacable es su elevada riqueza, la cual supera a la de todas las comunidades estudiadas y si bien está dada principalmente por especies herbáceas, tiene un componente importante dado por el resto de los hábitos.
El “Cañaveral de caña de mata” (o) y el “Bosque de álamo forestal con formio” (m) constituyen situaciones novedosas en la caracterización de la vegetación del Delta Frontal. La primera conformó un macizo homogéneo con un entramado denso de tallos de caña, acompañada con un pequeño conjunto de especies con baja cobertura, esto es esperable dado que las Bambusoideae tienen un alto potencial invasor (Xu et al., 2020). La fuerte dominancia de Phyllostachys bambusoides y su potencial invasor contrasta con la relativamente baja constancia con la que se la encontró en el muestreo. Es posible que la expansión de esta especie se vea interrumpida por la segmentación de los albardones al construir las zanjas (Galafassi, 2005), lo cual impide su propagación vegetativa a lo largo del albardón. Respecto las parcelas de “Bosque de álamo forestal con formio”, posiblemente correspondan a lugares antiguamente utilizados para el cultivo de formio en los que, luego de su abandono, se plantó álamo. Plantaciones de formio han sido reportadas para la región por Burkart (1957) y mencionadas por pobladores locales. También se encontraron coberturas apreciables de formio en algunas de las parcelas del “Bosque mixto con zarzamora y formio” (n), el “Ceibal con zarzamora” (p) y el “Ceibal” (c). Esta especie fue reportada como una especie de crecimiento espontáneo en la costa del Río de la Plata y en el Delta del Paraná (Hurrell et al., 2009). Debido al patrón espacial con el que encontramos a esta especie y a relatos de pobladores locales sobre la ubicación de las plantaciones, interpretamos que su presencia en el área de estudio respondería más a su capacidad de persistir luego del abandono del cultivo que a un proceso de invasión.
La modificación en el régimen hidrológico por la sistematización del terreno permite entender las particularidades de las comunidades que encontramos en las posiciones topográficas bajas e intermedias descritas en los párrafos previos. Esta sistematización, por un lado, permite la supervivencia de algunas especies cultivadas como el sauce y el formio, que se las encuentra en distintas comunidades de las zonas bajas e intermedias de las islas. Por otro lado, habilita que Rhynchospora sp., una especie nativa generalmente poco representada en las comunidades naturales, adquiera un desarrollo considerable, llegando a dominar el estrato herbáceo en determinadas situaciones. Si bien en el presente trabajo no hemos analizado la distribución espacial de estas comunidades, es importante considerar que la sistematización pudo generar modificaciones en la topografía local de manera que comunidades propias de las posiciones topográficas altas e intermedias puedan desarrollarse en el interior de las islas.
CONCLUSIÓN
Este trabajo pone de relieve la gran riqueza taxonómica y diversidad de comunidades que existen actualmente en sitios del Delta Frontal que son o han sido intervenidos antrópicamente. Algunas comunidades se encuentran dominadas por especies exóticas, tanto cultivadas como de crecimiento espontáneo, mientras que otras presentan una gran similitud con aquellas típicas de esta unidad de paisaje (Pajonal, Ceibal y Monte Blanco), contando con una importante riqueza de especies nativas. Además de ampliar la caracterización de las comunidades deltaicas y la descripción de situaciones novedosas, este trabajo permite la comparación cuantitativa entre estas comunidades complementando los trabajos preexistentes. Como se dijo, esta gran diversidad en la vegetación se da en un contexto en el que ha habido una historia de uso intenso de los recursos, y una fuerte intervención sobre los regímenes de disturbio naturales. Mostrando que aun en estos escenarios, que se repiten en otros importantes deltas del mundo (Mitsch & Gosselink, 2015; Nicholls et al., 2020), vale la pena, y es necesario, plantear estrategias de gestión orientadas a garantizar la conservación de la biodiversidad, sin dejar de contemplar e integrar las prácticas productivas locales. En este sentido la Reserva de Biósfera Delta del Paraná es un marco idóneo para diseñar e implementar estas estrategias y los resultados aquí expuestos constituyen una valiosa información de base para esta tarea.












 uBio
uBio 

