PUNTOS CLAVE
• En Argentina existen escasas publicaciones con una mirada crítica hacia las propagandas médicas.
• Este estudio destaca la escasa información sobre la seguridad de los fármacos, en contraposición a la ele vada información sobre posibles indicaciones. Asimismo, existe un elevado porcentaje de información cuestionable en los gráficos e imágenes de las propagandas.
• Al menos en nuestra muestra, las publicidades médicas presentan información deficiente en contraposición al uso racional de medicamentos.
En 1985, en Nairobi, la Organización Mundial de la Salud (OMS) definió el uso racional de medicamentos, decía allí: “Usar racionalmente los medicamentos significa que los pacientes reciban fármacos apropiados para sus necesidades clínicas, a dosis ajustadas a su situación particular, durante un período adecuado de tiempo y al mínimo costo posible para ellos y para la comunidad”1. Dentro del uso racional de medicamentos se encuentra la propaganda médica.
La OMS, en 1988, estableció los criterios éticos para la promoción, publicidad y propaganda de medicamen tos, los cuales tienen como finalidad fomentar e impulsar el cuidado de la salud de las personas mediante el uso racional de medicamentos2,3. A nivel internacional, cada agencia regulatoria presenta sus propias normativas para la regulación de las propagandas médicas, como es el caso de la guía BLUE de la MHRA (Medicines and Health Products Regulatory Agency) de Reino Unido, Red Panamericana para la armonización de la regla mentación farmacéutica (RED PARF), por citar algunos ejemplos4,5.
En Argentina, tanto la Administración Nacional de Medicamentos, Alimentos y Tecnología médica (ANMAT) como el Ministerio de Salud de la Nación, establecieron que los mensajes publicitarios deberán promocionar un medicamento aportando información veraz, clara y pre cisa2,3. Asimismo, no deberán ser engañosos ni tampoco atribuir al medicamento propiedades terapéuticas que no fueran aprobadas o reconocidas por la autoridad sanitaria3.
La Red PARF entiende por promoción a “todas las actividades informativas y de persuasión desplegadas por fabricantes y distribuidores con el objetivo de inducir a la prescripción, la dispensación, el suministro, la adquisición o la utilización de medicamentos, independientemente de las estrategias, los medios y los vehículos de comu nicación empleados (incluido el patrocinio de congresos, la entrega de muestras gratuitas y otros)”4. A su vez, entre sus criterios destaca que la información contenida en dichas promociones, publicidades o propagandas se debe basar en evidencia científica comprobable; deberán contener referencias bibliográficas y ser aprobadas por autoridades sanitarias reguladoras o pertinentes.
En la práctica médica, la actualización de conteni dos es constante y muchas veces es casi imposible de abarcar, lo que conlleva a conocer un fármaco a través de la propaganda médica. En suma, como estudiaron Castresana y col., las prácticas de promoción influyen en los patrones de prescripción médica, especialmente entre médicos residentes6.
Por lo anteriormente citado, el objetivo del presente es tudio fue analizar las propagandas médicas de fármacos neurológicos para determinar si la información brindada es apropiada para la prescripción racional y es acorde a los criterios de la OMS.
Materiales y métodos
Se realizó un estudio descriptivo a través de la recolección de propagandas de medicamentos de uso neurológico en formato impreso durante el período de marzo a octubre del 2018. Estos fueron solicitados a neurólogos a cargo de con sultorios en la Ciudad Autónoma de Buenos Aires (CABA) quienes los recibieron de forma aleatoria a través de agentes de propaganda médica.
Se incluyeron todos los folletos recibidos, excluyendo aquellos duplicados y las propagandas médicas que no fueran folletos informativos de los fármacos, como publicidades en recetarios, vademécum, revistas médicas y monografías. El presente trabajo fue centrado solamente sobre la información impresa entregada a médicos y no fue su objetivo evaluar la publicidad dirigida al paciente (medicamentos de venta libre) ni tampoco la promoción en los medios audiovisuales.
Los materiales fueron evaluados cualitativamente por un comité de docentes de Farmacología de la II Cátedra de Far macología de la Universidad de Buenos Aires (UBA), entre ellos especialistas en Farmacología y ciencia regulatoria. Se realizaron búsquedas bibliográficas para la evaluación de la información de cada folleto.
Se clasificaron los fármacos publicitados según el Sistema de Clasificación Anatómica, Terapéutica, Química (ATC del in glés Anatomical, Therapeutic, Chemical classification system)7.
Se evaluó la procedencia del laboratorio, es decir si era nacional o extranjero8.
Se utilizaron como fuentes de referencia los prospectos de la ANMAT, Food and Drugs Administration (FDA) y varios manuales de farmacología8-12. A su vez, se investigó si se trataba de promoción off-label del fármaco, considerando la misma como indicaciones médicas que no fueran acordes a las autorizadas por las agencias regulatorias (ANMAT, FDA y la European Medicines Agency (EMA))8-10.
Se examinó el contenido informativo de cada folleto según los criterios éticos de la OMS y la disposición regulatoria de ANMAT para la publicidad, propaganda y promoción de medicamentos3,4. También se tuvo en cuenta la Resolución del Ministerio de Salud N° 627/2007, sobre las “Buenas Prácticas de Promoción de Medicamentos de Venta Bajo Receta”2. Por lo tanto, se determinó si cada propaganda incluía el prospecto completo, indicación médica, contraindicaciones, reacciones adversas, advertencias, precauciones, posología y el meca nismo de acción según disposición ANMAT 5904/9613.
Por otro lado, se comparó si la información brindada por la propaganda impresa se encontraba dentro de los libros Las bases farmacológicas de Goodman & Gilman y Farmacología Humana de Jesús Flórez11,12.
Asimismo, se evaluó si contenían información sobre la bibliografía, si las citas eran acordes a las recomendaciones del International Committee of Medical Journal Editors y si éstas eran accesibles14.
Se analizó si el texto, las imágenes y los gráficos eran controversiales. De acuerdo con los criterios éticos de la OMS, se calificó como “engañosa” a aquella publicidad que inclu yera mensajes, símbolos o imágenes de cualquier naturaleza que distorsionaran, indujeran a error o confusión respecto al origen, los resultados, los beneficios, las características o las indicaciones aprobadas por las autoridades sanitarias4. También aquella que exaltara exageradamente la hombría o la femineidad del público a que iban dirigidas4. Con el propósito de realizar una evaluación objetiva, cada folleto fue analizado por tres expertos en forma paralela e independiente, sin que ninguno supiera la decisión del otro, definiéndose la califica ción de engañosa por mayoría (2/3).
Por último, se revisó el listado de especialidades me dicinales que se encuentra en Plan de Gestión de Riesgo (PGR) y se analizaron las características de los folletos de este subgrupo de fármacos. Esta exploración fue basada en el hecho crucial de que dentro de los contenidos de un PGR se encuentra la información médica dada por la industria farmacéutica para garantizar una buena farmacovigilancia del producto15-17.
Los datos fueron recolectados en una hoja de cálculo Ex cel, procesados y analizados utilizando IBM SPSS Statistics 24.0. Se realizó estadística descriptiva.
Dada la metodología descripta, el presente estudio no requirió la aprobación de un Comité de Ética. Resultados previos preliminares fueron presentados en modalidad póster y distinguidos dentro de la sesión de trabajos destacados de farmacología en el Congreso Argentino de Neurología 201818.
Resultados
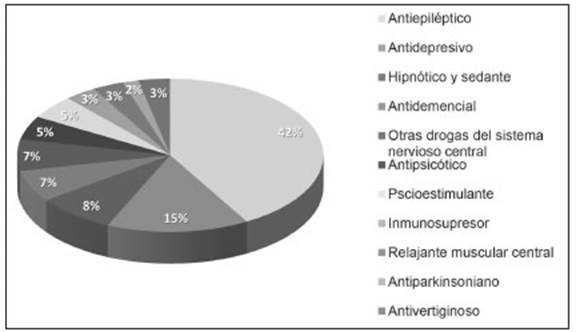
Se analizaron 60 folletos publicitarios de medicamentos neurológicos, de los cuales el 70% (n = 42) eran de laboratorios de origen nacional y el 30% (n = 18) eran extranjeros. Las familias de fármacos publicitadas más frecuentemente fueron los antiepilépticos y antidepresivos con 51.0% (n = 25) y 18.4% (n = 9), respectivamente (Fig. 1). Dentro de los antiepilépticos se destacaron leve tiracetam y pregabalina. El 33.3% (n = 20) de los folletos incluían los prospectos completos y un caso publicitaba una indicación off-label.
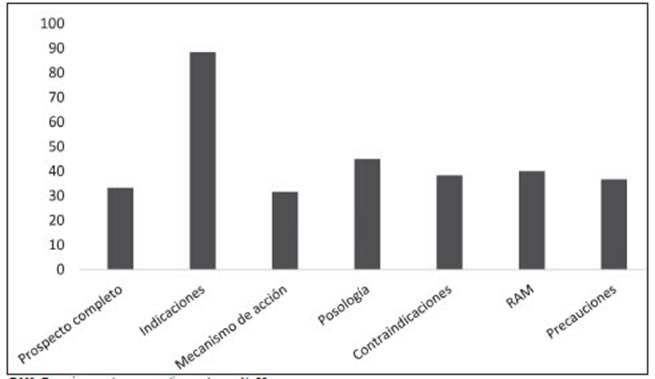
Los prospectos incluidos eran acordes según ANMAT en todos los casos, según FDA en el 98.3% (n = 59), y según EMA en el 96.7% (n = 58). Teniendo en cuenta las diferentes partes del prospecto, los folletos exponían las indicaciones 89.3% (n = 53), el mecanismo de acción en el 31.7% (n = 19), las reacciones adversas medicamen tosas 40% (n = 24), la posología en el 45% (n = 27), las contraindicaciones 38.3% (n = 23) y en el 36.7% (n = 22) las precauciones necesarias (Fig. 2).
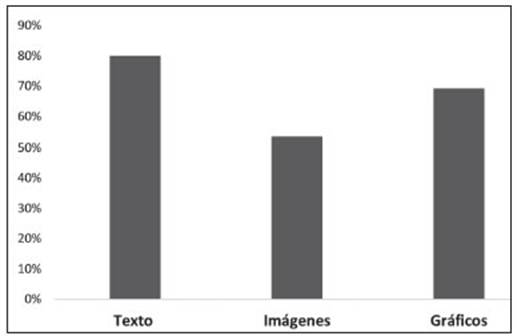
Por otra parte, se evaluó si la información contenida en los folletos, tanto el texto como los gráficos era falaz, detectando que el 80% (n = 48) tenían este tipo de con tenido. Asimismo, se determinó que el 53.3% (n = 32) contenían imágenes “engañosas”. El 43.3% (n = 26) de los folletos contenían gráficos, de los cuales el 69.2% (n = 18) presentaba un mensaje capcioso (Fig. 3) según la definición de la OMS. Con respecto a las citas bibliográ ficas, fueron incluidas en el 75% (n = 45), de las cuales 95.6% (n = 43) estaba correctamente citada.
Por último, se examinaron los fármacos que se encuentran actualmente dentro de un PGR (farmacovi gilancia). En este grupo se recibieron folletos de fingo limod, dextrometorfano-quinidina, acetato de glatiramer, fampiridina, onabotulinumtoxin A y dimetilfumarato. En este subgrupo de fármacos, el prospecto se encontraba completo en el 16.7% (n = 1), el mecanismo de acción en el 33.3% (n = 2), la posología el 16.7% (n = 1). Las contraindicaciones y las precauciones se hallaban en un solo folleto (16.7%) y las reacciones adversas en el 33.3% (n = 2). La bibliografía estaba disponible en el 50% (n = 3) de los folletos, de las cuales todas se encontraban correctamente citadas y accesibles.
Discusión
En Argentina, existen escasas publicaciones con una mirada crítica hacia las propagandas médicas. En el año 2011, Mejía y Avalos realizaron un trabajo en el cual se evaluaron 30 propagandas, de las cuales el 45.8% de las citas bibliográficas se encontraban de forma incorrecta19. A su vez, destaca que en ninguna propaganda se men cionaban las reacciones adversas y/o las precauciones. En el mismo año, Vacca y col. investigaron sobre las dife rentes regulaciones de publicidades médicas tanto las de venta bajo prescripción como las de venta libre en cinco países de Latinoamérica (Argentina, Colombia, Ecuador, Nicaragua y Perú)20. Evaluaron 132 piezas publicitarias, encontrando que la información más frecuentemente fal tante era la relacionada con la seguridad de los fármacos. Además, observaron que el 35.3% de las publicidades de fármacos bajo prescripción presentaban indicaciones no aprobadas, y Argentina se destacó por presentar un bajo porcentaje de cumplimiento de su propia regulación20.
Asimismo, en Argentina, la información médica brin dada por medios de comunicación dirigida a la población general es inapropiada según un estudio realizado por Izcovich y col., destacando una discordancia importante entre las indicaciones médicas publicitadas y las recomen daciones basadas en evidencia21. Si bien en el presente estudio las indicaciones eran acordes en su mayoría, fueron presentadas de forma engañosa y/o capciosa. Sigue siendo igual de necesaria la implementación de medidas destinadas a mejorar la calidad de la información médica que reciben tanto la población general como la población médica.
Con respecto a la seguridad de los fármacos publi citados en el ámbito de la neurología, el porcentaje de propagandas que contienen información acerca de las reacciones adversas fue apenas del 40%. Si bien repre senta una mejoría respecto a lo anteriormente publicado, continúa siendo un valor bajo. Dicha información resulta indispensable tanto para la prescripción adecuada de medicamentos, como para el seguimiento terapéutico y pesquisa de reacciones adversas.
Las reacciones adversas medicamentosas se encuen tran entre la cuarta y la sexta causa de muerte a nivel mundial, siendo de suma importancia su notificación a los entes regulatorios en la etapa de postcomercialización23. Dentro de las estrategias de farmacovigilancia existen los PGR, los cuales tienen el objetivo de asegurar que los beneficios de un fármaco superen los riesgos, tanto para el paciente como para la comunidad15. Éstos incluyen información acerca del perfil de seguridad del fármaco, actividades para incrementar el conocimiento de su segu ridad y los factores de riesgo para padecer una reacción adversa, entre otros.
Los entes regulatorios son los encargados de evaluar y aprobar las indicaciones de los fármacos en base a la calidad, eficacia y seguridad del producto para tales fines. Aquellos usos no evaluados al momento del registro se denominan off-label22. Es inadmisible incluir este tipo de indicaciones no probadas como herramientas de promo ción de un fármaco debido a que se contrapone con los criterios éticos y la normativa establecida.
En el presente trabajo se realizó un subanálisis de las publicidades sobre drogas que se encontraban en PGR16. El 83.3% (n = 5) no contenían prospecto, contraindica ciones o precauciones en el folleto. Esto se contrapone no solo con las buenas prácticas de farmacovigilancia sino con la normativa regulatoria vigente, evidenciando la dificultad para fiscalizar la propaganda dentro del con sultorio médico.
En Argentina, el número de prescripciones médicas sin indicación precisa es elevado, posiblemente parte del pro blema sea la falta de información o acceso a información de calidad. Rojas y col. investigaron sobre la prescripción de fármacos antidemenciales, denunciando una alta tasa de prescripción de fármacos no recomendados, como dihidroergotoxina, nimodipina, entre otras24. Reciente mente, Bustin y col. demostraron que las prescripciones inadecuadas de dichos medicamentos generan un gran impacto económico en el gasto público en la Argentina25. Por lo tanto, la regulación de las propagandas médicas tiene impacto no solo en el potencial daño al paciente, sino también en los gastos en salud.
En relación a las limitantes del trabajo, se analizó una muestra restringida al área de neurología de la publicidad farmacéutica, pero mayor a lo revisado en trabajos publi cados previamente en nuestro país19,20. Se determinó que lo importante para este trabajo era el material publicitario, considerando que no hay lugares seleccionados para la promoción de medicamentos20. Por otro lado, otra limitante del trabajo es que la definición de información “engañosa” se hizo a partir de un análisis cualitativo personal, par ticularmente con las imágenes de los folletos donde su observación puede ser aún más subjetiva. Por último, una posible fuente de sesgo es el hecho de que los folletos no fueron directamente recibidos por los investigadores. El hecho de que no se les explicara el objetivo de la inves tigación a los profesionales a quienes se les solicitaron folletos, fue una estrategia para minimizar el riesgo de sesgo de selección por parte de los mismos.
En conclusión, al menos en nuestra muestra la publi cidad entregada por los agentes de propaganda médica fue deficiente, faltando en muchos casos información básica para la prescripción e incumpliendo incluso con las normas regulatorias de nuestro país. La proporción de información sobre indicaciones es mucho mayor con respecto a la escasa información brindada sobre la seguridad de los fármacos. Por lo tanto, debido a que la industria farmacéutica es quién financia y lleva a cabo el desarrollo y promoción de nuevos fármacos, es fundamen tal que dichas prácticas de difusión estén rigurosamente reguladas, de modo que sean una fuente confiable y no meramente un instrumento comercial. El presente trabajo no pretende elaborar un juicio de opinión sino ser una fuente de reflexión para todos los que intervienen en el acto de prescripción: el médico, la industria farmacéutica y las autoridades regulatorias.