INTRODUCCION
Las infecciones por Staphylococcus aureus (SA) son prevalentes en nuestro país; se estima que casi un 80 % de ellas son causadas por Staphylococcus aureus meticilino resistente de la comunidad (SAMR-C) y pueden tener una evolución grave. Los casos en pacientes mayores de 8 años con neumonía, meningitis o sepsis presentan mayor morbimortalidad. En los últimos años se ha incrementado la tasa de hospitalización por SAMR-C.1'2
La bacteriemia por Staphylococcus aureus se define como el aislamiento de dicho germen en al menos un cultivo de sangre. Las metástasis infecciosas se originan por diseminación hematógena y su posterior localización en un sitio distinto al órgano en donde se originó el proceso infeccioso.3 La prevalencia en la presentación de estos focos infecciosos secundarios es baja en la edad pediátrica, siendo el SA el microorganismo que más frecuentemente los causa; por lo que representa un desafío diagnóstico.4'5
Se presenta el caso de un paciente pediátrico con una celulitis facial por Staphylococcus aureus, con metástasis infecciosas y evolución tórpida.
CASO CLÍNICO
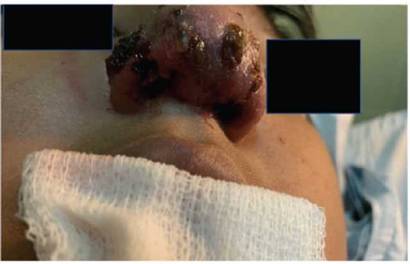
Paciente de sexo masculino de 10 años de edad, con obesidad, peso 105 kg (índice de masa corporal 40 kg/m2), sin controles de salud en el último año. Con antecedentes personales y familiares de forunculosis. Consultó por lesión inflamatoria en región nasal acompañada de edema y eritema perinasal y periorbitario (Figura 1). Por dicha lesión, el paciente recibió tratamiento antibiótico con trimetoprima sulfametoxazol vía oral durante 48 horas a dosis óptima (320 mg/día), previo a la consulta, sin mejoría.
Al momento del ingreso, a la sala de internación de Pediatría, se encontraba febril y en regular estado general. Se realizó análisis de laboratorio en el que se halló como dato positivo una franca leucocitosis con neutrofilia (20 300 glóbulos blancos/mm3, 77 % neutrófilos, 10 % linfocitos, 12 % monocitos) y proteína C reactiva elevada (13,6 mg/dl). Función renal y hepática en límites normales.
Se realizó tomografía de macizo craneofacial, donde se observó engrosamiento de los tegumentos de la cara, principalmente a nivel periorbitario y nasal. Con diagnóstico inicial de celulitis de puente nasal, en el primer día de internación, se inició tratamiento antibiótico empírico intravenoso con vancomicina y piperacilina-tazobactam, previa toma de 2 muestras para cultivo de sangre periférica. Se obtuvieron 2 hemocultivos positivos, en horas 12 y 15, según método cualitativo para Staphylococcus aureus meticilino resistente (sensible a vancomicina, trimetoprim-sulfametoxazol, linezolid, clindamicina, minociclina, tigeciclina, ceftarolina, ciprofloxacina, eritromicina; resistente a oxacilina).
Figura 1: Lesión máculo pápulo eritematosa con costras melicéricas en región nasal acompañada de edema y eritema perinasal y periorbitario
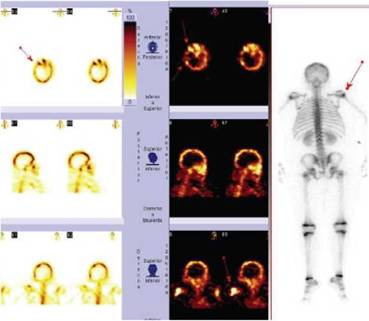
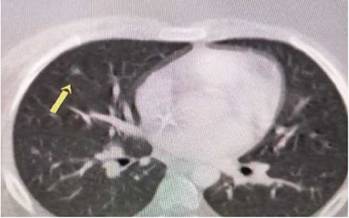
Se realizó búsqueda de metástasis infecciosas. En el centellograma óseo corporal total con marcación de ciprofloxacina se halló captación en cabeza humeral derecha, maxilar superior a nivel de la escotadura nasal, hueso frontal y malar derecho (Figura 2). En la tomografía de tórax, se hallaron nodulillos en ambos campos pulmonares con pequeña imagen quística apical izquierda (Figura 3).
Se realizó radiografía de tórax, fondo de ojos, ecocardiograma y resonancia magnética de cerebro dentro de límites normales. El paciente presentó una enfermedad invasiva por SAMR-C con evolución clínica tórpida a punto de partida de foco cutáneo.
Se realizaron hemocultivos de control cada 48 horas; fueron negativos a las 96 horas de inicio del tratamiento antibiótico intravenoso.
Figura 2: Centellograma óseo corporal total 15 mCi (740 MBq) de MDP-Tc99m. Ciprofloxacina-Tc99m (INFECTON), macizo facial, cráneo
Aumento de la captación de los difosfonatos marcados en la cabeza humeral derecha, hipercaptación focal en el maxilar superior a nivel de la escotadura nasal derecha, de la prolongación de dicho hueso hacia el frontal y a nivel del área malar derecha.
Figura 3: Tomografía de tórax
Nodulillos en ambos campos pulmonares.
Ante la persistencia de registros febriles (sin compromiso respiratorio clínico ni inestabilidad hemodinámica) y el hallazgo de metástasis infecciosas a nivel óseo y pulmonar, se modificó el esquema antibiótico según antibiograma a vancomicina y linezolid, en el décimo día de internación.
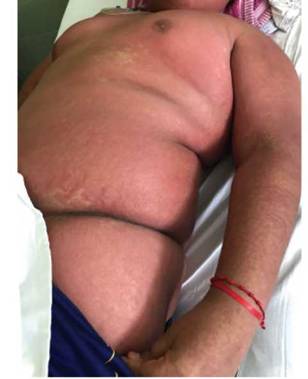
Luego de recibir 20 días totales de vancomicina y 10 días totales de vancomicina y linezolid, el paciente presentó eritema cutáneo generalizado con prurito, edema facial y afectación de mucosas, queilitis angular, odinofagia y petequias en paladar, asociadas a eosinofilia (1320 eosinófilos/mm3) y leve aumento de transaminasas. Se interpretó el cuadro como síndrome de DRESS (drug reaction with eosinophilia and systemic symptoms, reacción a las drogas con eosinofilia y síntomas sistémicos) (Figura 4) por lo cual, se suspendió completamente el tratamiento antibiótico, se indicó corticoterapia y fue derivado a sala de cuidados intermedios.
Mejoró el compromiso cutáneo y mucoso, con descenso de eosinófilos a 704 eosinófilos/ mm3. Completó tratamiento para enfermedad invasiva por SAMR con clindamicina; reinició antibioticoterapia luego de 24 horas de control en terapia intermedia. El paciente presentó evolución clínica favorable, recibió 6 semanas totales de tratamiento antibiótico; las últimas 2 semanas el tratamiento antibiótico se administró por vía oral.
La evaluación del paciente se realizó de forma interdisciplinaria junto con los servicios de Infectología, Diagnóstico por Imagen, Bacteriología y Endocrinología.
DISCUSIÓN
Las metástasis infecciosas como complicaciones secundarias a bacteriemia por Staphylococcus aureus son de baja prevalencia en pediatría. La prevalencia de dichas metástasis en adultos es de alrededor del 50 %, mientras que en pacientes pediátricos es menor al 20 % de los casos;4,5 es mayor en pacientes con enfermedades predisponentes de base, como patología nutricional, inmunosupresión, enfermedades oncohematológicas, cardiopatías congénitas, entre otras.6,7
Diferentes estudios realizados en nuestro país3,7 describen distinta distribución en orden de frecuencia de los focos infecciosos secundarios, comparado con los adultos. Las metástasis infecciosas por orden de frecuencia en la población pediátrica son las pulmonares, osteoarticulares y piel y partes blandas; es menos frecuente el compromiso cardiovascular, abdominal y ocular. En el caso descripto, las metástasis infecciosas mostraron compromiso osteoarticular y pulmonar. Al igual que en la bibliografía, en este caso, el foco primario fue cutáneo. Cabe destacar que, en la mayoría de las series descriptas, en el 90 % de los episodios se halló un foco primario de infección al inicio del cuadro clínico.3
Figura 4: Exantema eritematoso intenso micromaculopapular confluente y pruriginoso, compatible con farmacodermia
La persistencia de hemocultivos positivos a las 48 horas de la toma del primer hemocultivo positivo se relaciona directamente con mayor riesgo de metástasis infecciosas por SAMR.1'3’8 Según otros estudios, la persistencia de bacteriemia después del quinto día y la sepsis al ingreso se asocian con mayor riesgo de morbimortalidad.9
En el caso clínico presentado, la búsqueda precoz de metástasis infecciosas arribó a un tratamiento oportuno, considerando la persistencia de los hemocultivos positivos y la edad del paciente como factores asociados a mayor morbilidad.1 En cuanto a la búsqueda de focos profundos o metástasis infecciosas, si bien se solicitaron exámenes complementarios tales como ecocardiograma y fondo de ojo, es importante subrayar la frecuencia de compromiso pulmonar en pacientes pediátricos, por lo cual, fue pertinente la búsqueda de dicho foco a través de radiografía y tomografía de tórax. Respecto del compromiso osteoarticular, el centellograma con complejo ciprofloxacino-Tc99m fue útil para el diagnóstico del foco óseo. Este tipo de centellograma ha sido evaluado extensamente con buenos resultados en el diagnóstico de infecciones bacterianas activas osteoarticulares.10
Según el informe anual (2020) de resistencia antibiótica de la Sección de Microbiología Clínica de la institución, la resistencia para clindamicina de Staphylococcus aureus de piel y partes blandas de la comunidad fue del 13,8 % (IC95%: 4,5-32,6) y para vancomicina del 0 % (IC95%: 0-14,6). En el caso de Staphylococcus aureus meticilino resistente, en pacientes internados la resistencia a clindamicina reportada fue del 27,9 % (15,8-43,9) y para vancomicina el 0 % (IC95 %: 0-10,2).11
El tratamiento antibiótico empírico inicial se seleccionó siguiendo guías de prácticas clínicas12 y considerando que, para pacientes hospitalizados con infección de piel y tejidos blandos complicada, una de las opciones incluye vancomicina intravenosa (evidencia A-I). Para niños con osteomielitis hematógena aguda por SAMR, se recomienda vancomicina (evidencia A-II). En este caso, al tratarse de un paciente obeso con infección grave en rostro, se amplió la terapia antibiótica empírica inicial con piperacilina-tazobactam para cubrir también gérmenes gramnegativos y anaerobios. Según distintos estudios, se observó un porcentaje de persistencia de hemocultivos positivos al quinto día del tratamiento menor para los pacientes que recibían terapia combinada, con vancomicina más betalactámico (piperacilina-tazobactam), que para aquellos que recibían vancomicina sola.13 En el paciente estable sin bacteriemia ni infección intravascular en curso, se puede utilizar clindamicina como terapia empírica si la tasa de resistencia a clindamicina es baja (por ejemplo; <10 %) con transición a terapia oral si la cepa es susceptible (evidencia A-II). La duración exacta del tratamiento debe individualizarse, pero normalmente se recomienda un curso mínimo de 4 a 6 semanas para la osteomielitis. Las alternativas a la vancomicina y la clindamicina incluyen la daptomicina o linezolid (evidencia C-III).14
En cuadros infecciosos con BAS en pediatría, resulta pertinente la sospecha y búsqueda de focos metastásicos de infección, de acuerdo a su orden de frecuencia, para el abordaje diagnóstico y terapéutico oportuno.
Recibido: 2-10-2022
Aceptado: 15-12-2022