Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Acta bioquímica clínica latinoamericana
versão impressa ISSN 0325-2957versão On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.53 no.4 La Plata dez. 2019
CONTROL DE CALIDAD
Control de calidad en pruebas cualitativas aplicado a pruebas sexológicas
Jorgelina Elsa Aberer1a
1 Bioquímica.
a Programa Evaluación Externa de la Calidad, Fundación Bioquímica Argentina. Calle 148 Nº 584. La Plata (1900), Buenos Aires, Argentina.
Correspondencia Bioq. JORGELINA ELSA ABERER Programa Evaluación Externa de la Calidad, Fundación Bioquímica Argentina Calle 148 Nº 584. (1900) LA PLATA, Buenos Aires, Argentina Correo electrónico: joraberer@hotmail.com
Resumen
Si bien el control de calidad en determinaciones cuantitativas tiene amplia difusión, hay extensa bibliografía que lo avala y está en constante actualización, no sucede lo mismo cuando se refiere a pruebas cualitativas como las que se utilizan en diagnósticos serológicos. Es importante antes de la utilización de esta prueba serológica en el laboratorio disponer de información acerca de su caracterización, utilidad y algoritmos de trabajo más convenientes. Si bien se cuenta con poca bibliografía para estas pruebas, es posible definir parámetros de desempeño que el laboratorio debe tener en cuenta para poder liberar resultados confiables y de utilidad clínica. Tanto el control de calidad interno como el externo son dos valiosas herramientas orientadas a cumplir con la misión de los laboratorios en la cual el objetivo principal es la seguridad del paciente. Desde el Programa de Evaluación Externa de la Calidad se ofrecen varios subprogramas para el control de pruebas serológicas, que proporcionan a cada participante una evaluación objetiva del comportamiento de su laboratorio, información de los métodos disponibles y la identificación de factores que puedan afectar sus resultados.
Palabras clave: Control de calidad; Pruebas cualitativas.
Abstract
Quality control in qualitative tests applied to serological tests
Although the quality control in quantitative determinations has wide dissemination, an extensive bibliography that supports it and it is constantly being updated, this is not the case when referring to qualitative tests such as those used in serological diagnoses. Before using this serological test in the laboratory, it is important to have information about its characterization, usefulness and more convenient working algorithms. Although there is little literature for these tests, it is possible to define performance parameters that the laboratory must take into account to be able to release reliable and clinically useful results. Both internal and external quality control are valuable tools aimed at fulfilling the mission of laboratories in which the main objective is patient safety. From the External Quality Assessment Programme, several subprogrammes are offered for the control of serological tests, providing each participant with an objective evaluation of the behaviour of their laboratory, information on the available methods and the identification of factors that can affect the results.
Keywords: Quality Control; Qualitative tests.
Resumo
Controle de qualidade em testes qualitativos aplicado a testes sorológicos
Embora o controle de qualidade em determinações quantitativas possua ampla divulgação e haja extensa bibliografia que o apoie e esteja em constante atualização, o mesmo não acontece quando se refere a testes qualitativos, como os utilizados em diagnósticos sorológicos. Antes de usar esse teste sorológico em laboratório, é importante ter informações sobre sua caracterização, utilidade e algoritmos de trabalho mais convenientes. Embora exista pouca literatura para esses testes, é possível definir parâmetros de desempenho que o laboratório deve levar em consideração para poder liberar resultados confiáveis e clinicamente úteis. O controle de qualidade interno e externo são duas ferramentas valiosas destinadas a cumprir a missão dos laboratórios na qual o objetivo principal é a segurança do paciente. A partir do Programa de Avaliação Externa da Qualidade, são oferecidos vários subprogramas para o controle de testes sorológicos, proporcionando a cada participante uma avaliação objetiva do comportamento de seu laboratório, informações sobre os métodos disponíveis e identificação de fatores que possam afetar os resultados.
Palavras-chave: Controle de qualidade; Testes cualitativos.
Caracterización de las pruebas serológicas
Las pruebas serológicas son aquellas que permiten detectar en el suero del paciente una respuesta inmunológica específica dirigida contra algún agente infeccioso. Se pueden dividir según su utilidad clínica en pruebas de tamizaje (screening), de diagnóstico o confirmatorias. Tienen limitaciones que deben ser tenidas en cuenta a la hora de seleccionar el método más apropiado para utilizarse en cada laboratorio y en los algoritmos que se usan para interpretar los resultados. Estas limitaciones son inherentes al agente infeccioso (parásitos de composición genética y antigénicamente compleja), al hospedador (coinfecciones, inmunodepresión) y a la metodología empleada (reacciones cruzadas con otros agentes, con medicamentos o vacunas).
Las pruebas serológicas son pruebas cualitativas (1) de respuesta binaria: sí/no, ausencia/presencia, reactivo/ no reactivo, y se pueden agrupar en las de respuesta cualitativa dicotómica, pero de análisis instrumental cuantitativo o en pruebas de respuesta sensorial. No tienen en la respuesta un error total permitido, es decir no existe tolerancia admisible. Tienen exactitud diagnóstica. La guía EP12A2 del Clinical Laboratory Standard Institute (CLSI): User Protocol for Evaluation of Qualitative Test Performance (2), es la guía en la cual están definidos todos los parámetros de las pruebas cualitativas. En ella se define a la exactitud diagnóstica como “los mejores criterios disponibles en la actualidad para establecer la presencia o ausencia de la condición, evento o característica de interés, utilizando un único método o combinación de métodos que incluyen las pruebas de laboratorio, estudios por imágenes, patología, y la información clínica, incluyendo el seguimiento”.
Los requisitos indispensables para obtener calidad en el diagnóstico en una prueba serológica son: validez, reproductividad y seguridad.
Validez: es el grado en que un test mide lo que se supone que debe medir. La sensibilidad y la especificidad de un test son medidas de su validez.
Reproductividad: es la capacidad del test para ofrecer los mismos resultados cuando se repite su aplicación en circunstancias similares.
Seguridad (3): Viene determinada por el valor predictivo de un resultado positivo o negativo. Ante un resultado positivo de un test ¿qué probabilidad existe de que este resultado indique presencia de la enfermedad? (4). Se pueden definir dos tipos de seguridad: analítica y clínica (Tabla I).
Tabla I. Diferencias entre seguridad analítica y clínica.
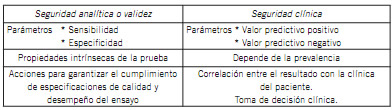
Si bien es posible caracterizar en estas pruebas aspectos metrológicos como la precisión, valor de corte, límite de detección, como así también aspectos clínicos asociados a sensibilidad, especificidad y valor predictivo, hay que tener en cuenta siempre los inconvenientes asociados a la falta de bibliografía y terminología metrológica (5).
Los parámetros de desempeño (6-8) que se deben evaluar en estas pruebas son
• Trazabilidad
• Tasa de falsos positivos
• Tasa de falsos negativos
• Sensibilidad y especificidad
• Límite de corte
• Zona o región de no confiabilidad
• Límite de detección (LD)
• Robustez
Trazabilidad
No existen métodos de referencia que faciliten comparaciones entre resultados, ni existen materiales de referencia de conmutabilidad demostrada y no es posible asegurar que el calibrador sea similar a la muestra, debido a la naturaleza proteica de la misma. Es difícil producir patrones biológicos homogéneos y puros, de contenido conocido similar a los patrones que se utilizan en Química Clínica pues los antígenos están formados por mezcla de diferentes componentes bacterianos y tisulares, y los anticuerpos contra esa mezcla son heterogéneos con respecto a clase, subclase, especificidad, avidez y afinidad. La Norma ISO 17511 (9) (in vitro diagnostic medical devices -- Measurement of quantities in biological samples -- Metrological traceability of values assigned to calibrators and control materials) especifica la manera de asegurar la trazabilidad metrológica de los valores asignados a los calibradores y materiales de control destinados a determinar la veracidad de las mediciones. Esta norma describe 5 grupos y en el grupo 4 engloba a las pruebas serológicas, describiendo que se cuenta con calibrador por convención internacional (el cual no es primario) con un procedimiento de medición por convención internacional y sin trazabilidad metrológica al Sistema Internacional. Por lo tanto, es responsabilidad del laboratorio disponer de información sobre la trazabilidad de los calibradores que utiliza para poder cumplir con este requisito de desempeño.
Sensibilidad
Es la proporción de pacientes con un trastorno clínico bien definido (o condición de interés) cuyos valores sean positivos o excedan un límite de decisión definido.
Especificidad
Es la proporción de pacientes que no tienen un trastorno clínico bien definido (o condición de interés) cuyos valores sean negativos o estén dentro de los límites de decisión definidos.
Límite de corte
El punto de corte para una prueba cualitativa es el umbral por encima del cual el resultado se informa como positivo y por debajo del cual el resultado se reporta como negativo. La concentración de corte, indicada como C50, es la concentración de analito a la cual el 50% de una gran serie de resultados de pruebas son positivos. Debido a la imprecisión, las muestras con concentraciones de analito cerca del punto de corte no producirán resultados de prueba completamente consistentes (es decir, positivos o negativos, más o menos, ausentes o presentes) en múltiples observaciones de la misma muestra. La concentración por encima de C50 en la que los resultados repetidos son 95% de las veces positivos y la concentración por debajo de C50 en la que los resultados repetidos son 95% de las veces negativos, en conjunto, se han denominado el “intervalo del 95%” para ese método o “intervalo C5-C95”. Se define C5 como la concentración por debajo de C50 en la que los resultados múltiples son positivos en el 5% o negativos en el 95% de las veces (el punto final inferior del intervalo del 95%), y a C95 como la concentración por encima de C50 en la que los resultados múltiples son positivos el 95% de las veces o 5% negativos (el punto final superior del intervalo del 95%).
En la práctica se define el valor C95 como el valor de corte en las pruebas cualitativas, ya que es el nivel de concentración asociado a la toma de decisión sobre la muestra, con una probabilidad de errores falsamente negativos del 5%.
Zona de no confiabilidad
Es el rango donde se encuentran errores tanto de tipo 1 (alfa) falsos positivos como de tipo 2 (beta) falsos negativos. Es una propiedad de los métodos de respuesta binaria, y se define como el intervalo donde se encuentran los errores. No se debe confundir con el término incertidumbre que se aplica a resultados cuantitativos y es el rango de valores donde se esperan resultados (1).
Verificación de pruebas cualitativas
De manera análoga a las pruebas cuantitativas, tanto el error sistemático como el error aleatorio deben considerarse en pruebas cualitativas, pero no hay consenso respecto a estas definiciones. Podrían considerarse estos errores como:
Error sistemático. Esta discrepancia entre el valor de corte declarado por el fabricante o a partir de la correlación del resultado con la presencia de enfermedad.
Precisión. Es la estimación de la zona de confiabilidad o intervalo C5-C95. El ancho del intervalo C5-C95 proporciona información sobre la precisión de las pruebas cualitativas porque reflejan la proporción de concentraciones reales en las que los resultados repetidos son inconsistentes.
Es de suma importancia evaluar y comparar lo declarado por el fabricante, evaluando si cumple con el uso previsto, teniendo en cuenta criterios de exactitud diagnóstica. Los fabricantes establecen sus concentraciones de corte de la prueba en función del uso previsto de la misma y la sensibilidad clínica esperada o deseada y la especificidad. Por lo tanto, desde el laboratorio deben verificarse estos parámetros de desempeño crítico, como la precisión, la sensibilidad y especificidad diagnóstica.
En circunstancias ideales, al realizar un estudio de precisión en una muestra que tenga un nivel de mesurando exactamente en la concentración de corte, C50 será exactamente igual al corte establecido por el fabricante. En un estudio de reproducibilidad en el punto de corte, el sesgo en una prueba cualitativa se relacionará con una posible discrepancia entre el punto de corte especificado por el fabricante y el C50 estimado en un estudio de evaluación. Para realizar los estudios de precisión para las pruebas cualitativas deben utilizarse concentraciones a evaluar cerca del valor de corte. Para sensibilidad y especificidad diagnóstica deben utilizarse paneles definidos, muestras confirmadas reactivas o positivas de diferente reactividad (Tabla II). La guía también señala que además de estimar la sensibilidad y especificidad diagnóstica se debe establecer un intervalo de confianza para dicha estimación. Si la especificidad y sensibilidad declarada por el fabricante se encuentra dentro de este intervalo de 95% de confianza entonces se pueden verificar los parámetros.
Tabla II. Tabla de contingencia: relación entre el resultado de una prueba cualitativa con el resultado del criterio de exactitud diagnóstica.

Calidad en pruebas sexológicas
Trabajar en calidad en estas pruebas implica varios desafíos.
1. Según la utilidad y prevalencia de la población a estudiar, seleccionar la metodología más apropiada:
• Selección cuidadosa del cut-off.
• Base antigénica empleada para captura de Ac.
• Formato del inmunoensayo.
• Estandarización del proceso de medición.
• Adecuada interpretación de los algoritmos de trabajo.
2. Verificaci ón de los parámetros de desempeño del fabricante: sensibilidad, especificidad diagnóstica y estimación de imprecisión.
3. Implementación de control de calidad interno.
4. Control de calidad externo: estimación del error total a partir de muestras similares a las muestras de pacientes.
Si bien el control de calidad en determinaciones cuantitativas tiene amplia difusión y extensa bibliografía que lo avala y en constante actualización, no sucede lo mismo cuando se refiere a pruebas cualitativas como las que se utilizan en diagnósticos serológicos. Las pruebas de laboratorio tienen un impacto crítico en la toma de decisiones médicas. Pueden ocurrir errores en cualquier etapa y en el ciclo que se inicia con la solicitud del médico y termina con la interpretación final del resultado. La evaluación de las causas que generan estos errores y la toma de medidas para detectarlos y prevenirlos, antes de que causen daño, es crítica en el proceso analítico. Tanto el control de calidad externo como el interno son fortalezas que permiten a los laboratorios poder liberar resultados confiables (10), que ayuden al médico en la consulta clínica a definir diagnósticos adecuados para beneficio de los pacientes. Uno de los objetivos del Programa de Evaluación Externa de la Calidad (PEEC) es ayudar a los participantes mediante un proceso educativo a tomar medidas que garanticen la calidad desde la toma de muestra oportuna hasta la emisión del resultado y a la implementación de procesos de control de calidad interno propios de estas pruebas cualitativas e implementación de requisitos de calidad.
Si bien el PEEC de la Fundación Bioquímica Argentina fue creado en el año 1987, recién a partir de septiembre de 1995 se inició el Subprograma de Inmunoserología, que consistía en la distribución de un suero control para el estudio de las pruebas no treponémicas para el diagnóstico de sífilis. Teniendo en cuenta todos los inconvenientes asociados a la ausencia de estandarización y las necesidades de los participantes, los cuales empezaban a incorporar las pruebas inmunológicas a las prácticas habituales del laboratorio de análisis clínicos, es que surge este subprograma bajo la Dirección del Dr. Daniel Mazziotta y la Organización y supervisión de la Dra. Liliana D’Agostino. Es un programa cuyo alcance involucra a todos los laboratorios de análisis clínicos públicos y privados, y se hace extensivo a los laboratorios de Banco de Sangre. Este programa fue creciendo a lo largo de los años con la incorporación de mensurandos según las necesidades e inquietudes de los participantes. Se generaron paneles para diagnóstico no sólo de sífilis, sino también de hepatitis B, chagas, toxoplasmosis y rubeola. En el año 2004 se incorporó un suero control para el diagnóstico de HIV y más tarde otro para hepatitis C.
Para la elaboración de estos paneles se tuvieron en cuenta las recomendaciones de las guías provistas por la Organización Mundial de la Salud (11), guías del Clinical Laboratory Standard Institute (CLSI) C37-A (12), y en caso de HIV las provistas por el programa UNAIDS de Naciones Unidas (“Guidelines for organizing National External Quality Assessment schemes for HIV serological testing” enero 1996 UNAIDS/96.5), la guía I/LA13-A (13), especificaciones para material de referencia para HIV 1 del CLSI y las indicaciones que rigen en el control de calidad australiano. Todas ellas refieren las especificaciones que deben cumplir las muestras para un programa de evaluación externa: paneles que cubran intervalo de medida en el cual están incluidos los valores de interés clínico, muestras homogéneas con matriz adecuada similar a la muestra de paciente y conmutable. En el caso del PEEC de la FBA se distribuyen paneles conformados por muestras de suero humano refrigerado de diferente nivel de reactividad preparadas en el Laboratorio de Referencia y Estandarización en Bioquímica Clínica (LARESBIC). Como todo programa de evaluación externa de calidad tiene entre sus objetivos la “determinación del desempeño individual y colectivo del laboratorio, y de las características del desempeño de los procedimientos analíticos mediante la comparación entre laboratorios diferentes” (14) (15). Por lo tanto, proporciona a cada participante una evaluación objetiva del comportamiento de su laboratorio, información de los métodos disponibles y la identificación de factores que afecten los resultados. Conocer el error total es muy importante pues es el que influye en los resultados que se entregan a los pacientes. La forma de medir este error total es a partir de la participación del PEEC. Para esto es importante que cada laboratorio establezca objetivos que permitan obtener la calidad necesaria, los cuales se deben transformar en especificaciones para cada paso del proceso a realizar y definir indicadores que permitan realizar un seguimiento de los mismos.
Las especificaciones o requisitos de calidad se refieren a los límites analíticos de desempeño que determinen claramente los errores máximos permisibles en los resultados de las mediciones, es decir, qué magnitud de error se puede permitir a un procedimiento de medida sin invalidar la utilidad clínica de los resultados considerando su uso previsto. La importancia en la definición de estas especificaciones en Serología reside en que son pruebas de alto impacto en la sociedad teniendo en cuenta como ejemplos la transmisión vertical o consecuencia psicosocial. Por lo tanto, al definir estos requisitos se está disminuyendo el riesgo clínico (gravedad del daño asociado a acción tomada o intervención) y aumentando la validez diagnóstica.
Según el Consenso de Milán de 2014 (18), el único modelo que se puede aplicar a las pruebas cualitativas es el modelo basado en el estado del arte; aquel que se relaciona con el mejor desempeño analítico técnicamente alcanzable o estado actual de la metodología, y establece con qué error ese analito puede ser medido con los métodos analíticos vigentes, es decir a través del estado del arte o estado de la tecnología. Estos datos se obtienen a partir de la participación en un PEEC.
Conclusiones
Teniendo en cuenta la complejidad que reside en la decisión sobre cuál es la prueba que más conviene en cada laboratorio según el uso previsto, asociado a la poca información por parte de los fabricantes en cuanto a parámetros de desempeño y la importancia en la liberación de resultados que influye en la toma de decisiones, la herramienta que se ofrece desde el PEEC es un valioso aporte para los laboratorios. La demanda fue en aumento con los años, lo mismo que los mensurandos a evaluar.
Es nuestra tarea seguir con este valioso programa, trabajando en conjunto para la mejora continua y asesoramiento frente a cualquier inquietud de los participantes.
1. Ríos A, Barceló D, Buydens L, Cárdenas K, Heydorn B, Karlberg K, et al. Quality assurance of qualitative analysis in the framework of the European project ’MEQUALAN’ Accred Qual Assur 2003; 8: 68-77. https://doi.org/10.1007/s00769-002-0556-x.
2. CLSI. User protocol for evaluation of qualitative test performance: approved guideline, 2nd ed. EP12-A2. Wayne, PA: CLSI, 2008. [ Links ]
3. Pita Fernández S, Pértegas Díaz S. Pruebas diagnósticas: sensibilidad y especificidad. Unidad de Epidemiología Clínica y Bioestadística. Complexo Hospitalario Universitario de A Coruña (España). Cad Aten Primaria 2003; 10: 120-4.
4. Manterola C. Cómo interpretar un artículo sobre pruebas diagnósticas. Rev Med Clin Condes 2009; 20: 708-17. [ Links ]
5. Joint Committee for Guides in Metrology. International vocabulary of metrology – Basic and general concepts and associated terms (VIM). JGGM 200: 2008.
6. Ruisánchez I, Trullols E, Rius X. Validación de métodos analíticos cualitativos. Técnicas de Laboratorio 2003; 81: 328-35. http://www.quimica.urv.es/quimio/general/divcualit3.pdf [ Links ]
7. Trullols E, Ruisánchez I, Rius FX, Huguet X. Validation of qualitative methods of analysis that use control samples. TrAC Trends in Analytical Chemistry 2005; 24: 516-24. [ Links ]
8. Ellison SLR.,Fearn T. Characterising the performance of qualitative analytical methods: Statistics and terminology, TrAC Trends in Analytical Chemistry 2005; 24(6): 468-76. [ Links ]
9. ISO 17511:2003 In vitro diagnostic medical devices – measurement of quantities in biological samples – metrological traceability of values assigned to calibrators and control materials. Geneva: ISO, 2003.
10. Sáez-Alquezar A, Albajar-Viñas P, Valpassos Guimarães A, Abol Corrêa J. Control de calidad en el tamizaje para enfermedades infecciosas en bancos de sangre. ¿Por qué? y ¿Cómo? EJIFCC 2015 l26: 286-94. [ Links ]
11. World Health Organization. Annex Ii Recommendations for the Preparation, Characterization and Establishment of International and Other Biological Reference Standards (revised 2004). WHO Technical Report Series, No. 932. World Health Organization; Geneva: 2006.
12. CLSI. Preparation and validation of commutable frozen human serum pools as secondary reference materials for cholesterol measurement procedures; approved guideline. CLSI document C37-A. Wayne (PA): CLSI; 1999. [ Links ]
13. NCCLS National Committee for Clinical Laboratory Standards. Human immunodeficiency virus type 1 reference material specifications; Approved Guideline. NCCLS document I/LA 13-A( ISBN 1-56238-134-2),1991. [ Links ]
14. Miller G, Jones GRD, Horowitz GL, Weykamp C. Proficiency testing/external quality assessment: current challenges and future directions. Clin Chem Dec 2011; 57: 1.670-80. [ Links ]
15. ISO/IEC 17043:2010 Evaluación de la conformidad. Requisitos generales para los ensayos de aptitud. [ Links ]
16. Sandberg S, Fraser CG, Horvath AR, Jansen R, Jones G, Oosterhuis W, et al. Defining analytical performance specifications: consensus statement from the 1st Strategic Conference of the European Federation of Clinical Chemistry and Laboratory Medicine. Clin Chem Lab Med 2015; 53: 833–5.
Recibido: 2 de agosto de 2019
Aceptado: 7 de octubre de 2019














