Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Fave. Sección ciencias agrarias
versão impressa ISSN 1666-7719
FAVE. Secc. Cienc. agrar. vol.14 no.2 Santa Fe dez. 2015
ARTICULO ORIGINAL
Eficacia de fungicidas de síntesis y biológico en base a trichoderma harzianum para controlar patógenos de semillas de soja
CROVO,V. 1; CLEMENTE, G.E.1
1Facultad de Ciencias Agrarias, UNMdP.CP 7620 CC 726; crovo.veronica@inta.gov.ar
RESUMEN
Los patógenos presentes en semillas causan fallas en la germinación, afectan el rendimiento del cultivo e introducen enfermedades en nuevas zonas. El tratamiento de semillas es una estrategia de protección ampliamente utilizada. En este trabajo se realizaron experimentos in vitro en cajas de Petri para evaluar la eficiencia de diferentes fungicidas p.a. pyraclostrobin+metil tiofanato, p.a. thiram+carbendazim y p.a. metalaxil-M para controlar Cercospora kikuchii, Fusarium spp. y Phomopsis spp., patógenos prevalentes en semillas de soja del sudeste de la provincia de Buenos Aires. Además se compararon la eficiencia de un fungicida biológico p.a. Trichoderma harzianum y uno químico (p.a. fludioxonil+metalaxil-M+tiabendazol). Los fungicidas en base a thiram+carbendazim y a pyraclostrobin+metil tiofanato mostraron la mayor inhibición del crecimiento de patógenos estudiados. El biofungicida mostró mayor control que el fungicida fludioxonil+metalaxil-M+tiabendazol, para los tres patógenos. Este trabajo analiza y presenta alternativas útiles para el control de patógenos de semillas de soja.
Palabras claves: Glycine max; Semillas; Fungicidas; Trichoderma harzianum.ABSTRACT
Efficacy of synthetic and biological fungicide with Trichoderma harzianum to control seedborne pathogens of soybean.
Seedborne pathogens cause germination failures, affect crop yield and introduce diseases into new areas. Seed treatment is a widely used strategy to protect them. In this work, in vitro test were performed to evaluate the efficiency of fungicides pyraclostrobin+thiophanate methyl, thiram+carbendazim and metalaxyl-M to control Cercospora kikuchii, Fusarium spp. and Phomopsis spp. (pathogens prevalent in the southeast of Buenos Aires province). Furthermore, the control efficiency of a bio-fungicide (i.a. Trichoderma harzianum) and chemical fungicide (i.a fludioxonil+metalaxyl-M+thiabendazole) was compared. Fungicides thiram+carbendazim or pyraclostrobin+thiophanate methyl showed the greatest inhibition of pathogens growth. For the three pathogens, the bio-fungicide showed better control than the fungicide fludioxonil+metalaxyl-M+thiabendazole. This work analyzes and presents useful alternatives for controlling soybean seedborne pathogens.
Keywords: Glycine max; Seeds; Fungicide; Trichoderma harzianum
INTRODUCCIÓN
Las semillas de soja pueden portar patógenos que afectan su germinación. Altos porcentajes de infección de semillas con estos patógenos pueden comprometer el establecimiento y el rendimiento de los cultivos y facilitar la introducción de enfermedades en predios sin antecedentes de ellas. Especies del género Fusarium spp. y Phomopsis spp. (20), así como Cercospora kikuchii son patógenos prevalentes en lotes de semillas de soja del sudeste de la provincia de Buenos Aires (20). Fusarium spp. no solo afecta la germinación de soja cuando contamina semillas sino también cuando está presente en su ambiente natural, el suelo, causando pudrición de las semillas, tizón de plántulas y podredumbre de cuello y raíces (22). Por otro lado, especies del género Phomopsis spp. son responsables del Cancro de la soja, enfermedad que limita la producción del cultivo cuando las condiciones epidemiológicas favorecen su presencia (9, 19, 21). Esta enfermedad afecta los rendimientos, pero sobre todo disminuye la calidad y el poder germinativo de las semillas (20). C. kikuchii, agente causal de la Mancha púrpura de la semilla, generalmente no reduce la germinación de semillas, pero pueden presentar menor vigor (9).
El tratamiento de semillas es una estrategia para proteger a las semillas y a las plántulas de plagas y enfermedades. Aunque durante muchos años se utilizaron productos químicos, y no se detectó resistencia de los patógenos de semillas a las moléculas de síntesis, actualmente existe una tendencia mundial a disminuir el uso de agroquímicos por sus potenciales efectos secundarios sobre la salud humana y el medio ambiente (16). Esta tendencia viene acompañada del aumento de uso de productos biológicos, como parte de una estrategia dentro del concepto de manejo integrado de enfermedades (1). En este campo, el género Trichoderma es uno de los agentes de control biológico más estudiado, por su habilidad de antagonizar con hongos fitopatógenos en condiciones naturales. Los principales mecanismos de biocontrol atribuidos a este géneroson el micoparasitismo, la competencia por espacio y nutrientes y la producción de metabolitos secundarios, tales como sideróforos, antibióticos y enzimas (11, 14, 5).
Como micoparásito, Trichoderma sp. crece sobre los hongos fitopatógenos, y penetra en sus células, alterando y degradando paredes celulares, causando retracción de la membrana plasmática y desorganización del citoplasma (14, 17).
Cuando actúa como competidor, Trichoderma sp. posee alta velocidad de crecimiento y mediante la secreción de metabolitos de diferente naturaleza, frena o elimina a otros microorganismos (14,17). Por otra parte, muchas cepas de Trichoderma producen metabolitos secundarios volátiles y no volátiles, algunos de los cuales inhiben el desarrollo de otros microorganismos con los que no tienen contacto físico. Estas sustancias inhibidoras son consideradas "antibióticos" (7, 13). La capacidad de Trichoderma de secretar varios compuestos antifúngicos simultáneamente, limita el riesgo de aparición demicroorganismos resistentes a estos metabolitos, tal como puede suceder cuando fungicidas de síntesis se utilizan en dosis no adecuadas y de manera reiterada (17).
En este trabajo se compararon tres fungicidas de síntesis química para el control de C. kikuchii, Fusarium spp. y Phomopsis spp.: (1) un fungicida tradicional con los principios activos (p.a.) thiram y carbendazim, (2) un fungicida con p.a. metalaxil-M recomendao para el control de oomycetes del Reino Cromista (Stramenopiles) pero a veces adoptado por productores para su uso en soja; y (3) un nuevo fungicida propuesto para el contro de patógenos de semillas de soja con los p.a. pyraclostrobin+metil tiofanato. Además se comparó respecto a un fungicida complejo (p.a. fludioxonil + metalaxil-M + tiabendazol) para el control de estos mismos patógenos, la eficiencia de la cepa de T. harzianum extraída de un biofungicidas comercial (seleccionada en el IMYZA, Instituto de Microbiología y Zoología Agrícola del INTA Castelar) y ha sido formulada comercialmente por Rizobacter® (Rizobacter Argentina, Pergamino, Argentina) para el control de patógenos de semillas de cereales de invierno (cebada y trigo). Para ello se condujeron experimentos in vitro, donde se evaluó el crecimiento de los patógenos en presencia de los distintos fungicidas o confrontados al biofungicida con T. harzianum.
MATERIALES Y MÉTODOS
Aislamiento de hongos fitopatógenos: Semillas de soja provenientes del sudeste de la provincia de Buenos Aires se colocaron sobre papel humedecido con agua destilada y se incubaron durante 7 días a 23±2ºC con alternancia de luz/oscuridad (12 h/12 h) para favorecer el crecimiento y esporulación de los hongos presentes (15; 22). Las semillas fueron examinadas bajo lupa binocular para detectar estructuras fúngicas e identificarlos mediante observación al microscopio y claves taxonómicas (3). Se obtuvieron aislamientos puros de C. kikuchii, Fusarium spp. y Phomopsis spp. para conducir luego experimentos in vitro. El medio de cultivo utilizado fue Agar Papa Dextrosa (APD) adicionado con 25 gotas/l de Ácido láctico 25%.
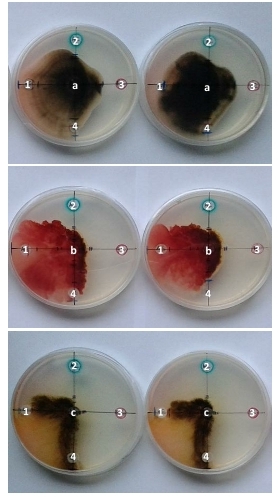
Evaluación de fungicidas para el control de C. kikuchii, Fusarium spp. y Phomopsis spp. aislados de semillas de soja. Se utilizó el método de difusión en agar Kirby-Bauer modificado (6). Para ello, se realizaron confrontaciones in vitro decada hongo con suspensiones de los fungicidas a las dosis comerciales: pyraclostrobin+metil tiofanato (100 ml/100 Kg de semilla), metalaxil-M (50 ml/100 Kg de semilla) y thiram+carbendazim (200 ml/100 Kg de semilla). Los experimentos se condujeron en cajas de Petri con medio de cultivo Agar Papa Dextrosa (APD). Para ello, en el centro del medio APD contenido en cajas de 9 cm de diámetro se colocó, por separado, un disco de agar de 8 mm de diámetro con micelio de cada patógeno procedente de un cultivo de 7 días, 25±2 ºC, en oscuridad. En forma equidistante del punto de siembra y cerca del borde se realizaron 4 hoyos de 8 mm de diámetro con un sacabocado. En tres de los hoyos se colocó una gota de 20 µl de suspensión de cada fungicida, mientras que en el hoyo restante se colocó como testigo un volumen idéntico de agua destilada (Figura 1). Las cajas se incubaron 8 días a 25±2 ºC, en oscuridad. Durante el periodo de incubación se midió el crecimiento de la colonia en cada una de las transectas marcadas en el fondo de la caja desde el centro del punto de siembra hacia el centro de cada uno de los hoyos donde se ubicaron los fungicidas. El experimento se condujo con un diseño de bloques completos aleatorizados (DBCA) con cuatro repeticiones. La unidad experimental la constituyó cada caja de Petri donde creció cada patógeno en presencia de los fungicidas evaluados.
Figura 1. Experimento in vitro para medir la eficacia para inhibir el crecimiento de a) Cercospora kikuchii, b) Fusarium spp. y c) Phomopsis spp. de los fungicidas 1) metalaxil-M (50 ml/100 Kg de semilla), 2) pyraclostrobin+metil tiofanato (100 ml/100 Kg de semilla), 3) thiram+carbendazim (200 ml/100 Kg de semilla). Se incluye un control sin funguicida 4).En el centro se ubica un disco de medio de cultivo colonizado con cada patógeno y en cada círculo equidistante (en los bordes de la caja) las soluciones de fungicida y el control del experimento.
Tasa de crecimiento de microorganismos patógenos y del biocontrolador. Se evaluó la tasa de crecimiento de los hongos patógenos C. kikuchii, Fusarium spp., Phomopsis spp. y del biocontrolador T. harzianum. Para ello, se colocó en el centro de una caja de Petri de 9 cm de diámetro con APD un disco de agar de 8 mm de diámetro con micelio de cada patógeno procedente de un cultivo crecido en APD (7 días, 25±2 ºC, en oscuridad). Durante el periodo de incubación se midió con frecuencia diaria el crecimiento de las colonias desde el centro del punto de siembra hacia los bordes, en cada una de las cuatro transectas marcadas en el fondo de la caja.
Comparación de eficacia de control de T. harzianum y el fungicida en el control de fitopatógenos. Se utilizó la técnica de cultivos duales, confrontando en una caja de Petri con APDcada hongo fitopatógeno con T. harzianum o con el fungicida p.a. fludioxonil + metalaxil-M + tiabendazol. Para ello, en un extremo de la caja de Petri de 9 cm de diámetro se colocó un disco de agar con micelio de cada patógeno (8 mm de diámetro) procedente de un cultivo de 7 días, crecido a 25±2 ºC, en oscuridad. En el extremo opuesto de la caja se colocó un disco (8 mm) con micelio de T. harzianum o se colocó en un orificio (8x8mm) una gota de 20 µl de suspensión del fungicida (concentración similar a dosis comercial 100µl + 400 µl de agua destilada). En los testigos se sembró un disco de agar sin micelio (testigo del hongo biocontrolador) o se agregaron 20 µl de agua destilada en hoyos de 8 mm de diámetro (testigo de fungicida).
Los cultivos duales permitieron evaluar dos mecanismos de antagonismo: competencia por sustrato y antibiosis. La evaluación de la competencia por sustrato de T. harzianum con los fitopatógenos se realizó aplicando la escala de Bell (4). Esta consta de cinco clases: 1- T. harzianum ocupa completamente la superficie del medio de cultivo cubriendo totalmente al patógeno; 2- T. harzianum llega a sobrepasar las dos terceras partes de la superficie del medio de cultivo; 3- T. harzianum y el patógeno colonizan cada uno aproximadamente la mitad de la superficie del medio y ninguno parece dominar al otro; 4- el patógeno sobrepasa al crecimiento de T. harzianum colonizando al menos dos terceras partes de la superficie del medio de cultivo y 5- el fitopatógeno cubre completamente a T. harzianum y cubre la totalmente de la superficie del medio. La evaluación del efecto por producción de sustancias difusibles al medio se realizó calculando el porcentaje de inhibición del crecimiento (PIC) mediante la fórmula utilizada por Skidmore y Dickinson (23), donde PIC= [(C1-C2)/C1] x100. C1 es el crecimiento radial del testigo (fitopatógeno sin antagonista y sin fungicida) y C2 el crecimiento radial del fitopatógeno con antagonista o con fungicida. El PIC fue evaluado a los 7, 8 y 40 días y a la mitad de este tiempo (3.5, 4 y 20 días), momentos en que Phomopsis spp., Fusarium spp. y C. kikuchii creciendo solos (testigos) cubrieron por completo las cajas de Petri. El efecto del fungicida también se evaluó calculando el PIC con la fórmula utilizada anteriormente.
Durante la incubación a 25±2 ºC en oscuridad, tanto en los cultivos duales como en la evaluación de la eficacia del fungicida se midió el crecimiento de las colonias en la transecta marcada desde un borde a otro de la caja de Petri. El diseño experimental utilizado fue DBCA con cuatro repeticiones. La unidad experimental la constituyó cada caja de Petri. En todos los experimentos se analizó la varianza de los datos y se compararon los promedios de los tratamientos por la prueba de LSD Fisher. Para ello se utilizó el paquete estadístico Infostat® (8).
RESULTADOS Y DISCUSIÓN
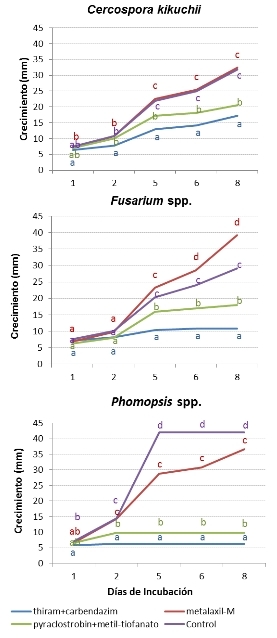
Evaluación de fungicidas para el control de fitopatógenos prevalentes de semillas de soja: El fungicida thiram+carbendazim demostró la máxima eficiencia para inhibir el crecimiento in vitro de todos los patógenos. Similar efecto demostró el fungicida en base a pyraclostrobin+metil tiofanato, con un 35% menos de eficiencia de inhibición del crecimiento de los tres patógenos.
Al evaluar el crecimiento in vitro de C. kikuchii, el fungicida metalaxil-M mostró no ser eficiente para controlar al patógeno, no diferenciándose del control sin tratamiento con fungicida, en todos los tiempos evaluados (Figuras 2 y 3). En el caso de Fusarium spp., el crecimiento del hongo en el medio de cultivo fue incluso promovido por la presencia de metalaxil-M. Con respecto a Phomopsis spp., el fungicida metalaxil-M, si bien controló parcialmente al hongo lo hizo con una evidente baja eficiencia respecto de la que demostraron los otros dos fungicidas para inhibir el crecimiento de este patógeno. La eficiencia de control fue además decreciendo al tiempo que avanzaron las evaluaciones.
Figura 2. Crecimiento de cultivos de Cercospora kikuchii (a), Fusarium spp. (b) y Phomopsis spp. (c) en medio de cultivo APD y en presencia de los fungicidas 1) metalaxil-M , 2) pyraclostrobin+metil tiofanato, 3) thiram+carbendazim y 4) agua (control sin funguicida).
Figura 3. Crecimiento de cultivos de Cercospora kikuchii, Fusarium spp. y Phomopsis spp. en medio de cultivo APD y en presencia de los fungicidas pyraclostrobin+metil tiofanato, metalaxil-M o thiram+carbendazim. Se incluye un control sin funguicida. En cada fecha de incubación, letras iguales indican diferencias no significativas entre los tratamientos (p=0,0001).
Tasa de crecimiento de microorganismos patógenos y del agente biocontrolador.
T. harzianum presentó la mayor tasa de crecimiento, diferenciándose significativamente de los tres patógenos. A los 2 días de incubación el biocontrolador cubrió por completo la caja de Petri. Con respecto a los patógenos, el primer día de incubación Phomopsis spp. se diferenció significativamente de los otros dos patógenos por su mayor tasa de crecimiento. A partir del segundo día las diferencias fueron significativas entre los tres patógenos, siendo Phomopsis spp. el primero en cubrir la caja de Petri (4 días), seguido por Fusarium spp. (7 días) y por último C. kikuchii (13 días) (Figura 4). Resultados similares han sido descriptos por Guédez et al. (10) quienes observaron que T. harzianum superó significativamente el crecimiento in vitro de Rhizoctonia solani, Sclerotium rolfsii y Fusarium oxysporum.
Figura 4: Tasa de crecimiento en centimetros (cm.día-1) de Trichoderma harzianum, Phomopsis spp., Fusarium spp. y Cercospora kikuchii
Comparación de actividad antagónica de T. harzianum con el fungicida en el control de fitopatógenos.
Evaluación de la competencia por sustrato.
De acuerdo a la escala de Bell et al. (4), la cepa de T. harzianum del biofungicida comercial utilizado correspondió a la clase I, ya que su crecimiento ocupó completamente la placa cubriendo a todos los patógenos evaluados. Teniendo en cuenta estos resultados, T. harzianum se comporta como antagonista "in vitro" de C. kikuchii, Phomopsis spp. y Fusarium spp.Esto también ha sido observado por Bell et al. (4) quienes hallaron que un 65% de las cepas de este hongo se ubicaron en la clase I al evaluar su eficiencia como biocontrolador de Rhizoctonia solani G-2. Nuestros resultados suman evidencias de que Trichoderma es un excelente competidor por espacio y nutrientes (13).
Evaluación del porcentaje de inhibición del crecimiento (PIC).
El biofungicida presentó los valores más altos de inhibición del crecimiento de los patógenos. Los valores de PIC relativo al testigo a los 3.5, 4 y 20 días para C. kikuchii, Fusarium spp. y Phomopsis spp. fueron de 69, 44 y 50%, respectivamente; mientras que para el fungicida químico estos valores fueron significativamente menores (8.5, 29.5 y 31% para cada patógeno). Este comportamiento también se mantuvo a los 7 y 40 días, para Phomopsis spp. y C. kikuchii; mientras que a los 8 días para Fusarium spp. si bien T. harzianum presentó mayor PIC que el fungicida químico, esta diferencia no fue estadísticamente significativa (Figura 5). Se reporta que el hongo Trichoderma se caracteriza por presentar altos valores de PIC en cultivos duales con hongos fitopatógenos (10). Por ejemplo, Barbosa et al. (2) observaron que T. harzianum se desarrolló a mayor velocidad que F. oxysporum., obteniendo un valor de PIC (65%) aún mayor que el obtenido en este trabajo para este género. Asimismo, Michel et al. (18) obtuvieron valores de inhibición de crecimiento de un 94% contra S. rolfsii en pruebas in vitro.
Figura 5. Porcentaje de inhibición del crecimiento (PIC) relativo al testigo a los 3.5, 4 y 20 días (A) y a los 7, 8 y 40 días (B) de Trichoderma harzianum o fungicida químico en base a fludioxonil + metalaxil-M + tiabendazol sobre Cercospora kikuchii, Phomopsis spp. y Fusarium spp. Letras iguales en los patógenos indica diferencias no significativas.
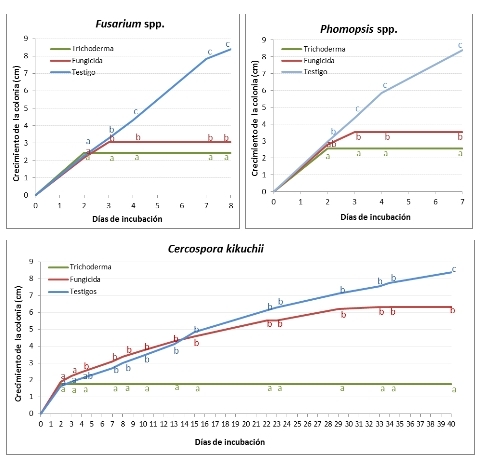
Figura 6. Crecimiento de colonias de Fusarium spp., Phomopsis spp. y Cercospora kikuchii confrontados con Trichoderma harzianu, con el fungicida fludioxonil + metalaxil-M + tiabendazol y creciendo solos (testigos).
En la figura 6 se puede observar que tanto el crecimiento de Fusarium spp. como el de Phomopsis spp. se detuvo a los 2 días de incubación cuando fueron confrontados con el biofungicida, mientras que esto ocurrió al tercer día cuando se confrontaron con el fungicida químico. Con respecto a C. kikuchii, el crecimiento también se detuvo al segundo día de incubación cuando creció en presencia de T. harzianum, mientras que en presencia del fungicida el patógeno sostuvo su crecimiento hasta el día 33. Durante los primeros 13 días el crecimiento de C. kikuchii en presencia del fungicida fue mayor que el del testigo, aunque estas diferencias no fueron significativas.
Al finalizar la evaluación de las pruebas duales se observó en los tres patógenos un crecimiento significativamente mayor en los tratamientos testigo que cuando los patógenos se confrontaron con los fungicidas. Esto demuestra la eficiencia de los productos en el control de los patógenos estudiados. Asimismo Hernandez et al. (12) observaron en ensayos in vitro que tanto el biocontrolador T. harzianum como el fungicida (carbendazim) impidieron el desarrollo del patógeno evaluado (Dothiorella sp.), no encontrando diferencias significativas entre ambos estrategias de control. En cambio en nuestro trabajo las diferencias ente el crecimiento de las colonias confrontadas con T. harzianum y con el fungicida químico fueron significativas, siendo mayor la inhibición obtenida con el biocontrolador.
CONCLUSIONES
Tal lo esperado, en nuestros estudios el fungicida en base a metalaxil-M, recomendado para Oomycetes demostró limitada capacidad para controlar a los hongos Ascomycetes patógenos de soja C. kikuchii, Fusarium spp. y Phomopsis spp. Esto también pudo ser corroborado en el experimento de confrontación in vitro de los hongos. Los fungicidas en base a los principios activos thiram+carbendazim y pyraclostrobin+metil tiofanato, en ese orden, inhibieron el crecimiento de los hongos evaluados con distinta eficiencia. El fungicida en base a pyraclostrobin+metil tiofanato constituye una alternativa actual a los fungicidas tradicionales del mercado de terápicos de semillas, restando establecer si dosis mayores a la ensayada pueden mejorar su performance, considerando que se utilizó la dosis recomendada por marbete para el tratamiento de semillas de otros cultivos.
T. harzianum, en cultivos duales, demostró ser un efectivo controlador biológico de C.kikuchii, Fusarium spp. y Phomopsis spp., patógenos aislados de semillas de soja.
Las diferencias significativas encontradas in vitro entre el curasemillas biológico en base a T. harzianum y el químico en base a fludioxonil + metalaxil-M + tiabendazol para el control de C. kikuchii, Fusarium spp. y Phomopsis spp. justifican el uso de T. harzianum como una herramienta de control que no dañe el medio ambiente ni la salud de las poblaciones.
Este trabajo utiliza métodos que permiten analizar la eficiencia de control puntual de moléculas fungicidas de síntesis o biocontroladores sobre patógenos específicos. De este modo se exponen algunas alternativas potencialmente útiles de tratamiento de semillas de soja para el control de patógenos habitualmente presentes en el sudeste de la provincia de Buenos Aires. Pruebas para la evaluación de terápicos de soja en suelos con infestación natural de patógenos agregarían información útil para valorarlos como una herramienta para el manejo de la sanidad del cultivo.
BIBLIOGRAFÍA
1. ALVES, SB Y LOPES, R. 2008. Controle microbiano de pragana América Latina: avanços e desafios. Piracicaba, BR, FEALQ. 414 p. [ Links ]
2. BARBOSA, R. J. F., VALERO, N. O., CARRILLO, R. M. G. Y REDONDO, A. R. P. 2008. Antagonismo in vitro de Trichoderma harzianum Rifai sobre Fusarium solani (Mart.) Sacc., asociado a la marchitez en maracuyá. Universidad Nacional de Colombia. [ Links ]
3. BARNETT, H.L., HUNTER, B.B. 1998. Illustratedgeneraofimperfectfungi. The American Phytopathological Society. USA. 218p. [ Links ]
4. BELL, D. K., WELLS, H. D. Y MARKHAM, C. R. 1982. In vitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology. 72(4), 379-382. [ Links ]
5. BENÍTEZ T., RINCÓN A.M., LIMÓN M.C. Y CODÓN A.C. 2004. Biocontrol mechanisms of Trichoderma strains. International microbiology. 7:249-260. [ Links ]
6. CANTÓN R., GARCÍA J.E., GÓMEZ L., MARTÍNEZ L., RODRÍGUEZ C., VILA, J. Y GARCÍA J. A 2000. Procedimientos en Microbiología Clínica. Métodos Básicos Para el Estudio de la Sensibilidad a los Antimicrobianos en Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Editor Picazo J J. 2000 http://www.seimc.org [ Links ]
7. DENNIS, C. Y WEBSTER, J. 1971. Antagonistic properties of species groups of Trichoderma. I. Production of nonvolatile antibiotics. Transactions of the British Mycological Society. 57:25-39. [ Links ]
8. Di RIENZO J. A., CASANOVES F., BALZARINI M G., GONZALEZ L., TABLADA M. Y ROBLEDO C. W., 2010. InfoStat versión 2010. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
9. GALLY, T. 2006. Enfermedades de las semillas de soja en Argentina. Soybean seed diseases in Argentina.Manejo Integrado de Plagas y Agroecología. Costa Rica(78), 86-90 [ Links ]
10. Guédez, C., Cañizález, L., Castillo, C. y Olivar, R. 2009. Efecto antagónico de Trichoderma harzianum sobre algunos hongos patógenos postcosecha de la fresa (Fragaria spp.).Rev. Soc. Venez. Microbiol,29(1), 34-38. [ Links ]
11. HARMAN G. 2000. Myths and dogmas of control. Changes in perceptions derived from research on Trichoderma harzianum T-22. Plant Disease. 84(4):377-393. [ Links ]
12. HERNÁNDEZ, J., ARCIA, M. Y RAMÍREZ, R. 1999. Comparación in vitro del control químico y biológico de Dothiorellla sp., causante de la pudrición apical de la guayaba (Psidium guajava L). Revista de la Facultad de Agronomía. 16(01). [ Links ]
13. HJELJORD, L. Y TRONSMO, A. 1998. Trichoderma and Gliocladium in biological control: an overview.Trichoderma and Gliocladium,2, 131-151. [ Links ]
14. INFANTE, D., MARTÍNEZ, B., GONZÁLEZ, N. Y REYES, Y. 2009. Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Revista de protección vegetal. 24(1), 14-21. [ Links ]
15. ISTA (International Seed Testing Association) 2008. International Rules for Seed Testing. Bassersdorf. Switzerland. 441p. [ Links ]
16. KIRCHHOFF, M. M. (2005). Promoting sustainability through green chemistry. Resources, conservation and recycling, 44(3), 237-243. [ Links ]
17. MARTÍNEZ, B., INFANTE, D. Y REYES, Y. 2013. Trichoderma spp. y su función en el control de plagas en los cultivos.Revista de Protección Vegetal,28(1)1-11. [ Links ]
18. MICHEL, A., REYES, A., OTERO, M., REBOLLEDO, O. Y LEZAMA, R. 2005. Potencial antagónico de Trichoderma spp., sobre Fusarium oxysporum Schlechtend.:Fr. f. sp. lycopersici (Sacc.) Snyder y Hansen y Sclerotium rolfsii (Sacc.) in vitro e invernadero. Revista Mexicana de Fitopatología 23:284-291. [ Links ]
19. RIDAO, A. DEL C., PEREYRA IRAOLA, M., PAGANI, A., BODEGA, E., AZPEITÍA, M. Y ROSS, F. 2005. Situación actual de las principales enfermedades de soja en el sudeste de Buenos Aires. Resúmenes. 13º Congreso Latinoamericano de Fitopatología. Villa Carlos Paz, Córdoba, Argentina. pp. 456. [ Links ]
20. ROSSI, M. E. 2008. La semilla como fuente de inóculo del complejo Diaporthe/Phomopsis en el centro sur de la provincia de Buenos Aires. Tesis de Grado para Título de Ingeniero Agrónomo. Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata. Balcarce. 48p. [ Links ]
21. SANCHEZ, M.C. 2015. Diaporthe caulivora: agente causal de cancro del tallo predominante en cultivos de soja del sudeste bonaerense en los ciclos agrícolas 2010 a 2013. Tesis de Grado para Título de Ingeniero Agrónomo. Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata. Balcarce. 35p. [ Links ]
22. SCANDIANI, M.M. Y LUQUE, A.G. 2009. Identificación de Patógenos en Semillas de Soja. Suplemento Especial Nº 2. Análisis de Semillas. ISSN 1852-5024. 148p. [ Links ]
23. SKIDMORE, A.M. Y DICKINSON, CH. 1976. Colony interactions and hyphal interference between Septoria nodorum and phylloplane fungi. Transactions of the British Mycological Society 66(1):57-64. [ Links ]