Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Fave. Sección ciencias agrarias
versão impressa ISSN 1666-7719
FAVE. Secc. Cienc. agrar. vol.14 no.2 Santa Fe dez. 2015
ARTICULO ORIGINAL
Diaporthe caulivora: agente causal de cancro del tallo predominante en cultivos de soja del sudeste bonaerense
MC Sánchez1; A del C Ridao1; ML Colavita1
1Facultad de Ciencias Agrarias, UNMdP.
Dirección Postal: CC 276 (7620) Balcarce -; (02266) 54-2266-430456-430353-430311) -
maclarasanchez@gmail.com
RESUMEN
El cancro del tallo (CTS) ha sido la enfermedad más destructiva de la soja en el sudeste de la provincia de Buenos Aires en los últimos ciclos agrícolas. Considerando la inserción actual del cultivo en los sistemas productivos de esta zona, que el CTS es una enfermedad prevalente y que Diaporthe caulivora (Dc) es el agente causal predominante en Argentina, es importante conocer la identidad del agente prevalente en el área. Los objetivos fueron reconocer por características morfológicas las especies del complejo Diaporthe/Phomopsis presentes en cultivos de soja, en los ciclos agrícolas 2010/11-2011/12-2012/13, y confirmar molecularmente mediante PCR-RFLP, que la especie predominante causante de síntomas de CTS fue Dc. De 39 aislamientos, 61% correspondió a Dc, 26% a P. longicolla, sólo uno a D. p. var. sojae y cuatro no pudieron ser determinados. No se detectó D. p. meridionalis. El agente causal predominante en la zona de estudio fue Dc.
Palabras clave: Glycine max (L.) Merr.; Diaporthe/Phomopsis; D. phaseolorum var. caulivora.
SUMMARY
Diaporthe caulivora: predominant causal agent of stem canker in soybean crops in the southeast of Buenos Aires province
Stem canker (SC) has been the most destructive disease of soybean in the southeast of Buenos Aires in the last agricultural cycles. Considering the current inclusion of the soybean in the production systems in this area, that the SC is a prevalent disease, and that Diaporthe caulivora (Dc) is the predominant causal agent in Argentina, it is important to know the identity of the agent prevalent in the area. The objectives of the study were to recognize by morphology the species of the Diaporthe/Phomopsis complex present in soybean crops during the agricultural cycles 2010/11-2011/12-2012/13, and confirmed using PCR-RFLP that the predominant species causing symptoms of SC was Dc. Out of 39 isolates, 61% corresponded to Dc, 26% to P. longicolla, only isolation to D. p. var. sojae, and four could not be determined. D. p. meridionalis were not detected. The predominant causal agent in the zone of the study was Dc.
Key Words: Glycine max (L.) Merr.; Diaporthe/Phomopsis; D. phaseolorum var. caulivora.
INTRODUCCIÓN
El complejo fúngico Diaporthe/Phomopsis (D/P) constituye un grupo de hongos de amplia diversidad genética que incluye variedades patogénicas de gran importancia económica para el cultivo de soja (22). Según Fernández et al. (6) el conjunto de enfermedades causadas por el complejo provoca mayores pérdidas en soja, que cualquier otra enfermedad fúngica. La mayoría de estos hongos son endémicos en las principales zonas productoras de soja del mundo y, bajo determinadas condiciones ambientales, pueden ser muy destructivos (26). Entre las enfermedades del complejo D/P se citan: tizón del tallo y de la vaina (TTV) causado por Diaporthe phaseolorum var. sojae (fase anamórfica: Phomopsis phaseoli); cancro del tallo (CTS) causado por dos variedades de D. phaseolorum, caulivora (fase anamórfica rara, Phomopsis phaseoli var. caulivora) y meridionalis (fase anamórfica: Phomopsis phaseoli var. meridionalis) y el decaimiento y deterioro de la semilla (DDS) por Phomopsis longicolla. Diaporthe phaseolorum y Phomopsis phaseoli son reconocidas como la fase sexual y asexual de este complejo Diaporthe/Phomopsis (17).
El CTS es una de las enfermedades con mayor potencial destructivo para el cultivo de soja. Esta enfermedad, ha provocado importantes epifitias en las principales áreas sojeras del mundo, ocasionando pérdidas de hasta el 100 % en Europa, Estados Unidos, Canadá (3) y Brasil (40). El hongo D. phaseolorum (Cke & Ell) Sacc.(teleomorfo) es el agente causal de esta enfermedaden sus dos variantes, D. p. var. caulivora (Dpc) y D. p. var. meridionalis (Dpm). Durante mucho tiempo, se consideró al CTS como una única enfermedad (6). Posteriormente, se descubrió que las entidades fúngicas que lo provocaban eran diferentes, dependiendo de la temperatura. En consecuencia, se denominó "cancro de tallo del norte de EE.UU.", a la enfermedad provocada por D. p. var. caulivora y "cancro de tallo del sur de EE.UU.", si el agente causal era D. p. var. meridionalis. En la actualidad se acepta a estas dos entidades como las responsables del cancro del tallo en soja. En trabajos recientes se ha postulado que estas dos variedades serían especies diferentes, resultando entonces D. p. var. meridionalis = D. aspalathi (Da) (12) y de D. p. var. caulivora = D. caulivora (Dc) (34). El CTS causado por Dpc (=Dc) ha incrementado gradualmente su importancia y se ha convertido en una de las enfermedades más destructivas que afectan al cultivo de soja en el centro-sur de la provincia de Buenos Aires (31). Además, los genes que confieren resistencia a Dpm, en los cultivares comerciales, no lo hacen para Dc(11). En base a la identificación morfológica y molecular de 19 aislamientos del sur de Santa Fe y norte de Buenos Aires, Pioli et al. (23) concluyeron que Dc fue el agente causal predominante del CTS en esa zona. En el sudeste bonaerense, se registraron síntomas de CTS durante las campañas 2003/04, 2004/05 (32) y 2005/06 (35). En el ciclo agrícola 2006/07, se realizó un relevamiento en 82 lotes comerciales de soja y se determinó la importancia de esta enfermedad en la zona (partidos de Azul, Balcarce, Gral. Alvarado, Necochea, Olavarría, San Cayetano, Tandil y Tres Arroyos), y se determinó una prevalencia de 94 %. En los partidos de Azul, Balcarce, Olavarría y Tandil, se observó al menos una planta enferma en el 100 % de los lotes evaluados. El alto grado de dispersión encontrado y los altos valores de incidencia por lote (10 a 56 %) confirmaron la relevancia del CTS causado por Dc en el centro-sudeste de la provincia de Buenos Aires (14, 15, 16, 30). Grijalba y Guillín (10) determinaron la presencia de la enfermedad en un lote de Necochea con una incidencia de 35 % y caracterizaron molecularmente un aislamiento desde una planta enferma, confirmando al agente causal como Dc. Ridao y Platz (32) determinaron las pérdidas de rendimiento en un lote en las cercanías de Balcarce (Buenos Aires) debidas al CTS causado por Dc en la campaña agrícola 2011/12, y estimaron que sobre un total de 367.000 plantas/ha, 34.224 plantas/ha fueron infectadas, lo que significa una reducción en el rendimiento de 170 kg/ha. Esta pérdida constituye un total de 93,8 U$S/ha, y representaría una pérdida de 105 millones de U$S para esa campaña en este área de la provincia de Buenos Aires.
Los primeros síntomas del CTS se visualizan en estados reproductivos tempranos del cultivo, y se caracterizan por pequeñas lesiones castaño-rojizas en la cicatriz foliar (2). Los síntomas típicos pueden tardar entre uno y dos meses en desarrollarse, lo que generalmente coincide con el establecimiento de vainas en el cultivo, estado fenológico (EF) R3 (25). A medida que la estación progresa, las lesiones se expanden longitudinalmente y forman cancros hundidos, de color castaño-rojizo que, en lesiones viejas, pueden variar de chocolate a negro (3, 40). Una característica importante para el diagnóstico de la enfermedad es el color de la médula que varía de castaño rojiza en plantas verdes, a púrpura en tallos secos. Esta tonalidad es más acentuada en los nudos, y se extiende mucho más allá del límite de los cancros visibles externamente (40). Los tejidos invadidos son frágiles, y las plantas se quiebran fácilmente a nivel del cancro (1). Los síntomas que ocasiona Dc incluyen cancros difusos y no muy bien definidos, o decoloración cerca de los nudos foliares inferiores, con muerte y marchitamiento rápido de las hojas (Fig.1). Si los cancros ciñen el tallo, la planta puede morir (30). La necrosis del follaje se presenta al inicio con una coloración castaño-anaranjada de las hojas, que luego se oscurecen. Los síntomas del follaje se pueden confundir con los causados por otras dos enfermedades como son la pudrición húmeda del tallo por Sclerotinia sclerotiorum y la pudrición del tallo y raíces por Phytophthora sojae (29). Las pérdidas de rendimiento se deben a la disminución del número y peso de la semilla como consecuencia de la menor área foliar por muerte prematura de las plantas (6). Los cancros ocasionados por Dpm se caracterizan por presentar un borde pardo-rojizo, localizados inicialmente en la zona de inserción de los pecíolos. Estas lesiones raramente circundan los tallos, pudiendo desarrollar amarillamiento y bronceado del tejido internerval de las hojas. La parte central de los cancros se observa con los tejidos decolorados y las fructificaciones o picnidios se distribuyen irregularmente. Estas dos variantes de D. phaseolorum (Dc y Dpm) no se diferencian fácilmente en el campo a través de síntomas que producen en las plantas afectadas y la identificación del agente causal se complica (29). En consecuencia, para determinar la variante del hongo involucrada en la enfermedad, es preciso recurrir al aislamiento y al posterior estudio de las colonias desarrolladas en cultivos puros, en laboratorio.
Figura 1. Plantas de soja con síntomas de cancro del tallo por D. caulivora, observándose coloración típica cerca de los nudos foliares inferiores del tallo.
La taxonomía y la nomenclatura de los patógenos involucrados en el complejo D/P ha sido ampliamente discutida (18, 20, 21). Morgan-Jones (18) mencionó que algunas características de estos hongos dificultan su clasificación, pues son entidades altamente variables, tanto en su morfología como en su patogenicidad. A su vez, Yorinori (39) y Vechiato et al. (38) demostraron que el diagnóstico basado en características morfológicas debe ser considerado como preliminar, debido a la gran variabilidad dentro del complejo D/P. Fernández y Hanlin (5) también criticaron la identificación morfológica, asegurando que las variaciones genéticas muchas veces no son tenidas en cuenta, y por eso complementaron sus trabajos con métodos moleculares. La incorporación de técnicas moleculares en los últimos años ha facilitado el avance en la diagnosis de las especies de este complejo fúngico. Zhang et al. (41, 42) desarrollaron un método para identificar estos patógenos, que combina las técnicas de reacción en cadena de la polimerasa (PCR), que permite amplificar segmentos específicos del ADNr nuclear de los hongos; y la restricción de fragmentos de longitud polimórfica (RFLP), que incluye la digestión de los productos de PCR mediante distintas enzimas (AluI, MseI, HhaI, RsaI, y ScrFI), resultando en patrones de bandas característicos que permiten distinguir entre las distintas especies del complejo.
Teniendo en cuenta la inserción actual del cultivo de soja en los sistemas productivos del centro-sur bonaerense, que el CTS es una enfermedad prevalente y destructiva, y que Dc es considerado el agente causal predominante en Argentina (9, 10, 13, 23, 30), es importante conocer la identidad del patógeno en el área, para un manejo adecuado y sustentable de la sanidad de los cultivos. La hipótesis del trabajo fue que Diaporthe caulivora, dentro del complejo Diaporthe/Phomopsis, fue la especie predominante causante de los síntomas del CTS en los cultivos de soja del sudeste de la provincia de Buenos Aires, en los ciclos agrícolas 2010/11 a 2012/13. Los objetivos del trabajo fueron: aislar y reconocer por características morfológicas, las especies y/o variantes del complejo D/P presentes en cultivos de soja, en los ciclos agrícolas 2010/11, 2011/12 y 2012/13 del sudeste de la provincia de Buenos Aires; y confirmar molecularmente, mediante uso de PCR-RFLP, que Dc fue la especie predominante entre los patógenos del complejo fúngico D/P, causante de los síntomas de CTS.
MATERIALES Y MÉTODOS
Durante los ciclos agrícolas 2010/11, 2011/12 y 2012/13, se monitorearon lotes de soja en estado reproductivo en la zona de influencia de la Unidad Integrada Balcarce (Latitud: 37° 45´ 44.14´´S; Longitud: 58° 18´ 8.62´´O). Cada lote se recorrió en W, registrando la presencia/ausencia de enfermedades sobre 25 plantas consecutivas en dos estaciones de muestreo en cada brazo. Se extrajeron plantas enfermas representativas de los síntomas observados. Se consideró como planta enferma aquella que presentaba cancros, ya sea de tipo unilateral, rodeando al tallo, o de ambos tipos en la misma planta. Además, se utilizaron plantas de soja provistas directamente por productores comerciales de la zona sudeste de la provincia de Buenos Aires. En laboratorio, a partir del margen de la lesión de las plantas enfermas, se cortaron trocitos de la médula que presentaba color pardo-oscuro o castaño-rojizo (Fig. 2), así como de lesiones en la corteza. Los mismos se desinfestaron mediante inmersión en hipoclorito de sodio (1% de Cl activo) durante 1 minuto y se sembraron en placas de Petri con medio Agar Papa Dextrosa 2%, acidificado con ácido láctico (APDA, pH 4,5-5) para inhibir bacterias contaminantes. Las placas se incubaron en estufa a 24 °C. Posteriormente se realizaron cultivos puros de los aislamientos a través de la siembra de puntas de hifa. Los cultivos purificados se sembraron en cajas de Petri que contenían APDA, con el agregado de un trocito de tallo de soja estéril de 4-5 cm de largo (25, 40) y se expusieron a ciclos alternados de luz-oscuridad de 12 horas cada uno, durante 40 a 45 días.
Figura 2. Corte longitudinal de tallo de soja con síntomas de cancro del tallo por D. caulivora, donde se observa una coloración castaño-rojiza de la médula.
Para la caracterización morfológica se utilizaron los criterios de morfometría, apariencia de la colonia, color, presencia y distribución de estroma, formación o no del anamorfo (presencia alfa y/o beta conidios) y/o teleomorfo (tipo de peritecio; presencia de ascos y ascosporas), según McGee (17), Nevena et al. (19) y Fernández et al. (6).
Para la caracterización molecular se introdujeron discos de APDA con micelio de cada aislamiento en erlenmeyers de 250 mL con 200 mL de caldo de papa y 20 g de Dextrosa 1-Hidrato (Biopack). Se incubaron en condiciones de laboratorio a 25ºC +/- 2°C en agitación en un agitador orbital (LAB-LINE) a 120 RPM. Luego de cinco días, las esferas de micelio obtenidas fueron filtradas con tela de tul, extrayendo por presión la mayor cantidad de líquido posible. La extracción de ADN se realizó a partir de micelio mediante un kit comercial (Wizard genomic, Promega Inc.), según protocolo e indicaciones del proveedor. Se amplificó selectivamente por PCR la región ITS (internal transcriptes spacer) del rADN con los iniciadores universales ITS4 (TCCTCCGCTTATTGATATGC) e ITS5 (GGAAGTAAAAGTCGTAACAAGG) (41, 42). Las reacciones de amplificación fueron realizadas con un termociclador Applied Biosystems (Veriti Thermal Cycler), las condiciones de reacción fueron las siguientes: 2 mM MgCl2; 0.2 mM de dNTPs; 0.2 µM de cada iniciador; 2 unidades de Taq Platinum (Invitrogen); 5x de buffer de PCR y 30 ng de ADN genómico en un volumen final de 50 µl. El perfil de reacción fue: 1 ciclo a 96°C durante 5 min, 34 ciclos a 94°C durante 45 seg, 53°C durante 30 seg, y 72°C durante 90 seg, con una extensión final a 72°C de 7 min. Cada corrida incluyó una reacción sin ADN (control negativo) para monitorear la contaminación potencial por ADN exógeno. Los productos de amplificación se verificaron por electroforesis en gel de agarosa (1%), y se visualizaron con luz UV en un trans-iluminador ImageQuant (GE, Suiza). La diferenciación de especies se realizó mediante PCR-RFLP digiriendo los amplicones con las enzimas de restricción AluI, HhaI, RsaI (Thermo Scientific) y MseI (BioLabs) (41, 42). Se trabajó con un volumen final de 15,5 µl en cada digestión, utilizando 5 µl de los productos de PCR; 0,5 µl de enzima; 1.5 µl de Buffer Tango 10x para AluI, HhaI y RsaI, y Buffer CutSmart 10x (#B7204S) para MseI; completando con 9 µl de H2O destilada estéril. La digestión se incubó a 37°C durante 2 a 4 h. Los resultados se analizaron en gel de agarosa (2,5%), y se visualizaron con trans-iluminador UV (ImageQuant; GE, Suiza). Los patrones de bandas obtenidos se compararon con los descriptos por Zhang et al. (42) y con Riccioni et al. (27) para las distintas variedades del complejo. Se contó con un control positivo de la especie D. caulivora (Gen Bank # HM625758) de la colección de hongos de la Facultad de Agronomía de la Universidad de Buenos Aires, cedido por el Ing. Agr. Grijalba.
RESULTADOS Y DISCUSIÓN
Formación y morfología de estructuras reproductivas
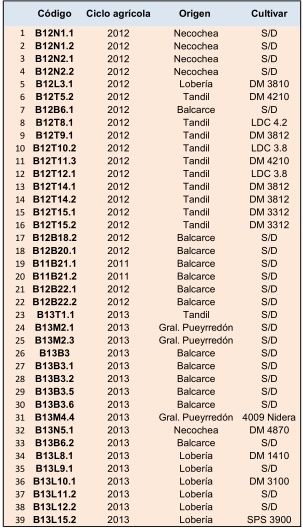
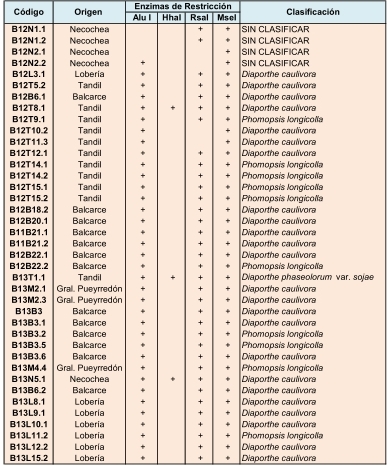
De un total de 84 aislamientos obtenidos con características de las colonias semejantes a las del complejo D/P, se seleccionaron 39 de acuerdo a la localidad o zona geográfica del sudeste de la provincia de Buenos Aires, del año del campaña agrícola y del cultivar de soja del que fueron aislados (Tabla 1). La caracterización morfológica se realizó sobre 25 aislamientos punta de hifa, descartando aquellos que provenían de la misma muestra y con características similares. Del total de aislamientos caracterizados morfológicamente, 13 correspondieron a Dc, siete a Pl, sólo uno a Dps, no se encontró Dpm, y cuatro (B12N1.1, B12N1.2, B12N2.1 y B12N2.2) no pudieron ser determinados. Visto que en la misma colonia se encontraron características diferentes, se postula que pudo haber ocurrido una mezcla al realizar los cultivos punta de hifa o hibridaciones naturales no determinadas (Ridao, 2014, Com. Pers.).
Tabla 1. Código, año de ciclo agrícola, procedencia y cultivar de soja de los aislamientos obtenidos con características dentro del complejo Diaporthe/Phomopsis
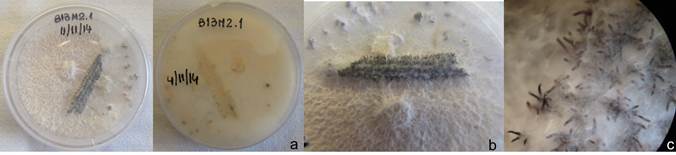
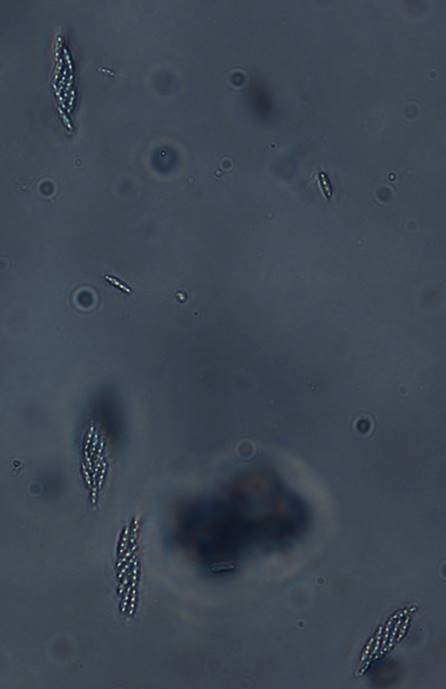
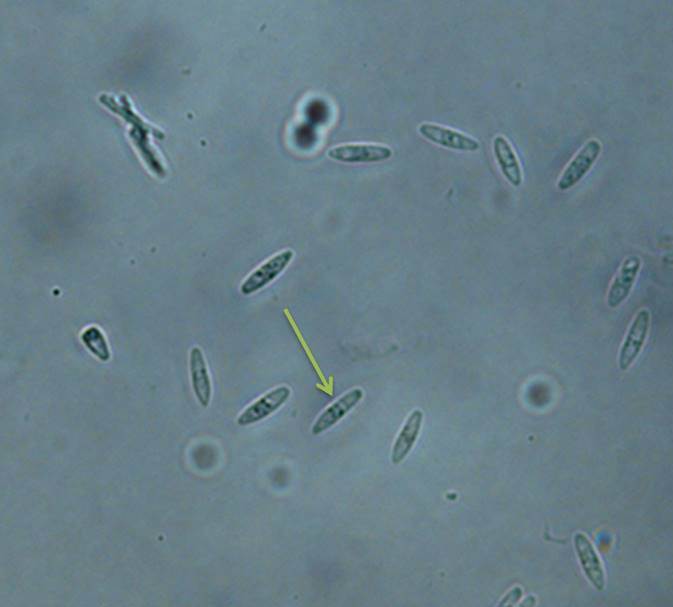
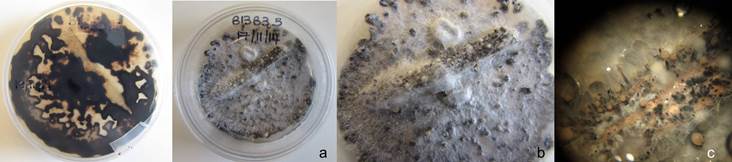
Las colonias de los aislamientos identificados como Dc desarrollaron micelio color blanco, de rápido crecimiento y aspecto comprimido y apelmazado, tornándose posteriormente de tipo algodonoso compacto con tonalidades beige. Luego de 15 a 20 días el envés de las colonias presentó una coloración ocre, con tonalidades amarillentas en algunos casos. En general, los estromas no se formaron; y sólo en pocos casos se observaron pequeños estromas (menores a 2 mm), negros y esféricos, distribuidos en el medio de cultivo (Fig. 3A-C). Entre los 40 y 45 días se observó el desarrollo de peritecios sobre el tallito de soja estéril, o bien, dispersos en el medio de cultivo. Los mismos se presentaban principalmente en grupos (o clusters) de dos o más, o solitarios (Fig.4). Las características culturales y morfológicas de los aislamientos de Dc fueron consistentes con las descripciones realizadas por Grijalba (8) y Lago (13), para aislamientos del patógeno desde tallos de soja provenientes de lotes ubicados en la zona centro y sudeste de la provincia de Buenos Aires; y por Rossi (33) para aislamientos de Dc desde semillas de soja. En ningún caso se observó la formación de picnidios, esta particularidad también concuerda con otros estudios para colonias desarrolladas en APDA. En cuanto a la morfología de las ascas y ascosporas de Dc, las ascas fueron sésiles con paredes finas, algo engrosadas en la base (Fig.5) y las ascosporas biceluladas con una pequeña constricción a nivel del tabique (Fig.6).
Figura 3. Colonias de Diaporthe caulivora (Dc) de 43 días de crecimiento en APDA; a: vistas superior e inferior de las colonias; b: detalle de peritecios de Dc formados sobre el tallito de soja; c: detalle de peritecios característicos de Dc, con cuellos prominentes (50X).
Figura 4. Peritecios de Diaporthe caulivora (Dc), formados sobre el tallito de soja e indicando con flechas peritecios agrupados (a) y solitarios (b).
Figura 5. Contenido de un peritecio de Diaporthe caulivora: detalle de ascos tunicados con ascosporas hialinas, bicelulares y bigutuladas (200X).
Figura 6. Detalle de ascosporas de Diaporthe caulivora, hialinas, bicelulares, bigutuladas y septadas, visualizadas con microscopio óptico (400X), la flecha señala el tabique.
Los aislamientos clasificados como Pl presentaron colonias con micelio blanco, denso, con áreas de color amarillo verdoso. En el reverso de las colonias se observaron grandes estromas, negros y coalescentes, que cubrían gran parte del medio del cultivo (Fig. 7A-C). Esta descripción responde a las características citadas previamente por Lago (13) para aislamientos provenientes de la zona centro y sudeste de Buenos Aires. Numerosos picnidios con cuellos prominentes se produjeron sobre el tallo de soja estéril o sobre el medio de cultivo, y ocasionalmente agrupados.
Las características morfológicas de las colonias del asilamiento identificado como Dps presentaron micelio flocoso, color blanco, con el reverso color blanco a blanco-grisáceo (Fig.8). El estroma era pequeño, intermitente y disperso en el medio de cultivo. Los picnidios muy cortos y estromáticos, se produjeron principalmente sobre el tallo de soja estéril, en forma agrupada o solitaria.
Figura 7. Colonias de Phomopsis longicolla (Pl) de 45 días de crecimiento en APDA; a: vistas inferior y superior de la caja de Petri; b: detalle de picnidios de Pl con cuellos prominentes formados sobre el tallito de soja; c: detalle de picnidios de Pl sobre el tallito de soja donde se observa una coloración amarilla - anaranjada correspondiente al contenido de los mismos.
Figura 8. Colonia de Diaporthe phaseolorum var. sojae de 41 días de crecimiento en APDA; vistas superior e inferior de la caja de Petri.
Caracterización molecular
La amplificación de la región ITS por PCR dio como resultado un fragmento de aproximadamente 600 pb, similar para todos los aislamientos incluyendo el control de Dc (Fig. 9 A y B). La digestión de dicho amplicón con las enzimas de restricción AluI, HhaI, RsaI y MseI, permitió detectar la presencia de tres especies del complejo D/P: Dc, Pl y Dps (Tabla 2).
Tabla 2. Especies del complejo Diaporthe/Phomopsis determinadas mediante PCR-RFLP.


Figura 9. Resultados de la amplificación de la región ITS con los iniciadores ITS 4 e ITS 5 de los 39 aislamientos, más el control Dc. a: Aislamientos B12N1.1, B12N1.2, B12N2.1, B12N2.2, B12L3.1, B12B6.1, B12T8.1, B12T10.2, B12T11.3, B12T12.1, B12T5.2, B12T9.1, B12T14.1, B12T14.2, B12T15.1, B12T15.2, B12B18.2, B12B20.1, B11B21.1, B11B21.2 y CONTROL Dc. b: Aislamientos B12B22.1, B12B22.2, B13T1.1, B13M2.1, B13M2.3, B13B3, B13B3.1, B13B3.2, B13B3.5, B13B3.6, B13M4.4, B13N5.1, B13B6.2, B13L8.1, B13L9.1, B13L10.1, B13L11.2, B13L12.2, B13L15.2 y CONTROL Dc. (M100 pb y M50 pb: Marcador de Peso Molecular cada 100 pares de bases, y cada 50 pares de bases, respectivamente).
De las enzimas utilizadas en el análisis de restricción de los productos de PCR de la región ITS, sólo AluI arrojó patrones distintivos y coincidentes con la identificación taxonómica (5, 8, 23, 41, 42) (Fig.10 A y B). Los aislamientos clasificados como Dc presentaron tres bandas de 280, 175 y 145 pb; diferenciándose claramente de Dpm que no es digerido por esta enzima y presenta una sola banda de 603 bp. Para la identificación de Dc es suficiente la utilización de esta enzima de restricción, y la obtención del patrón de restricción característico para dicha especie (28). Los aislamientos que se clasificaron como de Pl (B12T9.1, B12T14.1, B12T14.2, B12T15.1, B12T15.2, B12B22.2, B13B3.2, B13B3.5, B13M4.4, B13L11.2)presentaron dos bandas de aproximadamente 460 y 145 pb cuando fueron digeridos con AluI. El aislamiento, B13T1, clasificado como Dps, presentó el mismo patrón de bandas al digerirse con esta enzima, pero su identificación pudo realizarse con las demás enzimas de restricción.
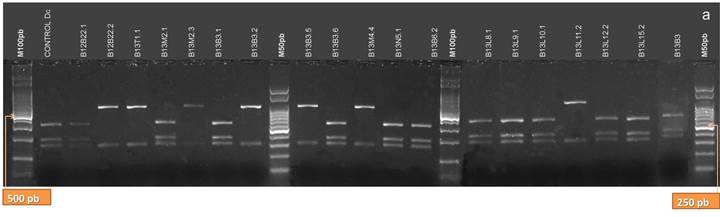
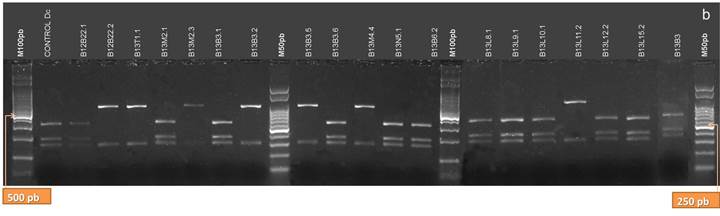
Figura 10. Patrones de bandas de restricción de los productos de la amplificación de la región ITS del ADNr de los aislamientos digeridos con la enzima AluI. a: aislamientos B12L3.1, B12B6.1, B12T8.1, B12T10.2, B12T11.3, B12T12.1, B12T5.2, B12T9.1, B12T14.1, B12N1.1, B12N1.2, B12N2.1, B12N2.2, B12T14.2, B12T15.1, B12T15.2, B12B18.2, B12B20.1, B11B21.1, B11B21.2. b: aislamientos B12B22.1, B12B22.2, B13T1.1, B13M2.1, B13M2.3, B13B3.1, B13B3.2, B13B3.5, B13B3.6, B13M4.4, B13N5.1, B13B6.2, B13L8.1, B13L9.1, B13L10.1, B13L11.2, B13L12.2, B13L15.2 y B13B3. (M100 pb y M50 pb: Marcadores de Peso Molecular cada 100 pares de bases, y cada 50 pares de bases, respectivamente)
La digestión con la enzima HhaI (Fig.11 A y B) permitió la confirmación de la identidad del aislamiento B13T1 como Dps, obteniéndose tres bandas de aproximadamente 270, 260 y 60 pb. Riccioni et al. (28) sostienen que para una confirmación del 100 % de la identidad de Dps es necesario digerir el producto de la amplificación de la región ITS con esta enzima de restricción, y obtener el patrón de tres bandas previamente mencionado. Sin embargo, la cantidad de patrones que posee esta enzima para Dps (42), con algunos muy similares a los patrones de bandas para las demás especies del complejo, hizo dificultosa la clasificación mediante el uso de HhaI. Por otra parte, sólo en los aislamientos B12T8 y B13N5, clasificados como Dc, los patrones de bandas que se obtuvieron con HhaI coincidieron con los citados por Zhang et al. (42) para esta especie. Para B12T8 se obtuvieron bandas de aproximadamente 230 y 140 pb, y otras menores a 100 pb; mientras que B12T5 presentó dos bandas de 255 y 230 pb, y otras menores prácticamente no visibles. El patrón de restricción de Pl al ser digerido por esta enzima es similar a este último (dos bandas de 260 y 228 pb, y otras de menor tamaño), no obstante ninguno de los aislamientos clasificados como Pl presentó tal patrón y la confirmación de la identidad fue realizada con las otras enzimas de restricción.
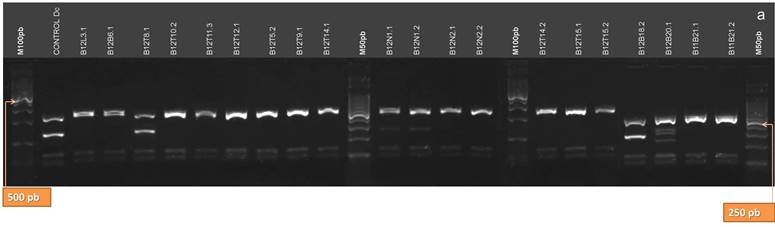
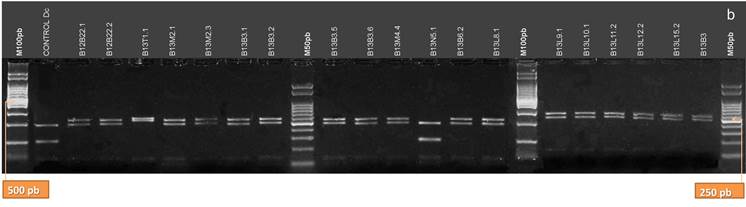
Figura 11. Patrones de bandas de restricción de los productos de la amplificación de la región ITS del ADNr de los aislamientos digeridos con la enzima HhaI. a: aislamientos B12L3.1, B12B6.1, B12T8.1, B12T10.2, B12T11.3, B12T12.1, B12T5.2, B12T9.1, B12T14.1, B12N1.1, B12N1.2, B12N2.1, B12N2.2, B12T14.2, B12T15.1, B12T15.2, B12B18.2, B12B20.1, B11B21.1, B11B21.2. b: aislamientos B12B22.1, B12B22.2, B13T1.1, B13M2.1, B13M2.3, B13B3.1, B13B3.2, B13B3.5, B13B3.6, B13M4.4, B13N5.1, B13B6.2, B13L8.1, B13L9.1, B13L10.1, B13L11.2, B13L12.2, B13L15.2 y B13B3. (M100 pb y M50 pb: Marcadores de Peso Molecular cada 100 pares de bases, y cada 50 pares de bases, respectivamente).
Los productos de la amplificación de la región ITS de los aislamientos identificados como Dc no son digeridos por la enzima RsaI, obteniéndose una única banda de 603 o 602 pb (42). Mediante esta enzima de restricción se clasificaron los aislamientos de Pl, para los cuales se obtuvieron dos bandas de 390/400 y 210 pb (Fig.12 A y B).
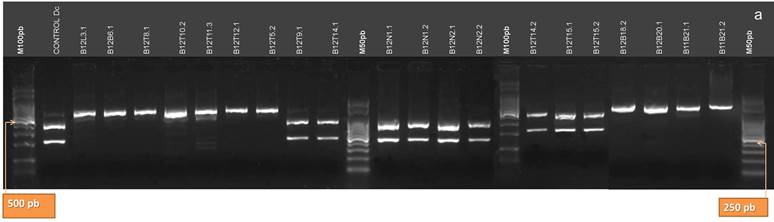
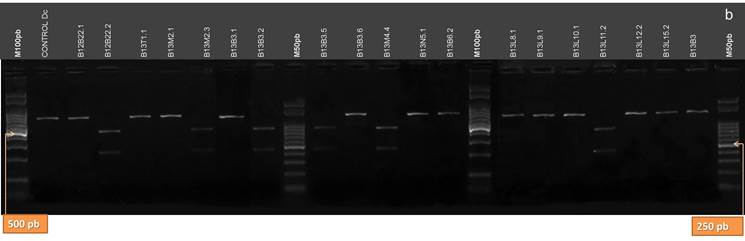
Figura 12. Patrones de bandas de restricción de los productos de la amplificación de la región ITS del ADNr de los aislamientos digeridos con la enzima RsaI. a: aislamientos B12L3.1, B12B6.1, B12T8.1, B12T10.2, B12T11.3, B12T12.1, B12T5.2, B12T9.1, B12T14.1, B12N1.1, B12N1.2, B12N2.1, B12N2.2, B12T14.2, B12T15.1, B12T15.2, B12B18.2, B12B20.1, B11B21.1, B11B21.2. b: aislamientos B12B22.1, B12B22.2, B13T1.1, B13M2.1, B13M2.3, B13B3.1, B13B3.2, B13B3.5, B13B3.6, B13M4.4, B13N5.1, B13B6.2, B13L8.1, B13L9.1, B13L10.1, B13L11.2, B13L12.2, B13L15.2 y B13B3. (M100 pb y M50 pb: Marcadores de Peso Molecular cada 100 pares de bases, y cada 50 pares de bases, respectivamente).
Con la enzima de restricción MseI se obtiene un patrón de bandas de 484, 57, 40 y 21 pb (esta última poco visible) para Dc y Dpm; mientras que para Pl y Dps se obtienen bandas de 526, 57 y 21 pb (también poco visibles) (Fig.13 A y B). En consecuencia, la enzima MseI fue útil para obtener la confirmación de la identidad de todos los aislamientos.

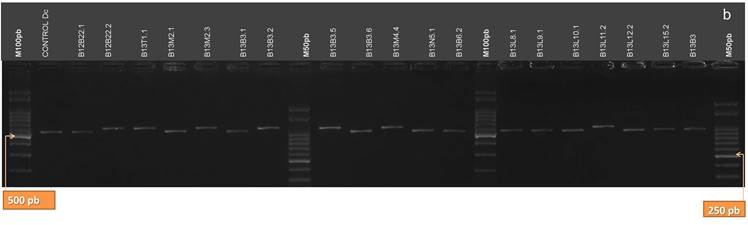
Figura 13. Figura 22. Patrones de bandas de restricción de los productos de la amplificación de la región ITS del ADNr de los aislamientos digeridos con la enzima MseI. a: aislamientos B12L3.1, B12B6.1, B12T8.1, B12T10.2, B12T11.3, B12T12.1, B12T5.2, B12T9.1, B12T14.1, B12N1.1, B12N1.2, B12N2.1, B12N2.2, B12T14.2, B12T15.1, B12T15.2, B12B18.2, B12B20.1, B11B21.1, B11B21.2. b: aislamientos B12B22.1, B12B22.2, B13T1.1, B13M2.1, B13M2.3, B13B3.1, B13B3.2, B13B3.5, B13B3.6, B13M4.4, B13N5.1, B13B6.2, B13L8.1, B13L9.1, B13L10.1, B13L11.2, B13L12.2, B13L15.2 y B13B3. (M100 pb y M50 pb: Marcadores de Peso Molecular cada 100 pares de bases, y cada 50 pares de bases, respectivamente).
Los aislamientos que no pudieron ser identificados mediante sus características culturales y morfológicas, B12N1.1, B12N1.2, B12N2.1 y B12N2.2, presentaron patrones de bandas que no coincidieron con ningún patrón de restricción citado en la bibliografía para las especies del complejo D/P (42) (Fig. 10, 11, 12 y 13). Esto avala la sospecha de que pudo haber existido mezcla en los cultivos punta de hifa, o que haya ocurrido hibridación entre especies.
El análisis de restricción de los productos de amplificación ha sido utilizado para identificar distintas especies de hongos, y también para diferenciar subgrupos dentro de especies (4, 7, 41). En el presente trabajo, se corroboró que la utilización de la amplificación de la región ITS del ADNr, seguida por la restricción con enzimas de restricción resultó consistente con la identificación morfológica para cada uno de miembros del complejo fúngico D/P. Tanto Dc como Dpm producen síntomas parecidos en las plantas afectadas, lo cual dificulta su identificación en el campo. En consecuencia, para determinar la variedad del hongo involucrada en el desarrollo de la enfermedad, es preciso recurrir al aislamiento y al estudio de las características de sus colonias.
Luego de la caracterización de los 39 aislamientos, se estableció que la distribución de especies del complejo D/P fue: 24 aislamientos correspondieron a la especie Dc, diez aislamientos se clasificaron como Pl, sólo un aislamiento se identificó como Dps y cuatro aislamientos no pudieron ser clasificados. Dc se obtuvo de tallos de soja provenientes de todos los partidos muestreados. Pl de Balcarce, Tandil, Lobería y Gral. Pueyrredón, y no de Necochea; mientras que Dps sólo de Tandil. En la localidad de Necochea hubo cuatro aislamientos que no fueron determinados. Ningún aislamiento fue identificado como Dpm. El agente causal prevalente en la zona de estudio, durante los ciclos agrícolas 2010/11 a 2012/13 fue Dc. Este resultado coincide con lo informado por Lago (13). Pioli et al. (23)concluyeron que Dc fue el agente causal predominante del CTS en la zona sur de Santa Fé y norte de Buenos Aires en base a la identificación morfológica y molecular de 19 aislamientos. También Xue et al. (38) mencionan a Dc como agente causal predominante para latitudes similares en el hemisferio norte. Varios factores como la expansión del cultivo de soja, el aumento de la superficie con siembra directa, la uniformidad genética de los cultivares de soja utilizados y la ocurrencia de condiciones ambientales propicias para el desarrollo del CTS, pudieron contribuir a la manifestación de la enfermedad en el sudeste bonaerense, tal como ha sucedido en otros lugares según Wrather et al. (37) y Pioli y Morandi (22).
CONCLUSIONES
D. caulivora, dentro del complejo Diaporthe/Phomopsis, fue la especie predominante causante de los síntomas de cancro del tallo en los cultivos de soja del sudeste de la provincia de Buenos Aires, en los ciclos agrícolas desde el 2010 al 2013, por lo tanto no hay evidencias para rechazar la hipótesis planteada en el presente estudio. El 61,5% de los aislamientos correspondió a D. caulivora, 25,6% a P. longicolla, 2,6% a D. p. var. sojae, y 10,3%no pudo ser clasificado. D. caulivora estuvo presente en todos los partidos muestreados, mientras que D. p. var. meridionalis no se aisló de ninguna muestra. D. p. var. sojae sólo se obtuvo en Tandil. P. longicolla se aisló de Balcarce, Tandil, Lobería y Gral. Pueyrredón, y no de Necochea, partido al cual pertenecieron los cuatro aislamientos no determinados.
BIBLIOGRAFIA
1 APS (The American Phytopathological Society). 1980. Compendio de enfermedades de la soja. Ed. Hemisferio Sur, S.A. 1º Ed. en español. Buenos Aires, Argentina. [ Links ]
2 ATHOW, K.L.; CALDWELL, R.M. 1954. A comparative study of Diaporthe stem canker and pod and stem blight of soybeans. Phytopathology. 44: 319-325. [ Links ]
3 BACKMAN, P.A.; MC GEE, D.C. Y MORGAN-JONES, G. 1989. Stem Canker. In: Compendium of soybean Diseases. Third Edition. The American Phytopathological Society, APS Press, St Paul, Minnesota, USA.p.41-43. [ Links ]
4 CHEN, W.D.; GRAY, L.E. Y GRAU, C.R. 1996. Molecular differentiation of fungi associated with brown stem rot and detection of Phialophora gregata in resistant and susceptible soybean cultivars. Phytopathology 86:1140-1148. [ Links ]
5 FERNÁNDEZ, F.A.; HANLIN, R.T. 1996. Morphological and RAPD analyses of Diaporthe phaseolorum from soybean. Mycologia. 88(3): 425-440. [ Links ]
6 FERNÁNDEZ, F.A; PHILLIPS, D.V.; RUSSIN, J.S.; Y RUPE, J.C. 1999. Stem canker. In: Hartman, G. L.; Sinclair, J. B y Rupe, J. C. eds. Compedium of Soybean Disease. 4th ed. APS. St. Paul, Minnesota, USA. p. 33-35. [ Links ]
7 GOODWIN; P.H.; KIRKPATRICK, B.C. Y DUNOWAY, J.M. 1989. Cloned DNA probes for identification of Phytophthora parasitica. Phytopathology 79:716-721. [ Links ]
8 GRIJALBA, P.E. 2010. Variabilidad morfológica, genética y patogénica de Diaporthe phaseolorum var. caulivora causante del Cancro del tallo de la soja en la provincia de Buenos Aires. Tesis Magister Scientiae en Producción Vegetal. Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata. Balcarce, Argentina. 68p. [ Links ]
9 GRIJALBA P.E.; GULLIN E. 2005. Diaporthe phaseolorum var. caulivora en Buenos Aires. En proc.: 13° Congreso Latinoamericano de Fitopatología. Córdoba, Argentina. pp. 428. [ Links ]
10 GRIJALBA, P.E.; GUILLIN, E. 2007. Occurrence of soybean stem canker caused by Diaporthe phaseolorum var. caulivora in the southern part of Buenos Aires province, Argentina. Australas. Plant Dis. Notes. 2:65-66. [ Links ]
11 GRIJALBA, P.E.; RIDAO, ADELC. Y GUILLIN, E. 2011. Caracterización taxonómica y análisis de la variablidad del agente causal del cancro del tallo de la soja en la provincia de Buenos Aires (temporadas 2005/2007). En: http://ria.inta.gov.ar/?p=1363. RIA 37 (3):290-297. ISSN 0325-8718. [ Links ]
12 JANSE VAN RENSBURG, J.C.; LAMPRECHT, S.C.; GROENEWALD, J.Z.; CASTLEBURY, L.A. Y CROUS, P.W. 2006. Characterisation of Phomopsis spp. associated with die-back of rooibos (Aspalathus linearis) in South Africa.Studies in Mycology 55:65-;74. [ Links ]
13 LAGO M.E. 2010. Etiología y Aspectos Epidemiológicos del Cancro del Tallo de la Soja en el Centro y Sudeste Bonaerense. Tesis Magister Scientiae. Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata. Balcarce, Argentina. 87p. [ Links ]
14 LAGO, M.E.; RIDAO, ADELC. Y SANMARTINO, S. 2007. Prevalencia e incidencia del tallo de la soja en el SE de la provincia de Buenos Aires, Argentina. Fitopatologia Brasileira. 32: 311. [ Links ]
15 LAGO, M.E.; RIDAO, ADELC., GUILLÍN, E. Y BARRETO, D. 2009, Etiología del cancro del tallo de la soja en el centro y sudeste bonaerense. 13° Jornadas. Fitosanitarias Argentinas. 30/09-1/02/10/09. Termas de Río Hondo, Sgo.del Estero, Argentina. E56. ISBN 978-950-673-600-2 [ Links ]
16 LAGO, M.E.; S. SANMARTINO Y ADELC RIDAO. 2010. Caracterización y comparación de curvas de progreso de la enfermedad de cancro del tallo de la soja a través de modelos no lineales mixtos. Workshop en Modelos Mixtos- San Miguel de Tucumán, septiembre10. pp49. [ Links ]
17 MCGEE, D. 1992. Soybean Diseases.A reference source for seed technologists.The American Phytopathological Society, APS Press. St. Paul, Minnesota, USA.151p. [ Links ]
18 MORGAN-JONES, G. 1989. The Diaporthe/Phomopsis complex: taxonomic considerations. World Soybean Research Proceedings. A. Pascale, ed. Buenos Aires, Argentina. p.1699-1706. [ Links ]
19 NEVENA, M.; JELENA, V. Y FRANIC-MIHAJLOVIC, D. 1997. A comparative study of Diaporthe/Phomopsis fungi on soybean from two different regions of the world. Mycopathology. 139: 107-113. [ Links ]
20 PIOLI, R.N.; MORANDI, E.N. 2002a. D. phaseolorum var. caulivora. In: Global Crop Protection Compendium, 2002. Wallingford, UK: CAB International. ISSN- 1365-9065, ISBN-0-85199-649-3. Ed. L. Mogillivray. [ Links ]
21 PIOLI, R.N.; MORANDI, E.N. 2002b. D. phaseolorum var. meridionalis, CABI. [ Links ]
22 PIOLI, R.; MORANDI, E. 2006. Situación del complejo Diaporthe/Phomopsis en el cultivo de soja de Argentina. Workshops 3º Congreso de Soja del Mercosur. Rosario, Argentina. p.325-331. [ Links ]
23 PIOLI, R.N.; CAIRO, C. Y MORANDI, E. 2005. Prevalence of DPC as causal agent of SSC in Argentina. Biocell. 29 (1):141. [ Links ]
24 PIOLI, R.N.; MORANDI, E.N.; MARTÍNEZ, M.C.; LUCCA, F.; TOZZINI, A.; BISARO, V. Y HOPP, E. 2003. Morphologic, molecular, and pathogenic characterization of Diaphorte phaseolorum variabillity in the core soybean-producing area of Argentina. Phytopathology. 93(2): 136-146. [ Links ]
25 PLOETZ, R.C.; SHOKES, F.M. 1985. Soybean stem canker incited by ascospores and conidia of the fungus causing the disease in the southeastern United States. Plant Disease. 69:990-992. [ Links ]
26 PLOPER, L.D. 1989. The Diaporthe/Phomopsis disease complex of soybean. World Soybean Research Proceedings. A. Pascale, ed. Buenos Aires, Argentina.p.1695-1697. [ Links ]
27 RICCIONI, L. 2009. Cap V: Identificación de las especies del Complejo Diaporthe/Phomopsis por Métodos Moleculares. En: SCANDIANI, M.M.; LUQUE, A.G. Identificación de patógenos en Semilla de soja. Sup. Esp. N° 2 Análisis de Semillas.p.81-84. [ Links ]
28 RICCIONI, L.; DUVNJAK, T.; PUCCI, N. Y HARTMAN, G.L.2005. PCR-RFLP identification of the Phompsis/Diaporthe species on soybean seeds. In: 5th ISTA-SHC Seed Health Symposium, May 10-13 Anger, Francia, p 12. [ Links ]
29 RIDAO, A DEL C. 2012. Cancro del tallo: el enemigo de la soja. Visión Rural XIX (92): 12-15. ISSN 0328-7009. [ Links ]
30 RIDAO, A DEL C.; LAGO, M.E. 2007. Cancro del tallo de la soja. Visión Rural XIV (68): 56-57. [ Links ]
31 RIDAO, A DEL C..; PLATZ, P. 2013. Effects of stem canker for Diaporthe caulivora on soybean yields in the Southeastern Buenos Aires Province, Argentina in 2012. Word Soybean Research Conference IX, Feb 17-22. Durban, South Africa. Poster E.1-185. [ Links ]
32 RIDAO, A DEL C..; PEREYRA IRAOLA, M.; PAGANI, A.; BODEGA, E.; AZPEITÍA, M. Y ROSS, F. 2005. Situación actual de las principales enfermedades de soja en el sudeste de Buenos Aires. Resúmenes.13°Congreso Latinoamericano de Fitopatología. Villa Carlos Paz, Córdoba, Argentina. pp.456 [ Links ]
33 ROSSI, M. E. 2008. La semilla como fuente de inóculo del complejo Diaporthe/Phomopsis en el centro sur de la provincia de Buenos Aires. Tesis de Grado para Título de Ingeniero Agrónomo. Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata.Balcarce,Argentina.48 p. [ Links ]
34 SANTOS, J.M.; K. VRANDEC IC´, K; C´ OSIC´, J.; DUVNJAK, T Y PHILLIPS,A.J.L. 2011. Resolving the Diaporthe species occurring on soybean in Croatia. Persoonia 27:9-;19.
35 SINAVIMO (SENASA).2006. Programa Nacional Roya de la Soja. Informe semanal 16. En: <http://www.sinavimo.gov.ar/fito/incs/programasnacionales/roya_soja2006/16/16.htm> Acceso: 15/05/2014. [ Links ]
36 VECHIATO M.H.; MARINGONI A.C.; MARTINS E.M.F. Y KOHARA E.Y. 2003. Caracterizacao de isolados de Diaporthe spp. e Diaporthe phaseolorum var. meridionalis. Arq. Inst. Biol. Sao Paulo. 70 (2): 159-167. [ Links ]
37 WRATHER, J.A., ANDERSON, T.R., ARSYAD, D.M., TAN, Y., PLOPER, L.D., PORTA-PUGLIA, A., Y YORINORI, J.T. 2001. Soybean disease loss estimates for the top ten soybean-producing countries in 1998.Canadian Journal of Plant Pathology,23(2): 115-121. [ Links ]
38 XUE, A.G.; MORRISON, M.J.; COBER, E.; ANDERSON, T.R.; RIOUX, S.; ABLETT, G.R.; RAJCAN, I.; HALL, R. Y ZHANG, J.X. 2007. Frequency of isolation of species of Diaporthe and Phomopsis from soybean plants in Ontario and benefits of seed treatments. Canadian Journal of Plant Pathology. 29: 354-364. [ Links ]
39 YORINORI, J.T. 1991. Distinction between pod and stem blight and stem canker Phomopsis on soybean seeds by the blotter test. Fitopatol. Brasil. 16:37. (In Portuguese. [ Links ]).
40 YORINORI, J.T. 1996. Cancro da haste da soja: Epidemiología e Controle. EMBRAPA- Soja. Londrina, Paraná, Brasil. Circular Técnica 14. 75 p. [ Links ]
41 ZHANG A.W.; HARTMAN G.L.; RICCIONI L.; CHEN W.D.; MA R.Z. Y PEDERSEN W.L. 1997. Using PCR to distinguish Diaporthe phaseolorum and Phomopsis longicolla from other soybean fungal pathogens and to detect them in soybean tissues. Plant Disease 81(10): 1143-1149. [ Links ]
42 ZHANG A.W.; RICCIONI L.; PEDERSEN W.L.; KOLLIPARA K.P.; HARTMAN G.L. 1998. Molecular identification and phylogenetic grouping of Diaporthe phaseolorum and Phomopsis longicolla isolates from soybean. Phytopathology 88(12): 1306-1314. [ Links ]