Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Fave. Sección ciencias agrarias
versão impressa ISSN 1666-7719
FAVE. Secc. Cienc. agrar. vol.14 no.2 Santa Fe dez. 2015
ARTICULO ORIGINAL
Variabilidad en la resistencia a mancha amarilla en genotipos de trigos primaverales de diversos orígenes
Uranga, J.P.1, 2; Schierenbeck, M.1, 2; Perelló, A.E. 2,3; Borner A.4 ; Simón M.R.1
1Cerealicultura, Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, La Plata, Argentina.
2CONICET, La Plata, Argentina.
3Centro de Investigaciones de Fitopatología (CIDEFI), Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, La Plata, Argentina.
4Leibniz-Institute for Plant Genetics and Plant Crop Research (IPK), Gatersleben, Germany.
mrsimon@agro.unlp.edu.ar
RESUMEN
La mancha amarilla producida por Pyrenophora tritici-repentis (Died.) Drechs. (anamorph Drechslera tritici-repentis (Died.) Shoem.) es una de las enfermedades más importantes que afectan al trigo. El objetivo de este trabajo fue generar información acerca de la variabilidad en la resistencia a mancha amarilla en una población de genotipos de trigos primaverales previamente mapeada. El experimento fue realizado a campo en la Estación Experimental Julio Hirschhorn (EEJH) de la Universidad Nacional de La Plata (UNLP). El diseño experimental fue de parcela dividida con dos repeticiones. La parcela principal fueron dos aislados de P. tritici-repentis y la subparcela fueron 110 genotipos. Se evaluó la severidad en plántula como porcentaje de área afectada por clorosis y necrosis. Los genotipos y aislados presentaron diferencias significativas. El aislado Los Hornos se mostró más agresivo que el aislado Gualeguaychú. La severidad varió entre 18,4 y 78,7%, con algunos genotipos que mostraron comportamientos diferenciales entre aislados. La alta variabilidad en la resistencia frente a mancha amarilla encontrada puede ser de utilidad en mejoramiento genético.
Palabras claves:Pyrenophora tritici-repentis; Mancha amarilla; Resistencia; Variabilidad; Trigo.
SUMMARY
Variability on tan spot resistance of spring wheat genotypes from diverse origins
Tan spot caused by Pyrenophora tritici-repentis (Died.) Drechs. (anamorph Drechslera tritici-repentis (Died.) Shoem.)is one of the most important wheat diseases. The aim of this work was to generate information about variability of the resistance to tan spot in a population of spring wheat genotypes. Field experiments were carried out in 2014 at the Experimental Station Julio Hirschhorn, National University of La Plata. The experimental design was a split-plot with two replications. The main plots were two isolates of P. tritici-repentis. Subplots were 110 spring wheat genotypes. Severity evaluation was performed in seedlings as the area affected with necrosis and chlorosis. Genotypes and isolates significanlty influenced the disease severity. Los Hornos isolate was more aggressive than Gualeguaychú isolate. Severity ranged between 18,4% to 78,7%. Some genotypes showed better performance against one of the isolates. The high variability in resistance to tan spot found could be used in breeding to improve the resistance to the disease.
Key words:Pyrenophora tritici-repentis; Tan spot; Resistance; Variability; Wheat
INTRODUCCIÓN
Una de las principales limitantes biológicas que reducen la expresión de la potencialidad de los rendimientos del cultivo de trigo en la Argentina son las enfermedades (4). Los agentes causales de estas enfermedades, principalmente de origen micótico, parasitan los tejidos de la raíz, tallos, hojas, espigas y granos. Las enfermedades foliares del trigo se han incrementado en los últimos años en Argentina, debido a factores culturales, tales como el incremento de la siembra directa, como así también la susceptibilidad de los cultivares y la alta variabilidad genética de los patógenos causales (1). La mancha amarilla producida por Pyrenophora tritici-repentis (Died.) Drechs. (anamorph Drechslera tritici-repentis (Died.) Shoem.) es una de las enfermedades más importantes que afectan al trigo.
El hongo P. tritici-repentis se encuentra distribuido en las principales zonas de cultivo del trigo. Este patógeno induce la formación de manchas necróticas en las hojas, que se rodean de un halo clorótico y produce exotoxinas involucradas en el desarrollo de síntomas de la enfermedad. El hongo produce básicamente tres toxinas denominadas ToxA, ToxB y Toxb con receptores específicos en el hospedante (16). El área foliar enferma resta a la hoja capacidad fotosintética pudiéndose ver afectado de manera importante el rendimiento en grano cuando existe alta susceptibilidad del cultivar a la enfermedad.
El ciclo de vida del patógeno se encuentra altamente relacionado con los sistemas conservacionistas (rastrojos en superficie). La cantidad de rastrojo infectado está correlacionado con la severidad de la enfermedad y las pérdidas en producción (8). En particular, la enfermedad se incrementa en siembra directa de trigo en monocultivo (10, 15). La presencia de otros hospedantes es una fuente de inóculo primario y reservorio de una población del patógeno genéticamente diferente de la que prevalece en trigo (9) y de amplia diversidad genética y patogénica en Argentina (13).
El control de esta enfermedad en el contexto del manejo integrado implica la combinación de resistencia genética, prácticas culturales (rotaciones, densidad, fecha de siembra, fertilización) control biológico y químico (2, 5, 6, 12,15).
La resistencia genética es la base del manejo integrado, ya que tiene una baja relación costo/beneficio y preserva el medio ambiente. La resistencia es una reacción de defensa del hospedante, resultante de una suma de factores que tienden a disminuir la agresividad y / o la virulencia del patógeno, una vez establecido el contacto con el hospedante (7). La resistencia disponible frente a mancha amarilla es de tipo parcial o incompleta. Se expresa en menores niveles de severidad pero no en ausencia de síntomas (inmunidad) bajo condiciones predisponentes. Este tipo de resistencia es generalmente durable pero su eficacia se restringe bajo condiciones altamente predisponentes (3). Para lograr resistencia genética tanto la caracterización de las razas del patógeno como la evaluación de germoplasma y la localización e identificación de genes de resistencia al patógeno en poblaciones de mapeo, es de fundamental importancia. En Argentina hay información reciente sobre la caracterización de razas del patógeno y es conocido que muchos aislados no se corresponden con las razas actualmente conocidas (11)
El objetivo de este trabajo fue generar información acerca de la variabilidad en la resistencia a mancha amarilla en una población de genotipos de trigos primaverales, previamente seleccionados para estudios de mapeo por asociación con dos aislados que no se corresponden con las razas conocidas del patógeno.
MATERIALES Y MÉTODOS
2.1 Datos climáticos y de suelo
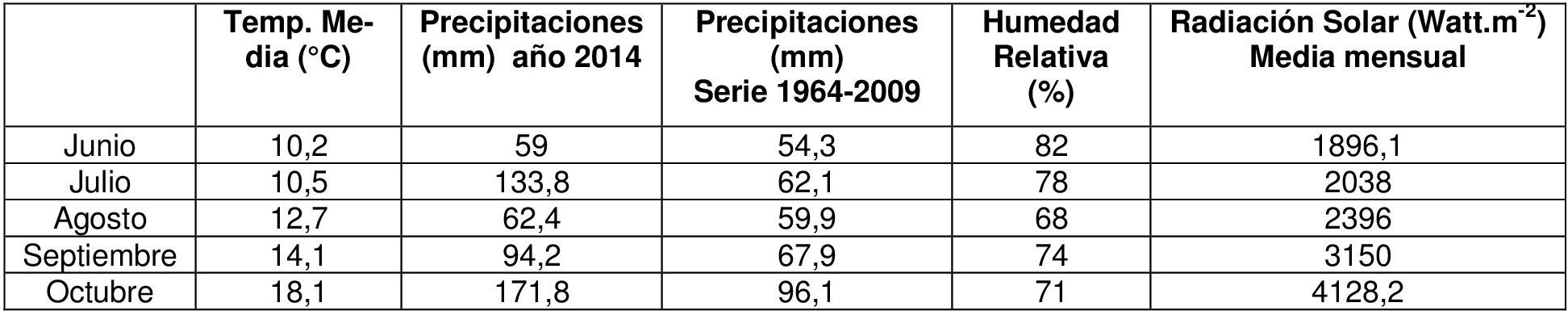
El ensayo se llevó a cabo durante 2014 en la Estación Experimental Julio Hirschhorn de la Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, ubicado en la localidad de Los Hornos, partido de La Plata, provincia de Buenos Aires, Argentina (34° 52' LS; 57° 58' LO). Durante el ciclo del cultivo se registró diariamente la temperatura media, precipitaciones, humedad relativa y radiación incidente en la estación meteorológica situada a 200 m de los ensayos (Tabla 1). El suelo fue un Argiudol típico (Serie Los Hornos) con los siguientes resultados de análisis: 0-20 cm: Materia orgánica 3,3%; N 0,167%; Nitratos 26,3 ppm; P 16,1 mg kg1, pH 6,15. 20-40cm: Nitratos 22,5 ppm, pH 5,89.
Tabla 1. Datos climáticos registrados durante el ensayo.
2.2 Preparación suelo y diseño del ensayo
La preparación del suelo consistió en un esquema de labranza convencional, mediante disco, rastra y rolo. En las parcelas se realizó un barbecho químico con glifosato y en post-emergencia temprana se aplicaron 100 cm3 Misil® + 5 gr/ha (dicamba 48% -;metsulfurón metil 60%). La siembra se realizó el 30 de julio de 2014.
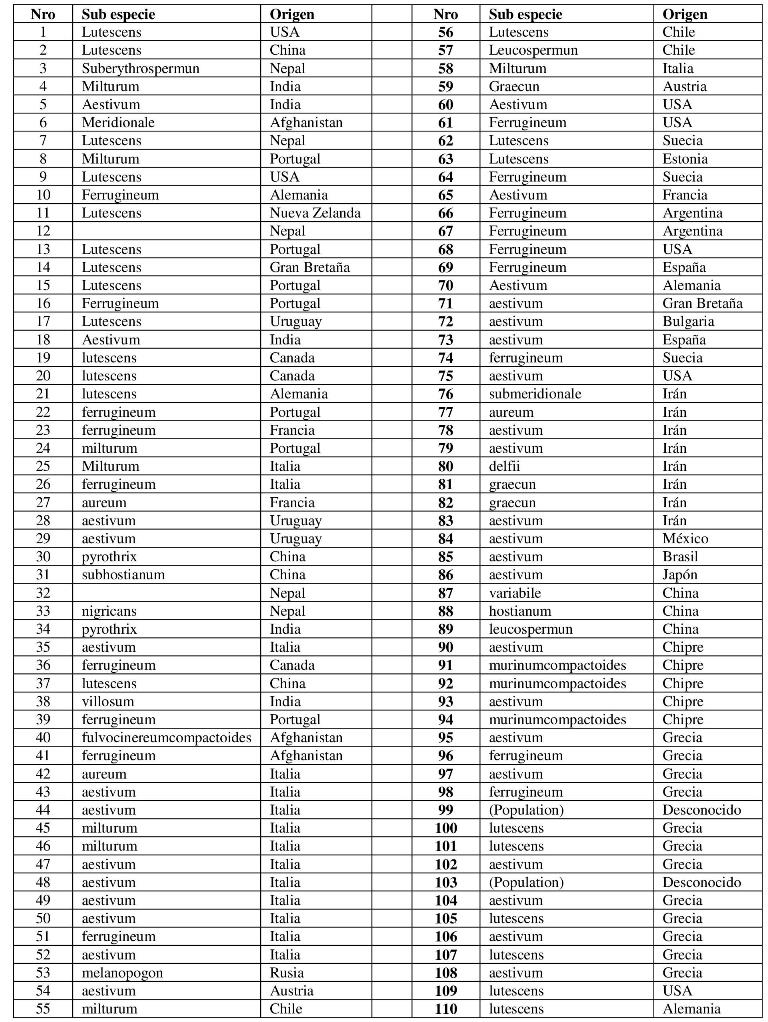
El diseño experimental fue de parcela dividida con dos repeticiones. La parcela principal fueron dos aislados de P. tritici-repentis obtenidos de diferentes localidades de Argentina. Uno de los aislados se obtuvo del mismo lugar donde se realizó el ensayo, llamado por lo tanto Los Hornos, mientras que el otro se obtuvo de la localidad de Gualeguaychú, provincia de Entre Ríos, por lo tanto se lo denominó Gualeguaychú. La subparcela fue una población de 110 genotipos de trigos primaverales provenientes del ¨Institute of Plant Genetics and Crop Plant Research¨ (Institut für Pflanzengenetik und Kulturpflanzenforschung - IPK) de Gatersleben, Alemania; los cuales son originarios de varios países de todo el mundo (Tabla 2).
Tabla 2. Subespecies y orígenes de T. aestivum utilizadas en el ensayo.
2.3 Preparación del inóculo
Se utilizaron dos aislados de Los Hornos y Gualeguaychú que fueron provistos por el laboratorio de la Cátedra de Cerealicultura de la Facultad de Ciencias Agrarias y Forestales (UNLP). El medio de cultivo utilizado fue caldo V8, que fue autoclavado y vertido en cajas de Petri. Posteriormente se multiplicó el inóculo mediante sucesivos repiques en flujo laminar. Las cajas fueron incubadas durante 15-21 días a 23 °C +/- 2 °C en alternancia de luz y oscuridad para favorecer la esporulación del hongo siguiendo el protocolo sugerido por Raymond y Bockus (14). Una vez cumplido ese lapso, se rasparon las cajas mediante agua destilada estéril y un cepillo para extraer el micelio y conidios infectivos, de la cual se obtuvo una solución concentrada de la cual se realizaron diluciones para obtener suspensiones de diferente concentración. La solución fue ajustada a 3x103 esporas/mL contada con un hemocitómetro (cámara de Neubauer).
Las inoculaciones se realizaron en dos hojas desplegadas (EC12) (17) utilizando 800 mL de suspensión (inóculo, agua destilada y coadyuvante -;Tween 20, a razón de 0.5 mL/L-1 suspensión-) por parcela. Dentro de las 48 h posteriores a la inoculación se efectuaron sucesivas pulverizaciones con agua para mantener las condiciones de humedad necesarias para el desarrollo de la enfermedad, siguiendo ciclos de mojado de 10 a 15 minutos cada 2 h.
2.4 Evaluaciones
La variable evaluada fue la severidad en plántula (EC14) como porcentaje de área afectada por clorosis y necrosis. Las evaluaciones se realizaron a los 14 días de la inoculación. Se evaluaron siete plantas de cada genotipo, evaluando en cada planta las tres hojas inferiores.
2.5 Análisis estadístico
El análisis de datos se realizó mediante un análisis de varianza (ANVA) para parcelas divididas mediante el programa GenStat 12th Edition. Las medias se compararon mediante el test LSD (P=0,05).
RESULTADOS Y DISCUSIÓN
De acuerdo a los resultados obtenidos mediante el ANVA (Tabla 3), se encontraron diferencias estadísticamente significativas entre medias (P = 0,05) para la variable severidad en plántula en los factores aislados y genotipos, mientras que la interacción aislados-; genotipos no presentó diferencias significativas. Para el análisis se tomaron los promedios de las siete plantas evaluadas por genotipo y el promedio de las tres hojas inferiores evaluadas.
Tabla 3. Cuadrados medios y valor p de porcentaje de severidad, para 110 genotipos de trigos primaverales, inoculados con dos aislados de P. tritici-repentis.
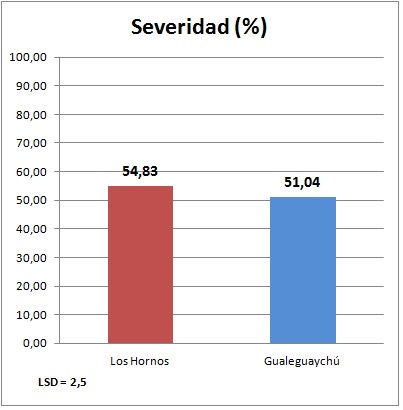
Los dos aislados de P. tritici-repentis utilizados en este ensayo presentaron diferencias significativas. El aislado Los Hornos, fue algo más agresivo, presentando una severidad promedio de 54,83%, mientras que el aislado Gualeguaychú, obtenido de la localidad homónima, mostró una severidad promedio de 51,04% (Figura 1).
Figura 1. Porcentaje promedio de severidad en plántula para dos aislados de P. tritici-repentis, promedio de 110 genotipos de trigo.
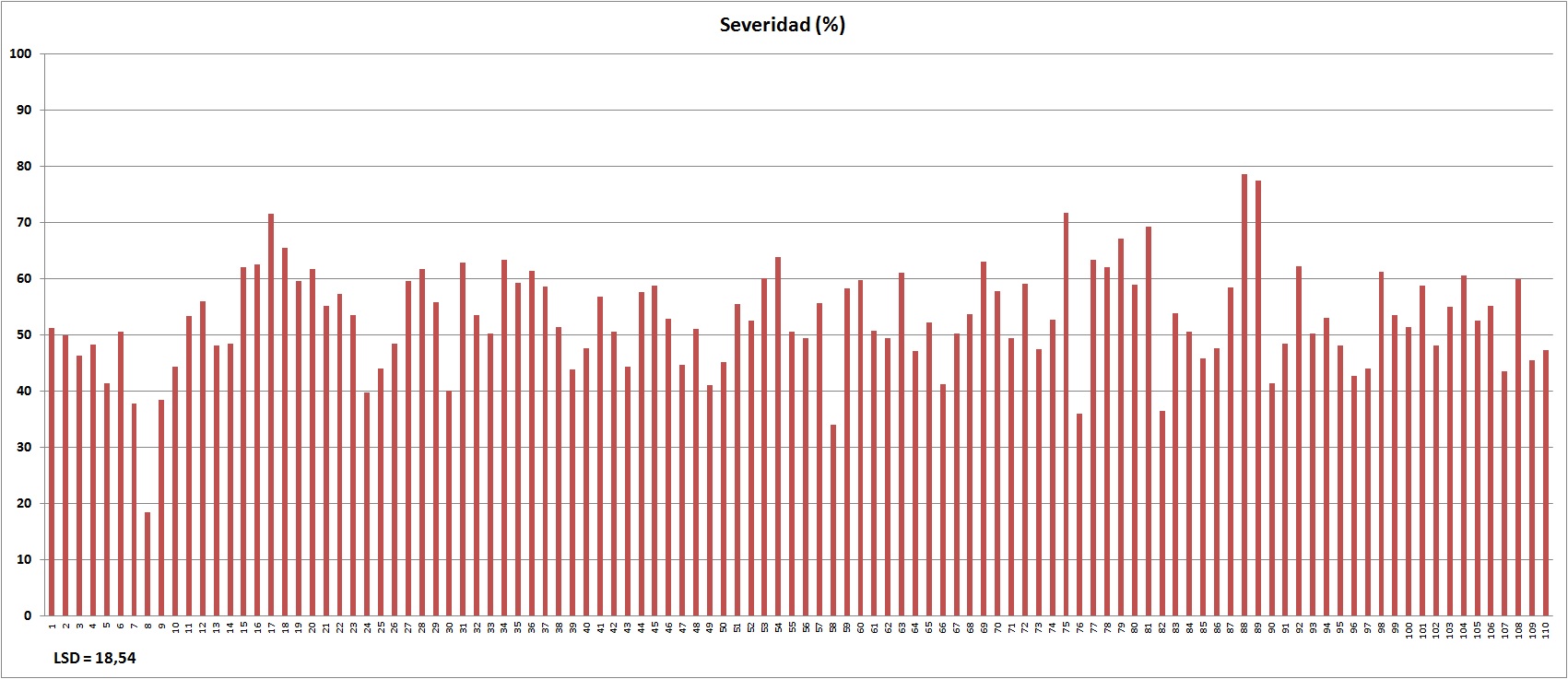
El rango de severidad de los diferentes genotipos evaluados osciló entre 18,4 y 78,7%, mostrando la gran variabilidad de resistencia frente a la enfermedad (Figura 2). El genotipo T. aestivum L. cv. milturum de Portugal (número 8) fue el genotipo con mejor comportamiento frente a mancha amarilla, el cual presentó una severidad promedio de 18,4 %. Otros genotipos que presentaron buen comportamiento frente a la enfermedad fueron T. aestivum L. cv. milturum de Italia (nro 58) con un 34% de severidad, T. aestivum L. cv. submeridionale de Irán (nro 76) con 36 % de severidad, T. aestivum L. cv. graecun de Irán (nro 82) con 36,5 % de severidad, T. aestivum L. cv. lutescens de Nepal (nro 7) con 37,7 % de severidad, T. aestivum L. cv. lutescens de Estados Unidos (nro 9) con 38,4 % de severidad y T. aestivum L. cv. milturum de Portugal (nro 24) con 39,8%. Estos genotipos se caracterizaron por presentar moderada resistencia a mancha amarilla. Varios otros genotipos (nros 30, 49, 66, 5, 90, 96, 107, 39, 97, 25, 10, 43 y 47) presentaron una severidad entre 40 y 45% comportándose significativamente más resistentes que el genotipo más susceptible. Por otro lado los genotipos que se presentaron con mayor suceptibilidad frente al patógeno fueron T. aestivum L. cv. hostianum (nro 88) con 78,7 % de severidad y T. aestivum L. cv. leucospermun (nro 89) con 77,4 %, ambos originarios de China (Figura 2).
Figura 2. Porcentaje promedio de severidad en plántula para 110 genotipos de trigo, promedio de dos aislados.
En cuanto a la interacción genotipo -; aislados, si bien no se encontraron diferencias significativas, hubo siete genotipos que presentaron un comportamiento diferencial entre aislados, lo cual podría indicar la presencia de resistencia específica. De los siete genotipos, cinco mostraron mejor comportamiento frente al aislado Gualeguaychú. Estos fueron T. aestivum L. cv aestivum de India (nro 5), T. aestivum L. cv. milturum de Portugal (nro 24), T. aestivum L. cv. milturum de Italia (nros 25 y 58) y T. aestivum L. cv. aureum de Italia (42). Mientras que los otros dos, T. aestivum L. cv. lutescens de China (nro 37) y T. aestivum L. cv. aestivum de Chipre (nro 93) manifestaron mayor resistencia frente al aislado Los Hornos.
Algunos de los genotipos que presentaron en promedio de los dos aislados muy buen comportamiento, no lo hicieron igual al analizar el comportamiento frente a cada aislado por separado. Es el caso del genotipo T. aestivum L. cv. milturum de Italia (nro 58) con un 34% de severidad promedio, pero su severidad frente al aislado Los Hornos fue de 50 %, mientras que frente a Gualeguaychú fue de 18 %. Esto podría deberse a la resistencia específica que existiria en el genotipo frente al aislado Gualeguaychú. El genotipo T. aestivum L. cv. milturum de Portugal (nro 24) también parece tener resistencia específica frente a Gualeguaychú, ya que frente a este aislado se vio afectada su area foliar en un 21,7 %, mientras que frente a Los Hornos la severidad fue de 58%.
CONCLUSIONES
Se detectan diferentes niveles de resistencia a mancha de la hoja entre 110 genotipos de trigo de una colección internacional.
La información es de utilidad para asociar los datos fenotípicos a marcadores moleculares ya disponibles en esta población para planes de mejora futuros.
BIBLIOGRAFÍA
1 ALVAREZ, R. Y STEINBACH, H.S. 2009. A review of the effects of tillage systems on some soil physical properties, water content, nitrate availability and crops yield in the Argentine Pampas. 2009. Soil and Tillage Research 104:1-5 [ Links ]
2 ANNONE, J.G. 2006. Las principales enfermedades del trigo en Argentina: su importancia relativa en las Regiones productoras Norte y Sur. In: Congreso A Todo Trigo. Conocimiento y Producción. Federación de Centros y Entidades Gremiales de Acopiadores de Cereales, Hotel Sheraton, 18 y 19 de Mayo de 2006. Mar del Plata, Argentina. pp 53-58. [ Links ]
3 ANNONE, J.G. Y GARCÍA, R. 2004. Las Principales Manchas Foliares del Trigo. INTA Pergamino. Revista IDIA XXI. pp 58-64. [ Links ]
4 ANNONE, J.G., BOTTA, G. Y IVANCOVICH, A. 1994. Ocurrencia de la mancha bronceada del trigo en el área norte de la provincia de Buenos Aires. Actas del II Congreso Nacional de Trigo y primer simposio Nacional de Cereales de Invierno. pp 205-208. [ Links ]
5 BOCKUS, W.W., DAVIS, M.A. Y SHROYER, J.P. 1992. Effect of foliar fungicide application on seed size of winter wheat. J. Applied Seed Production 10: 1-6. [ Links ]
6 CARMONA, M.A. 2003. Manejo Integrado de Enfermedades en el cultivo de trigo. Información Técnica de trigo, Campaña 2003. INTA Rafaela. 6 p. [ Links ]
7 CARMONA, M.A. 2008. El manejo integrado de las enfermedades del cultivo de trigo. INTA -; EEA Rafaela. Información Técnica de Trigo y otros Cultivos de Invierno, campaña 2008. Publicación Miscelánea N° 109.
8 CARMONA M., REIS E.M. Y CORTESE P. 1999. Manchas foliares en Trigo. Diagnóstico, epidemiologia y nuevos criterios para el manejo. Edición impresa en Gráfica Condal SRL Bs.As. Argentina. pp 1-29. [ Links ]
9 DE WOLF, E.D., EFFERTZ, R.J., ALI, S. Y FRANCL, L.J. 1998. Vistas of tan spot research. Canadian Journal of Plant Pathology 20: 349-370. [ Links ]
10 KRUPINSKY, J.M., HALVORSON, A.D., TANAKA, D.L. Y MERRILL, S.D. 2007. Nitrogen and tillage effects on wheat leaf spot diseases in the northern Great Plains. Agronomy Journal 99:562-569. [ Links ]
11 MORENO, MV, STENGLEIN, S. Y PERELLÓ, A.2015. Distribution of races and Tox genes in Pyrenophora tritici-repentis isolates from wheat in Argentina. Tropical Plant Pathology 40:141-146. [ Links ]
12 PERELLÓ, A., MORENO, V., SIMÓN, M.R. Y SISTERNA, M. 2003. Tan spot of wheat (Triticum aestivum L.) infection at different stages of crop development and inoculum type. Crop Protection 22: 157-169. [ Links ]
13 PERELLÓ, A., YANNICCARI, M., MORENO V. Y CASTRO, A. 2012. Genetic analysis and comparative virulence of isolates of Pyrenophora tritici-repentis from wheat in Argentina. 2012. African Journal of Microbiology Research 6: 5558-5567. [ Links ]
14 RAYMOND, P.J. Y BOCKUS, W.W. 1982. An in vitro technique for profuse sporulation of Drechslera tritici-repentis, (Abstr.). Phytopathology 72, 934. [ Links ]
15 SIMÓN, M.R., AYALA, F., GOLIK, S., TERRILE, I., CORDO, C., PERELLÓ, A., MORENO, V. Y CHIDICHIMO, H. 2011. Influence Integrated Foliar Disease Management to Prevent Yield Loss in Argentinean Wheat Production. Agronomy Journal.103: 1441-1451. [ Links ]
16 SINGH P.K., MERGOUM M., ADHIKARI T.B., SHAH T., GHAVAMI F. Y KIANIAN S.F. 2009. Genetic and molecular analysis of wheat tan spot resistance effective against Pyrenophora tritici repentis races 2 and 5. Molecular Breeding. www.springerlink.com/content/b62484q0314625j6/fulltext.html#Fig1. [ Links ]
17 ZADOKS, J.C., CHANG, T.T. Y KONZAK, C.F. 1974. A decimal code for the growth stages of cereals. Weed Research Vol.14. pp 415-421. [ Links ]