INTRODUCCION
Rhodophiala bifida (Herb.) Traub - azucenita colorada- es una especie bulbosa perteneciente a la familia Amaryllidaceae, nativa de Argentina, Brasil, Paraguay y Uruguay (Arroyo-Leuenberger, 1996). Esta familia se destaca por sus numerosos géneros cultivados como plantas ornamentales tales como Amaryllis, Crinum, Galanthus, Leucojum, Lycoris y Narcissus (Simpson, 2006).
En Argentina, R. bifida se distribuye en las provincias de Buenos Aires, Entre Ríos, Corrientes y Misiones en pastizales de suelos fértiles y bien drenados (Hurrell et al., 2009). Es una especie perenne de floración estival tardía que se concentra luego de las lluvias. Las inflorescencias están formadas por 2 a 7 flores zigomorfas, infundibuliformes, declinadas y pediceladas. Sus flores presentan 6 tépalos de color rojo carmín, bermellón, rojo vinoso, rosado y rara vez blanco (Hurrell et al., 2009).
El tamaño y color de sus flores la hacen muy atractiva para el cultivo ornamental. Además, se propone especialmente para xerojardinería, ya que tiene bajo requerimiento hídrico y nutricional que la hace apta para jardines con un uso racional del agua, aspecto muy valorado en tiempos en que se busca mitigar los efectos del cambio climático (Bisgrove y Hadley, 2002). El desarrollo de protocolos de domesticación, propagación y mejoramiento genético son esenciales para poder proponerla como un nuevo cultivo, considerando que la industria florícola global requiere novedades.
En Amaryllidaceae se encuentran especies con distintos grados de compatibilidad (Broyles y Wyatt, 1991; Fernandez et al., 2013; Saavedra et al., 1996; Sage et al., 1999) e incompatibilidad (Streher et al., 2018). En algunos casos, se evidenció autoincompatibilidad de acción tardía (Kiepiel y Johnson, 2014; Vaughton et al., 2010). A pesar de ello, la mayoría de los sistemas reproductivos de las plantas de la familia siguen siendo desconocidos, especialmente en las especies del hemisferio sur, donde se encuentran la mayor diversidad (Kiepiel y Johnson, 2014).
La comparación de los resultados en autopolinización y polinización cruzada es uno de los tópicos centrales en los estudios de biología reproductiva y resulta esencial su abordaje antes de comenzar tareas de mejoramiento genético. Asimismo, el estudio del crecimiento del tubo polínico en las polinizaciones controladas puede aportar información acerca de las posibles barreras que dificulten la hibridación.
El objetivo de este trabajo fue estudiar la compatibilidad y eficiencia reproductiva en R. bifida a través de la realización de cruzamientos controlados, tanto autopolinizaciones como polinizaciones cruzadas, tomando en cuenta fenotipos de flores de distintos colores como inicio de un plan mejoramiento genético para la obtención de variedades ornamentales.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron para los experimentos 400 plantas de una población de R. bifida naturalizada en el Jardín Botánico Arturo Ragonese, Instituto de Recursos Biológicos INTA, Partido de Hurlingham, Buenos Aires, Argentina (34° 40 S, 5° 39 O, 22 msnm) donde se hallaron fenotipos de tres colores de flores: rojas, fucsias y rosas con predominancia de color rojo (Fig. 1). No se hicieron cuidados culturales de la población excepto el corte de pastizales en verano.
Los suelos del predio son arguidoles típicos (Gomez, 1993) y según la serie histórica del observatorio Agrometeorológico de INTA Castelar, Instituto de Clima y Agua, la temperatura máxima y mínima media anual en la zona es de 30°C y 17°C, respectivamente. La precipitación anual aproximada es de 1000 mm. La humedad relativa anual varía entre 64 y 79 %.
Cruzamientos
Los cruzamientos se realizaron en febrero y marzo de 2014 y 2018 entre las 10 y 14 hs. Para ello, se emascularon flores en estado de botón cerrado de un tamaño de 3 a 5 cm y se procedió a la polinización con granos de polen de la misma planta o de plantas distintas según el caso. Para la polinización cruzada se utilizaron individuos distantes en la población. Luego de la polinización, las flores se cubrieron con sobres de papel para evitar la contaminación con polen extraño. También, se consideraron flores emasculadas y sin polinizar con el fin de observar una posible partenogénesis.
En un primer experimento (2014) se realizaron cruzamientos sólo con plantas de flores rojas, color de mayor representatividad en la población. Los tratamientos fueron autopolinización, polinización cruzada y flores emasculadas sin polinizar.
En el segundo experimento (2018), se profundizó en las diferencias fenotípicas y se consideraron plantas con flores las rojas, fucsias y rosas. A los tratamientos antes mencionados se sumó la fructificación libre, es decir, se consideraron flores marcadas sin ningún tratamiento para identificar la fructificación natural.
Se evaluó en ambos casos la cantidad de frutos producidos en los cruzamientos y se calculó el porcentaje de fructificación (Fructificación % = frutos producidos/flores polinizadas x 100). Se evaluó la cantidad de semillas obtenidas por fruto y su germinación, para lo cual las semillas se colocaron en cajas plásticas sobre papel de filtro (3) y se mantuvieron en cámara a 25 ± 2º C y con un fotoperíodo de 16 horas luz/8 horas oscuridad. A los 14 días de la siembra, se procedió al conteo de las plántulas normales obtenidas.
La eficiencia reproductiva se calculó según la fórmula de Dafni (1992): (Nº frutos/ Nº flores polinizadas) x (Nº promedio de semillas por fruto/Nº promedio óvulos/ovario) y se le agregó el factor Nº plántulas normales/Nº semillas sembradas. El número promedio de óvulos por ovario se calculó contando todos los óvulos de 15 ovarios sobre lupa.
El índice de autocompatibilidad (IAI) se obtuvo como el cociente entre el porcentaje de frutos producidos por autopolinización y el porcentaje obtenido por polinización cruzada según Ruiz y Arroyo (1978).
Los datos se sometieron a análisis estadísticos a través de tests de diferencia de proporciones y ANOVA (p ≤ 0.05) con el programa INFOSTAT 2009 (Di Rienzo et al., 2011).
Crecimiento del tubo polínico
Para evaluar la velocidad y reacción de los tubos polínicos en los cruzamientos, se recolectaron pistilos al primero, segundo y tercer día posterior a las polinizaciones (DPP), tanto en la autopolinización como en polinización cruzada. Se fijaron en FAA (formol; ácido acético; etanol/1: 0,5:8) por, al menos, 24 horas. Luego, se enjuagaron con agua destilada y se trataron con NaOH 8 N a 60º C por dos horas según el método de Martin (1959). Los pistilos se enjuagaron nuevamente, se tiñeron con azul de anilina al 1% en agua durante una hora y se montaron sobre un portaobjetos con una gota de la mencionada solución, se cubrieron con un cubreobjetos y se presionó levemente. Se observaron con microscopio de epi-fluorescencia OLYMPUS BX 50 (Japón) con filtros de excitación y emisión de 330-385 nm y 420 nm, respectivamente. Se evaluó el crecimiento del tubo polínico en los pistilos considerando la distancia recorrida y a los 3 DPP se contabilizó la cantidad de tubos polínicos que llegaron al ovario. Se evaluaron 10 pistilos por tratamiento.
RESULTADOS
Los cruzamientos derivados de la autopolinización y la polinización cruzada produjeron frutos en R. bifida. En la Tabla 1 se presentan los datos de fructificación, producción de semillas por fruto y plántulas obtenidas en la auto-polinización y en la polinización cruzada en los cruzamientos realizados utilizando flores rojas, genotipo predominante en la población estudiada (experimento 1). La capacidad de producir frutos fue significativamente mayor en la polinización cruzada respecto a la autopolinización siendo de 79.6% y 52.6 %, respectivamente. Dicha tendencia también se reflejó en los valores de eficiencia reproductiva siendo 19 y 49.6 para la autopolinización y polinización cruzada, respectivamente. En ningún caso las flores emasculadas y no polinizadas produjeron frutos. El IAI resultó 0.66 y 0.89 en el caso de flores rojas en el primer y segundo experimento (Tablas 1 y 2).
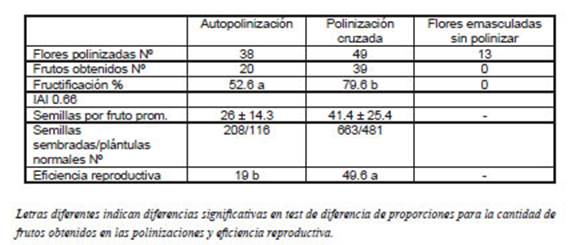
Tabla 1 Fructificación (%), semillas por fruto (prom.) y eficiencia reproductiva en la autopolinización y polinización cruzada de Rhodophiala bifida realizado con fenotipos de flores rojas.
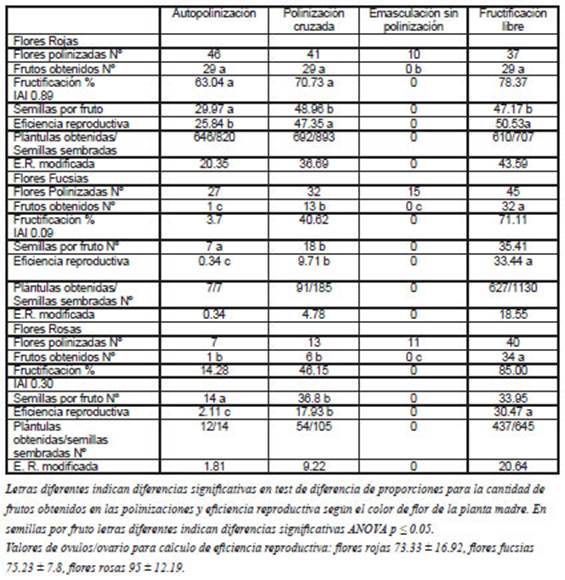
Tabla 2 Fructificación (%), semillas por fruto (prom.), índice de autoincompatibilidad y eficiencia reproductiva en la auto-polinización y polinización cruzada de Rhodophiala bifida en fenotipos de flores rojas, fucsias y rosas.
En el segundo experimento se produjeron frutos tanto en la autopolinización como en la polinización cruzada considerando los tres fenotipos florales (Tabla 2). El porcentaje de fructificación fue mayor en la polinización entre los fenotipos de flores fucsias y entre los de flores rosas; las plantas de flores rojas no presentaron diferencias significativas. A pesar de esta excepción, los valores de semillas por fruto fueron significativamente mayores en la polinización cruzada en los tres fenotipos (Tabla 2). Los datos de IAI para los fenotipos de flores rojas, fucsias y rosas, fueron 0.89, 0.09 y 0.30 respectivamente (Tabla 2).
No hubo diferencias significativas en la fructificación natural entre los tres fenotipos para color de flor; el porcentaje de formación de frutos en flores marcadas sin polinizar manualmente arrojó valores de 78,37%, 85% y 71,11% para fenotipos de flores rojas, rosas y fucsias, respectivamente (Tabla 2).
El estudio del crecimiento de los tubos polínicos en los pistilos autopolinizados y sometidos a polinización cruzada para el caso de flores rojas demostró que, a los 3 DPP, éstos llegan a los ovarios en ambos casos. En la Fig. 2 se graficaron la cantidad de muestras observadas (%) y la cantidad de tubos polínicos observados. Debido al elevado número de tubos polínicos y a su superposición resultó metodológicamente imposible realizar un recuento de los mismos cuando superaban los 100 tubos. A pesar de ello, se observó una diferencia muy notoria ya que se contabilizaron hasta 20 y más de 100 tubos polínicos en el ovario de pistilos autopolinizados y sometidos a polinización cruzada, respectivamente. En la Fig. 3 se presentan fotografías de ambas situaciones observando estas conspicuas diferencias.
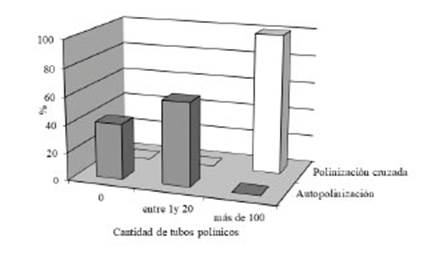
Figura 2: Tubos polínicos (%) observados en el ovario en pistilos autopolinizados y sometidos a polinización cruzada de Rhodophiala bifida a los 3 días post polinización considerando la cantidad de los mismos (flores rojas).
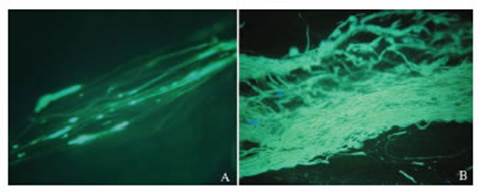
Figura 3: Crecimiento de tubos polínicos en el estilo en la autopolinización (izquierda) y polinización cruzada de Rhodophiala bifida (flores rojas) a los 3 días post polinización.
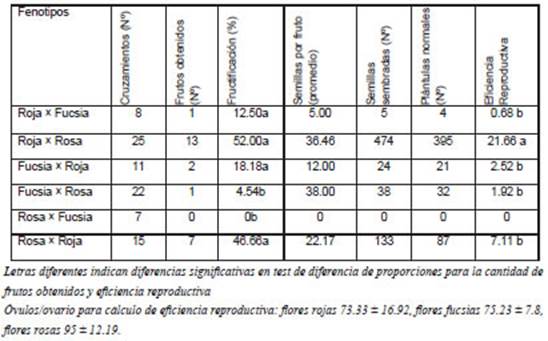
Los cruzamientos entre fenotipos de distintos colores produjeron frutos en todos los casos excepto para el caso de los cruzamientos entre genotipos de flores rosas × fucsias (Tabla 3). La eficiencia reproductiva más alta (21.66) se presentó en fenotipos de flores rojas polinizados por fenotipos de flores rosas.
DISCUSIÓN
A partir de los resultados de los cruzamientos dirigidos, germinación de las semillas y los estudios del crecimiento del tubo polínico se comprobó un sistema reproductivo mixto para R. bifida. A pesar de ello, la eficiencia reproductiva y la producción de semillas fueron menores en la autopolinización, tal como Ladd y Arroyo (2009) reportaron para R. rhodolirion. La autopolinización generó una menor producción de semillas que la polinización cruzada también se ha presentado en otras especies de Amaryllidaceae tales como Narcissus triandrus (Sage et al., 1999) y Hippeastrum advenum (Saavedra et al., 1996) y Habranthus tubispathus (Fernandez et al., 2013). Para el caso de Zephyranthes atamasco, Broyles y Wyatt (1991) hallaron la misma cantidad de semillas en frutos provenientes de autopolinización que en la polinización cruzada. La longevidad de cada flor de R. bifida fue de aproximadamente 3 días (observación de las autoras), período que, por ser tan corto, requeriría de una polinización y fecundación eficientes como lo sugiere este caso al producir frutos y semillas viables, tanto en la autopolinización, como en la polinización cruzada.
Según Echeverría y Alonso (2010), las semillas de R. bifida presentarían nula a escasa dormición innata ya que germinan casi en su totalidad luego de dos meses de la cosecha. A partir de los resultados obtenidos por estos autores, se infiere que la dormición no estaría interfiriendo en la cantidad de plántulas normales obtenidas a partir de las semillas sembradas en los cruzamientos realizados en este trabajo.
Los estudios del crecimiento del tubo polínico en ambas situaciones (autopolinización y polinización cruzada) fueron consistentes con la cantidad de semillas obtenidas ya que, en la polinización cruzada la cantidad de tubos polínicos que arribaron al ovario fue significativamente mayor. Esta característica demostró que a pesar de que R. bifida produce semillas viables a partir, tanto de la autopolinización como de la polinización cruzada, resulta más eficiente cuando se producen por esta última. Se puede sugerir la presencia de una reacción de autoincompatibilidad débil, que se acentúa en el caso de los fenotipos de flores fucsias.
La autoincompatibilidad es un sistema de auto-reconocimiento genético que favorece el cruzamiento entre individuos diferentes en plantas con flores hermafroditas (Durand et al., 2020). Es una de muchas estrategias que se cree ha evolucionado en respuesta al efecto negativo de la depresión por endocría, causada por la expresión de alelos deletéreos en homocigotas (Charlesworth y Charlesworth, 1987). El mantenimiento de la autoincompatibilidad en una población, como podría haber sucedido en esta especie, es reflejo del balance entre las ventajas aportadas por la prevención de los efectos deletéreos de la endocría y sus desventajas, que radican en la limitación reproductiva que este mecanismo conlleva (Durand et al., 2020).
Los resultados de IAI obtenidos en este trabajo, 0.89 y 0.30 para plantas de flores rojas y rosas respectivamente la clasifican como autocompatible. Según Ruiz y Arroyo (1978) un IAI mayor o menor a 0.20 indica una especie autocompatible o autoincompatible, respectivamente.
Stevens (2001) afirma que, de acuerdo con la bibliografía tradicional, la presencia de especies con IAI intermedio es común. Radusky et al. (2010) analizaron el IAI de 1238 especies correspondientes a 144 familias y determinaron que la frecuencia de la distribución era fuertemente bimodal, aunque hallaron que una fracción sustancial tenía valores intermedios, como en el caso de la especie en estudio.
En el caso de las plantas con flores de color fucsia, el AIA se redujo dramáticamente, arrojando un resultado de 0.09, clasificándola como autoincompatible. Sin embargo, sería interesante estudiar un posible efecto pleiotrópico que asocie este fenotipo a una menor viabilidad reproductiva.
En todos los casos de polinización libre se obtuvieron frutos con semillas viables, esto indicaría que no hubo limitaciones en la llegada de polen o presencia de polinizadores.
Asimismo, el crecimiento del tubo polínico reflejó una inhibición precigótica parcial en pistilos autopolinizados que luego se manifestó en la menor cantidad de semillas producidas. Streher et al. (2018) afirmaron que la germinación de granos de polen en el estigma y su detención en el estilo, situación encontrada en este trabajo, representa un signo típico de autoincompatibilidad gametofítica.
En ningún caso se observó fructificación en flores emasculadas sin polinizar por lo que se descartó la posibilidad de apomixis autónoma en esta especie.
En este trabajo, la variabilidad encontrada en el color de flor sería originaria de la segregación alélica en la población, reflejando la heterocigosis de los individuos de una población alógama.
CONCLUSIONES
Se comprobó un sistema reproductivo mixto en R. bifida, es decir polinización cruzada y autopolinización. A pesar de ello, la eficiencia reproductiva fue mayor en la polinización cruzada por lo que la especie tiende a ser más alógama. Se comprobó una inhibición precigótica parcial en la autopolinización. Se obtuvieron frutos y semillas viables en cruzamientos entre distintos fenotipos. Asimismo, se pudo descartar la posibilidad de una apomixis autónoma.
El presente trabajo permitió recabar información básica sobre la biología reproductiva para poder iniciar un plan de mejoramiento genético en R. bifida.