INTRODUCCION
El trigo (Triticum aestivum L.), junto con el maíz (Zea mays L.) y el arroz (Oriza sativa L.), es uno de los cereales que más se cultiva en el mundo. En Occidente, el trigo es el cereal más consumido (Cuniberti, 2019), y en Argentina, ocupa el tercer lugar en toneladas de granos producidas después de la soja [Glycine max (L.) Merrill] y del maíz (FAOSTAT, 2018). Además de su importancia productiva, el trigo contribuye a mejorar condiciones físicas de los suelos dada la estructura de su sistema de raíces y su aporte de residuos orgánicos. Esto contribuye favorablemente a parámetros del suelo tales como la fertilidad, la estructura, la capacidad de intercambio catiónico y la capacidad de retención de agua (Wang, Fonte, Parikh, Six y Scow, 2017; Zhao etal., 2018).
En las condiciones extensivas predominantes en Argentina, la producción de trigo de altos rendimientos requiere de la frecuente y abundante aplicación de nutrientes tales como nitrógeno (N) y fósforo (P) (García y Díaz-Zorita, 2015). Algunos de los riesgos del uso en exceso de N es su posibilidad de acumulación fuera del sitio de aplicación y la contaminación del medio ambiente (Ni y Wang, 2015). Por eso, es importante plantear alternativas de manejo eficiente de los nutrientes, incorporando buenas prácticas de producción (Grasso y Díaz-Zorita, 2018). Una alternativa es el uso de rizobacterias promotoras del crecimiento vegetal (PGPR, según sus siglas en inglés). Estas bacterias inducen el crecimiento vegetal en forma directa o indirecta. En general, la influencia directa incluye la producción de fitohormonas, la solubilización de fosfatos y de micronutrientes y la fijación biológica de nitrógeno (Ruzzi y Aroca, 2015; Kumar, Singh, Tripathi, Singh y Singh, 2018). Los efectos indirectos resultan de la modificación del ambiente rizosférico debido a la solubilización de fósforo, y a la acción de las bacterias como biocontroladores de fitopatógenos mediante la liberación de sustancias como sideróforos, compuestos orgánicos volátiles (COVs), enzimas hidrolíticas, antibióticos y cianidas (Kumar et al, 2018).
Azospirillum spp. y Pseudomonas spp., reconocidos microrganismos PGPR con diferentes mecanismos de acción, han mostrado mejoras en el crecimiento y en la productividad de cultivos en diversas condiciones agroecológicas de producción (Saubidet, Fatta y Barneix, 2002; Díaz-Zorita y Fernández Canigia, 2009; Mehnaz, Kowalik, Reynolds y Lazarovits, 2010; Lana, Dartora, Marini y Hann, 2012; Puente et al., 2018; Goswami y Deka, 2020). Estas PGPR promueven mejoras en algunos parámetros relacionados a la germinación de las semillas y al crecimiento de las plántulas (Pathak, Chakrabarti, Das y Mandal, 2016; Safari, Jamali, Nooryazdan y Bayat, 2018; Yarzábal, Monserrate, Buela y Chica, 2018). También hay estudios que muestran que las plantas asociadas a las PGPR son afectadas en menor frecuencia por condiciones adversas tales como estrés hídrico, salino y térmico (Meena, Md. Afjal y Prakash, 2015; Safari et al., 2018; Azadikhah, Jamali, Nooryazdan y Bayat, 2019; Goswami y Deka, 2020). En particular, ante condiciones limitantes en la oferta normal de nutrientes, se ha observado que estos microorganismos mejoran la eficiencia de uso de los recursos disponibles en el suelo (Cassán y Díaz-Zorita, 2016).
El género Azospirillum está constituido por bacterias mutualistas no específicas capaces de habitar en la rizósfera de muchas especies vegetales. Promueven el crecimiento de las plantas por una sinergia de mecanismos tales como la producción de fitohormonas, la fijación de N, y la producción de sideróforos y de óxido nítrico (Cassán y García de Salamone, 2008; Bashan y de-Bashan, 2010; Lana et al., 2012; Mehnaz, 2015; Cassán y Díaz-Zorita, 2016; Coniglio, Mora, Puente y Cassán, 2019).
En la producción de trigo la inoculación con Azospirillum spp. es una práctica económicamente conveniente y se aplica principalmente como tratamiento a las semillas (Mehnaz et al., 2010). Al inocular con Azospirillum spp., se observan mayores rendimientos y contenidos de proteína en grano, atribuidos a un incremento en la absorción radical de N (Saubidet et al., 2002). El mayor crecimiento inicial de las raíces contribuye a mejorar la eficiencia de uso del agua y el aprovechamiento de las fuentes de nutrientes de las que disponen las plantas (Cassán y Díaz-Zorita, 2016). Además, la inoculación con Azospirillum spp. en la siembra de trigo, muestra aumentos en el número y en el largo de pelos radicales, en el número y en el diámetro de raíces laterales, en el peso fresco y seco de las raíces y de la parte aérea y en el rendimiento en granos (Díaz-Zorita y Fernández Canigia, 2009; Veresoglou y Menexes, 2010; Díaz-Zorita, Canigia, Bravo, Berger, y Satorre, 2015; Mehnaz, 2015). Los cambios en el crecimiento de las raíces se asocian principalmente a la producción de auxinas como producto del metabolismo de esta rizobacteria (Mehnaz, 2015). Las respuestas en los parámetros de crecimiento y de producción de trigo cuando se usan estas rizobacterias son variables. Se ha descrito que algunos de los factores que explican esta variabilidad se relacionan con el cultivar de trigo utilizado, la cepa de Azospirillum spp. aplicada y la cantidad de recursos disponibles que tienen las plantas para su crecimiento (Veresoglou y Menexes, 2010; Díaz-Zorita et al., 2015; Cassán y Díaz-Zorita, 2016; Pathak et al., 2016; Ludwig et al, 2018).
En presencia de Pseudomonas spp. se puede observar tanto el aumento del contenido de N y la acumulación de biomasa en tejidos vegetativos y reproductivos debido a aumentos en la absorción de N, como el crecimiento del sistema radical debido a la producción de fitohormonas por parte de estas PGPR (Fox et al., 2016; Kumar et al. 2018). Se reconoce que estas PGPR contribuyen a incrementos en el crecimiento y en el rendimiento del trigo debido a mejoras en la solubilización del fósforo y del zinc del suelo al liberar ácidos orgánicos y fosfatasas que modifican el pH en la rizósfera (Oteino et al., 2015; Sirohi, Upadhyay, Srivastava y Srivastava, 2015; Rehman, Farooq, Naveed, Ozturk, y Nawaz, 2018; Liu et al., 2019). También Pseudomonas spp. promueven el crecimiento vegetal en forma indirecta actuando como agentes de biocontrol que protegen los vegetales del ataque de algunos microorganismos patógenos como Fusarium oxysporum, Pythium ultimum y Phytophtora infestans (Yarzábal et al., 2018). Estas PGPR actúan como biocontroladores mediante la inducción de resistencia sistémica en las plantas por la liberación de COVs y sideróforos, además de la liberación de antibióticos (Yuttavanichakul et al., 2012; Kejela, Thakkar y Patel, 2017).
La contribución de Azospirillum spp. y de Pseudomonas spp. sobre el crecimiento de trigo ha sido ampliamente documentada en estudios bajo condiciones controladas y extensivas de producción. Sin embargo, son escasos los estudios comparativos entre ambos microorganismos con el fin de discriminar sus aportes específicos durante la implantación y crecimiento del cultivo en condiciones contrastantes de disponibilidad de P y de K. Se espera que los cambios en plantas de trigo resultantes de la actividad directa de A. brasilense sean de mayor magnitud y se extiendan durante más etapas del crecimiento que el derivado de la actividad de P. psychrophila. Además, dada la contribución específica en la mejora de la disponibilidad de P, el mayor crecimiento al inocular con P psychrophila se observaría solo en ausencia de correcciones por aplicación de nutrientes.
MATERIALES Y MÉTODOS
Microorganismos
Se utilizaron como rizobacterias promotoras del crecimiento vegetal las especies A. brasilense cepa Az39 y P psychrophila cepa PSE10 provistas por el cepario del laboratorio de Microbiología Agrícola de la Facultad de Ciencias Agropecuarias de la Universidad Nacional de Córdoba (Córdoba, Argentina). Los inoculantes se prepararon a partir del cultivo de A. brasilense en el medio descrito en laTabla 1 y de P psychrophila en Tripteína Soya Caldo (Britania B0210305 B0210306) a 28-30 °C durante 48 h alcanzando, en ambos casos, 1x109 ufc ml-1.
Ensayo de germinación y de crecimiento en cámara de crecimientoSe estudió la germinación y el crecimiento inicial de trigo variedad BIOINTA 1006 en un sustrato de suelo y arena (Tabla 2) esterilizado y mantenido al 50 % de su capacidad de campo (CC). La esterilización del sustrato fue realizada en autoclave durante 2 h a 121 °C y 1,21 kgF cm-2 de presión.
Para determinar la CC se secó una masa de sustrato en estufa hasta peso constante (PS), luego se saturó con agua y se la dejó drenar hasta que se detuvo el flujo vertical, y se tomó el peso húmedo (PH). El contenido de agua gravimétrico en CC se calculó según la siguiente ecuación,
CC (%) = [(PH - PS) PS-1] x 100.

Tabla 1 Composición del medio de cultivo para la preparación del inoculante con Azospirillum. El pH del medio se ajusta a 7 con KOH 0,1 N.
Los tratamientos evaluados fueron: control sin inoculación ni fertilización (T0), fertilización con P y con K (T1), inoculación con A. brasilense (T2), inoculación con P psychrophila (T3), inoculación con A. brasilense y fertilización con P y con K (T4) e inoculación con P psychrophila y fertilización con P y con K (T5). Antes de su siembra, las semillas se desinfectaron con hipoclorito de sodio al 10 % y luego se enjuagaron con agua destilada (Camiletti et al., 2018). En los tratamientos inoculados (T2 a T5), se aplicaron 80 pL semilla-1 de los cultivos de microorganismos así alcanzaron un aporte aparente de 8 x 107ufc semilla-1. Este tratamiento se realizó aplicando el 50 % de la dosis sobre el sustrato en el punto de siembra de las semillas y el resto sobre las semillas luego de colocadas en el sustrato de crecimiento. Los tratamientos de fertilización (T1, T4 y T5) se realizaron con una solución con fosfato monobásico de potasio (KH2PO4; Cogliatti, Cataldi e Iglesias, 2010) aplicado antes de la siembra en una dosis equivalente a 20 kg P ha-1 y a 25 kg K ha-1 y en cada riego de mantenimiento hasta el 50 % de CC del sustrato. Los controles sin fertilización (T0, T1 y T2) solo se regaron con agua destilada.
A los cuatro DDS se realizó el primer conteo de plántulas emergidas, y a los ocho DDS, el conteo final (Ludwig et al., 2018; ISTA 2020). A los diez DDS, se midió el largo de las radículas, el peso seco aéreo y el peso seco de las radículas. Se calculó el peso total de las plántulas a partir de la suma de los pesos secos aéreos y de las radículas. Para determinar el largo de raíces, se tomó como referencia el pelo radical de mayor extensión, a partir del pericarpio de cada semilla. El secado del material se realizó en estufa a 60 °C hasta peso constante, 48 h aproximadamente.
Dentro de la cámara, las unidades experimentales se distribuyeron al azar y se mantuvieron condiciones de 12 h de luz y 12 h de oscuridad (Safari. et al. 2018; ISTA 2020) y una temperatura de 22 °C durante 10 días. El diseño experimental fue bifactorial con un factor fertilidad y un factor PGPR. Se realizaron 3 repeticiones por tratamiento y se sembraron 20 semillas por bandeja. Con los resultados, se realizó un análisis de la varianza (ANAVA) utilizando el software InfoStat (Di Rienzo et al., 2014). Donde hubo diferencias significativas, se realizaron diferencias de medias usando la prueba DGC (Di Rienzo, Guzmán y Casanoves, 2002) con un nivel de significancia de 0,1.
Ensayo de crecimiento en invernaderoSe estudió el crecimiento de trigo variedad BIOINTA 1006 cultivado en macetas. Se utilizaron macetas de 815 cm3 lavadas con detergente y desinfectadas con solución de etanol al 70 %. El sustrato utilizado fue suelo y arena (1:1) (Tabla 2), que fue esterilizado y mantenido entre 60 y 80 % de su CC a fin de facilitar la potencial expresión de desempeño de las PGPR (Skopp, Jawson y Doran 1990; Grant y Rochette 1994). Las plantas crecieron con luz natural en los meses de septiembre y octubre de 2019, y con una temperatura media de 23 °C y 51 % de humedad relativa. Se sembraron ocho semillas por maceta, y a los ocho DDS se raleó dejando seis plantas por maceta. Se realizaron siete repeticiones por tratamiento, siendo cada maceta una unidad experimental distribuida al azar. Los tratamientos (T0 a T5) y su instalación (esterilización de las semillas, inoculación, fertilización) se realizaron según lo descrito en el estudio en condiciones de cámara de crecimiento. El control y el mantenimiento del contenido de humedad de las macetas, se llevó a cabo por gravimetría, pesando y completando en cada maceta la diferencia de peso, producto de la transpiración y evaporación del sistema suelo-planta. Simultáneamente se registró la fenología de las plantas según Zadoks, Chang y Konzak (1974) y alcanzaron el estadio Z 15 al final del estudio (40 DDS).
A los 40 DDS se determinó el peso seco total (PST), el peso seco aéreo (PSA) y el peso seco de raíces (PSR) secando las plantas a 60 °C hasta peso constante, aproximadamente durante 48 h. Además, se calculó un índice de partición de biomasa (IPB) como la relación entre el PSR y el PST de cada planta según la siguiente ecuación,
IPB = (PSR planta-1) x (PST planta-1)-1
A los 40 DDS se determinó el área foliar verde de cada planta utilizando un integrador de área foliar LI 3000 (Li Cor, Inc., Lincoln, Nebraska, USA).
En ambos ensayos, los datos se analizaron con análisis de la varianza (ANAVA) utilizando el software InfoStat (Di Rienzo et al., 2014). Donde hubo diferencias significativas, se realizaron diferencias de medias usando el test DGC (Di Rienzo, Guzmán y Casanoves, 2002) con un nivel de significancia de 0,1.
RESULTADOS Y DISCUSIÓN
Crecimiento de plántulasEl largo de las raíces a los 10 DDS varió entre 13,2 y 27,7 cm planta-1 (Tabla 3), con una media general de 20,4 cm entre todos los tratamientos mostró interacción significativa entre los factores fertilización e inoculación (p>0,1). A. brasilense y P psychrophila promovieron el crecimiento en longitud de las raíces de plántulas de trigo en etapas tempranas del crecimiento y las plantas inoculadas sin la incorporación de P y de K fueron las de mayor longitud (Tabla 3). Esto coincide con los resultados encontrados por Pathak et al. (2016), quienes inocularon con Azospirillum semillas de trigo que tenían distintos períodos de almacenamiento. Además, Safari et al. (2018) y Yarzábal et al. (2018) también mostraron que la inoculación con Pseudomonas spp. aumenta la longitud de las raíces en condiciones normales y de estrés por salinidad y por bajas temperaturas. En nuestro estudio, el efecto promotor del crecimiento de A. brasilense y P psychrophila sobre el largo de raíces fue más notorio cuando estas rizobacterias se inocularon sin el agregado de P-K. Mientras que, al inocular en combinación con estos nutrientes, la longitud de las raíces fue similar a la alcanzada con solo el agregado de P-K. En los primeros 10 DDS el efecto promotor del crecimiento de estos organismos fue de mayor magnitud relativa en un sustrato limitado en P y en K, esto se debe presumiblemente a una mayor contribución sobre la actividad fisiológica de las plantas en comparación con un aumento en el acceso a nutrientes.
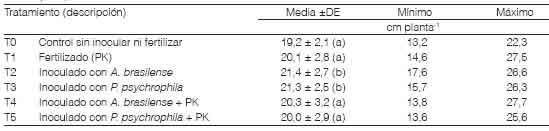
Tabla 3 Longitud de raíces de trigo evaluada a los 10 días de su siembra en un sustrato esterilizado según tratamientos de inoculación con Azospirillum y con Pseudomonas. Medias con letras distintas tienen diferencias significativas para un análisis DGC (Di Rienzo, et al., 2002) con p > 0,10. DE: desvío estándar de la media.
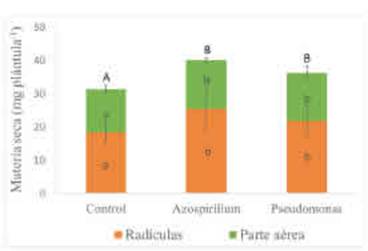
Figura 1 Materia seca de plántulas de trigo acumulada a los 10 días de la siembra según tratamientos de inoculación con A. brasilense y con P psychrophíla. Promedio de tratamientos con y sin fertilización con P y con K. Letras minúsculas diferentes indican diferencias en la materia seca de las radículas o de la parte aérea entre tratamientos de inoculación (p>0,10). Letras mayúsculas diferentes muestran diferencias en la acumulación total de materia seca entre tratamientos de inoculación (p>0,10). Las barras muestran el desvío estándar de las medias.
La biomasa total alcanzada a los 10 DDS en las plántulas tratadas con A. brasilense fue 6,3 % mayor que en el control sin inocular, mientras que las plántulas tratadas con P psychrophila lo superaron en 4,9 % (Figura 1). No obstante, las diferencias entre ambos microorganismos no fueron significativas. El factor fertilidad a los 10 DDS no tuvo un efecto significativo en el crecimiento de las plántulas de trigo y no se detectó interacción entre los factores fertilidad y PGPR (p> 0,1).
Al particionar la biomasa total en biomasa aérea y radicular, se observó que los efectos de la inoculación con una u otra rizobacteria fueron independientes del efecto de fertilización con P y con K (interacción Fertilización x Inoculación no significativa, p> 0,1). En la Figura 1, se observa que la inoculación con los PGPR incrementó el crecimiento aéreo de las plántulas. Al igual que para la biomasa total, la biomasa aérea se incrementó en promedio 13 % sobre el control al inocular con A. brasilense (14,7 mg plántula-1) o con P psychrophila (14,5 mg plántula-1). En contraposición, Liu et al. (2019) evaluaron el crecimiento de plantas de trigo inoculadas con Pseudomonas en condiciones no controladas en bandejas para crecimiento de raíces y no observaron modificaciones en la biomasa total y de raíces a los 6 y a los 12 días desde su siembra con respecto al control. En nuestro estudio, a los 10 DDS, la biomasa de las raíces fue la variable de respuesta que mejor mostró los aportes de los PGPR sobre el crecimiento de plántulas de trigo (Figura 1). Al agregar A. brasilense, el peso seco de las radículas fue de 25,5 mg plántula-1, mientras que el alcanzado con P. psychrophila fue de 21,8 mg plántula-1. Este resultado con A. brasilense sugiere efectos hormonales de estas bacterias sobre las plántulas que conducen a cambios en los patrones de crecimiento al aumentar la partición de asimilados hacia las raíces. Esto se explica, en parte, por el efecto PGPR de Azospirillum asociado principalmente a la producción de fitohormonas o compuestos precursores de estos (Perrig et al., 2007; Mehnaz, 2015). En tanto que el efecto de Pseudomonas se debe principalmente a aportes indirectos a partir de mejoras en la solubilización del P inorgánico (Oteino et al., 2015).
Ensayo de crecimiento en condiciones de invernaderoLos resultados del ensayo de crecimiento de trigo para biomasa total y particionada en aérea y radicular evaluada a los 40 DDS se presentan en la Tabla 4. No se detectó interacción significativa entre los factores inoculación con PGPR y fertilización con P-K (p>0,1), pero sí se identificaron respuestas a la aplicación de los nutrientes y de los microorganismos de forma independiente. En promedio no se observaron diferencias en estos parámetros entre los PGPR.
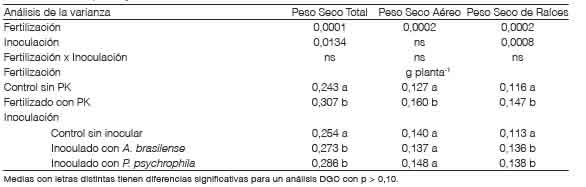
Tabla 4 Producción de materia seca de trigo a los 40 días después de la siembra según dos niveles de fertilización con P y con K e inoculación con Azospirillum y con Pseudomonas.
El peso seco de las raíces mostró efectos independientes entre los tratamientos de fertilización con P y con K y de inoculación (p>0,1). La inoculación con A. brasilense contribuyó a incrementos de la biomasa radical de 20,3 % con respecto al control. Estas respuestas coinciden con lo reportado por Díaz-Zorita y Fernández Canigia (2009) que mostraron aumentos del 22 % en el peso seco de raíces al estudiar la inoculación de trigo con A. brasilense en 297 sitios experimentales bajo condiciones de producción en el campo en la región pampeana de Argentina. La inoculación con P psychrophila condujo a aumentos del 22,1 % en el peso seco de raíces con respecto al control. En concordancia con estos resultados, Meena et al. (2015) también observaron incrementos en la biomasa radical de plantas de trigo inoculadas con P aeruginosa en condiciones controladas simulando estrés por temperatura elevada. En nuestro estudio, los incrementos de biomasa total y radical de los tratamientos fertilizados e inoculados respecto al control se observaron a pesar de las condiciones de estrés hídrico moderadas impuestas durante el desarrollo de las plantas (60 - 80 % CC del sustrato).
A medida que el trigo avanzó en su fenología, aumentó la importancia del efecto de la aplicación de nutrientes, ya que el aporte de P y de K incrementó la biomasa total en 26,3 % en comparación con los controles sin fertilización (Tabla 4). El peso seco aéreo fue de 0,160 g planta-1 al fertilizar y de 0,127 g planta-1 sin el agregado de P y de K. Similares resultados al fertilizar se observaron sobre la acumulación de biomasa de las raíces.
La inoculación con las PGPR no mostró cambios significativos en el crecimiento aéreo. Sin embargo, la inoculación con P psychrophila mostró una tendencia a ser el tratamiento PGPR con mayor biomasa aérea (Tabla 4). Las posibles diferencias en respuestas entre la inoculación con A. brasilense y con P. psychrophila podría atribuirse parcialmente por el pH del sustrato que, al ser neutro, decrece la disponibilidad de P para las plantas (Thompson y Troeh, 1980). En un escenario con estas características es de mayor relevancia el efecto solubilizador de P de Pseudomonas al liberar ácidos orgánicos (Liu et al., 2019). No obstante, Veresouglou y Menexes (2010), haciendo una revisión de publicaciones en las que se estudió el efecto de la inoculación con Azospirillum spp. sobre trigo, describieron aumentos medios del 17,8 % en la biomasa aérea de plantas inoculadas con Azospirillum spp. En nuestro estudio esos resultados no fueron corroborados, probablemente debido a diferencias en los momentos de evaluación y a que las mejoras en acumulados en crecimiento aéreo se detecten con mayor consistencia en estadios fenológicos más avanzados.
Solo las PGPR modificaron la relación de partición de biomasa mostrando el mayor IPB cuando las semillas fueron inoculadas con A. brasilense (Tabla 5). Al inocular, la proporción de biomasa acumulada de raíces fue mayor que al no hacerlo e independientemente del agregado de nutrientes (Tabla 5). Los microorganismos PGPR producen fitohormonas, metabolitos y enzimas que inducen a modificaciones en la expresión de genes y en el patrón de crecimiento de las plantas (Fahad et al., 2014; Goswami y Deka, 2020). El mayor IPB alcanzado en los tratamientos con PGPR sugiere que la incorporación de estas bacterias genera efectos hormonales que conllevan a un incremento de la partición de asimilados hacia las raíces. Los cambios en la cantidad de nutrientes no alteraron la partición de fotoasimilados evaluada a partir de la relación entre la biomasa acumulada aérea y de raíces (Tabla 5). Tal como se observó en los estadios iniciales del crecimiento, los aportes sobre la biomasa de las raíces fueron de mayor magnitud en presencia de A. brasilense que con P. psychrophila (Figura 1).
La fertilización con P y con K, independientemente de la inoculación, incrementó el área foliar fotosintéticamente activa de las plantas evaluada a los 40 DDS (Tabla 5). Esta variable fue 14,2 % mayor al fertilizar que en el control sin aplicación de P y de K (Figura 3). En este estudio no se Medias con letras distintas tienen diferencias significativas para un análisis DGC (Di Rienzo, Guzmán y Casanoves, 2002) con p > 0,1. La ausencia de valores medios indican diferencias significativas entre tratamientos del factor evaluado.
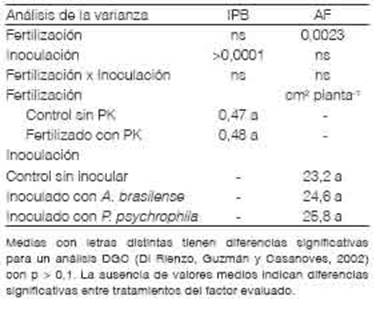
Tabla 5 Partición de biomasa seca y área foliar de trigo a los 40 días después la siembra con y sin fertilización con P y con K e inoculación con Azospirillum y con Pseudomonas.
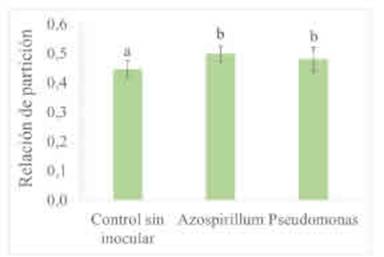
Figura 2 Partición de biomasa de trigo acumulada a los 40 días de la siembra según tratamientos de inoculación con A. brasilense y con P psychrophila. Promedio de tratamientos con y sin fertilización con P y con K. Relación de partición: (peso seco de raíces) x (peso seco total)-1. Letras diferentes indican diferencias entre tratamientos de inoculación (p>0,10). Las barras muestran el desvío estándar de las medias.
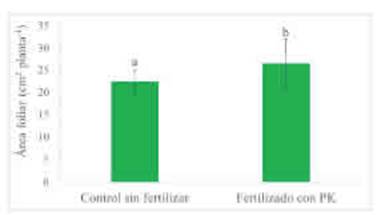
Figura 3 Área foliar de trigo a los 40 días de la siembra según tratamientos de fertilización con P y con K. Promedio de tratamientos de inoculación con A. brasilense y con P. psychrophila. Letras diferentes indican diferencias entre tratamientos de fertilización (p>0,10). Las barras muestran el desvío estándar de las medias.
CONCLUSIONES
En condiciones controladas de crecimiento, se validó que la incorporación tanto de A. brasilense como de P. psychrophila mejora el crecimiento inicial del trigo al incrementar la elongación y la acumulación de biomasa de las raíces. Al inocular con A. brasilense se modificó la partición de biomasa hacia las raíces lo que sugiere un mayor efecto fitohormonal que por la presencia de P psychrophila. Los tratamientos de inoculación mostraron efectos sobre la acumulación de biomasa total del trigo independientemente de la fertilización con P y con K lo que sugiere la ocurrencia de aportes combinados no compensatorios de ambos factores sobre el crecimiento.















