Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista veterinaria
versão On-line ISSN 1669-6840
Rev. vet. vol.27 no.1 Corrientes jan. 2016
TRABAJOS DE INVESTIGACIÓN
Desarrollo embrionario-larval y metamorfosis de Physalaemus albonotatus (Anura: Leptodactylidae)
Gómez, M.L.; Zaracho, V.H.; Sandoval, M.T.
Laboratorio de Herpetología, Facultad de Ciencias Exactas y Naturales y Agrimensura, Universidad Nacional del Nordeste, Av. Libertad 5470, Corrientes (3400), Argentina, Tel. 0379-4473931 (int. 412). E-mail: gomezmlujan85@gmail.com.
Resumen
Los anuros poseen una gran plasticidad fenotípica y constituyen un grupo de referencia para estudios de desarrollo ontogenético, así como aspectos morfo-fisiológicos, ecológicos, filogenéticos y evolutivos. Existe abundante información sobre la morfología larval de numerosas especies de anuros, sin embargo, el desarrollo embrionario y larval ha sido escasamente explorado en Leptodactylidae. En el presente trabajo se describen y caracterizan los principales cambios en la morfología externa de varios órganos así como también del sistema digestivo durante los estadios embrionarios, larvales y metamórficos de Physalaemus albonotatus. Para ello se coleccionaron embriones y larvas en ambientes naturales, los cuales fueron criados en condiciones de laboratorio y fijados periódicamente en formol 10%. Las observaciones se realizaron bajo lupa estereoscópica y microscopio electrónico de barrido. El desarrollo embrionario y larval siguió el patrón característico de los anuros con fase larval acuática obligada. La organización de los principales órganos ocurrió durante los estadios embrionarios y primeros larvales, abarcando el periodo comprendido entre los estadios 17 y 25. Algunos órganos transitorios como las branquias externas y las papilas adhesivas desaparecen tempranamente durante el desarrollo, mientras que otras estructuras como la cámara opercular, el espiráculo, el disco oral, el tubo proctodeal, la cola y las aletas caudales se conservan hasta el final del periodo larval, y se pierden recién durante la metamorfosis. En esta última etapa se evidencian cambios bruscos en la anatomía de la mayoría de los sistemas de órganos y se configura el diseño corporal propio del individuo juvenil. Las caracterizaciones morfológicas de estructuras embrionarias y larvales de P. albonotatus contribuirán con información de referencia aplicable a otros miembros de la familia Leptodactylidae.
Palabras clave: anfibios, ontogenia, estadios embrionarios, morfología larval.
Embryonic and larval development and metamorphosis of Physalaemus albonotatus (Anura: Leptodactylidae)
Abstract
Anurans have a great phenotypic plasticity and are a useful group for ontogenetic studies regarding morpho-physiological aspects as well as ecological, phylogenetic and evolutionary approaches. Descriptions of larval morphology is available for most species of frogs, however, embryonic and larval development has been poorly explored in Leptodactylidae. In this paper, the internal and external morphology of embryonic, larval and metamorphic stages of Physalaemus albonotatus are described and characterized. Embryos and tadpoles collected in natural ponds were kept under laboratory conditions and fixed periodically in formalin 10%. Observations were performed under stereoscopic microscope and scanning electron microscope. The embryonic and larval development followed the characteristic pattern of frogs with obligated aquatic larval phase. The organization of the main organs occurs during the embryonic and early larval stages, between the stages 17 and 25. Some transitory organs as the external gills and the adhesive organ disappear early during the development, while the operculum, the spiracle, the oral apparatus, vent tube, tail and caudal fins are retained until the end of the larval period and disappear during the metamorphosis. In this period occur important changes in the organ systems anatomy that configure the juvenile body plan. The embryonic and larval morphological characterization of P. albonotatus contributes to knowledge of the ontogeny of this species and could be potentially applicable to other Leptodactylidae species.
Key words: amphibians, ontogeny, embryonic stages, larval morphology.
Recibido: 1 diciembre 2015
Aceptado: 19 febrero 2016
INTRODUCCIÓN
Los anfibios presentan diversas estrategias de reproducción y modelos de desarrollo, incluyendo especies con fertilización interna o externa, desarrollo oví- paro o vivíparo, indirecto o directo, huevos acuáticos o terrestres, además de variadas formas de nutrición, respiración y metabolismo embrionario y larval 6 . Estas estrategias están íntimamente asociadas con la historia filogenética y con aspectos ecológicos de las especies.
Los anuros, por su plasticidad fenotípica, son un grupo de interés para abordar estudios ontogenéticos, tanto en relación a aspectos morfo-fisiológicos como de importancia ecológica, filogenética y evolutiva. Los aportes que puedan realizarse acerca de la anatomía embrionaria y larval son relevantes ya que resultan de gran utilidad y aplicabilidad en estudios que integren diversos aspectos del desarrollo.
Si bien existe información sobre la morfología larval externa de muchas especies de anuros, la morfogé- nesis embrionaria ha sido escasamente explorada, y en general la información disponible corresponde a especies de Bufo, Hyla y Rana del hemisferio horte 12, 23, 24 .
La tabla de desarrollo de Gosner fue propuesta para diversas familias de anuros de América del Norte pero su aplicación es generalizada y utilizada para especies de otras regiones 13 . Esta tabla consiste en una secuencia de 46 estadios caracterizados principalmente a partir de la morfología externa y caracteres fisiológicos de embriones y larvas exotróficas. Adicionalmente, existen tablas de desarrollo para Xenopus laevis 20 , Eleutherodactylus coqui 27 , Spea intermontana 14 , Microhyla okinavensis 22 , Dendropsophus columbianus 18 , entre otras. Para la anurofauna de Argentina existen tablas de desarrollo para Rhinella arenarum 4, 7 , Pseudis platensis 9, 10 , Phyllomedusa azurea, P. sauvagii 21 , Dermatonotus muelleri 11 y Pleurodema borellii 17 .
En este trabajo se describe la organogénesis externa e interna de Physalaemus albonotatus desde la etapa de segmentación hasta el final de la metamorfosis, ampliando la descripción morfológica sugerida para los estadios de Gosner 13 y de descripciones morfológicas previas breves y parciales de embriones y larvas de la especie 16 .
MATERIAL Y MÉTODOS
Se coleccionaron puestas de huevos y larvas de P. albonotatus durante los meses de octubre a marzo del periodo 2007-2010, en el Campus Universitario (27º28'04"S; 58º46'58"O) de la Universidad Nacional del Nordeste, Corrientes, Argentina. Embriones y larvas fueron criados en laboratorio en recipientes plásticos (1,5 litros) con agua declorinada.
Las larvas fueron alimentadas ad libitum con lechuga hervida y/o alimento comercial para peces. Los estadios embrionarios fueron asignados de acuerdo a la tabla de Gosner 13 . Entre 10 y 20 individuos por estadio (hasta el estadio 21 cada 3-6 h y luego cada 12-48 h) fueron fijados en formol 10%, previa anestesia con aminobenzoato de etilo 6%, según la Guía de Eutanasia Animal propuesta por la AVMA 2 .
Se describieron los estadios embrionarios y larvales a partir de caracteres anatómicos externos considerados por otros autores utilizando la terminología propuesta 1, 4, 7, 13, 17. Adicionalmente se realizaron disecciones de los ejemplares para analizar y describir la anatomía interna. Las observaciones se realizaron con lupa estereoscópica Leica ES2 y complementariamente para estadios embrionarios tempranos, microscopio electrónico de barrido JEOL JSM-5800 LV.
Para esto los ejemplares fueron preparados siguiendo el protocolo estandarizado de deshidratación en soluciones de concentración creciente de acetona (12,5; 25; 50; 75 y 100%), secado a punto crítico y metalizado con oro-paladio. Se midió el diámetro embrionario, longitud total, longitud hocico-cloaca y longitud de la cola de 10 ejemplares por estadio, utilizando una escala micrométrica incorporada a lupa estereoscópica Olympus SZX9 y se calculó el valor promedio de cada variable. El material biológico analizado se encuentra depositado en la Colección Herpetológica de la Universidad Nacional del Nordeste (UNNEC 12332).
RESULTADOS
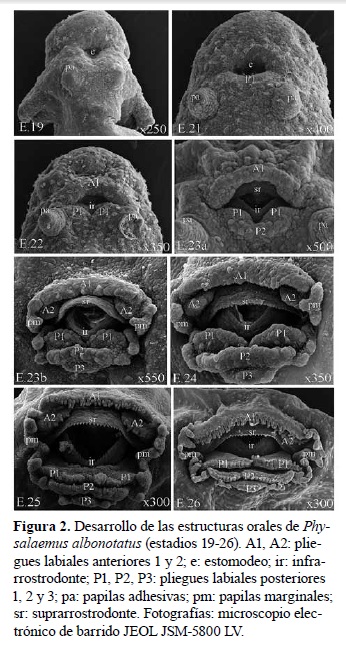
El desarrollo de P. albonotatus se dividió en dos periodos. El periodo embrionario (hasta la eclosión) comprendió los procesos de segmentación, gastrulación, neurulación y organogénesis temprana y el periodo larval incluyó las etapas de prometamorfosis, premetamorfosis y clímax metamórfico 17 . Las medidas obtenidas en embriones y larvas se presentan en Tabla 1, mientras que secuencias del desarrollo de las branquias externas, del disco oral, de las extremidades anteriores y del sistema digestivo son ilustradas en las Figuras 1, 2, 3 y 4.
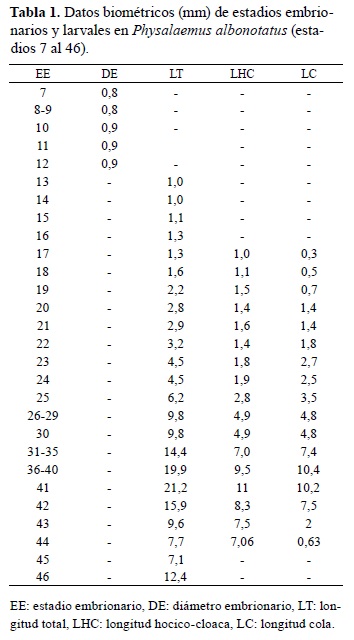
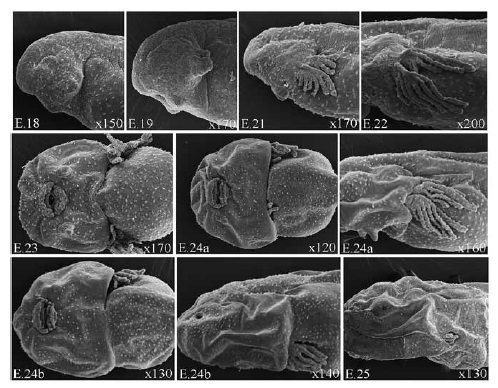
Figura 1. Desarrollo de las branquias externas y formación de la cámara opercular en Physalaemus albonotatus (estadios 18-25). Fotografías: microscopio electrónico de barrido JEOL JSM-5800 LV.

Características de los estadios embrionarios
E. 7: micrómeras en el polo animal y macrómeras en el polo vegetativo, cavidad blastocélica central.
E. 8-9: micrómeras y macrómeras de menor tamaño que en el estadio anterior, cavidad blastocélica ubicada en el polo animal.
E. 10: esbozo del labio dorsal del blastoporo y del arquenterón visibles en la región posterior, blastocele excéntrico.
E. 11: labios laterales del blastoporo, macrómeras visibles sólo en el polo vegetativo, arquenterón más desarrollado que en el estadio anterior.
E. 12: labio ventral del blastoporo, macrómeras visibles en el tapón vitelino, blastocele pequeño y arquenterón amplio ubicado en la región dorsal.
E. 13: embrión oblongo en sentido antero-posterior, tapón vitelino pequeño, placa neural visible.
E. 14: pliegues neurales y surco neural visibles.
E. 15: región cefálica y abdominal diferenciadas, pliegues neurales fusionados a nivel del prosencéfalo, surco neural profundo, arcos branquiales I, II y III visibles.
E. 16: tubo neural completamente cerrado, placodas ópticas e invaginación del proctodeo visibles.
E. 17: región cefálica, abdominal y caudal bien definidas, arcos branquiales I, II, III y IV visibles, riñón pronéfrico distinguible dorsalmente por detrás de la cabeza, esbozo de la cola.
E. 18: arco branquial I visible a ambos lados del estomodeo, II, III y IV más prominentes que en estadio anterior, un par de esbozos de filamentos branquiales externos a cada lado, esbozo de papilas adhesivas visibles, abdomen globoso con abundante vitelo.
E. 19: arcos branquiales no visibles externamente, filamentos branquiales externos simples, papilas adhesivas de forma cónica, cola con esbozos de aletas dorsal y ventral, melanóforos dispersos sobre la región dorsal de la cabeza, abdomen y cola.
Características de los estadios larvales (prometamórficos)
E. 20: filamento branquial anterior ramificado en 5 filamentos secundarios cortos y posterior simple, ojos pequeños, melanóforos más abundantes que en el estadio anterior y dispersos en el dorso del cuerpo, tubo proctodeal visible.
E. 21: filamentos branquiales largos (hasta la región pronéfrica), anterior y posterior ramificados en 6 y 4 filamentos secundarios respectivamente, retina levemente pigmentada, cristalino blanquecino, placa oral perforada, labio posterior con esbozo de pliegue labial P1, papilas adhesivas cónicas, invaginación de placodas nasales visible, melanóforos más abundantes que en el estadio anterior, distribuidos uniformemente en la región de la cabeza y flancos, en la cola, distribuidos en pequeños grupos separados por zonas sin pigmentar delimitando patrón de bandas transversales, longitud de la cola aproximadamente 50% de la longitud total, aleta caudal bien desarrollada, no pigmentada, abdomen oblongo con abundante vitelo distribuido uniformemente.
E. 22: filamentos branquiales más largos (hasta región anterior abdominal), disco oral con infrarrostrodonte, labio anterior con esbozo de pliegue labial A1 y pliegue labial P1 más desarrollado, melanó- foros más abundantes, en la cabeza distribuidos uniformemente excepto en la región nasal, ocular y de la epífisis, esbozo del intestino visible ventralmente.
E. 23 a y b: pliegue opercular cubre parcialmente las branquias externas, retina bien pigmentada, disco oral con suprarrostrodonte, infrarrostrodonte y pliegues labiales A1 y P1 bien organizados, esbozos de pliegues labiales A2 y P2 y P3, papilas marginales ventrales visibles, esbozo del hígado visible en el flanco derecho, 23a con esbozo del asa intestinal, 23b con una vuelta del asa intestinal completa.
E. 24 a y b: pliegue opercular cubre completamente las branquias externas derechas, papilas adhesivas vestigiales, disco oral con suprarrostrodonte e infrarrostrodonte aserrados y queratinizados, pliegues labiales con esbozos de queratodontes, papilas marginales laterales más desarrolladas y papilas ventrales visibles a ambos lados del claro mental,24a con una vuelta y media del asa intestinal, 24b con dos vueltas del asa intestinal.
E. 25: pliegue opercular cubre completamente los filamentos branquiales derechos e izquierdos, abertura del espiráculo visible, queratodontes bien desarrollados, queratinizados y con dentículos marginales en los pliegues labiales A1, A2, P1 y P2, y esbozo de queratodontes en P3, papilas marginales bien desarrolladas, con claro rostral amplio, un claro mental y dos claros ventro-laterales pequeños, cestilla branquial interna desarrollada visible por transparencia, dos vueltas y media del asa intestinal completas, tubo proctodeal bien desarrollado, aleta caudal dorsal con cromatóforos dispersos.
Características de los estadios premetamórficos
E. 26-30: la morfología larval externa general es semejante al E. 25, diferenciándose por el grado de desarrollo y patrón de pigmentación de los miembros anteriores y posteriores, así como y crecimiento de las asas intestinales.
E. 31-35: delimitación del estilopodio, zeugopodio y autopodio de los miembros anteriores y posteriores y desarrollo secuencial de los dígitos: miembro posterior: dígito 4 (E. 31), 3 y 5 (E. 33), 2 (E. 34) y 1 (E. 35); miembro anterior: dígito 4 (E.31), 3 (E.32); 5 (E.33) y 2 (E.34).
E. 36-40: se caracterizan por crecimiento general y establecimientos del patrón de pigmentación de los miembros y dígitos. Características de los estadios metamóficos (clímax metamórfico) Agrupa los estadios donde se producen los principales cambios de la forma larval a la juvenil.
E. 41: miembros anteriores bien desarrollados dentro de la cámara branquial, abertura de salida del miembro anterior visible en el flanco derecho, miembros posteriores bien desarrollados, inicio de regresión del tubo proctodeal.
E. 42: inicio de reconfiguración de la estructura cefálica, inicio de regresión de queratodontes y papilas marginales del disco oral, rostrodontes aún visibles, miembros anteriores externos, inicio de organización del estómago y reconfiguración de las asas intestinales, tubo proctodeal ya no es visible, inicio de regresión de la cola y aletas caudales.
E. 43: queratodontes y rostrodontes ausentes, se delimitan las mandíbulas, comisura de la boca no alcanza región ocular, comienza a configurarse el hocico, ojos dorso-laterales, estómago, intestino delgado y grueso bien delimitados, hígado prominente con varios lóbulos, cola más corta que en el estadio anterior.
E. 44: comisura de la boca alcanza la altura del cristalino, estómago y lóbulos hepáticos prominentes, cola reducida.
E. 45: forma juvenil bien establecida, comisura de la boca sobrepasa límite posterior del ojo, lóbulos hepáticos, estómago e intestinos delgado y grueso más desarrollados, vestigios de cola aún visibles.
E. 46: juvenil recién metamorfoseado con características anatómicas externas e internas semejantes al adulto.
DISCUSION
El desarrollo embrionario comprende una serie de eventos ontogenéticos que incluyen los procesos de segmentación, gastrulación y organogénesis temprana que han sido extensa y detalladamente descriptos a nivel morfológico, genético y molecular en el género Rana 3 y X. laevis 8, 15, 19 . En P. albonotatus, semejante a lo descripto en la tabla de Gosner 13 , el patrón de clivaje es holoblástico desigual con formación de micrómeras en el polo animal y macrómeras en el polo vegetativo, que acumulan las reservas vitelinas.
La blástula presenta inicialmente una cavidad blastocélica central que luego adquiere posición excéntrica. El proceso de gastrulación es similar al descripto para Colostethus machalilla 5 . Ocurre entre E. 10 y el E. 13- 14 donde se evidencia, externamente, la formación secuencial de los labios del blastoporo e internamente, la formación de la notocorda y arquenterón, así como la obliteración progresiva del blastocele.
La organogénesis se inicia en E. 14 donde es visible, externamente, la placa neural (inicio de la neurulación) y progresa paulatinamente con la formación de los principales sistemas de órganos, con evidentes cambios en la forma corporal. El embrión pasa de ser redondeado a oblongo (E. 14) y luego, a partir de E. 15, se organizan las tres regiones corporales (cabeza, abdomen y cola).
El desarrollo larval de los anuros comprende procesos morfogenéticos donde pueden reconocerse: diferenciación, desarrollo y desaparición de estructuras larvales; remodelación de estructuras larvales en estructuras adultas y desarrollo y diferenciación de estructuras propias del adulto, que ocurren de forma simultánea durante el periodo larval y la metamorfosis 11 .
En P. albonotatus, entre E. 17 y E. 25, se organizan estructuras propias de la mayoría de los embriones y larvas de anuros 6 . Ellas corresponden a órganos transitorios como branquias externas y papilas adhesivas, que regresan tempranamente, y estructuras que se conservan hasta el final del periodo larval como la cámara opercular, el espiráculo, el disco oral, el tubo proctodeal, la cola y las aletas caudales.
La ontogenia de dichas estructuras es conservada en la mayoría de las especies con larvas exotróficas 6 , de modo que en E. 25 puede reconocerse la morfología larval típica, que para la especie en estudio corresponde al tipo IV. Los estadios larvales posteriores se diferencian principalmente por el grado de desarrollo de las extremidades anteriores y posteriores. Durante la metamorfosis se evidencian cambios bruscos en la anatomía de la mayoría de los sistemas de órganos y se configura el diseño corporal característico del individuo juvenil.
Una de las estructuras larvales más importantes de interés taxonómico, ecológico y filogenético es el disco oral. Asimismo, el estudio comparado de su ontogenia en especies emparentadas aporta datos útiles para comprender la evolución de las estructuras orales 25, 28 . En representantes del género Physalaemus, la etapa temprana de formación del disco oral es semejante hasta el E. 24, estadio a partir del cual se evidencian dos trayectorias de desarrollo diferentes que explican las variaciones morfológicas interespecíficas dentro del clado 26 .
En P. albonotatus la formación de los pliegues labiales del disco oral sigue la siguiente secuencia: P1 (E. 21); A1 (E. 22); A2, P2 y P3 (E.23 a y b), registrándose la formación de los queratodontes de forma simultánea en todos los pliegues labiales a partir del E. 24. Las papilas marginales comienzan a desarrollarse en el E. 23 y están completamente organizadas en el E. 25. En este estadio se observa, la configuración C4 del disco oral caracterizada por una fórmula dentaria 2/3, con pliegue labial P3 corto, y claros dorsal, ventral y ventrolaterales. Este patrón es compartido con P. cuvieri y P. cuqui 26 .
Se concluye que adicionalmente a las descripciones previas de aspectos anatómicos y fisiológicos considerados por otros autores en la elaboración de tablas de desarrollo, las caracterizaciones morfológicas de estructuras embrionarias y larvales de P. albonotatus brindadas en este trabajo contribuirán con información de referencia aplicable a otros miembros de la familia Leptodactylidae.
Agradecimientos: A la SGCYT-UNNE (PI F019- 2008). A la Lic. Blanca Beatriz Álvarez por la lectura crítica del manuscrito y a las Lic. Cecilia Galíndez y Lucila Curi por la colaboración en la redacción del abstract. Al Servicio de Microscopía Electrónica de Barrido de la Secretaría General de Ciencia y Técnica de la Universidad Nacional del Nordeste.
1. Altig R, McDiarmid RW. 1999. Body plan: development and morphology. In: Tadpole: the biology of anuran larvae (McDiarmid RW, Altig R, eds), The University of Chicago Press, London, 458 p. [ Links ]
2. American Veterinary Medical Association's (AVMA). 2007. Guidelines on euthanasia. http://www.avma.org/issues/animal_welfare/euthanasia.pdf [ Links ]
3. Carlson BM. 1981. Patten's foundations of embryology, McGraw-Hill, 4th ed, New York, 672 p. [ Links ]
4. Del Conte E, Sirlin L. 1951. The first stages of Bufo arenarum development. Acta Zool Lilloana 12: 495-499. [ Links ]
5. Del Pino EM, Ávila ME, Pérez OD, Benítez MS, Alarcón I, Noboa V, Moya IM. 2004. Development of the dendrobatid frog Colostethus machalilla. Int J Dev Biol 48: 663-670. [ Links ]
6. Duellman WE, Trueb L. 1986. Biology of amphibians, The John Hopkins Univ Press, Baltimore, USA, 670 p. [ Links ]
7. Echeverría DD, Fiorito L. 1981. Estadios de la metamorfosis en Bufo arenarum (Anura). Physis (Buenos Aires) 40-B: 15-23. [ Links ]
8. Ewald AJ, McBride H, Reddington M, Fraser SE, Kerschmann R. 2002. Surface imaging microscopy: An automated method for visualizing whole embryo simple in three dimensions at high resolutions. Develop Dynam 225: 359-375. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
9. Fabrezi M, Goldberg J. 2009. Heterochrony during skeletal development of Pseudis platensis (Anura, Hylidae) and the early offset of skeleton development and growth. J Morph 270: 205-220.
10. Fabrezi M, Quinzio SI, Goldberg J. 2010. The ontogeny of Pseudis platensis (Anura, Hylidae): Heterochrony and the effect of larval development on postmetamorphic life. J Morph 271: 496-510.
11. Fabrezi M, Quinzio SI, Goldberg J, De Sá RO. 2012. The development of Dermatonotus muelleri (Anura: Microhylidae: Gastrophryninae). J Herpetol 46: 363-380.
12. Fox H. 1984. Amphibian Morphogenesis, Humana Press, Clifton, New Jersey (USA), 301 p.
13. Gosner KL. 1960. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica 16: 183-190.
14. Hall JA, Larsen JH, Fitzner RE. 1997. Postembryonic ontogeny of the spadefoot toad, Scaphiopus intermontanus (Anura: Pelobatidae): External morphology. Herpetological Monographs 11: 124-178.
15. Heasman J, Ginsberg D, Goldstone K, Pratt T, Yoshidanaro C, Wylie C. 1994. A functional test for maternally inherited cadherin in Xenopus shows its importance in cell adhesion at the blastula stage. Development 120: 49- 57.
16. Kehr AI, Schaefer EF, Duré MI. 2004. The tadpole of Physalaemus albonotatus (Anura: Leptodactylidae). J Herpetol 38: 145-148.
17. Lavilla EO, Rougés M. 1992. Reproducción y desarrollo de anuros argentinos. Asociación Herpetológica, Serie de Divulgación 5: 1-66.
18. Marín GB. 2005. Aspectos del desarrollo larval de Dendropsophus columbianus (Anura: Hylidae) del Jardín Botánico de la Universidad de Caldas, Colombia. Boletín Científico del Museo de Historia Natural de la Universidad de Caldas 10: 151-165.
19. Marsden M, DeSimone DW. 2001. Regulation of cell polarity, radial intercalation, an epiboly in Xenopus: novel roles for integrin and fibronectin. Development 128: 3635- 3647.
20. Nieuwkoop PD, Faber J. 1967. Normal table of Xenopus laevis (Daudin), Ed. North-Holland, Amsterdam, 252 p.
21. Salica MJ, Haad MB, Vera F, Faivovich J. 2011. Early development of two species of Phyllomedusa (Anura: Phyllomedusinae). Salamandra 47: 144-154.
22. Shimizu S, Ota H. 2003. Normal development of Microhyla ornata: The first description of the complete embryonic and larval stages for the microhylid frogs (Amphibia: Anura). Curr Herpetol 22: 73-90.
23. Shumway W. 1940 Stages in the normal development of Rana pipiens. I. External form. Anat Rec 78: 139-147.
24. Taylor AC, Kollros J. 1946 Stages in the normal development of Rana pipiens larvae. Anat Rec 94: 7-23.
25. Thibaudeau DG, Altig R. 1988. Sequence of ontogenetic development and atrophy of the oral apparatus of six anuran tadpoles. J Morphol 197: 63-69.
26. Thiebaudeau G, Altig R. 1999. Endotrophic anurans: development and evolution. In: Tadpoles: The biology of anuran larvae (McDiarmid RW, Altig R, eds), The University of Chicago Press, Chicago (USA), p. 170-188.
27. Townsend DS, Stewart MM. 1985. Direct development in Eleutherodactylus coqui (Anura: Leptodactylidae): a staging table. Copeia 1985: 423-436.
28. Vera MF, Haad B, Baldo D, Kolenc F, Borteiro C, Altig R. 2011. Different pathways are involved in the early development of the transient oral apparatus in anuran tadpoles (Anura: Leiuperidae). Biol J Linn Soc 104: 330-345.














