Introducción
A nivel mundial existe una creciente demanda de alimentos de origen animal, por lo que los productores ganaderos están en constante búsqueda de la eficiencia en sus crianzas. La reproducción es una pieza fundamental para lograr estos objetivos, y es también fundamental el uso de biotecnologías que contribuyan al progreso genético (Davis y White 2020).
La criopreservación es una herramienta fundamental en el desarrollo de biotecnologías de reproducción asistida. El uso de semen criopreservado tiene múltiples beneficios, tales como: la conservación de material genético por tiempo indefinido, la facilidad de transporte, entre otros. Sin embargo, los valores de calidad espermática después de cada proceso, durante la congelación - descongelación, varía entre especies y hasta entre individuos de la misma especie, lo que dificulta la aplicación de una metodología estandarizada para las etapas de dilución, centrifugación, resuspensión del sedimento con el medio de congelación, empaque, congelación y descongelación de semen (Yánez-Ortiz et al. 2022). La criopreservación permite tener a disponibilidad el esperma de un reproductor para la fertilización; sin embargo, la capacidad de fertilización de los espermatozoides sometidos a congelación - descongelación, está comprometido debido a alteraciones estructurales y fisiológicas. Sin embargo, aunque las alteraciones a las que son sometidos los espermatozoides, como la criopreservación, son capaces de disminuir viabilidad, la dilución podría mejorar la adaptabilidad, buscando enfoques que compensen el líquido seminal (Medeiros et al. 2002).
La etiología de las alteraciones del espermatozoide puede representar una combinación de factores tale como: la fragilidad heredada para resistir la criopreservación y la dilución del semen. Aunque el primer factor es difícil de abordar, se pueden buscar enfoques que compensen la dilución del líquido seminal. El dilutor juega un rol fundamental en la provisión de condiciones del medio, a través de sus componentes bioquímicos y físicos, como la temperatura, para realizar un adecuado proceso de refrigeración y criopreservación (Santos et al. 2018).
Existen dos etapas previas antes del almacenamiento del semen procesado: la refrigeración y la criopreservación. La refrigeración del semen diluido consiste en el enfriamiento durante al menos 2 a 3 horas, a una temperatura de 5°C antes de ser congelado (Baiee et al. 2018).
La dilución del semen puede ser de un solo paso (semen + dilutor total), de dos pasos (semen + dilutor 1:1; dilución 1:1 + dilutor total) o de hasta tres pasos (semen + dilutor en 1:1; dilución 1:1 + mitad de la cantidad de dilutor total; semen diluido + dilutor restante) de manera gradual y la temperatura varia conjuntamente. El método de un solo paso de dilución usualmente se puede realizar a temperatura ambiente, pero las diluciones de dos o tres pasos, se llevan a cabo a 4 - 5°C o 34°C (Almeida et al. 2015). En semen porcino, Soler et al. (2020), sostienen que es frecuente realizar la dilución seminal en dos pasos, utilizando una dilución isotérmica (aproximadamente 32°C) o hipotérmica (temperatura ambiente 21 - 22°C), y no encontró diferencias entre ambos métodos, pero recomienda el uso de una dilución hipotérmica de manera segura en sementales para inseminación artificial (IA). El objetivo de esta investigación fue determinar el efecto de dos temperaturas de dilución sobre la calidad de semen en ganado cebuino en el Trópico Peruano.
Materiales y métodos
Animales de estudio. Se trabajó con dos toros adultos de la raza Gyr de 7 y 9 años. Cada macho reproductor contaba con un box individual y su alimentación de basó en pasto de corte (Maralfalfa y King Grass morado) en una cantidad diaria de 10% de su peso vivo y 2 Kg de alimento concentrado, brindados diariamente a las 10:00 am y 4:00 pm.
Colección de semen. Se recolectó un total de 10 eyaculados obtenidos cada 15 días por el método de electroeyaculación, los cuales fueron trasladados al Laboratorio de Biotecnología Animal - EEA El Porvenir - INIA - San Martín, en un tiempo máximo de 2 minutos. Las muestras se colocaron en baño maría a 34°C y se realizaron las evaluaciones macroscópicas mediante observación directa como: volumen, consistencia, color y olor; y microscópicas: motilidad masal (MM) (0-5) se evaluó mediante una valoración subjetiva del movimiento masivo de los espermatozoides según Evans y Maxwell (1990), motilidad individual (MI) (0-100%) medida en base a la proporción de espermatozoides progresivamente móviles, concentración (>400 x 106 sptz mL-1) medida por un Fotómetro (marca: MINITUBE; modelo Photometer SDM 1 Bovine). Solo se procesaron eyaculados con >60% de motilidad individual y <20% de anormalidades evaluado mediante la metodología descrita por Evans y Maxwell (1990).
Dilución. Se preparó el dilutor (OptiXcell) siguiendo las indicaciones del envase para colocarlo en baño maría a 34°C. El eyaculado que cumplió con los parámetros de evaluación fue separado en dos tubos con volúmenes homogéneos, clasificándolos en dos tratamientos: el Tratamiento 1 (T1) consistió en una pre dilución o dilución inicial 1:1 a una temperatura de 34°C, luego de 30 minutos de incubación se realizó una dilución final con un dilutor temperado a 34°C; mientras que, el Tratamiento 2 (T2) consistió en una pre dilución 1:1 a 34°C, luego de 30 minutos de incubación el semen pre diluido fue puesto a temperatura ambiente por 10 minutos conjuntamente con el recipiente del dilutor restante, posteriormente el semen pre diluido y el dilutor restante fueron puestos de manera individual en refrigeración. Después de que el semen pre diluido y el dilutor restante llegaron a los 5°C, se realizó la dilución final. Luego de 16 horas de refrigeración se analizó la vitalidad, funcionalidad de membrana, integridad acrosomal y morfología.
Vitalidad. Después de las 16 horas de refrigeración, se evaluó la vitalidad mediante tinción Eosina-Nigrosina de Agarwal et al. (2016), con algunas modificaciones. Brevemente, se colocó una lámina portaobjetos en una platina térmica (37°C), en la cual se depositó 5 µL de la muestra, para luego agregar 5 µL de solución Eosina 5% (Sigma-Aldrich, USA), homogenizar y posteriormente agregar 5 µL de solución Nigrosina 10%. Se homogenizó la muestra con las tinciones, se realizó el frotis y se dejaron secar a temperatura ambiente. Los frotis secos se observaron en microscopio de contraste de fases con objetivo de 40x, para contabilizar aleatoriamente al menos 200 células, de las cuales, los espermatozoides de color blanco estaban vivos y los espermatozoides de color púrpura estaban muertos (Figura 1).
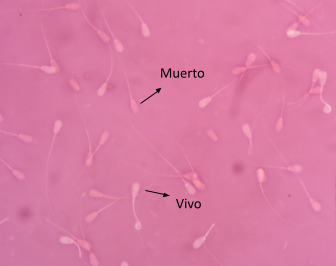
Figura 1 Captura de campo de espermatozoides bovinos con tinción Eosina-Nigrosina para evaluación de vitalidad (40x).
Prueba hipoosmótica (HOST). Se utilizó la prueba hipoosmótica de Jeyendran et al. (1984) con algunas modificaciones. Se preparó una solución de 50 mOsm L-1 con 0,1225 g de D-fructosa y 0,225 g de Citrato de Sodio para 50 mL de agua bidestilada. En baño maría a 37°C se precalentaron dos microtubos con 100 µL de solución hipoosmótica a la cual se agregó 25 µL de muestra de cada tratamiento de manera individual. Se incubaron por 5 minutos y se agregó 31 µL de solución hipoosmótica formolada (1 mL de solución hipoosmótica + 3 µL de formaldehido 40%) en cada tubo, con la finalidad de detener la reacción. Para la evaluación, sobre una lámina porta objetos se depositó 5 µL de muestra, y cubierto con lámina cubre objetos se observó en microscopio de contraste de fases con objetivo de 40x. Los espermatozoides se clasificaron como: una adecuada función osmótica de la membrana espermática produce enrollamiento de la cola de variable intensidad (HOST+), en cambio, una membrana defectuosa no genera ninguna respuesta a la solución hipoosmótica ni enrollamiento de la cola (HOST-) (Jeyerand et al. 1984) (Figura 2).
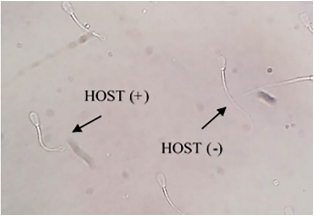
Figura 2 Captura de campo de espermatozoides bovinos sometidos a prueba hipoosmótica para evaluación de la funcionalidad de membrana (40x).
Integridad acrosomal. Se evaluó mediante una tinción con Coomassie Blue 0,22% (Fumuso et al., 2014), para lo cual se utilizó como base agua destilada (20 mL) con Brilliant Blue para Coomassie G250 (0,11 g), metanol (25 mL) y ácido acético 99% (5 mL). Se utilizaron 10 µL de muestra para preparar un frotis y se dejó secar a temperatura ambiente. Posteriormente los frotis secos fueron sumergidos en formaldehido a 4% en PBS por 15 minutos para su fijación y fueron lavados en PBS, con cinco inmersiones de un segundo cada una. Los frotis se colocaron verticalmente para eliminar el exceso de PBS para luego sumergirse horizontalmente en solución Coomassie Blue 0,22% durante 5 minutos. Finalmente, se dejó escurrir el exceso de tinción y se lavaron por inmersión en agua destilada (5 inmersiones de 1 minuto cada una) y secadas al ambiente. Los frotis secos fueron observados a 100x con aceite de inmersión en un microscopio de campo claro, para clasificar los espermatozoides con coloración azul del acrosoma o estructura acrosomal integra (CB+), o coloración blanca del acrosoma o acrosoma dañado (CB-), cuantificando no menos de 100 espermatozoides por cada muestra (Figura 3).

Figura 3 Captura de campo de espermatozoides bovinos teñidos con Coomassie Blue 0,22% para análisis de integridad acrosomal (100x).
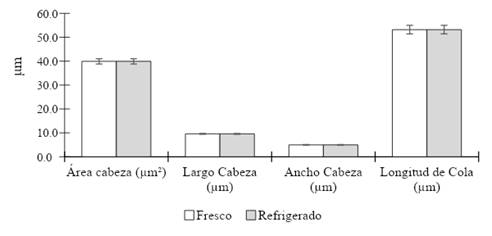
Morfología. Se realizó un frotis de cada tratamiento, que se secaron a temperatura ambiente. Posteriormente, se utilizó un kit para diferenciación celular Hemacolor® de acuerdo a instrucciones del fabricante. Brevemente, se realizaron cinco inmersiones de 1 s cada una en la Solución I (fijación), tres inmersiones de 1 segundo cada una en la Solución II (eosina), seis inmersiones de 1 segundo cada una en la Solución III (azur) y dos inmersiones de 10 segundos cada una en la Solución de Lavado (tampón pH 7,2). Finalmente, se dejaron drenar verticalmente y se secaron al ambiente, para luego ser analizados en microscopio de campo claro (OLYMPUS BX53, Tokio, Japón), equipado con cámara (OLYMPUS U-TV0.63XC, Tokio, Japón), objetivo de 100x y aceite de inmersión. Se midieron manualmente los espermatozoides utilizando las herramientas del software CellSens de OLYMPUS, considerando mediciones del largo de cabeza, ancho de cabeza, área de cabeza y longitud de cola (Figura 4).

Figura 4 Captura de campo de espermatozoides bovinos teñidos con Hemacolor® para análisis morfológico y medición manual (100x).
Análisis de datos. El estudio desarrolló bajo un diseño completo al azar con dos tratamientos. Se analizó la distribución normal de la vitalidad, prueba hipoosmótica (HOST+), integridad acrosomal (CB+) y rasgos morfométricos (largo, ancho y área de cabeza, y longitud de cola) con la prueba de Shapiro-Wilk (p>0,05) y la homogeneidad de varianzas con la prueba de Levene (p>0,05). Luego, se realizó un ANOVA y la prueba t (p<0,05) para comparación de medias en el programa SPSS v.26.0.
Resultados
Luego de un periodo de refrigeración de 16 horas, se observó mayor valor de funcionalidad de membrana mediante la prueba hipoosmótica (HOST+) en T1 (dilución final a 34°C) respecto a T2 (dilución final a 5°C) (p<0,05), y la reacción negativa (HOST-) fue mayor en T2 (Figura 5), que correspondía a una primera dilución 1:1 a 34°C y una dilución final a 5°C.
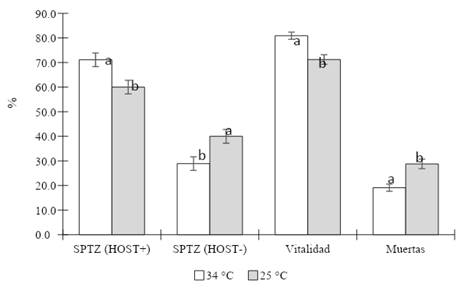
Figura 5 Integridad funcional (HOST+) y estructural de membrana plasmática (vitalidad). Se presenta la media ± error estándar de la media. Letras diferentes (a, b) en barras indican diferencias significativas (p<0,05).
La prueba de integridad acrosomal se realizó con la finalidad de evidenciar algún daño en la matriz del acrosoma espermático, mediante la tinción de enzimas acrosomales con Coomassie Blue. Según la Figura 6, no se encontró ningún efecto de la temperatura del medio de dilución final sobre el porcentaje de células con acrosoma integro (CB+).

Figura 6 Integridad acrosomal mediante tinción con Coomassie Blue (0,22 %). Se presenta la media ± error estándar de la media. Letras diferentes (a, b) en barras indican diferencias significativas (p<0,05).
En la Figura 7 se observan los valores de medición de algunos rasgos morfométricos en espermatozoides frescos y refrigerados por 16 horas, para determinar algún cambio morfológico durante el proceso. Sin embargo, no se encontró variación significativa de largo de cabeza, ancho de cabeza, área de cabeza ni longitud de cola (p<0,05), entre ambos grupos.
Discusión
En este estudio se evaluó el efecto de la temperatura del medio de dilución final, de 34°C (T1) y 5°C (T2), sobre la vitalidad, funcionalidad de membrana e integridad acrosomal de espermatozoides bovinos refrigerados después de 16 horas. La tinción eosina-nigrosina es capaz de diferenciar espermatozoides vivos de muertos (Agarwal et al. 2016) y la prueba hipoosmótica evalúa la funcionalidad de la membrana plasmática de los espermatozoides, importante durante la fertilización (Kumaresan et al. 2017). La dilución final en un medio a 34°C fue capaz de conservar la calidad de los espermatozoides, evidenciando una mayor tasa de espermatozoides con reacción HOST+ (71,11 ± 2,78%) y porcentaje de vivos (80,89 ± 1,45%), respecto a un medio a 5°C (60 ± 2,80% y 71,22 ± 1,93%, respectivamente) (Figura 5). No se encontró diferencias en el porcentaje de células con acrosoma íntegro (media de 68,92 ± 1,40%), evidenciado por la reacción positiva a Coomassie Blue (CB+), entre ambos medios de dilución. Si bien ambos grupos fueron sometidos a una primera dilución en un medio isotérmico (34°C), el efecto diferenciado de la dilución final en la integridad estructural y funcional de la membrana plasmática podría deberse al choque de frío, ya que T1 y T2 fueron refrigerados en una misma temperatura y tiempo. El enfriamiento permite que la membrana de los espermatozoides, así como la de sus orgánulos, se adapte a los cambios estructurales por las transiciones de fase lipídica que ocurrirán durante el ciclo de criopreservación (Watson 1995, Medrano et al. 2012). En T1 los espermatozoides fueron sometidos a una dilución isotérmica antes de almacenarse en refrigeración, por lo que tuvieron la oportunidad de adaptar la estructura de su membrana y función metabólica en el medio de dilución final, conforme descendía la temperatura. En cambio, en T2 no se da un tiempo de adaptación porque el dilutor final ya se encontraba a 5°C, entonces el choque de frío pudo haber lesionado la estructura y función de la membrana (en consecuencia, hubo mayor tasa de penetración de eosina al citoplasma y menor reacción al medio hipoosmótico). La criolesión en la criopreservación se debe al cambio de temperatura y a la formación-disolución de hielo, y sus consecuencias, durante el enfriamiento y calentamiento (choque de frío, choque térmico e incluso choque osmótico) (Watson 1995). Sin embargo, existe la teoría de que la capacidad de adaptación al enfriamiento podría ser variable según la fluidez de membrana plasmática de cada especie, de cada macho y de la heterogeneidad de la población de espermatozoides, haciendo a algunos más criopreservables que otros (Watson 1995, Medrano et al. 2012).
Según López et al. (2012), se pueden realizar dos tipos de dilución en semen porcino, en función a la temperatura de dilución. Este autor comparó una dilución final isotérmica (29,3°C) y una dilución final hipotérmica (22,7°C), y no encontró diferencias de ambos medios en la integridad de membrana por tinción eosina-nigrosina e integridad acrosomal. En esta investigación se comparó la dilución final a 34°C y 5°C, y se obtuvo valores similares de vitalidad e integridad acrosomal que lo reportado por López et al. (2012), pero con diferencias significativas. Por otra parte, los reportes de Soler et al. (2020) tampoco muestran diferencias en los parámetros de calidad seminal de verracos entre la dilución isotérmica (32°C) y dilución hipotérmica (21 - 22°C o temperatura ambiente); por lo tanto, la dilución a temperatura ambiente podría tener ventajas como evitar el precalentamiento del diluyente, optimizando el tiempo y recursos respecto a la conservación de medios atemperados a 34 - 37°C. Sin embargo, un medio hipotérmico de 5°C podría impactar negativamente en los espermatozoides, sugiriendo que esta temperatura pudo haber sobrepasado su nivel de tolerancia térmica, provocando choque por frio. En espermatozoides porcinos, el choque de frio con 0, 5, 10 y 15°C por 10 minutos, es capaz de reducir la motilidad y alterar la morfología acrosomal (Pursel et al. 1972). A nivel ultraestructural, la dilución y almacenamiento isotérmico (35°C) por 2 horas, en espermatozoides carneros, no provocó cambios significativos en el acrosoma, aunque si una pérdida de material mitocondrial en la pieza media. Pero en un medio hipotérmico (5°C) se observó hinchazón y vacuolización del acrosoma, formación de vesículas en la membrana acrosomal externa y pérdida de material mitocondrial. Además, aunque la refrigeración a 5°C por dos horas no afecta la tasa de preñez, un almacenamiento prolongado por 24 a 48 horas provocaría una caída dramática de la fertilidad (Jones y Martin 1973). Chen (2017) sostiene que el acrosoma es una estructura de gran importancia y cualquier daño estructural podría alterar una adecuada fecundación. En este estudio no hubo diferencias en la tasa de integridad acrosomal (CB+) aunque el porcentaje fue mayor en T2. Coomassie Blue tiene afinidad por las enzimas del acrosoma, mostrando una coloración intensa en un acrosoma íntegro; por lo que, probablemente el choque térmico en la dilución final a 5°C provocó vacuolización de acrosoma y mayor porcentaje de CB- en T2. El tiempo de 16 horas de refrigeración podría haber hecho evidente el descenso de la calidad espermática, que no se observaría en periodos cortos de 1 a 2 horas de otros estudios.
Contrario a este estudio, un estudio de almacenamiento de epidídimos bovinos a 5°C y 20°C por 6 horas mostró similares porcentajes de motilidad, vitalidad y anormalidades morfológicas; pero luego de la descongelación, la vitalidad fue mayor en 5°C y la funcionalidad de membrana fue mayor en 20°C (Valverde-Peralta et al. 2018) En toros Brangus se encontró un mayor vigor espermático al refrigerar semen diluido en yema de huevo a 5°C que a 15°C (Rodrigues y Valenzuela 2019) Aunque es importante valorar un procedimiento viable en condiciones de campo, este no debe comprometer la capacidad fecundante del espermatozoide luego de la conservación. La conservación de la capacidad fecundante del semen durante la dilución, refrigeración y congelación, es un factor esencial para garantizar el éxito en los procesos biotecnológicos como Inseminación Artificial, Multiovulación y transferencia de embriones, producción de embriones in vitro (Jones y Martin 1973). La refrigeración con una curva de descenso y medios adecuados puede conservar la calidad de los espermatozoides durante menos de 16 horas, debido a la menor actividad metabólica y menor tasa de crecimiento microbiano (Nichi et al. 2007, Ribeiro et al. 2014).
Se analizó el efecto del proceso de enfriamiento sobre la morfología espermática, pero no hubo diferencias en las mediciones de largo, ancho y área de cabeza ni longitud de cola, entre espermatozoides frescos y luego de la refrigeración. En la criopreservación de espermatozoides se debe controlar la temperatura de dilución, ya que se pueden generar consecuencias negativas durante el enfriamiento y la congelación. Los daños pueden causar anomalías en la cabeza, pieza media y cola del espermatozoide (El-Bahrawy et al. 2017, Gruhot et al. 2019). En este estudio se midieron dimensiones morfométricas de espermatozoides frescos y refrigerados a 5°C, lo que podría no haber sido un desafío suficiente para generación alteraciones en el tamaño de la cabeza. La criopreservación generó menor longitud, ancho, área y perímetro de cabeza de espermatozoides de carnero (Choquepuma et al. 2017), sin embargo, no modificó significativamente las dimensiones de espermatozoides caprinos (Hernandez-Corredor et al. 2021). Probablemente una mayor variación morfométrica sería observada luego de la descongelación de espermatozoides bovinos.
Conclusión
La dilución inicial y final a 34°C antes de la refrigeración y congelación de pajillas de semen, influye positivamente sobre la calidad seminal en toros de la raza Gyr; en cambio, la dilución inicial a 34°C y final a 5°C tiene impactos negativos en la vitalidad y funcionalidad de membrana plasmática.