Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de cardiología
versão On-line ISSN 1850-3748
Rev. argent. cardiol. vol.85 no.1 Ciudad Autónoma de Buenos Aires fev. 2017
CARTAS CIENTÍFICAS
Seudoaneurisma tardío gigante del tracto de salida del ventrículo izquierdo posterior a recambio valvular aórtico
Se presenta el caso de una paciente mujer de 52 años intervenida hace 9 años de recambio valvular aórtico con implante de prótesis mecánica valvular Carbome-dics N° 19, por endocarditis infecciosa sobre la válvula aórtica. Es derivada para realización de coronariografía por diagnóstico en ecocardiografía de control ambulatoria de seudoaneurisma gigante calcificado en el tracto de salida del ventrículo izquierdo y disfunción protésica aórtica. Arterias coronarias sin enfermedad angiográfica. Su caso es presentado en sesión médico-quirúrgica, donde se decide completar estudio con resonancia magnética cardíaca y tomografía cardíaca (Figura 1 A, B y D) para evaluación del abordaje quirúrgico y tomografía por emisión de positrones-tomografía cardíaca (Figura 1 C) para descartar proceso infeccioso activo. Tras la realización de dichos estudios complementarios, la paciente es aceptada para intervención quirúrgica cardíaca, que se lleva a cabo con favorable evolución clínica posterior.
El seudoaneurisma se define como una rotura de la pared miocárdica, contenida por adherencias o pared pericárdica. Se ha demostrado que durante las intervenciones quirúrgicas la utilización de la hipotermia puede incrementar la rigidez de las cánulas de circulación extracorpórea y las que están en contacto con el endocardio podrían generar daño en las paredes cardíacas por roce y pequeños traumatismos, generando con el paso del tiempo un seudoaneurisma a dicho nivel. (1)
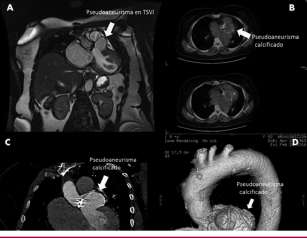
Fig. 1. A. Resonancia magnética nuclear cardíaca. Seudoaneurisma en el tracto de salida del ventrículo izquierdo (TSVI). B. Tomografía por emisión de positrones-tomografía computarizada cardíaca. Seudoaneurisma calcificado. Sin evidencia de infección macroscópica periprotésica. C. Tomografía computarizada cardíaca. Seudoaneu-risma calcificado. D. Tomografía computarizada cardíaca. Reconstrucción volumétrica. Seudoaneurisma calcificado en el tracto de salida del ventrículo izquierdo.
Las localizaciones más frecuentes de los seudoa-neurismas de la aorta ascendente son el sitio de la aortotomía, el de canulación aórtica, la anastomosis proximal de los injertos o trasplantes venosos y, con menor frecuencia, en las suturas aórticas postrasplante cardíaco y en endocarditis infecciosa de las prótesis valvulares. El tiempo transcurrido desde la operación hasta la aparición de esta afección es muy variable, desde los primeros días de la cirugía hasta 10 a 20 años de realizada esta. Pueden llegar a crecer tanto como hasta convertirse en gigantes masas pulsátiles que provocan compresiones de la tráquea, los bronquios, de la vena cava superior y el tronco de la arteria pulmonar. (2)
Otra de las causas de la aparición de un seudoaneu-risma tardío son los traumatismos torácicos. Aproximadamente un 2% de los pacientes con un traumatismo de la aorta torácica que se trata de forma conservadora o con lesiones aórticas no diagnosticadas desarrollarán un seudoaneurisma tardío, y de estos, más del 90% se localizan a nivel del istmo aórtico. (3)
Katsumata y colaboradores publicaron en 1998 una serie de nueve seudoaneurismas tardíos, de los cuales dos se trataron de forma conservadora con buena evolución. (4) Aunque existen pequeñas series de casos como la previamente reseñada, consideramos que continúa siendo una patología de resolución quirúrgica y debe ser intervenida lo antes posible una vez diagnosticada, previa definición con las armas diagnósticas de imagen cardíaca que disponemos en la actualidad.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la web/ Material suplementario).
Javier Urmeneta Ulloa, Elena Rivero Fernández,
Isabel Molina Borao, Esther Sánchez-Insa,
Carmen Aured Guallar, Pilar Lapuente González
Departamento de Cardiología del Hospital Universitario
Miguel Servet. Zaragoza, España
Urmeneta Ulloa Javier - Tel. 0034665561807 - e-mail:
BIBLIOGRAFÍA
1. Laguna G, Echevarría JR, Fernández M. Left ventricular pseu-doaneurysm following thoracic aorta replacement. Rev Esp Cardiol 2015;68:340. http://doi.org/f2vzf3
2. Valdés Dupeyrón O, Céspedes Arias G, Mederos B, Pupo Suárez P. Pseudoaneurisma de la aorta ascendente después de sustitución valvular aórtica. Revista Electrónica de las Ciencias Médicas en Cienfuegos. Medisur 2010;8:66-8.
3. Hernando Rydings M, Martínez López I, González Sánchez S, Saíz Jerez A, Serrano FJ. Delayed pseudoaneurysm after thoracic aortic injury. Angiología 2012;64:247-9.
4. Katsumata T, Shinfeld A, Westaby S. Operation for chronic trau-matic aortic aneurysm: when and how? Ann Thorac Surg 1998;66:774-8. http://doi.org/d9wg8k
Válvula Sapien transapical sobre anillo mitral previo
La enfermedad mitral, fundamentalmente la insuficiencia, es la segunda enfermedad valvular más frecuente en nuestro medio. (1) La reparación mitral, que incluye una anuloplastia en la mayoría de los casos, es la intervención preferida cuando es posible. (2) La estabilidad de la reparación permite obtener resultados excelentes a largo plazo. (3) Cuando la insuficiencia mitral recidiva tras una reparación, la reoperación es la intervención estandarizada; sin embargo, en algunos casos esto puede suponer un riesgo no asumible. En caso de hipertensión pulmonar avanzada o disfunción ventricular derecha, algunos enfermos se consideran inoperables.
En estas circunstancias, el auge de las técnicas transcatéter proporciona una alternativa para estos pacientes. Los resultados en posición aórtica de los procedimientos valve-in-valve son prometedores. (4)
Del mismo modo, también existe experiencia de procedimientos valve-in-valve en posición mitral. (5)
Con todos estos ingredientes, existen series de casos limitadas de implantes de prótesis transcatéter sobre anillos mitrales. (6)
Desde 2007 hasta abril de 2016 se han implantado en nuestro centro más de 90 válvulas por vía tran-sapical. De estas, ocho casos fueron procedimientos valve-in-valve. Presentamos nuestra experiencia inicial en el implante de prótesis mitral transapical sobre un anillo mitral.
El presente caso es el de una mujer de 84 años, intervenida en 2002 de reparación mitral por enfermedad degenerativa mediante resección de prolapso del velo posterior y anuloplastia correctora. La paciente evolucionó de manera favorable durante los 10 primeros años hasta que progresivamente desarrolló una insuficiencia mitral que terminó condicionando empeoramiento de su clase funcional. En el momento de plantear la intervención, la insuficiencia mitral era grave con clara inversión del flujo en venas pulmonares. La paciente había desarrollado disfunción ventricular (FEVI 42%) y la hipertensión pulmonar pasó a ser grave con afectación del ventrículo derecho (TAPSE 13 mm) e insuficiencia tricuspídea. Debido a la afectación ventricular derecha, la edad y cierto grado de insuficiencia renal, se decidió realizar un procedimiento transcatéter.
El procedimiento se lleva a cabo en el laboratorio de hemodinámica mediante un equipo compuesto por cirugía cardiovascular, un hemodinamista y un anestesista. Tras la toracotomía anterior izquierda por el quinto espacio intercostal se diseca pericardio hasta acceder al ápex cardíaco. Se procede al implante a través de una doble bolsa de tabaco con puntos apoyados en teflón. Con ayuda de escopia y ecocardiográfica se consigue el paso de una guía flexible a través de la válvula mitral y posteriormente un catéter de coronaria derecha
permite el intercambio de la guía para obtener alto soporte mediante una guía alojada en la vena pulmonar (Figura 1). El anillo huésped era un Carpentier-Physio I del número 32 y su carácter semirrígido permitía albergar la esperanza de un implante circular de la prótesis transcatéter. El número de prótesis calculada era 29 Sapiens 3 (Edwards Lifesciences; Irvine, California, Estados Unidos). La altura del implante es un elemento crucial en estos casos y tras alinear mediante escopia el anillo mitral, y de manera ortogonal, se decide liberar la prótesis dejando el 50% a cada lado del anillo (véase Figura 1). El inflado progresivo permitió comprobar la ausencia de desplazamiento de la prótesis y finalmente la escopia y la ecografía demostraron nor-mofuncionamiento de la prótesis. La paciente presentó una evolución posoperatoria correcta y fue dada de alta sin insuficiencia mitral (Figura 2).
La reoperación es el tratamiento de elección para enfermos con insuficiencia mitral posanuloplastia. Sin embargo, el implante valve-in-ring parece una opción factible para enfermos de riesgo alto. La facilidad en el acceso transapical la convierte en una vía atractiva en estos casos.
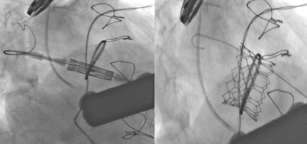
Fig. 1. Alineación de la prótesis con alojamiento de guía en vena pulmonar (izquierda). Escopia tras implante definitivo (derecha).

Fig. 2. Imagen ecocardiográfica tras el implante de la prótesis autoexpandible.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la web/ Material suplementario).
Cynthia J. Las, Gregorio Cuerpo Caballero,
Álvaro Pedras Prieto, Ángela Irabien Ortiz,
Susana Alonso Perarnau, Ángel González Pinto
Servicio de Cirugía Cardíaca. Hospital Universitario Gregorio Marañón. Madrid, España - e-mail: jahaveesina@hotmail.com
BIBLIOGRAFÍA
1. Nkomo V T, Gardin JM, Skelton TN, Gottdiener JS, Scott CG, Enriquez-Sarano M. Burden of valvular heart-disease. A population-based study. Lancet 2006;368:1005-11. http://doi.org/dhzdrf
2. Vahanian A, Alfieri O, Andreotti F, Antunes MJ, Barón-Esquivias G, Baumgartner H, et al. Guidelines for the management of valvular heart disease. Eur J Cardiothorac Surg 2012;42:1-44. http://doi.org/ bzbqtw
3. Ciarka A, Barun J, Delgado V, Versteegh M, Boersma E, Klautz R, et al. Predictors of mitral regurgitation recurrence in patients with heart failure undergoing mitral valve annuloplasty. Am J Cardiol 2010;106:395-401.
4. Webb JG, Wood DA, Ye J, Gurvitch R, Masson JB, Rodes-cabau J, et al. Transcatheter valve-in-valve implantation for failed bioprosthetic valves. Circulation 2010;121:1848-57. http://doi.org/bw5zrf
5. Roda J, Cuerpo G, Rodríguez-Abella H, Manuel Ruiz, Jaime Elizaga, González-Pinto A. Implante transapical de prótesis mitral sobre bioprótesis degenerada. Rev Esp Cardiol 2015;68:808-19.
6. Descoutures F, Himbert D, Maisano F, Casselman F, de Weger A, Bodea O, et al. First-in-man implantation of a transcatheter aortic valve in a mitral annuloplasty ring. Eur J Cardio-Thorac Surg 2013;44:e8-e15. http://doi.org/b2bp
Síndrome de Reel: una complicación poco frecuente en un paciente con implante reciente de marcapasos endocavitario
Se presenta el caso de un paciente varón de 61 años, con antecedentes de hipertensión arterial sistémica en tratamiento con enalapril, 10 mg cada 12 horas, dislipidémico, sedentario y con sobrepeso (IMC: 27) y un infarto agudo de miocardio de pared inferior en el año 2003, que ingresó a la guardia externa de nuestro hospital por síncope. El electrocardiograma (ECG) mostró un bloqueo AV de tercer grado, con un ritmo idioventricular a 35 latidos por minuto. Se le implantó un marcapasos definitivo Medtronic Adapta ADDD-R01 con sus respectivos catéter electrodo auricular Medtronic PJN4103433 y catéter electrodo ventricular Biotronik Selox ST 60 por vía venosa cefálica izquierda (ambos). El generador, luego de conectar los extremos proximales de los electrodos, fue ubicado en un bolsillo preformado en la región deltopectoral anterior izquierda. Las mediciones intraoperatorias revelaron umbrales de detección y estimulación auricular y ven-tricular adecuados. Dentro de las 24 horas después de la implantación del dispositivo, la radiografía de tórax mostró la posición anatómica apropiada de los catéteres electrodo y en el ECG no se advirtieron fallas de detección ni de estimulación en ambas cámaras.
El paciente concurrió a los 15 días para el control del marcapasos refiriendo mareos leves. Se objetivan evidencias telemétricas y electrocardiográficas de fallas de detección y de estimulación auricular y ventricular. En la radiografía de tórax se observó el desplazamiento del catéter electrodo auricular hacia la vena subclavia y tracción del catéter ventricular hacia la AD (Figura 1). El paciente presentaba por ECG un bloqueo auriculo-ventricular de tercer grado con un escape ventricular a 55 latidos por minuto, lo que le producía síntomas (mareos). Se indicó la exploración quirúrgica para la recolocación de ambos catéteres. Dado que el ritmo cardíaco del paciente era dependiente de la estimulación ventricular, y estaba sintomático por momentos, se le colocó un catéter de marcapasos transitorio por vía yugular derecha como puente a la recolocación de los electrodos en su sitio. La radiografía de tórax mostró la rotación del generador del marcapasos sobre el propio eje transversal con los catéteres auricular y ventricular enrollados a su alrededor (síndrome de Reel) (véase Figura 1).
Se realizó la exploración quirúrgica del bolsillo y se recolocaron ambos catéteres, procediéndose a fijar el generador del marcapasos a la fascia del músculo pectoral. El paciente evolucionó sin nuevas complicaciones luego de 6 meses de seguimiento.
Nos parece importante, y además por considerarlo de utilidad, un repaso sobre la ordenación terminológica sobre macrodislocación de electrodos de marcapasos endocavitarios, que quedaría distribuida de la siguiente manera y se esquematiza en la Figura 2:
Síndrome de Twiddler: Retracción y dislocación de electrodos debida a la rotación del generador del dispositivo alrededor del eje definido por el electrodo. Aunque la manipulación externa por el paciente puede facilitar que se produzca, esta no sería una condición necesaria. Debido al movimiento de giro del generador, el electrodo se enrollaría como una trenza, lo que permite observar un aspecto característico y definitorio.
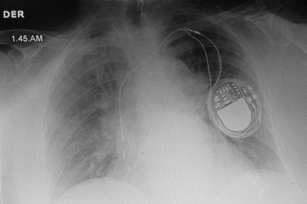
Fig. 1. Radiografía de tórax que muestra el desplazamiento del catéter auricular y la tracción del catéter ventricular. También se observa la rotación del generador sobre su eje transversal y el enrollamiento de los catéteres alrededor (síndrome de Reel).
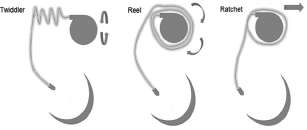
Fig. 2. Esquema de cada uno de los mecanismos de macrodisloca-ción de electrodos.
Síndrome de Reel: Es el que ocupa nuestro caso y se caracteriza por una retracción y dislocación de electrodos debidas a la rotación del generador sobre su eje sagital, lo que ocasiona que el electrodo se enrolle como un carrete o "yo-yo" encima, debajo o alrededor del generador. Debido al mecanismo operante tanto en el síndrome de Twiddler como en el de Reel, deberían verse afectados todos los electrodos en mayor o menor medida, en caso de que haya varios.
Síndrome de Ratchet: Retracción y dislocación de electrodos ocasionada por el desplazamiento progresivo de los electrodos por sus piezas fijadoras o sus protecciones, facilitado por los movimientos del brazo homolateral y debido a una fijación no completa del electrodo con el protector, pero sin que haya rotación del generador sobre alguno de sus ejes. En este caso podrían afectarse todos los electrodos de un sistema en un paciente o, lo que puede ser más frecuente, que solo se afecte alguno de los electrodos con posición absolutamente normal de otros, algo que puede resultar clave a la hora de identificar el síndrome de Ratchet y su diferenciación de los otros dos síndromes de ma-crodislocación de electrodos. (1)
El resultado final del caso que nos ocupa y de los demás descriptos es el desplazamiento de los catéteres electrodo y la pérdida de la estimulación auricular y/o ventricular. Pueden causar síntomas diversos, entre ellos mareos, síncope o presíncope, e incluso constituir una amenaza para la vida de pacientes cuyo ritmo cardíaco es absolutamente dependiente de la estimulación del marcapasos.
El síndrome de Reel es una entidad muy poco frecuente. Al igual que el síndrome de Twiddler, se debe a mecanismos similares, pero no idénticos, y se presta fácilmente a confusión. La diferencia radica en el eje de la rotación del marcapasos: cuando la rotación se produce en el eje longitudinal, se describe como "Twiddler" y cuando ocurre en el eje transversal se denomina "Reel". El primer mecanismo genera desplazamiento y/o fractura de los catéteres electrodo; el segundo, por su parte, solo suele producir el desplazamiento de esos elementos. El síndrome de Ratchet es algo más frecuen-
te. El género femenino, un "bolsillo" del marcapasos grande, la obesidad o la abundancia de tejido adiposo subcutáneo y la manipulación voluntaria o involuntaria del "bolsillo" del marcapasos son factores contribuyentes. (2, 3) Se trata de una entidad de fácil diagnóstico por radiografía de tórax, en la cual se observa que los catéteres desplazados se enrollan alrededor del generador del marcapasos. (4) En nuestro caso, la falta de fijación del dispositivo a los tejidos adyacentes, que no se practica con frecuencia en nuestro servicio, sumado a la manipulación confesa del dispositivo por parte del paciente, desempeñó un rol decisivo en la generación de este síndrome. Es posible que mediante la fijación del catéter y el generador a la fascia muscular con un punto de sutura y la realización de un "bolsillo" pequeño pueda prevenirse este fenómeno.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la web/ Material suplementario).
Martín N. Calvelo, Roberto F. Marrero Mederos,
Matías Macedo Valls, Rodolfo G. Pivetta,
Ricardo Fernández Alegría, José M. Puccio Widobro
Sección Electrofisiología. Unidad Cardiovascular. Complejo
Hospitalario "San José". Santiago de Chile, Chile
Martín N. Calvelo - Suecia 151 1109 - (7510114) Santiago de
Chile, Chile - e-mail: martincalvelo@hotmail.com -
Tel. +56 987361394
BIBLIOGRAFÍA
1. Arias MA, Pachón M, Puchol A, Jiménez-López J, Rodríguez-Picón B, Rodríguez-Padial L. Ordenación terminológica sobre macrodislocación de electrodos de dispositivos cardíacos electrónicos implantables. Rev Esp Cardiol 2012;65:671-3. http://doi.org/fx2tbc
2. Aliyev F, Çeliker C, Türkoğlu C, Turhan FN. Early development of pacemaker Reel syndrome in an elderly patient with cognitive impairment. Turk Kardiyol Dern Ars 2009;37:488-9.
3. Vural A, Agacdiken A, Ural D, Komsuoglu B. Reel syndrome and pulsatile liver in a patient with a two-chamber pacemaker. Jpn Heart J 2004;45:1037-42. http://doi.org/dtzwzg
4. Gallino S, Di Toro D, Hadid C, López C, Duce E, Fernández A y cols. Síndrome de Reel: una variante infrecuente de síndrome de Twid-dler como complicación en un paciente con marcapasos bicameral. SADEC 2010;4:126-7.
Manejo de la rotura coronaria y sus complicaciones durante la angioplastia en una paciente portadora de lupus eritematoso sistémico
La rotura de una arteria coronaria constituye una de las complicaciones más graves que pueden ocurrir durante una angioplastia transluminal coronaria percutánea (ATCP). La incidencia es baja y varía en función de las características de las lesiones, del tipo de procedimiento realizado y de la historia clínica del paciente. Se puede presentar con diversos grados de gravedad, siendo la rotura coronaria (RC) abierta a pericardio la más complicada, ya que produce un hemopericardio de rápida instalación que evoluciona al taponamiento cardíaco (TC) y, en ciertos casos, a la necesidad de pericardiocentesis de emergencia. Por otro lado, el lupus eritematoso sistémico (LES) es una enfermedad inflamatoria multisistémica que afecta a las arterias coronarias por aumento de enfermedad aterosclérotica, predisposición al desarrollo de arteritis y trombosis coronaria.
Se presenta el caso de una paciente con antecedentes de LES que debió ser sometida a una angioplastia de urgencia por infarto de miocardio sin elevación del segmento ST (IAMSEST), durante la cual se produjo la RC con evolución al TC, que requirió drenaje.
Paciente de sexo femenino de 45 años con antecedentes de hipertensión arterial (HTA) no tratada, LES con abandono de medicación hace 9 años y angina progresiva de un mes de evolución. Consulta a la guardia por episodio de dolor precordial urente, de intensidad 8/10 que inicia en clase funcional (CF) II y persiste en CF I V, de media hora de duración, acontecido 12 horas antes de la consulta. Al ingreso se encontraba hemodi-námicamente estable, con registro de tensión arterial elevada (160/90), asintomática para angor y disnea. El electrocardiograma evidenció ritmo sinusal a 80 lpm, T negativas de V1-V6. El dosaje de troponina tuvo un valor positivo de 0,11 µg/ml.
Se inició tratamiento médico completo. Por recu-rrencia anginosa se realizó una cinecoronariografía que a nivel de la arteria descendente anterior (DA) evidenció una obstrucción crítica, segmentaria, con compromiso del tercio proximal y medio (Figura 1 A y B) y una obstrucción moderada en el tercio medio de la arteria circunfleja (Cx) y la arteria coronaria derecha (CD), sin obstrucciones angiográficamente significativas.
Debido a estos hallazgos se realizó angioplastia en la arteria DA con implante de dos stents liberadores de fármacos de 3,0 × 22 mm y 3,5 × 26 mm en superposición (Figura 1 C y D). En angiografía de control se evidenció fuga dinámica de contraste hacia el pericardio (Figura 1 E). Se decidió en primera instancia reversión de heparina con protamina y paralelamente insuflaciones de un minuto y medio de duración a intervalos de dos minutos con balón de 3,5 × 26 mm sobre el sitio de rotura. A continuación se implantó un stent forrado (MGuard) de 3,5 × 23 mm, lográndose el cese de la pérdida del material de contraste (Figura 1 F, G y H). Al finalizar el procedimiento se realizó un ecocardiograma transtorácico, que evidenció derrame pericárdico (DP) leve, por lo que se decidió su pase a unidad coronaria con disminución progresiva del dolor.
Tres horas más tarde intercurrió con inestabilidad hemodinámica y requerimiento progresivo de inotró-picos asociado con signos clínicos de TC. Se realizó un nuevo ecocardiograma, que evidenció un aumento del DP con respecto al estudio previo. Se procedió a realizar una nueva cinecoronariografía, que mostró a ambos stents previamente implantados permeables con nueva imagen compatible con fuga de contraste a nivel distal del stent implantado en el tercio medio (Figura 2 A). Se implanta nuevo stent MGuard a 12 atm sobre el sitio de rotura, lográndose la interrupción de fuga de contraste (Figura 2 B y C). Por último se realizó pericardiocentesis con drenaje de 170 ml de líquido he-mático con normalización de la tensión arterial hasta el cierre completo, e inotrópicos, con evolución favorable.
La RC es una complicación infrecuente del intervencionismo percutáneo, con una incidencia reportada que oscila entre el 0,1% y el 3%. (1)
La clasificación más utilizada es la de Ellis (2):
Tipo I: Cavidad extraluminal sin extravasación de contraste.
Tipo II: Infiltración miocárdica o pericárdica sin jet de extravasación.
Tipo III: Extravasación de contraste a través de un jet claramente visible (> 1 mm).
Si bien las roturas pueden cursar de manera asin-tomática, en ocasiones pueden evolucionar al TC, el infarto de miocardio, las arritmias malignas y, ocasionalmente, la muerte. La aparición de un DP precoz se asocia con un peor pronóstico, puesto que un tercio de estos pacientes requieren cirugía de emergencia, ya sea porque la pericardiocentesis es ineficaz o porque es preciso reparar el daño arterial.
Los predictores de RC se pueden clasificar arbitrariamente en angiográficos y clínicos. Dentro de los primeros se incluyen las lesiones con abundante contenido cálcico, las arterias tortuosas y las oclusiones crónicas. En relación con los factores clínicos predisponentes, se han encontrado asociaciones con las mujeres, los pacientes añosos, los hipertensos, los diabéticos y los pacientes que se presentan con IAMSEST. (3)

Fig. 2. A. Proyección oblicua derecha, donde se observa nueva fuga de contraste. B. Implante de stent Mguard. C. Proyección oblicua derecha. Angiografía de control que evidencia la ausencia de fuga de contraste.
En los pacientes portadores de LES (enfermedad inflamatoria multisistémica que se asocia con producción de autoanticuerpos con depósito de inmunocomplejos y múltiples anomalías de laboratorio y manifestaciones clínicas), la afectación cardíaca es frecuente y es una causa importante de morbimortalidad. Las causas postuladas de esta asociación son el desarrollo de una aterosclerosis precoz (acelerada probablemente por la administración de corticoides), la coagulopatía, especialmente en relación con los anticuerpos anti-fosfolípidos, los aneurismas coronarios y la vasculitis. La arteritis coronaria, causa de isquemia cardíaca, se produce de manera muy infrecuente en los pacientes con LES y es difícil de diagnosticar con certeza, a menos que se realice un examen anatomopatológico. El estudio histológico de las arterias coronarias en pacientes con LES revela la presencia de proliferación celular a nivel de la íntima y obstrucción focal o difusa por material fibroso presente en la capa media. No está claro si estos hallazgos corresponden a secuelas de arteritis o de trombosis, ya sea primaria (como consecuencia de la presencia del anticoagulante lúpico o de los anticuerpos antifosfolípidos), o secundaria (debida a la agregación de plaquetas y neutrófilos en el lumen de estos vasos). (4, 5) Un estudio experimental evidenció que un mayor contenido fibroso en la placa de aterosclerosis sometida a la compresión con balón provoca mayor cantidad de fisuras horizontales en la pared de la placa y mayor predisposición a la rotura de la pared del vaso. (6) En este sentido se podría proponer que un aumento del componente fibroso en la placa de aterosclerosis en pacientes portadores de LES se relacione de manera directa con un aumento de la tasa de RC durante la angioplastia.
La evolución intrahospitalaria de la perforación se encuentra relacionada con el grado de RC, el desarrollo de TC y la necesidad de efectuar una intervención quirúrgica de emergencia. La perforación tipo III se asocia con una incidencia alta de complicaciones y presenta una elevada mortalidad, que oscila entre el 25% y el 40% según las distintas series. (1)
El tratamiento en primera instancia consiste en sellar la perforación mediante el empleo de un balón inflado en el sitio de la rotura, previa reversión de la anticoagulación con protamina. Si la oclusión de la arteria es bien tolerada, se puede proceder a efectuar inflaciones prolongadas con las cuales, ocasionalmente, se podría controlar la perforación. Sin embargo, lo habitual es que se tenga que continuar con otras medidas, entre las cuales se propone: la embolización mediante el uso de coils, el implante de stents recubiertos o no con una capa impermeable de politetrafluoroetileno y el uso de stents recubiertos de malla polimérica porosa (Mguard), que se encuentran disponibles en múltiples diámetros y longitudes y con los que incluso se obtiene una navegación mejor que con los stent-graft. Sin embargo, es importante mencionar que su uso en situaciones de rotura se ha vinculado al desarrollo de reestenosis intrastent a los 9-12 meses, por lo cual deberían tener un seguimiento estricto en este aspecto.
En relación con el TC, tanto el diagnostico precoz como la resolución de la RC, son los elementos fundamentales para restaurar la estabilidad hemodinámica.
En nuestra paciente, la resolución se llevó a cabo mediante pericardiocentesis sin necesidad de recurrir a cirugía de revascularización luego de sellar la rotura.
La RC con salida de sangre hacia el pericardio puede llevar al colapso hemodinámico por TC, complicación infrecuente pero potencialmente mortal de la angioplastia con stent. Inferimos que en la paciente presentada fue influida en parte por el implante de un stent sobre una lesión con elevado componente fibroso, dados los antecedentes de la paciente. La complicación fue resuelta de manera exitosa mediante el implante de stents micromallados, lográndose sellar la rotura y con el drenaje pericárdico percutáneo. Resaltamos la importancia del control ecocardiográfico estricto posterior a esta complicación.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la web/ Material suplementario).
Patricio Rattagan, Agustín Girassolli, Javier Castro,
Gustavo Leiva, Pablo Pérez Baliño,
Miguel A. Payaslian
Unidad de Hemodinámica y Cardiología Intervencionista,
Servicio de Cardiología Hospital Juan A. Fernández - Cerviño 3356, 1° Piso -
Buenos Aires, Argentina Tel./Fax: 0054-911-5630-8455 - e-mail: prattagan@gmail.com
BIBLIOGRAFÍA
1. Javaid A, Buch AN, Satler L F. Management and outcomes of coro-nary artery perforation during percutaneous coronary intervention. Am J Cardiol 2006;98:911-4. http://doi.org/dfp5pv
2. Ellis SG, Ajluni S, Arnold AZ. Increased coronary perforation in the new device era. Incidence, classification, management, and outcome. Circulation 1994;90:2725-30. http://doi.org/bzj6
3. Shimony A, Zahger D, Van Straten M, Shalev A, Gilutz H, Ilia R, et al. Incidence, risk factors, management and outcomes of coronary artery perforation during percutaneous coronary intervention. Am J Cardiol 2009;104:1674-7. http://doi.org/d3mgnn
4. Bulkley BH, Roberts WC. The heart in systemic erythematosus and the changes induced by corticosteroid therapy. Am J Med 1975;58:243-64. http://doi.org/bqs3cj
5. Kumar V, Abbas A, Fausto N. Patología estructural y functional. Madrid: Elsevier; 2005.
6. Kaltenbach M, Gruentzig A, Rentrop K, Bussmarin WD. Translu-minal coronary angioplasty and intracoronary thrombolysis. Coronary Heart Disease I V. Berlin-New York: Springer-Verlag; 2012.
Rev Argent Gardiol 2017;85:54-57. http://dx.doi.org/10.7775/rac.es.v85. i1.9383
Hallazgo casual de trombo en tránsito en el ventrículo derecho
La detección de trombos móviles en el ventrículo derecho (VD) constituye un hecho poco frecuente y más cuando aún no se hayan documentado clínicamente eventos tromboembólicos. Este hallazgo es una emergencia médica que requiere tratamiento inmediato porque conlleva una mortalidad elevada.
Presentamos un caso en el que se detecta un trombo móvil en el VD en una paciente que consulta para evaluación de riesgo preoperatorio.
Paciente de sexo femenino, de 27 años, que consultó para evaluación de riesgo preoperatorio de cirugía estética. No refería síntomas; sin embargo, en el interrogatorio dirigido relataba fatiga e intolerancia a esfuerzos moderados en los últimos 3 meses, posteriormente a haber sido sometida a cirugía de esclerosis de várices de miembros inferiores. Como antecedente personal era tabaquista de 10 cigarrillos al día, y como medicación habitual utilizaba anticonceptivos orales (etinilestradiol asociado con drospirenona). Al examen físico presentaba frecuencia cardíaca de 80 latidos por minuto, tensión arterial de 120/80 mm Hg, saturación de oxígeno del 98%, sin hallazgos en la evaluación por sistemas excepto leve edema maleolar bilateral. El electrocardiograma evidenciaba ritmo sinusal con ondas T negativas de V3 a V6. Fue derivada al laboratorio de ecocardiografía Doppler, donde en un estudio transto-rácico (Figura 1) se encontró una masa compatible con trombo, de aspecto serpenteante, móvil, con anclaje en el aparato subvalvular tricuspídeo de 8 × 1,5 cm. El VD mostraba dilatación y deterioro de su función sis-tólica, evidenciándose en el análisis Doppler color una insuficiencia tricuspídea grave, estimando una presión sistólica pulmonar de 34 mm Hg. La ecografía Doppler venosa de miembros inferiores reveló signos a favor de una trombosis venosa subaguda del territorio poplíteo y del tronco tibioperoneo del lado derecho. Posteriormente, una tomografía computarizada de tórax con contraste intravenoso (Figura 2) demostró embolias centrales en ambas arterias pulmonares. El laboratorio al ingreso reveló valores normales de troponina T ultrasensible y elevados de propéptido natriurético cerebral N-terminal (NT-proBNP de 793 pg/ml). Se realizó estudio de hemofilia, el cual fue negativo en todas sus pruebas. La paciente fue hospitalizada, tratada inicialmente con heparina no fraccionada intravenosa a 18 UI/kg, y posteriormente con acenocumarol por vía oral buscando una razón internacional normatizada de entre 2 y 3. Fue dada de alta a los 7 días con buena evolución clínica, se mantuvo la anticoagulación por 6 meses, momento en el que fue suspendida, sin presentar nuevos episodios hasta la actualidad.
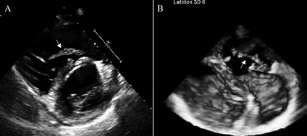
Fig. 1. A. Ecocardiograma transtorácico en vista paraesternal eje corto; se observa trombo flotante en un ventrículo derecho dilatado. B. Imagen en 3D en vivo del tracto de entrada del ventrículo derecho, donde puede observarse el trombo adherido al aparato subvalvular tricuspídeo (flecha).
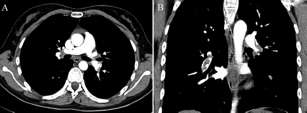
Fig. 2. Trombos en ambas arterias pulmonares (flechas), tanto en los cortes axiales (A) como coronales (B).
La incidencia de trombos móviles dentro de las cavidades derechas reportada en la literatura varía desde el 4% al 18% (1) y habitualmente se asocian con tromboembolia pulmonar (TEP). Su ubicación más frecuente es en la aurícula derecha (80%). Además, en ausencia de catéteres, fibrilación auricular o patología estructural cardíaca, casi invariablemente representan coágulos que viajan desde los miembros inferiores, con un riesgo elevado de mortalidad debido a la posibilidad de fragmentación y embolia pulmonar masiva. (2)
La morfología del trombo descripta en este caso se corresponde con trombos en tránsito desde los miembros inferiores, ya que los redondeados o laminares, adheridos a la pared cardíaca con una base de implantación ancha, e inmóviles, suelen deberse a dilatación de cavidades, estasis sanguínea o daño endotelial y son los que mejor pronóstico tienen con tratamiento de anticoagulación. (3)
Las recomendaciones de tratamiento incluyen anticoagulación, administración de agentes trombolíticos o eliminación mecánica del trombo a través de embolec-tomía percutánea o quirúrgica. (4) Pero a pesar de que la presencia de un trombo en las cavidades derechas en pacientes con estabilidad hemodinámica se considera una emergencia médica debido al riesgo de shock, no existe consenso sobre el tratamiento adecuado para estos pacientes.
En un análisis en 2002, Rose y colaboradores encontraron que los pacientes con tromboembolia en cavidades derechas que no recibieron tratamiento alguno tuvieron una mortalidad de 100%, en los sometidos a anticoagulación con heparina fue del 28,6%, en los tratados quirúrgicamente fue del 23,8% y en los que recibieron tratamiento trombolítico fue del 11,3%, una diferencia significativa respecto de las demás conductas. (5) De manera similar, Athappan y colaboradores reportaron que en 328 pacientes con trombos en cavidades derechas y TEP la mortalidad fue del 23,2%. Sin embargo, los que no recibieron ningún tratamiento tuvieron una tasa de decesos del 90,9%, mientras que aquellos que recibieron anticoagulación, embolectomía quirúrgica o trom-bolíticos tuvieron tasas del 37,1%, 18,3% y 13,9%, respectivamente. (6)
Nuestro caso se trataba de una paciente joven, en quien la presencia de un trombo flotante en cavidades derechas asociado con TEP submasiva fue un hallazgo casual, desconociéndose así el tiempo de evolución y el grado de organización del coágulo. Además, se encontraba estable hemodinámicamente y no se demostraron estado de hipercoagulabilidad ni comorbilidades subyacentes. Por ello se decidió administrar tratamiento anticoagulante con heparina no fraccionada y monitorización intensiva, obteniendo, como hemos descripto, resultados satisfactorios.
(Véanse formularios de conflicto de intereses de los autores en la web/ Material suplementario).
Matías H. Clavero, María L. Servato, Augusto J. Lépori, Julio O. Bono
Sanatorio Allende Nueva. Servicio de Cardiología.
Departamento de Ecocardiografía Doppler Córdoba - Obispo
Oro 42 - 2° Piso - (X5000BFB) Córdoba (Capital), Argentina
- e-mail: ajl087@gmail.com - Tel: 00543513190090
BIBLIOGRAFÍA
1. Torbicki A, Galié N, Covezzoli A, Rossi E, De Rosa M, Goldhaber SZ. Right heart thrombi in pulmonary embolism: results from the International Cooperative Pulmonary Embolism Registry. J Am Coll Cardiol 2003;41:2245-51. http://doi.org/fv84q7
2. Naeem K. Floating thrombus in the right heart associated with pulmonary embolism: The role of echocardiography. Pakistan J Med Sci 2016;31:233-5.
3. Wittlich N, Erbel R, Eichler A, Schuster S, Jakob H, Iversen S, et al. Detection of central pulmonary artery thromboemboli by trans-esophageal echocardiography in patients with severe pulmonary embolism. J Am Soc Echocardiogr 2016;5:515-24. http://doi.org/b2bq
4. Jaff MR, McMurtry MS, Archer SL, Cushman M, Goldenberg N, Goldhaber SZ, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation 2011;123:1788-830. http://doi.org/fgnx8w
5. Rose PS, Punjabi NM, Pearse DB. Treatment of right heart throm-boemboli. Chest 2002;121:806-14. http://doi.org/fhpmng
6. Athappan G, Sengodan P, Chacko P, Gandhi S. Comparative ef-ficacy of different modalities for treatment of right heart thrombi in transit: a pooled analysis. Vasc Med 2015;20:131-8. http://doi.org/b2br
Rev Argent Gardiol 2017;85:57-58. http://dx.doi.org/10.7775/rac.es.v85. i1.8959
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.














