INTRODUCCIÓN
La disfunción diastólica (DD) del ventrículo izquierdo (VI) es un predictor independiente de mortalidad de todas las causas en la población general, aun en los estadios preclínicos. 1) (2 En pacientes con estenosis aórtica (EAo) grave se ha propuesto una clasificación en estadios de daño anatómico y funcional para evaluar la repercusión en las cámaras cardíacas de la valvulopatía. 3 Dicha clasificación se basa en el concepto de que el aumento de la poscarga secundaria a la EAo ocasiona disfunción del VI (estadio 1) que progresa al daño miocárdico del VI y posteriormente del ventrículo derecho (estadio 4). En el estadio 1 la DD se cuantifica con una relación E/e´mayor de 14, indicando aumento de las presiones diastólicas en VI en reposo, que se transmiten a la aurícula izquierda (AI) con la consiguiente dilatación (estadio 2), y luego al capilar pulmonar, ocasionando hipertensión pulmonar (estadio 3) y posteriormente disfunción del ventrículo derecho (estadio 4). El aumento de la relación E/e´ es uno de los parámetros que se utilizan para clasificar la DD juntamente con el flujo mitral, la presión sistólica de la arteria pulmonar y el índice de volumen de AI (IVAI) >34 ml/m2 de acuerdo con las Guías de la ASE/EACVI. 4 La función de la AI se caracteriza por una fase de reservorio durante la sístole ventricular y una fase de conducción y otra de contracción auricular durante la diástole del VI. 5), (6 Hay interacción entre el VI y la AI en cada una de las fases de la AI. La fase de reservorio está determinada por la relajación y complacencia de la AI, la presión sistólica del ventrículo derecho transmitida a la circulación pulmonar y la función sistólica longitudinal del VI representada por el descenso del plano auriculoventricular, el cual debido al flujo desde las venas pulmonares, ocasiona un progresivo aumento del volumen de la AI hasta llegar al volumen máximo (Mx) (Figura 1). La fase de conducción comienza con la apertura de la válvula mitral, luego de la cual la sangre acumulada en la AI ingresa al VI, y está influenciada por la relajación y la complacencia ventricular. La fase de contracción auricular depende del nivel inotrópico de la AI, de la presión de fin de diástole del VI y de la complacencia ventricular, luego de la cual la AI llega a su volumen mínimo (Mn) (Figura 1). En la Figura 2 puede observarse que el volumen de sangre que aporta la AI, determinado por la diferencia entre el volumen Mx y Mn (42 ml) es menor que el volumen que llena el VI, el cual es igual al volumen que eyecta, o sea el volumen sistólico (VS) (60 ml). En individuos normales, la contribución del volumen auricular (fase de conducción y contracción auricular) al VS es de aproximadamente 60-70%, y el resto es completado por el volumen conducido (VC), definido como el volumen de sangre que pasa desde las venas pulmonares al VI durante el lleno pasivo, sin producir cambios en el volumen auricular. 7), (8), (9), (10 En la DD del VI, a medida que las presiones de lleno ventricular aumentan y se acercan al límite de reserva de la precarga, la AI dilatada se comporta predominantemente como un conducto con disminución de las fases de reservorio, conducción y de contracción, con el consiguiente aumento del VC. En los estadios avanzados de DD, el volumen de lleno del VI (equivalente al VS) es completado en su mayor parte por el VC y el resto, por el volumen aportado por la AI (Mx-Mn). La EAo grave se caracteriza por DD en los estadios iniciales y disfunción de la AI en los estadios más avanzados.
El objetivo del presente estudio fue analizar el rol del VC como mecanismo compensador de la disfunción de la AI para completar el lleno del VI en la EAo grave.
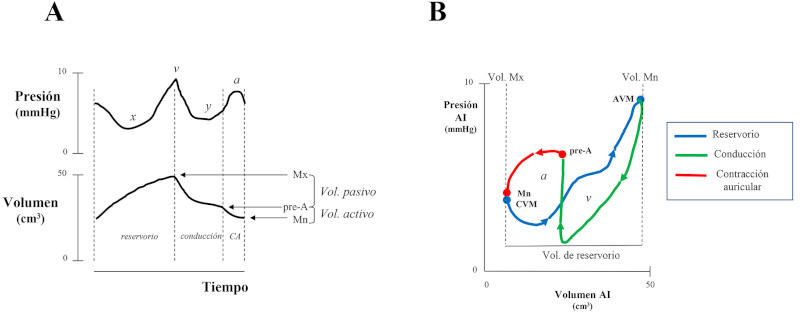
Fig. 1: A. Esquema de la curva de presión y de volumen de la aurícula izquierda (AI) en función del tiempo durante las fases de reservorio, conducción y contracción auricular (CA). Mx: volumen máximo de la AI Mn: volumen mínimo de la AI. B. Bucle presión - volumen de la AI con la porción “a” y la “v” mostrando las fases con diferentes colores. CVM: cierre valvular mitral, AVM: apertura de la válvula mitral.
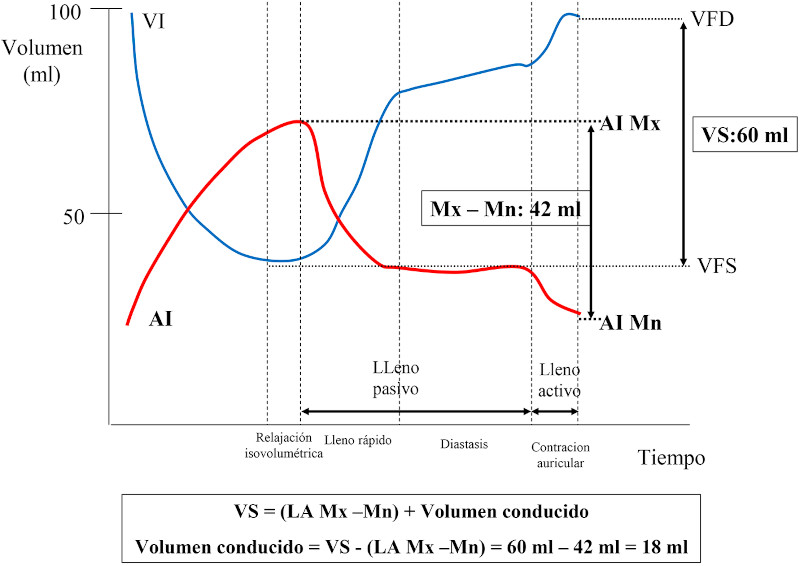
Fig. 2 Curvas de presión del ventrículo izquierdo (VI) y au rícula izquierda (AI) en función del tiempo, mostrando las fases del lleno diastólico ventricular. Mx -Mn es el volumen que aporta la AI (42 ml) al llenado del VI (60 ml). El volumen conducido (VC) es lo que com pleta el llenado del VI (18 ml), calculándose de acuerdo con la fórmula que se detalla en la figura. VFD: volumen de fin de diástole de VI, VFS: volumen de fin de sístole del VI, VS: volumen sistólico del VI, el cual es igual al volumen de llenado del VI.
MATERIAL Y MÉTODOS
Se estudiaron prospectivamente 210 pacientes (pac.), edad 69 ± 11 años, 48% mujeres, con EAo grave (índice de área valvular 0.37 ± 0.12 cm2/m2) con eco-Doppler cardíaco. El protocolo fue aprobado por el Comité de Docencia e Investigación del Hospital. Fueron excluidos los pacientes que presentaban calcificación del anillo mitral significativa, insuficiencia aórtica o mitral de grado moderado o grave Se consideró antecedente de hipertensión arterial a la necesidad de haber indicado tratamiento antihipertensivo previamente y de cardiopatía isquémica si el paciente había presentado uno o más de los siguientes criterios: 1) antecedentes de infarto agudo de miocardio angioplastia o cirugía de revascularización, 2) obstrucciones mayores del 50% en las arterias coronarias determinadas por angiografía y 3) acinesia en el ecocardiograma. A todos los pacientes se les efectuó ecocardiograma Doppler completo, además de realizarse antes del mismo el interrogatorio para detectar la presencia de factores de riesgo coronario y síntomas, examen físico cardiovascular y medición de la tensión arterial.
Ecocardiograma y Doppler cardíaco: El estudio fue realizado con un ecocardiógrafo ESAOTE MyLab 40 con transductor de 2.5-3.5 MHz, con el paciente en decúbito lateral izquierdo, y la derivación DII del electrocardiograma como referencia. Las mediciones en modo M, ecocardiograma bidimensional, cálculo la fracción de acortamiento endocárdica (FAe) de VI, espesor parietal relativo (EPR), volumen de fin de diástole (VFD) (método de Simpson), volumen de fin de sístole (VFS) y fracciòn de eyecciòn ventricular izquierda (FEVI) se realizaron de acuerdo con los criterios de la ASE. 11 La masa del VI se calculó según la fórmula de Devereux 12 y el índice de masa (IM) como la masa normalizada a la superficie corporal.
Con Doppler continuo se registró la velocidad máxima transvalvular aórtica, el gradiente medio (GM) y la integral de la curva de flujo desde las vistas apical, paraesternal derecha, subxifoidea y supraesternal. Con Doppler pulsado se obtuvo el flujo en el tracto de salida del VI desde la vista de cinco cámaras. El cociente adimensional se estimó como el cociente entre la integral de flujo en el tracto de salida de VI y la integral de flujo Ao. Se calculó el área valvular aórtica (AVA) efectiva utilizando la ecuación de continuidad, el índice de AVA, la impedancia válvulo-arterial y el índice de pérdida de energía de acuerdo con la ASE.11 El VS se calculó como el producto del área del tracto de salida por la integral de flujo a dicho nivel, el índice de VS como el VS dividido por la superficie corporal y el flujo aórtico como el cociente entre el VS y el período eyectivo del VI. La FEVI se estimó por el método de Simpson biplano y el espesor parietal relativo (EPR) como 2 × pared posterior en diástole/diámetro diastólico de VI.
Se registró el flujo transmitral colocando el volumen de muestra del Doppler pulsado a nivel del borde libre de la válvula mitral en la vista de 4 cámaras para obtener la velocidad pico de la onda E y la onda A, con lo cual se calculó la relación E/A. 14 Posteriormente se registró el Doppler tisular pulsado del anillo mitral lateral y septal, se midió la velocidad pico de la onda e´ y se la consignó como el promedio de ambas para la determinación de la relación E/e´. 15 Se registró la velocidad pico del jet de insuficiencia tricúspidea con Doppler continuo para estimar la presión sistólica de la arteria pulmonar, adicionando la presión de la aurícula derecha estimada a través del diámetro y colapso de la vena cava inferior. En 48 pacientes se estimó el strain longitudinal con speckle tracking bidimensional utilizando el software provisto por el equipo desde las vistas apicales de cuatro, dos cámaras y eje largo apical. Se realizó un promedio de las 3 vistas debido a que la versión del programa disponible no calcula el strain global en forma automática.
Evaluación de la función auricular izquierda: El volumen Mx y Mn de la AI se obtuvo desde las vistas de cuatro y dos cámaras con el método de Simpson. La diferencia de ambos volúmenes (Mx-Mn) representa el volumen que aporta la AI al lleno del VI. El IVAI se calculó dividiendo el volumen Mx de AI por la SC. La fracción de vaciado de aurícula izquierda (FVAI) se estimó de acuerdo a la siguiente fórmula: FVAI = [(AI Mx-AI Mn)/AI Mx] × 100. Se calculó también el volumen conducido (VC) (Fig. 2), que es el volumen que se dirige desde las venas pulmonares hacia el VI sin ocasionar modificaciones en el volumen de la AI, y se lo expresó en valores absolutos y como porcentaje del VS (VC%): [(VS - (AI Mx-Mn)) /VS] × 100. El strain global pico de laAI se obtuvo con speckle tracking bidimensional en 48 pacientes; se utilizó el software del equipo para medir el strain global longitudinal del VI en cuatro cámaras, con optimización de la vista para obtener el mayor volumen Mx. Posteriormente se trazó el borde endocárdico de la AI con exclusión de la orejuela de la AI y las venas pulmonares, y se hicieron correcciones manuales en caso de ser necesarias. 16 Para cada parámetro evaluado se consideró el promedio de 3 mediciones consecutivas.
El grado de DD fue clasificado de acuerdo con las recomendaciones de la ASE/EACVI considerando la relación E/A, E/e´, presión sistólica de arteria pulmonar e IVAI.
Los pac. fueron divididos en 3 grupos: DD grado I (n = 98), DD grado II (n = 74) y DD grado III (n = 38).
Análisis estadístico: se realizó con el software Statistix 10. Las variables continuas se expresaron como media ± desviación estándar. Para la comparación de los grupos se utilizó el análisis de la varianza y para la correlación el cálculo del coeficiente r (Pearson). Como límite de significación se consideró una p < 0,05.
RESULTADOS
En la Tabla 1 se muestran los factores de riesgo cardiovascular, comorbilidades y síntomas de los pacientes estudiados. No hubo diferencias significativas en la edad y superficie corporal entre los tres grupos de DD. (Tabla 2) Comparando con los pacientes con DD I, el grupo DD III tuvo menor tensión arterial sistólica y diastólica. No hubo diferencias con respecto a la frecuencia cardíaca.
Tabla 1 Parámetros clínicos
| Factores de riesgo cardiovascular y comorbilidades (%) | |
| Enfermedad coronaria | 25 |
| Infarto de miocardio previo | 10 |
| Hipertensión arterial | 61 |
| Diabetes | 17 |
| Dislipemia | 32 |
| Tabaquismo | 28 |
| Obesidad (IMC > 30 Kg/m2) | 23 |
| Enfermedad pulmonar obstructiva crónica | 4 |
| Síntomas (%) | |
| Ángor | 15 |
| Síncope | 3 |
| Disnea I-II | 28 |
| Disnea III-IV | 50 |
IMC: índice de masa corporal
Tabla 2 Parámetros ecocardiográficos del ventrículo izquierdo y la válvula aórtica
| Todos los pacientes | DD I | DD II | DD III | |
|---|---|---|---|---|
| n = 210 | n = 98 | n = 74 | n = 38 | |
| Edad (años) | 68 ± 12 | 69 ± 11 | 66 ± 13 | 71 ± 9 |
| Superficie corporal (m2) | 1,83 ± 0,20 | 1,81 ± 0,17 | 1,87 ± 0,23 | 1,78 ± 0,19 |
| Tensión arterial sistólica (mmHg) | 129 ± 23 | 133 ± 21^ | 129 ± 27 | 120 ± 19 |
| Tensión arterial diastólica (mmHg) | 75 ± 13 | 77 ± 11 ^ | 75 ± 14 | 67 ± 11 |
| Frecuencia cardíaca (latidos por minuto) | 69 ± 11 | 69 ± 10 | 69 ± 13 | 72 ± 11 |
| Función sistólica del VI | ||||
| Diámetro diastólico VI (cm) | 5,3 ±0,84 | 5 ± 0,74*∆ | 5,4 ± 0,71* | 6,2 ± 0,79 |
| Diámetro sistólico VI (cm) | 3,6 ± 1 | 3,2 ± 0,82*∆ | 3,7 ± 0,91* | 4,8 ± 1 |
| Fracción de acortamiento (%) | 33 ± 10 | 36 ± 9 * | 33 ± 10 * | 22 ± 9 |
| Espesor pared posterior diastólico (cm) | 1,2 ± 0,19 | 1,2 ± 0,18 | 1,4 ± 0,20 | 1,2 ± 0,20 |
| Espesor septum interventricular diastólico (cm) | 1,3 ± 0,22 | 1,4 ± 0,18 | 1,4 ± 0,25 | 1,2 ± 0,27 |
| Espesor parietal relativo | 0,48 ± 0,11 | 0,52 ± 0,11*∆ | 0,46 ± 0,09^ | 0,39 ± 0,10 |
| Índice de masa (gr/m2) | 162 ± 45 | 149 ± 41 * ∆ | 167 ± 49 π | 189 ± 38 |
| Fracción de eyección VI (%) | 55 ± 18 | 62 ± 14 * ∆ | 53 ± 17 * | 33 ± 14 |
| Volumen sistólico VI (ml) | 64 ± 19 | 64 ± 19 ^ | 67 ± 20 ^ | 53 ± 19 |
| Índice de volumen sistólico (ml/m2) | 35 ± 11 | 35 ± 10 π | 36 ± 11π | 30 ± 10 |
| Flujo aórtico (ml/seg) | 188 ± 49 | 190 ± 45 π | 195 ± 50 π | 164 ± 51 |
| Strain global VI (%) | - 14 ± 5 | -16 ± 3 * ∆ | - 14 ± 5 * | - 8 ± 2 |
| Estenosis aórtica | ||||
| Velocidad pico Ao (m/seg) | 4,1 ± 0,9 | 4,15 ± 0,9π | 4,24 ± 0,9^ | 3,7 ± 0,9 |
| Gradiente medio Ao (mmHg) | 42 ± 19 | 42 ± 19 | 44± 19 π | 34 ± 19 |
| Cociente adimensional | 0,21 ± 0,06 | 0,21 ± 0,06 | 0,21 ± 0,06 | 0,19 ± 0,07 |
| Área valvular aórtica (cm2) | 0,68 ± 0,20 | 0,68 ± 0,21 | 0,68 ± 0,20 | 0,65 ± 0,20 |
| Índice de área valvular aórtica (cm2/m2) | 0,37 ± 0,12 | 0,38 ± 0,12 | 0,37 ± 0,11 | 0,37 ± 0,12 |
| Impedancia válvulo-arterial (mmHg/ml/m2 | 5 ± 1,5 | 5 ± 1,4 | 4,9 ± 1,5 | 5,7 ± 1,6 |
| Índice de pérdida de energía (cm2/m2) | 0,42 ± 0,15 | 0,43 ± 0,15 | 0,42 ±0,14 | 0,42 ± 0,15 |
| * p < 0,0001 vs DD III ∆ p < 0,01 vs DD II π p < 0,05 vs DD III ^p < 0,01 vs DD III | ||||
DD: disfunciòn diastòlica VI: ventrìculo izquierdo
Los valores se presentan como media ± desviación estándar
Función sistólica del VI: El diámetro diastólico y sistólico del VI se incrementó progresivamente desde el grupo con DD I hasta el grupo con DD III. (Tabla 2) La FAe estuvo significativamente disminuida en los pacientes con DD III. De acuerdo con el EPR y el IM, predominó la hipertrofia concéntrica en los pacientes con DD I y II, y la hipertrofia excéntrica en la DD III. La FEVI disminuyó significativamente desde el grupo DD I al DD III. Sin embargo, el VS, el índice de VS y el flujo aórtico estuvieron disminuidos solo en el grupo DD III, sin diferencias significativas entre los grupos DD I y DD II. El strain longitudinal del VI disminuyó desde la DD I a la DD III, con diferencia significativa entre los tres grupos.
Estenosis aórtica: la gravedad de la EAo fue similar en los tres grupos al considerar el cociente adimensional AVA, índice de AVA, impedancia válvulo-arterial e índice de pérdida de energía. La velocidad pico del flujo transvalvular aórtico y el GM fueron menores en los pacientes con DD III, en concordancia con el menor índice de VS y flujo aórtico en este grupo. (Tabla 2)
Función diastólica del VI: en la Tabla 3 se presentan los parámetros de función diastólica. De acuerdo con la división en tres grupos de DD propuestos por la
ASE/EACVI, la relación E/A y la relación E/e´ se incrementaron desde la DD I hasta la DD III. Lo inverso ocurrió con el tiempo de relajación isovolumétrica y el tiempo de desaceleración. Es de notar que la velocidad pico de la onda e´ del Doppler pulsado tisular estuvo disminuida, pero no varió significativamente entre los tres grupos. La presión sistólica de la arteria pulmonar aumentó significativamente desde el grupo DD I al DD III.
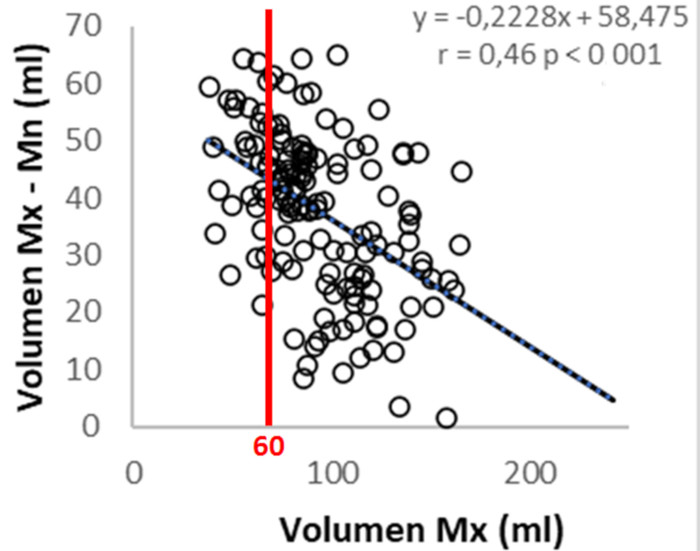
Función de la AI: (Tabla 3) El volumen Mx, el volumen Mn y el IVAI se incrementaron significativamente desde el grupo DD I al DD III. Sin embargo, la diferencia entre ambos volúmenes (Mx-Mn), o sea el volumen que aporta la AI al llenado del VI, estuvo disminuido en los pacientes con DD III. En la Figura 3 se representa la correlación negativa entre el volumen Mx y el volumen aportado por la AI al llenado ventricular (volumen Mx-Mn). Se puede observar que luego de los 60 ml, la dilatación de AI no puede compensar la disminución del volumen Mx -Mn, lo cual evidencia el mecanismo de Frank-Starling a nivel auricular, con fase de descompensación a la derecha de la línea de 60 ml. La FVAI disminuyó progresivamente desde el grupo DD I hasta el DD III, con diferencia significativa entre los tres grupos. El comportamiento del strain de la AI fue diferente, ya que se observó disminuido en los pacientes con DD III pero no hubo diferencias significativas entre los pacientes con DD I y DD II.
Tabla 3 Función diastólica del ventrículo izquierdo y función de la aurícula izquierda
| Todos los pacientes | DD I | DD II | DD III | |
|---|---|---|---|---|
| n = 210 | n = 98 | n = 74 | n = 38 | |
| Función diastólica de VI | ||||
| Velocidad pico onda E mitral (m/seg) | 0,82 ± 0,24 | 0,66 ± 0,16 # | 0,96 ± 0,20 | 1 ± 0,20 |
| Velocidad pico onda A mitral (m/seg) | 0,82 ± 0,24 | 1 ± 0,23 #´ | 0,77 ± 0,22 # | 0,35 ± 0,10 |
| Relación E/A flujo mitral | 1,25 ± 0,90 | 0,66 ± 0,13 # | 1,29 ± 0,31 # | 3 ± 0,80 |
| Tiempo de relajación isovolumétrica (mseg) | 82 ± 26 | 101 ± 19 #´ | 68 ± 18 * | 53 ± 10 |
| Tiempo de desaceleración (mseg) | 221 ± 96 | 278 ± 87 #´ | 187 ± 78 * | 125 ± 23 |
| Velocidad pico onda e´ tisular (cm/seg) | 5,4 ± 1,7 | 5,2 ±0,5 | 5,7 ± 1,8 | 5,3 ± 1,6 |
| Relación E/e´ | 15 ± 7 | 14 ± 7 ^Δ | 17 ± 7 | 18 ± 8 |
| Presión sistólica de arteria pulmonar (mmHg) | 49 ± 16 | 36 ± 7 #Δ | 48 ± 16 ^ | 60 ± 12 |
| Función de AI | ||||
| Volumen (ml) AI Mx | 98 ± 33 | 86 ± 34 #´ | 104 ± 29 Δ^ | 122 ± 25 |
| Volumen (ml) AI Mn | 65 ± 31 | 52 ± 29 #´ | 68 ± 25 Δ^ | 100 ± 23 |
| Volumen (ml) Mx - Mn | 35 ± 13 | 34 ± 11 ^ | 37 ± 14 ^ | 28 ± 12 |
| Fracción de vaciado de AI (%) | 36 ± 15 | 42 ± 11 #Δ | 36 ± 13 # | 16 ± 12 |
| Índice de volumen de AI (ml/m2) | 54 ± 17 | 47 ± 16 #Δ | 56 ± 15 # | 69 ± 14 |
| Volumen conducido (ml) | 24 ± 17 | 20 ± 13 # | 23 ± 18 # | 39 ± 19 |
| Volumen conducido % | 39 ± 23 | 33 ± 16 # | 36 ± 22 # | 65 ± 26 |
| Strain pico de AI (%) | 21 ± 9 | 23 ± 6 ^ | 22 ± 11 ^ | 13 ± 2 |
| ^ p < 0,01 vs DD III Δ p < 0,01 vs DD II # p < 0,0001 vs DD III * p < 0,001 vs DD III ´ p < 0,0001 vs DD II | ||||
DD: disfunción diastólica; VI: ventrículo izquierdo; AI: aurícula izquierda Los valores se presentan como media ± desviación estándar
Volumen conducido: el VC y el VC % se observó incrementado en forma significativa en el grupo DD III, sin diferencias entre DD I y DD II. (Tabla 3) El VC% se correlacionó negativamente con la FVAI (r = - 0,57, p < 0,0001) (Figura 4 A), el strain pico de AI (r = - 0,58, p < 0,001) (Figura 4 B) y positivamente con el grado de DD (r = 0,35 p < 0,001). La FEVI se correlacionó con la FVAI (r = 0,45, p < 0,01) (Figura 4 C) y el VC% (r = - 0,33, p < 0,001). En el grupo DD III el VS fue mantenido por el aumento del VC% a pesar de la significativa disminución de la FVAI y el strain pico de la AI. El strain del VI se correlaciono estrechamente con el strain de la AI (Figura 4 D). En la Figura 5 A y B se muestra cómo el volumen Mx y volumen Mn se incrementan a medida que progresa la DD, mientras que con la FVAI ocurre lo inverso. El strain de la AI tiene un comportamiento similar al volumen Mx - Mn, disminuye significativamente en el grupo DD III, pero no se modifica de DD I a DD II (Figura 5 A y B). El VC % compensa la disminución del volumen Mx- Mn (y del strain de AI) aumentando significativamente en DD III, completando de esa forma el llenado del VI, el cual quedaría incompleto si dependiera solo del volumen Mx - Mn (Figura 5 A y B). En la Figura 6 se representan las curvas de volumen de VI y AI, con la utilización como referencia de los volúmenes Mx, Mn, Mx-Mn, VFD, VFS y VS promedio para cada grupo de DD. En las barras se observa el porcentaje de composición del VS (similar al volumen de lleno ventricular) correspondiente al volumen aportado por la aurícula (Mx-Mn) y el VC. El volumen Mx-Mn disminuye desde el grupo DD I al III y lo inverso ocurre con el VC.
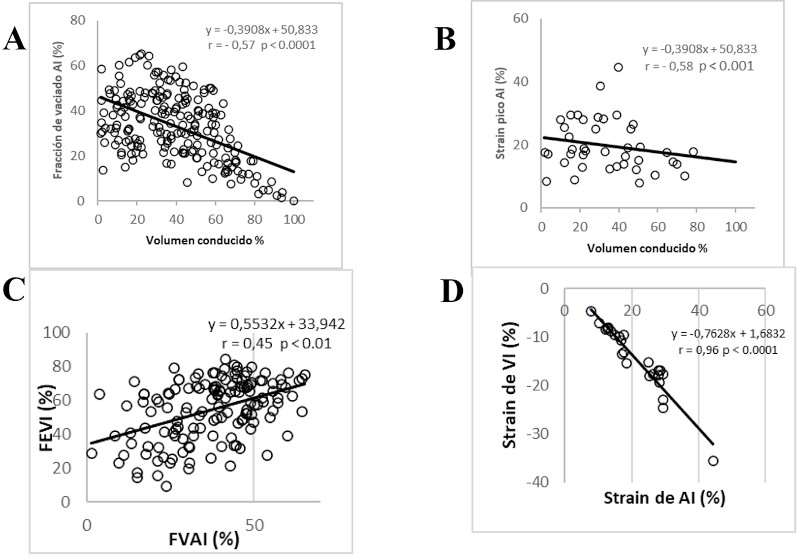
Fig. 4 A. Correlación entre la fracción de vaciado de AI y el volumen conducido. B.correlación entre el strain pico de AI y el volumen con ducido. C.Correlación entre la fracción de eyección del ventrículo izquierdo (FEVI) y la fracción de vaciado de la aurícula izquierda (FVAI). D.Correlación entre el strain de VI y el strain de AI.
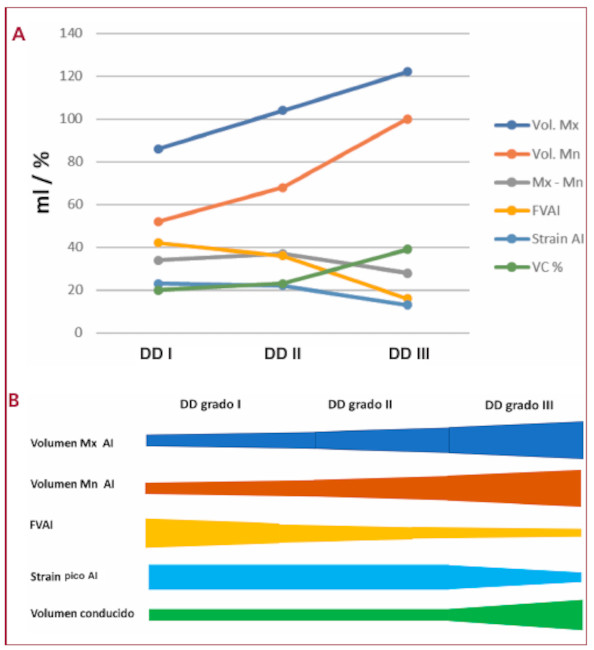
Fig. 5 A. y B. Explicación en el texto. FVAI: fracción de vaciado de la aurícula izquierda. VC: volumen conducido. DD: disfunción diastólica
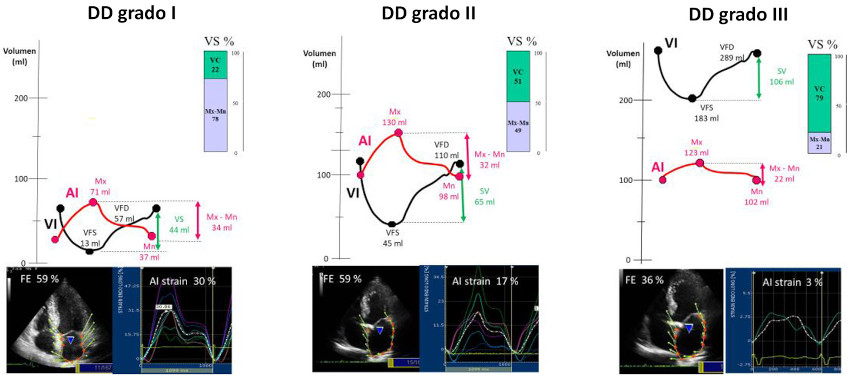
Fig. 6 Curvas de volumen de VI y AI para cada uno de los grupos de disfunción diastólica (DD). La barra que se observa en el extremo superior derecho de cada grupo de DD corresponde a la composición del VS. Puede observarse como a medida que progresa la DD, aumenta el porcentaje de volumen conducido (VC), que completa el VS. En la parte inferior se observan las curvas de strain auricular de los diferentes grupos. Las abreviaturas son similares a las figuras anteriores.
DISCUSIÓN
El principal hallazgo del presente trabajo es que en los pacientes con EAo grave que presentan disfunción diastólica severa (DD III) y disfunción de AI (FVAI y strain auricular disminuidos), el volumen de llenado diastólico ventricular está compuesto en su mayoría por el VC, que es el volumen de sangre que pasa desde las venas pulmonares hacia el VI, sin modificar el volumen de la AI. 10 El IVAI es la medición estándar que se efectúa en un estudio convencional con eco-Doppler, y es, junto con la relación E/A, E/e´ y la presión sistólica de la arteria pulmonar uno de los cuatro elementos para evaluar la función diastólica del VI. Además de las características estructurales de la AI que determinan su volumen Mx a partir del cual se estima el IVAI, la aurícula es una estructura dinámica que cambia de volumen durante todo el ciclo cardíaco, pudiendo evaluarse con el volumen Mn, la FVAI y el strain auricular. El volumen Mx refleja el aumento crónico de las presiones diastólicas y tiene implicancias pronósticas, pero no cambia significativamente cuando se normalizan las presiones diastólicas de la misma forma que la FVAI o el strain, 5 además de estar influenciado por la función longitudinal del VI a través del descenso del plano mitral. Por esta razón, se ha propuesto al volumen Mn como un mejor indicador de la función de la AI, ya que se produce al final de la diástole del VI, cuando está expuesto directamente a la presión de fin de diástole del VI. 17,18 El strain pico de la AI y el volumen Mx han demostrado correlacionarse con la determinación invasiva de las presiones diastólica del VI. 19 O’Connor y col. estudiaron el strain auricular en 52 pacientes con EAo y 20 individuos normales con Doppler tisular y hallaron disminución de la fase de reservorio, conducción y contracción que se correlacionaron con el tiempo de desaceleración del flujo mitral y la relación E/e´. 20 Meimoun y col. analizaron 102 pacientes con EAo moderada y grave en los cuales el strain de la AI y la distensibilidad auricular (parámetro similar a la FVAI pero utilizando Mn como denominador) se asociaron con disfunción del VI, gravedad de la estenosis e internación por insuficiencia cardíaca o muerte de cualquier causa. 10 De acuerdo con nuestros hallazgos, al progresar la DD aumentan el volumen Mx y el volumen Mn, pero con una disminución del volumen Mx - Mn y la FVAI (Figura 5 A y B), lo cual sugiere que el mecanismo de Frank-Starling a nivel auricular es “compensador” cuando la DD progresa de grado I a II, pero es “descompensador” cuando progresa de DD II a III. La FVAI y el strain de la AI disminuyeron 62% y 44% (considerando los valores promedios) al comparar el grupo DD I con DD III, mientras que el VS disminuyó solo un 17%, debido al incremento del VC% (Figura 5 A y B). El VC es un mecanismo compensador cuando el aumento de las presiones diastólicas ocasiona disfunción de AI evidenciado a través de la disminución de la FVAI y el strain auricular, 8 y debería ser tenido en cuenta en la evaluación de la DD. Sin embargo, este aspecto es citado rara vez en las revisiones sobre estructura y función de la AI o en las guías de evaluación de la función diastólica. La alta correlación entre el strain de VI y el strain de AI (r ═ -0.96) (Figura 4 D) se explicaría porque el VI y la AI comparten el anillo mitral, el cual es uno de los determinantes de la función longitudinal del VI y también de la AI. Por lo tanto, es esperable que todo VI con strain disminuido se acompañe también de strain de AI disminuido, y que sea el VC el que complete el llenado del VI para compensar la disfunción auricular.
CONCLUSIÓN
La disfunción de la AI expresada como la disminución de la FVAI y el strain pico de AI se correlaciona con un aumento de la contribución del VC al VS (VC%). En pacientes con EAo grave, a medida que la DD progresa, el VS es mantenido a expensas del incremento del VC como un mecanismo compensador de la disfunción de la AI.