RESUMEN
La evaluación de la anatomía y dinámica de la válvula mitral (VM) es esencial para comprender la valvulopatía y planificar intervenciones terapéuticas para disminuir la morbimortalidad de los pacientes. El ecocardiograma transtorácico (ETT) permite la evaluación estructural y funcional exhaustiva de la VM en tiempo real y, gracias a su reproducibilidad y disponibilidad casi universal, se ha convertido en la modalidad principal para evaluar la VM.
Debido a la naturaleza tomográfica del ETT, es necesario evaluar la VM ubicando el transductor en varias posiciones para lograr una evaluación anatómica y funcional completas. Las modalidades ecocardiográficas avanzadas, como la ecocardiografía transesofágica (ETE), suelen ser esenciales para determinar la etiología, el mecanismo y la gravedad de la valvulopatía mitral, así como para decidir el momento y el método de intervención adecuados. 1 Además, en las guías se ha propuesto que sería útil lograr una mayor expansión de esta técnica para facilitar la toma de decisiones quirúrgicas. 2
El uso de la ecocardiografía tridimensional (3D) permite rotar y visualizar las estructuras cardíacas desde cualquier perspectiva deseada, lo que evita suposiciones geométricas y, al mismo tiempo, aporta información anatómica y funcional. 1
Una amplia variedad de anomalías estructurales y diversas etiologías pueden afectar la VM. Debido a la estructura y fisiología complejas del aparato de la VM, suele ser difícil identificar los mecanismos que originan la valvulopatía mitral. Aunque se han desarrollado procedimientos percutáneos como tratamiento alternativo para determinados pacientes cuya anatomía es adecuada, la intervención quirúrgica sigue siendo el tratamiento esencial para la enfermedad de la VM nativa y las complicaciones asociadas a la prótesis. 3
En este trabajo presentamos una serie completa de casos de etiologías diferentes de la enfermedad de la VM nativa y protésica con el fin de describir la correlación entre la información clínica aportada por las distintas modalidades ecocardiográficas y los hallazgos anatómicos observados en el quirófano, y así presentar una “imagen completa” de la enfermedad, desde el transductor ecocardiográfico hasta el bisturí.
CASO 1: Valvulopatía mitral degenerativa
Una mujer de 50 años sin antecedentes médicos acudió al servicio de urgencias por un cuadro de disnea de una semana de evolución. Se sospechó de infarto de miocardio sin elevación del segmento ST , pero en la coronariografía realizada de urgencia no se observó enfermedad coronaria epicárdica significativa. Durante ese mismo procedimiento, en el cateterismo derecho se observó elevación de la presiones de lleno derecha e izquierda e insuficiencia mitral (IM) grave. Debido a la mala ventana acústica del ETT, se realizó un ETE.
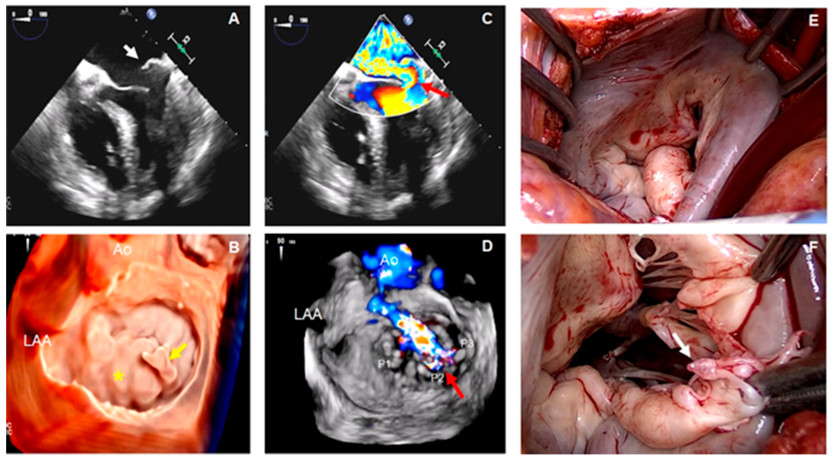
En una vista medioesofágica de 4 cámaras se observó que la valva posterior tenía un movimiento ondulante (flail) (Fig. 1A, flecha blanca). En una imagen ampliada D de la VM (vista frontal), se muestra el festón P2 con movimiento ondulante (flail) (Fig. 1B, flecha amarilla) asociado con cambios mixomatosos de los segmentos restantes (Fig. 1B, asterisco amarillo). En la ecografía Doppler color se observa la presencia de un excéntrico de IM grave dirigido hacia adelante (Fig. 1C, flecha roja), y en la ecografía Doppler color 3D correspondiente se identifica el origen exacto del chorro,(jet) entre los festones P2-P3 (Fig. 1D, flecha roja). En concordancia con los hallazgos ecocardiográficos, en los hallazgos quirúrgicos se aprecia el aspecto mixomatoso de la VM (Fig. 1E), así como la rotura de una cuerda tendinosa (Fig. 1F, flecha blanca) correspondiente al segmento P2.
Objetivos de aprendizaje: Estos hallazgos son característicos del espectro degenerativo de la valvulopatía mitral, en el que se han descrito dos fenotipos morfológicos diferentes: degeneración mixomatosa difusa (enfermedad de Barlow) y la deficiencia fibroelástica. (4 La deficiencia fibroelástica se caracteriza por el prolapso de la valva que suele producirse en un segmento aislado, con rotura cordal o valva ondulante (flail). Este segmento suele ser grueso y redundante, mientras que el resto de la valva es delgado y translúcido. (4 Desde una perspectiva ecocardiográfica, es importante medir la altura de las valvas anterior y posterior y el diámetro anular para determinar el tamaño adecuado de la banda o anillo mitral que se debe utilizar. (5 Las vistas frontales de la VM mediante ETE 3D permiten evaluar la protrusión (billowing), el prolapso o el movimiento ondulante (flail) de cualquier segmento de la valva o incluso de las comisuras. (4 Aunque en más del 60% de los pacientes operados se observa prolapso del segmento P2, podría haber otros segmentos concomitantes prolapsados. 2
Algunas de las técnicas de reparación de la VM utilizadas en estos pacientes son la resección de las valvas, la plicatura, las neocuerdas artificiales, la reducción de las valvas y anuloplastia mediante banda o anillo. (5
CASO 2: Calcificación grave del anillo mitral
Un hombre de 63 años con antecedentes de insuficiencia renal terminal (IRT), hemodiálisis de larga duración y accidente cerebrovascular 2 años antes e insuficiencia cardíaca con fracción de eyección conservada, un año antes. En la actualidad, presenta disnea progresiva y tos seca. Se realizaron ETT y ETE.
En la vista en eje largo paraesternal del ETT se observa la aurícula izquierda (AI) muy dilatada y calcificación del anillo mitral (CAM) grave, que afecta las partes anterior y posterior del mismo (Fig. 2A, flechas amarillas). En esta misma vista de la ecografía Doppler color se detecta aceleración del flujo hacia el orificio de la VM (Fig. 2B, flecha blanca). Esto se corrobora posteriormente en las imágenes de la ETE, donde la convergencia del flujo hacia el orificio de la VM muestra una gran área de superficie de isovelocidad proximal (PISA) en la vista medioesofágica de 4 cámaras (Fig. 2C, flecha blanca). Estos hallazgos y la presencia de un gradiente medio de la VM de 16 mmHg en la ecografía Doppler de onda pulsada (Fig. 2D) son compatibles con estenosis mitral (EM) grave. En la vista frontal 3D ampliada de la VM se puede observar la distribución circunferencial de la CAM (Fig. 2E, línea blanca discontinua) y el tamaño extremadamente reducido del orificio de la VM en la fase inicial-media de la diástole (asterisco blanco). En la Fig. 2F se evidencia la correlación sólida entre los hallazgos quirúrgicos y las imágenes ecocardiográficas, según se aprecia a través la CAM extendida hacia delante y atrás (líneas blancas discontinuas), la afectación de las comisuras (flecha blanca) y la estenosis grave del orificio de la VM (asterisco blanco).
Objetivos de aprendizaje: La CAM es un proceso crónico, degenerativo y metabólicamente regulado que da lugar al depósito de calcio, sobre todo en la parte posterior del anillo, y se relaciona no solo con el estrés hemodinámico, sino también con la inflamación, los lípidos y la alteración del metabolismo óseo y mineral. (6 Su prevalencia varía del 5% al 42% en función de la modalidad de obtención de imágenes utilizada, las características de la población estudiada y sus factores de riesgo asociados. (7 Los pacientes con IRT tienen, en particular, alto riesgo de CAM 7. Se ha demostrado que esta enfermedad se asocia de forma independiente con mortalidad cardiovascular y por cualquier causa, accidente cerebrovascular y arritmias (específicamente fibrilación auricular). 7 Aunque se detecta con frecuencia mediante ETT y ETE, la tomografía cardíaca es útil para calificar y cuantificar la densidad, gravedad y extensión de la CAM y su relación con otras estructuras cardíacas. 6 Las opciones de tratamiento médico son limitadas. La cirugía (reparación o reemplazo) puede constituir un reto, ya que suele requerir un tiempo quirúrgico prolongado para la descalcificación y reconstrucción de la VM.
CASO 3: Fibroeslastoma papilar mitral
Un hombre de 38 años sin antecedentes médicos presentó dos episodios transitorios de debilidad del brazo y la pierna derechos 48 horas antes del ingreso hospitalario. La tomografía cerebral y la resonancia magnética arrojaron resultados negativos, y en la ecografía Doppler de las carótidas no se apreciaron anomalías. En el electrocardiograma se observó ritmo sinusal normal sin alteraciones. Se realizaron un ETT y posteriormente un ETE.
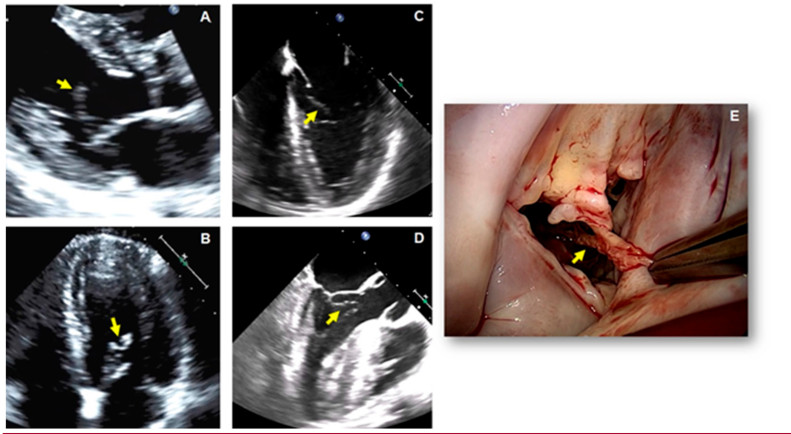
En las vistas en eje largo paraesternal y apical de 4 cámaras del ETT se observa una estructura ecodensa, delgada y con mucha movilidad adherida a la cara ventricular de la valva anterior de la VM (Figs. 3A y B respectivamente, flechas amarillas). Esto también se visualiza en las imágenes del ETE, según la vista medioesofágica de 4 cámaras (Fig. 3C, flecha amarilla) y de 3 cámaras donde se puede observar que esta estructura es arrastrada hacia el infundíbulo del ventrículo izquierdo durante la sístole (Fig.3D, flecha amarilla). En las imágenes obtenidas durante la resección quirúrgica del tumor, se muestra muy buena correlación con los hallazgos ecocardiográficos, en cuanto a las características anatómicas y la localización (Fig. 3E). El estudio de anatomía patológica determinó el diagnóstico de fibroelastoma papilar (FEP) de la VM.
Objetivos de aprendizaje: El FEP es el tercer tumor más frecuente del corazón después del mixoma y el lipoma auriculares, y es el tumor más habitual en las válvulas cardíacas. 8 En el 90% de los casos, los FEP son únicos y más del 95% se localizan en el corazón izquierdo. 8 Aunque histológicamente sea benigno, el FEP es una afección peligrosa debido a la posibilidad de embolización cerebral y coronaria. 9 Las dos terceras partes de los casos se diagnostican de forma fortuita mediante un ETT sistemática, y una tercera parte se diagnostica después de un evento embólico que desencadena la exploración. 9 Se recomienda su extirpación para evitar complicaciones embólicas; esto constituye el tratamiento definitivo, ya que la recidiva es muy poco frecuente. 8
CASO 4: Trombosis de la válvula bioprotésica
Una mujer de 70 años con antecedentes médicos de hipertensión, nefropatía crónica y sustitución de la VM por una válvula bioprotésica St. Jude Epic de 29 mm tres años antes se presentó con disnea de esfuerzo progresiva, opresión torácica y palpitaciones. Se descartó infarto agudo de miocardio sin elevación del segmento ST, según las guías. 9 Debido a la mala ventana acústica, se realizó un ETE.
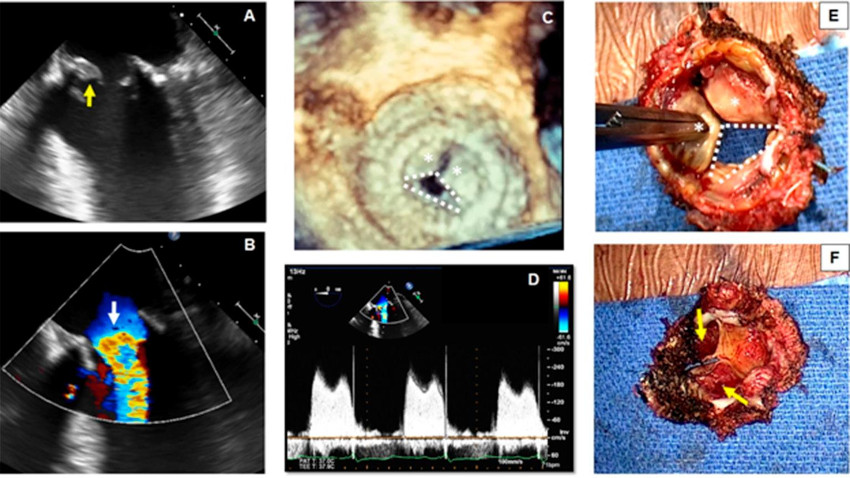
En la vista medioesofágica de 4 cámaras se observa una apertura restringida de la bioprótesis de la VM y una estructura hiperecogénica adherida a la cara ventricular de las valvas de la bioprótesis (Fig. 4A, flecha amarilla). En la ecografía Doppler color se evidencia aceleración del flujo hacia la entrada de la VM (Fig. 4B, flecha blanca). En la imagen 3D ampliada de la bioprótesis de la VM se puede visualizar el movimiento restringido de dos de las valvas (Fig. 4C, asteriscos blancos) y la apertura completa únicamente de una valva (Fig. 4C, líneas blancas discontinuas). El gradiente transmitral medio de 12 mmHg en la ecografía Doppler pulsada indica estenosis mitral grave (Fig. 4D). Una vez retirada la bioprótesis, el cirujano comprueba el movimiento restringido de dos de las valvas (Fig. 4E, asteriscos blancos) y el movimiento conservado de solo una (Fig. 4E, líneas blancas discontinuas). Cuando se observa la bioprótesis extirpada desde su cara ventricular, se aprecia la presencia de trombos organizados que afectan ambas valvas inmóviles (Fig. 4F, flechas amarillas).
Objetivos de aprendizaje: Se debe sospechar de trombosis de la VM bioprotésica cuando hay restricción de movimiento de las valvas protésicas. En los pacientes que presentan insuficiencia cardíaca, gran carga de coágulos (>0,8 cm2) o enfermedad coronaria, en particular cuando la fibrinólisis está contraindicada, se prefiere la cirugía. 11 El análisis del eco 3D de la VM desde la perspectiva del cirujano (vista desde la aurícula izquierda) proporciona información adicional para el diagnóstico. La reconstrucción multiplanar del eco 3D también se puede utilizar para visualizar mejor la trombosis desde múltiples planos anatómicos.
CASO 5: Fuga paravalvular
Un hombre de 62 años, con antecedentes de enfermedad pulmonar obstructiva crónica, fibrilación auricular de larga duración y reemplazo bioprotésico de la VM realizado tres años antes se presentó con fiebre. Un mes antes, había sido hospitalizado con un diagnóstico de sepsis debido a una infección por Escherichia coli multirresistente y fue tratado con ertapenem. En la actualidad, presenta disnea de esfuerzo y progresiva. En el momento del ingreso, el valor de la hemoglobina era de 6,9 gr/dL, por lo que fue necesario realizar transfusiones de sangre para mantener el valor de la hemoglobina >7,0 gr/dL. Además, en un frotis de sangre se observaron signos de hemólisis. Se realizó un ETE.
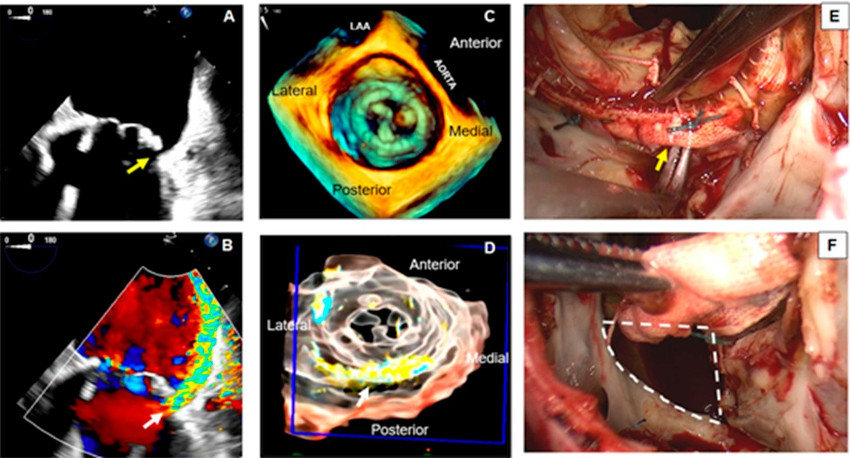
En una vista medioesofágica de 4 cámaras, se observa una extensa dehiscencia en la parte posterior del anillo bioprotésico (Fig. 5A, flecha amarilla). En la ecografía Doppler color se corrobora la presencia de un jet de regurgitación importante a través de esta apertura, el cual se extiende a lo largo de la pared posterior de la aurícula izquierda (AI) y crea el efecto de Coanda (Fig. 5B, flecha blanca). Estos hallazgos son compatibles con fuga paravalvular (FPV) importante. En la imagen frontal ampliada del eco 3D se observa mejor la válvula bioprotésica (Fig. 5C), y el uso de la imagen color 3D proporciona información adicional sobre la extensión del defecto paravalvular (Fig. 5D, flecha blanca). Durante la operación, el cirujano observa la dehiscencia completa en la parte posterior (Fig. 5E, flecha amarilla. Las líneas blancas discontinuas corresponden a la extensión virtual de la pinza de Lahey por debajo de la prótesis). Después de que el cirujano levanta la bioprótesis, se pueden observar mejor las dimensiones reales del defecto (Fig. 5F, líneas blancas discontinuas).
Objetivos de aprendizaje: La FPV se produce en casi el 3% de los reemplazos quirúrgicos de la VM. 12 Se debe sospechar de FPV en los pacientes con válvulas protésicas que presentan síntomas de insuficiencia cardíaca, anemia o evidencia de hemólisis en el frotis sanguíneo. La dehiscencia valvular y el excesivo balanceo protésico suelen asociarse con endocarditis activa o previa u otras alteraciones inflamatorias sistémicas. 12 Las técnicas de diagnóstico por imagen después de una intervención de la VM incluyen la evaluación minuciosa de la integridad, posición, estabilidad e interacción del dispositivo con las estructuras adyacentes. (13 La evaluación mediante ecografía Doppler color de la gravedad de la IM a través de un ETT constituye un reto debido a la interacción del dispositivo o las estructuras adyacentes con los jets de la IM y a la presencia frecuente de múltiples jets que suelen entrecruzarse en diferentes planos 13. Aunque el eco 3D es fundamental para identificar el origen y la extensión del defecto, un abordaje exhaustivo que integre varios parámetros de la morfología y la función valvulares es clave para detectar y cuantificar adecuadamente la disfunción protésica. El tratamiento de los pacientes con FPV grave e insuficiencia cardíaca de CF III/IV NYHA requiere intervención quirúrgica o percutánea. 11 El tipo de prótesis, el riesgo quirúrgico del paciente y la viabilidad de un abordaje percutáneo deben determinar si es más apropiado este o el quirúrgico.