INTRODUCCIÓN
El aumento en la masa corporal observado en sujetos con sobrepeso y obesidad se asocia con alteraciones hemodinámicas, entre las que sobresalen el aumento del volumen plasmático y la disfunción vascular. Desde el punto de vista fisiopatológico, diferentes alteraciones endocrinas actúan en forma concurrente y sinérgica en el desarrollo de dichas alteraciones circulatorias. Con el incremento en la masa corporal -particularmente en obesos-, el aumento de la reabsorción de agua y sodio promovida por la insulina través de la activación del intercambiador de sodio-hidrógeno en el túbulo contorneado proximal, 1 la hiperreninemia derivada del aumento del flujo simpático, 2 la disminución del flujo sanguíneo tubular renal y la estimulación del feedback tubuloglomerular 3 además del aumento de la secreción autónoma de aldosterona en los adipocitos disfuncionantes, 4 propicia un estado circulatorio caracterizado por aumento del gasto cardíaco y remodelado excéntrico de las cámaras cardíacas y de las arterias de conductancia, que coexiste con aumento del tono de los esfínteres precapilares y desarrollo de hipoperfusión periférica. Dado que el suministro de macronutrientes a órganos metabólicamente activos, como el músculo esquelético y el tejido adiposo, depende en gran medida de una perfusión adecuada, la incapacidad de incrementar el flujo sanguíneo durante el período postprandial puede asociarse con alteraciones metabólicas en sujetos con sobrepeso y en obesos. A modo de ejemplo, el bloqueo del flujo muscular mediado por insulina reduce un 40 % del consumo de glucosa por parte del músculo según la técnica de clampeo euglucémico-hiperinsulinémico. 5 En este escenario, las alteraciones en la estructura y función de las arterias de conductancia que participan en la perfusión de los músculos (los cuales consumen del 75 el 80 % de la glucosa corporal total) 6 sumadas al aumento de las resistencias periféricas podrían inducir en forma conjunta trastornos metabólicos a punto de partida periférico con el incremento progresivo en la masa corporal.
MATERIAL Y MÉTODOS
Evaluamos retrospectivamente 3493 pacientes de la base metabólica del registro CARFARE (CARDIOMETABOLIC RISK FACTORS REGISTRY) realizado a partir de un programa de prevención cardiovascular de la Unidad Cardiometabólica Officia, del servicio de Cardiología del Hospital Universitario Austral, desde julio de 2016 hasta enero de 2020. Dichos pacientes se sometieron a una evaluación estructurada, secuencial, en la misma fecha, que consta de análisis de laboratorio que incluyen determinaciones de metabolitos en orina y en sangre periférica luego de un ayuno de 12 horas. Posteriormente los sujetos fueron evaluados con un interrogatorio con recolección de datos de factores de riesgo cardiovascular (FRC) y de antecedentes clínico-cardiológicos, medición de peso y altura con cálculo del índice de masa corporal (IMC), medición de la presión arterial (PA) basal (reposo, 3 determinaciones), y realización de diferentes estudios por imágenes.
A los fines prácticos del presente estudio se utilizaron los datos de antecedentes patológicos, de factores de riesgo cardiovascular, de mediciones de perfil metabólico -niveles de glucemia (Glu), de colesterol HDL (HDLc) y de triglicéridos (TG) en sangre periférica- y de la vasodilatación mediada por flujo (VDMF). La obesidad fue definida según la OMS como un IMC ≥30 kg/m2, y el síndrome metabólico (SM) según el Joint Interim Statement IDF y AHA/NHLBI 2019 7 como la presencia de 3 de los siguientes criterios: TG>150mg/dL, HDL < 40 mg/dL en hombres y < 50 mg/dL en mujeres, PA >130/85 mm Hg, glucosa >100 mg/dL y tratamiento para diabetes (DBT), hipertensión arterial (HTA) o dislipidemia.
La determinación de la VDMF se realizó con un ecógrafo vascular de alta resolución (Phillips HD7 XE, Koninklijke Philips N.V) equipado con una sonda de matriz lineal de 10 MHz. Dicho procedimiento se realizó en la arteria humeral, en ambiente silencioso, a 22°C, con ayuno de 12 horas, sin ingesta de medicación, durante el período matinal,y en ausencia de drogas antihipertensivas por un período de 12 horas . El cálculo se realizó a través de la siguiente fórmula: VDMF= [(diámetro humeral basal en mm -diámetro humeral postisquemia en mm) / diámetro basal humeral en mm]*100. La inducción de la isquemia se realizó a través de una compresión supra-sistólica de 30 mm Hg con un manguito colocado sobre la arteria humeral, 3 a 5 cm por sobre el pliegue del codo durante el lapso de 3 minutos, en el brazo izquierdo. Los datos del diámetro basal de la arteria humeral (D-Hum) y de la VDMF fueron recolectados en mm y en porcentaje, respectivamente.
Para el presente análisis se excluyeron pacientes con edad < 18 y >80 años, con antecedentes de cardiopatía isquémica (angina crónica estable, angina inestable, infarto agudo de miocardio), insuficiencia cardíaca, arritmia crónica o eventos arrítmicos significativos, patología cerebrovascular (accidente isquémico transitorio, accidente cerebrovascular) o enfermedad vascular periférica, insuficiencia renal crónica estadio III o superior, patologías reumatológicas conocidas, patologías crónicas descompensadas, además de datos incompletos. Se excluyeron del análisis aquellos pacientes en tratamiento con estatinas o con agonistas β2 adrenérgicos por su efecto sobre la función endotelial.
Se analizó la existencia de una relación lineal entre el D-Hum y la VDMF, y posteriormente se evaluaron cada una de estas variables (D-Hum y VDMF) según niveles de IMC. Se evaluó la existencia de asociaciones lineales entre D-Hum y VDMF con variables constitutivas del SM (PA, Glu, TG y HDLc). Se realizaron dos regresiones logísticas para explorar la asociación independiente del D-Hum y la VDMF con el SM.
Análisis estadístico
Las características basales se expresan como media y desviación estándar en el caso de variables continuas, y número de casos y porcentaje en el caso de variables categóricas. La correlación lineal se expresa con el coeficiente r de Pearson en al caso de variables de distribución normal y rho de Spearman en las de distribución no normal. Los niveles de IMC se obtuvieron a través de su estratificación en decilos. El análisis de variables según decilos se realizó a través del test de ANOVA en aquellas de distribución normal, y de Kruskall Wallis en las de distribución no normal. Dada la probable colinealidad de D-Hum y de VDMF, se realizaron dos regresiones logísticas: 1) con el SM como variable dependiente y D-Hum, edad, sexo, IMC y FRC (dislipemia, HTA, DBT, tabaquismo, sedentarismo) como independientes, y 2) con el SM como variable dependiente más VDMF, edad, sexo, IMC y FRC (dislipidemia, HTA, DBT, tabaquismo, sedentarismo) como independientes. Se consideró estadísticamente significativo un valor de p < 0,05. El análisis fue realizado con el software de estadística MedCalc versión 20.2.17.
RESULTADOS
Se incluyeron finalmente en el estudio 1995 pacientes (48,2 ± 11 años, 56 % sexo masculino, IMC 27,9 ± 5,9 kg/m2, SM 20,3 %). La población presentó pacientes con bajas prevalencias de tabaquismo, dislipidemia y DBT (Tabla 1).
Tabla. 1 Características basales (n=1995)
| Variable | |
|---|---|
| Edad, años (media ± DE) | 48,2 ± 11,2 |
| Sexo masculino (%) | 56 |
| IMC, kg/m2 (media ± DE) | 27,9 ± 5,9 |
| HTA (%) | 26 |
| Tabaquismo (%) | 14 |
| DBT (%) | 4 |
| Dislipidemia (%) | 25,9 |
| Sedentarismo (%) | 33 |
DBT: diabetes; DE: desviación estándar; HTA: hipertensión arterial IMC: índice de masa corporal
En el análisis univariado el D-Hum y la VDMF presentaron una relación inversa y significativa (r: -0,42, p < 0,0001). El D-Hum mostró un incremento a través de los decilos de IMC (p < 0,000001) (Figura 1). La VDMF, en cambio, presentó una reducción progresiva a través de los decilos de IMC (p < 0,000001) (Figura 2). El D-Hum presentó correlaciones directas con la PA (r = 0,26, p < 0,001), la Glu (r = 0,25, p < 0,001) y los TG (r = 0,26, p < 0,001) e inversa con el HDLc (r= - 0,35, p < 0,001). La VDMF, en cambio, presentó asociaciones inversas y más débiles con la PA (r= -0,15, p < 0,001), la Glu (r= -0,11, p < 0, 001) y los TG (r= -0,12, p < 0,001) y directa con el HDLc (r= 0,14, p < 0,001).
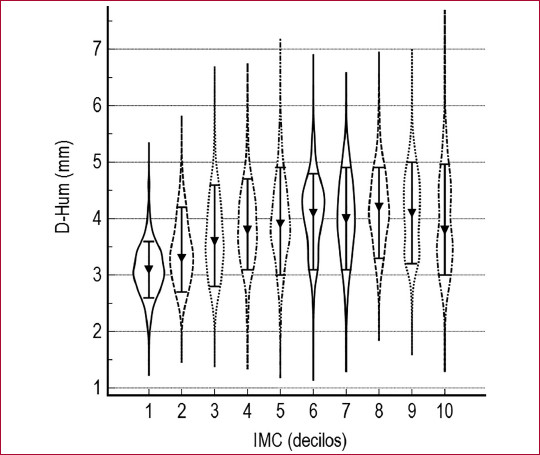
Fig. 1 Diámetro de la arteria humeral según decilos de índice de masa corporal. Kruskall Wallis, p < 0,000001. Valores expresados como mediana (IC 10-90 %) D-Hum: diámetro humeral basal; IMC: índice de masa corporal

Fig. 2 Vasodilatación mediada por flujo según decilos de índice de masa corporal. Kruskall Wallis, p < 0,000001 Valores expresados como mediana (IC 10-90%) VDMF: vasodilatación mediada por flujo; IMC: índice de masa corporal
En el primer análisis de regresión logística, el DHum se asoció en forma independiente con el SM, con un OR 1,42 (IC 95% 1,14-1,77, p = 0,002), ajustado por edad, sexo, IMC, dislipidemia, tabaquismo, DBT, HTA y sedentarismo [test de Hosmer & Lemeshow p=0,12, área bajo la curva ROC 0,77 (IC 95% 0,75- 0,79)]. (Tabla 2).
Tabla 2 Diámetro de la arteria humeral ajustado y su relación con el síndrome metabólico (SM)
| Variable | Coeficiente beta | Error estándar | p | OR | IC 95% |
|---|---|---|---|---|---|
| Edad | 0,009 | 0,006 | 0,125 | 1,01 | 0,99 - 1,02 |
| Sexo masculino | 0,325 | 0,169 | 0,054 | 1,38 | 0,99 - 1,92 |
| IMC | 0,115 | 0,013 | <0,0001 | 1,12 | 1,09 - 1,15 |
| D-HUM | 0,350 | 0,112 | 0,002 | 1,42 | 1,14 - 1,77 |
| DLP | 0,384 | 0,134 | 0,004 | 1,47 | 1,12 - 1,91 |
| TBQ | -0,119 | 0,179 | 0,503 | 0,88 | 0,62 - 1,26 |
| DBT | 0,630 | 0,263 | 0,016 | 1,87 | 1,12 - 3,14 |
| HTA | 0,773 | 0,132 | <0,0001 | 2,16 | 1,67 - 2,80 |
| Sedentarismo | 0,134 | 0,143 | 0,347 | 1,14 | 0,86 - 1,51 |
DBT: diabetes; DE: desviación estándar; D-Hum: diámetro humeral basal; DLP: dislipidemia; HTA: hipertensión arterial; IMC: índice de masa corporal; TBQ: tabaquismo
En el segundo análisis de regresión logística, la VDMF no mostró una asociación significativa con el SM, con un OR 0,98 (IC 95% 0,97-1,007, p = 0,217) cuando fue ajustada por las mismas variables [test de Hosmer & Lemeshow p = 0,15, área bajo la curva ROC = 0,77(IC 95% 0,75-0,79)] (Tabla 3).
Tabla 3 Relación entre la vasodilatación mediada por flujo ajustada con el síndrome metabólico (SM)
| Variable | Coeficiente beta | Error estándar | p | OR | IC 95% |
|---|---|---|---|---|---|
| Edad | 0,012 | 0,005 | 0,024 | 1,01 | 1,01-1,02 |
| Sexo masculino | 0,641 | 0,135 | <0,0001 | 1,89 | 1,45-2,47 |
| IMC | 0,122 | 0,013 | <0,0001 | 1,13 | 1,10-1,15 |
| VDMF | -0,011 | 0,009 | 0,217 | 0,98 | 0,96-1,00 |
| DLP | 0,345 | 0,134 | 0,010 | 1,41 | 1,08-1,83 |
| TBQ | -0,122 | 0,180 | 0,497 | 0,88 | 0,62-1,26 |
| DBT | 0,662 | 0,261 | 0,011 | 1,93 | 1,16-3,24 |
| HTA | 0,772 | 0,132 | <0,0001 | 2,16 | 1,67-2,81 |
| Sedentarismo | 0,103 | 0,143 | 0,472 | 1,10 | 0,83-1,46 |
DBT: diabetes; DE: desviación estándar; DLP: dislipidemia; HTA: hipertensión arterial IMC: índice de masa corporal; TBQ: tabaquismo VDMF: vasodilatación mediada por flujo
DISCUSIÓN
El remodelado vascular excéntrico -caracterizado en este estudio como un aumento en el diámetro basal de la arteria humeral- se asoció con el desarrollo de componentes del SM con el incremento progresivo de la masa corporal. Así, la relación inversa entre el remodelado vascular (el diámetro basal de la arteria humeral) y la VDMF (mecanismo que permite aumentos en el flujo vascular ante situaciones de alta demanda metabólica, como ejercicio y período postprandial) podrían estar vinculando a la disfunción hemodinámica con alteraciones metabólicas en contexto del incremento de peso. Si bien resulta inobjetable el impacto de las alteraciones metabólicas sobre la estructura y función vascular, resulta altamente probable que en algún punto del continuo evolutivo las alteraciones en la dinámica vascular contribuyan, a modo de un círculo vicioso, con el desarrollo/profundización de dichos desequilibrios metabólicos
De esta forma el remodelado excéntrico representaría un intento de asegurar una adecuada perfusión muscular en respuesta tanto al aumento del volumen intravascular como a la sobreoferta de sustratos de alta energía. De hecho, azúcares tales como la glucosa 8 o la fructosa 9 aumentan la actividad del sistema simpático, con incrementos en el gasto cardíaco -causa de remodelado vascular excéntrico- y aumento del tono de los esfínteres precapilares con hipoflujo muscular. Dichos ajustes se asocian con una caída en el consumo de sustratos energéticos -glucosa y triglicéridos- y finalmente con desarrollo de alteraciones metabólicas periféricas. De hecho, diferentes drogas que comparten efectos simpaticolíticos/vasodilatadores como moxonidina 10, rilmenidina 11 y azelnidipina, 12 o donantes de óxido nítrico como el nitroprusiato de sodio 13 inducen mejorías en el perfil glucémico y lipídico en sujetos con obesidad, SM o DBT.
La asociación entre el aumento del diámetro de la arteria humeral observado y su relación con alteraciones metabólicas parece no ser un fenómeno generalizado con el incremento de la masa corporal. De hecho, y a modo de ejemplo, 1 de cada 3 obesos exhibe un fenotipo “metabólicamente saludable” en el cual no se manifiestan alteraciones metabólicas ostensibles. 14 Estos sujetos al parecer presentan como características distintivas una adecuada capacidad de reservorio subcutáneo de lípidos, adipocitos normofuncionantes y bajos niveles de inflamación, todo ello en contexto de una adecuada perfusión muscular y función microvascular.
Esta observación estaría en línea con estudios recientes que sugieren que la oxigenación del tejido adiposo, determinada por el equilibrio entre el suministro de oxígeno y el consumo de oxígeno, podría ser un factor clave en la determinación del fenotipo del tejido adiposo en el obeso. (15,16)
Resulta altamente probable que las alteraciones en la función vascular puedan vincularse con desarrollo de alteraciones en el metabolismo tanto de los hidratos de carbono como de los lípidos en sujetos metabólicamente complicados. Estudios recientes evidencian que la insulino-resistencia vascular secundaria a dietas altas en grasas compromete el flujo vascular esquelético aún en el corto plazo. Estos datos sugieren que la alteración del flujo sanguíneo en la microvasculatura del músculo esquelético es un evento primario que precedería a la insulino-resistencia corporal total en el desarrollo de DBT II. 17
En el mismo sentido, en un gran estudio poblacional prospectivo realizado en sujetos de mediana edad, los niveles basales elevados de 2 marcadores de disfunción endotelial (sE-selectina y sICAM-1) se asociaron significativamente con el riesgo de desarrollo de DBTII, en particular la sE-selectina, que resultó ser un fuerte predictor independiente de DBT incidente después del ajuste por obesidad, otros parámetros clínicos y estilo de vida tanto en hombres como en mujeres. 18
Paralelamente han surgido evidencias que parecerían vincular la hipoperfusión de los depósitos grasos con el desarrollo de insulino-resistencia corporal total. La asociación inversa entre el aumento posprandial de la perfusión del tejido adiposo con el grado de insulinoresistencia sugiere que la hipoperfusión del tejido adiposo puede afectar la sensibilidad a la insulina de todo el cuerpo. Así, la caída del suministro de glucosa, de lípidos y de oxígeno hacia el tejido adiposo generaría una disminución en la captación de sustratos energéticos a nivel de los depósitos grasos subcutáneos, con acumulación ectópica de lípidos en vísceras y músculo, hipoxemia adipocitaria e insulino-resistencia central y periférica. 19
Desde nuestro punto de vista hemos objetivado una interesante asociación entre alteraciones en la estructura y función vascular de los vasos de conductancia y alteraciones metabólicas con el incremento del peso. Sin embargo, dichas asociaciones deberían ser interpretadas con cautela a causa de las limitaciones inherentes al estudio. De hecho, su diseño -que no permite imputar causalidad-, la ausencia de una medición objetiva de masa grasa y el hecho de que la VDMF no fue medida durante el período postprandial ni ajustada por drogas limitan la interpretación de los resultados. Sin embargo, es probable que las alteraciones dinámicas del flujo vascular se comporten como inductoras de trastornos metabólicos, particularmente durante el período postprandial. Evidencia reciente nos muestra que efectivamente una diferencia fundamental entre obesos metabólicamente saludables y sujetos con SM reside en una preservación de la VDMF durante el período postprandial en aquellos metabólicamente no complicados, con una respuesta endotelial similar a la de los sujetos con peso normal y sin alteraciones metabólicas, 20 hallazgos que están haciendo reinterpretar la función del endotelio vascular como un actor fundamental en el control del metabolismo de la glucosa y de los hidratos de carbono. 21 Asimismo debemos señalar que en el presente estudio no se realizó el ajuste de las variables hemodinámicas por cada una de las drogas con la intención de no complejizar el análisis. El estudio se realizó sin la administración matutina de la medicación habitual de los pacientes, lo que limitaría al menos el efecto inmediato de elevados niveles plasmáticos de las drogas.
Finalmente, no es posible descartar totalmente el hecho de que el aumento de la conductancia arterial esté ligado principalmente a modificaciones anatómicas secundarias al aumento de la masa corporal. De hecho, en un estudio de Dalli y cols. 22 se evidenció una relación significativa entre el diámetro de la arteria humeral y el perímetro de brazo, Sin embargo, la persistencia de la asociación entre el D-Hum y el SM ajustada por el IMC -un parámetro estrechamente relacionado con la superficie corporal y, por lo tanto, con el perímetro de brazo- sugeriría una asociación independiente de la antropometría en esta relación.
CONCLUSIONES
En el presente estudio hemos evidenciado una relación entre alteraciones en la estructura y la función vascular en arterias de conductancia con trastornos metabólicos a través del incremento de la masa corporal. Un estudio prospectivo con el objetivo de evaluar la insulino-resistencia vascular y la causalidad hemodinámico-metabólica con el incremento de peso en sujetos previo desarrollo de SM podría ayudar a clarificar estas asociaciones.











 texto em
texto em 



