INTRODUCCIÓN
La miocardiopatía hipertrófica (MCH) es una enfermedad cardíaca hereditaria con una expresión fenotípica y genética compleja y una prevalencia estimada de 1:500 en la población general. 1),(2
Alrededor del 70 % de los pacientes con MCH presenta alguna forma de obstrucción dinámica (MCHO) que contribuye al desarrollo de síntomas como disnea y angina. A su vez, hay suficiente evidencia que muestra el impacto de la obstrucción dinámica en el desarrollo de cambios funcionales y estructurales a nivel cardíaco, como el aumento de las presiones de llenado intraventricular, la presión pulmonar y la dilatación auricular izquierda y derecha. 3),(4
La miectomía septal ampliada (MSA) ha demostrado ser una estrategia útil para mejorar los síntomas y la calidad de vida en los pacientes con formas de MCHO refractarios al tratamiento médico. 3),(4),(5
En este trabajo nos propusimos evaluar el impacto de dicha cirugía en los cambios estructurales asociados a la obstrucción dinámica.
Nuestro objetivo fue analizar el impacto de la MSA en parámetros estructurales y funcionales ecocardiográficos a corto y mediano plazo, de pacientes con MCH y obstrucción dinámica del tracto de salida del ventrículo izquierdo (VI).
MATERIAL Y MÉTODOS
Diseño del estudio: Se realizó un estudio observacional, sobre una cohorte prospectiva de pacientes a los que se realizó miectomía septal ampliada en el período comprendido entre noviembre de 2011 y diciembre de 2022. Se incluyó a los pacientes con posibilidad de seguimiento que se hubieran realizado un ecocardiograma de control en el período postoperatorio inmediato y alejado.
Diagnóstico de MCH: El diagnostico de MCH se realizó según recomendación de las guías internacionales, con la presencia de un aumento del espesor de la pared del VI en uno o más segmentos miocárdicos, determinado por cualquier técnica de imagen, en ausencia de otra enfermedad cardíaca o sistémica que lo justificara. En adultos se estableció como diagnostico un espesor de la pared del VI ≥15 mm, o una relación espesor septal/pared posterior > 1,3, y para el diagnóstico de familiares de primer grado de un enfermo con MCH se consideró un espesor de la pared del VI ≥13 mm. 2),(3
El diagnostico de MCHO se realizó según recomendaciones de las guías internacionales por ecocardiografía Doppler, cuando el gradiente máximo obtenido en forma espontánea y/o con maniobras de provocación (Valsalva, ejercicio) era ≥30 mmHg. 2),(3
Evaluación del ecocardiograma: Mediante ecocardiograma bidimensional se midieron el espesor miocárdico septal máximo, el diámetro anteroposterior de la aurícula izquierda en el eje largo paraesternal, el área y volumen auricular, en la vista de 4 cámaras apical. El volumen de la aurícula izquierda (AI) se calculó utilizando el método biplano área-longitud y el índice de volumen de la AI se calculó utilizando el área de superficie corporal.
La función sistólica del VI se cuantificó mediante el método de Simpson, en la vista apical de 4 cámaras y 2 cámaras 6
Utilizamos la vista apical de 4 cámaras con Doppler pulsado del flujo mitral en las puntas de las valvas de la válvula mitral, para determinar las velocidades diastólicas máximas temprana (E) y tardía (A), la relación E/A y el tiempo de desaceleración de la onda E y clasificarla según las guías de cuantificación ecocardiográfica en normal, disfunción diastólica grado 1, grado 2 y grado 3. Se analizaron mediante Doppler tisular las velocidades pico diastólica temprana del anillo lateral y medial mitral, para valorar las presiones de llenado ventricular, tomando la relación entre el pico de la velocidad de la onda E mitral y el pico de la velocidad de la onda e´ promediada (E/e´). 7
De acuerdo con las recomendaciones internacionales la evaluación de la función diastólica en pacientes con MCH se consideró mediante un enfoque integral teniendo en cuenta todos los parámetros ecocardiográficos que incluyen y consideran como valores anormales: relación E/e´>14, volumen indexado de la AI >34 ml/m2, diferencia en la duración de la onda A retrógrada en la vena pulmonar - la duración de la onda A anterógrada en el flujo transmitral >30 mseg, y velocidad máxima del jet de insuficiencia tricúspidea > 2,8 m/seg. Se consideró una presión en la AI normal y disfunción diastólica grado I si < 50 % de estas variables alcanzaban los valores de corte, y una presión elevada en la AI y disfunción diastólica grado II cuando >50 % estas variables lo hacían. En caso de 50 % de discordancia los hallazgos no son concluyentes para estimar la presión en la AI. Se consideró disfunción diastólica grado III en presencia de un patrón de llenado restrictivo y velocidad de Doppler tisular anular mitral reducida (septal < 7 cm/seg, y lateral < 10 cm/seg). 7
La presencia de la insuficiencia mitral se evaluó con Doppler color, se la graduó en forma cualitativa en leve, moderada y grave, y se determinó si su mecanismo era secundario a movimiento anterior sistólico de la válvula mitral, o consecuencia de alguna anormalidad propia de la válvula, como prolapso, rotura cordal, calcificación del anillo valvular o mal posicionamiento de un músculo papilar o anormalidades del aparato subvalvular mitral. 7
Para la determinación de la presión sistólica de la arteria pulmonar (PSAP) se utilizó la velocidad pico del jet de regurgitación tricúspidea, con Doppler continuo, sumado a la presión diastólica de la aurícula derecha, según el diámetro de la vena cava inferior y su porcentaje de colapso inspiratorio. 7
El gradiente obstructivo se identificó mediante Doppler color y se cuantificó mediante Doppler continuo con la fórmula de Bernoulli, en reposo y con maniobra de Valsalva/ ejercicio. 7
La valoración clínica de los pacientes en el preoperatorio, postoperatorio y seguimiento, fue realizada por cardiólogos de la unidad de Miocardiopatías del centro y se estableció la clase funcional para disnea, según la clasificación de la New York Heart Association (NYHA), presencia o ausencia de angina, síncope, antecedentes heredofamiliares de muerte súbita, factores de riesgo cardiovascular y tratamiento médico óptimo. Figura 1.
Seguimiento: Se realizaron ecocardiogramas transtorácicos en los siguientes períodos:
Preoperatorio: hasta 3 meses antes de la cirugía.
Postoperatorio inmediato: 1 mes después de la cirugía.
Postoperatorio alejado: entre 2 y 3 años post cirugía.
Análisis estadístico
Las variables cuantitativas se presentan como media o mediana con su correspondiente desviación estándar (DE) o rango intercuartílico (RIC) según corresponda. Las variables categóricas se presentan como frecuencia y porcentaje. Se comprobó la normalidad de las variables con la prueba de Kolmogorov-Smirnov (n ≥ 30) y Shapiro-Wilk (n < 30) y los supuestos de aplicación de cada una de las pruebas utilizadas.
Según correspondiera (2 muestras o más, independientes o apareadas) se utilizaron los test de chi cuadrado, McNemar, el test del signo, Wilcoxon o ANOVA.
Se aceptó como significativo un valor de p < 0,05 a dos colas.
En el análisis de los datos se empleó el programa estadístico SPSS (Statistical Pakage for the Social Science) versión 19.
Consideraciones éticas
El estudio fue conducido de acuerdo con las normas éticas nacionales (ley CABA 3301) y Ley nacional de investigación clínica en seres humanos, declaración de Helsinki y contó con la aprobación del comité de Docencia y Ética de nuestra Institución.
Los pacientes firmaron consentimiento informado para la utilización de sus datos de forma anónima.
RESULTADOS
En el período estudiado, se intervinieron 94 pacientes con una edad media de 57,6 ± 13,8 años, 53 % de sexo femenino con una mediana de seguimiento de 3,3 años (RIC 1,1-5,1). Tabla 1
Tabla 1 Características basales de la población
| Variables | n= 94 |
|---|---|
| Edad (años), media ±DE | 57,3 ± 13,2 |
| Género femenino, n (%) | 50 (53,1) |
| HTA, n (%) | 59 (62,7) |
| Dislipidemia, n (%) | 54 (57,4) |
| Diabetes, n (%) | 11 (11,7) |
| Tabaquismo, n (%) | 21 (22,3) |
| Síncope, n (%) | 13 (13,8) |
| Angina, n (%) | 17 (18) |
| Enfermedad coronaria, n (%) | 19 (20,2) |
| Tratamiento farmacológico, n (%) | |
| Betabloqueantes | 65 (69,1) |
| Verapamilo | 2 (2,1) |
| Amiodarona | 23 (24,4) |
| Diuréticos | 35 (36,1) |
| ARA II | 17 (18) |
| Muerte súbita familiar, n (%) | 11 (11,7) |
| Ablación septal previa con alcohol, n (%) | 6 (6,3) |
| CDI previo, n (%) | 11 (11,7) |
ARA II: antagonistas de la angiotensina II; CDI: cardiodesfibrilador implantable; DE: desviación estándar; HTA: hipertensión arterial
A todos los pacientes se les realizo una MSA, y a 43 de ellos (45,7 %) se les efectuó además tratamiento concomitante de la válvula mitral o el aparato subvalvular mitral (plástica de la válvula mitral a 9, plicatura de la válvula mitral a 26, sección de cuerda de segundo orden a 14, sección de músculo accesorio a 8, reemplazo de la válvula mitral a 3). Además se realizó reemplazo de la válvula aórtica a 3 pacientes (3,1 %), bypass coronario a 19 (20,2 %) y cirugía de Maze a 17 (18 %).
Todos los pacientes presentaron bloqueo completo de rama izquierda luego de la intervención; el 7,4 % requirió marcapaso definitivo por bloqueo auriculoventricular completo, el 5,3 % en los pacientes que se realizó miectomía septal aislada. Dos pacientes presentaron fibrilación auricular (FA) en el pre y postoperatorio inmediato y 5 en el postoperatorio alejado.
Hubo 3 (3,1 %) comunicaciones interventriculares relacionadas con el acto quirúrgico, y la mortalidad perioperatoria dentro de los 30 días fue de 1 paciente (1,06 %). Nueve pacientes fallecieron en el seguimiento (9,5 %), 3 de ellos en relación con su patología de base (3,2 %).
Respecto de la clase funcional, en el seguimiento alejado el 89 % se encontraba asintomático.
Con relación a los parámetros estructurales, se observó una reducción significativa del máximo espesor septal, de 21,3 mm en el preoperatorio a 14 mm en el postoperatorio inmediato, (p < 0,001) que se mantuvo en el postoperatorio alejado.
Respecto del tamaño de la aurícula izquierda, se observó una reducción significativa, su diámetro anteroposterior pasó de 49,7 mm a 48,2 mm en el período postoperatorio inmediato (p < 0,001) y a 46,2 mm en el posoperatorio alejado (p < 0,001). El volumen indexado por superficie corporal pasó de 57,6 ml/m2 a 51,2 ml/m2 (p < 0,001) en el postoperatorio inmediato, y a 46,1 ml/m2 (p < 0,001) en el alejado. Por su parte, el área pasó de 30,1 cm2 a 28,2 cm2 (p < 0,001) en el postoperatorio inmediato, y a 26,3 cm2 (p < 0,001) en el postoperatorio alejado (Tabla 2 y Figura 2).
Tabla 2 Modificación de los parámetros ecocardiográficos con la intervención
| Variable | Preoperatorio | POP inmediato | POP alejado | p |
|---|---|---|---|---|
| Espesor máximo (mm), media ±DE | 21,3 ± 3,9 | 14 ± 3 | 14 ± 3 | <0,001 |
| Gradiente reposo (mmHg), media ±DE | 49,2 ± 31,4 | 6,4 ± 9,3 | 4,6 ± 9,4 | <0,001 |
| Gradiente Valsalva (mmHg), media ±DE | 93,9 ± 39,7 | 8,7 ± 13 | 7,2 ± 14 | <0,001 |
| Volumen AI (ml/m2), media ±DE | 57,6 ± 18,4 | 51,2 ± 17,2 | 46,1 ± 16,5 | <0,001 |
| Área AI (cm2), media ±DE | 30,1 ± 5,9 | 28,2 ± 5,4 | 26,3 ± 5,6 | <0,001 |
| Diámetro AI anteroposterior (mm), (media ±DE) | 49,7 ± 6 | 48,2 ± 5,8 | 46,2 ± 5,4 | <0,001 |
| Función diastólica, n (%) | ||||
| Normal | 0 | 0 | 1 (1,2) | |
| FA | 2 (2,1) | 2 (2,1) | 5 (5,3) | |
| Grado I | 36 (38,3) | 40 (43) | 57 (61,3) | <0,001 |
| Grado II | 55 (58,5) | 48 (51,7) | 27 (29) | |
| Grado III | 1 (1,1) | 0 | 0 | |
| Prótesis mitral | 0 | 3 (3,2) | 3 (3,2) | |
| Relación E/e´, media ±DE | 15,7 ± 4,8 | 13 ± 3,3 | 11,1 ± 3,2 | <0,001 |
| FEVI (%), media ±DE | 65 ± 6,2 | 59,9 ± 6,1 | 60 ± 6,8 | <0,001 |
| PSAP (mmHg), media ±DE | 32,9 ± 9,5 | 30,1 ± 7,9 | 27,5 ± 8,4 | <0,001 |
| Insuficiencia mitral, n (%) | ||||
| Sin | 0 | 3 (3,2) | 3 (3,2) | |
| Leve | 44 (46,7) | 80 (87,9) | 80 (87,9) | <0,001 |
| Moderada | 38 (40,4) | 8 (8,7) | 8 (8,7) | |
| Grave | 12 (12,7) | 0 | 0 | |
AI: aurícula izquierda; DE: desviación estándar; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; POP: postoperatorio; PSAP: presión sistólica de la arteria pulmonar
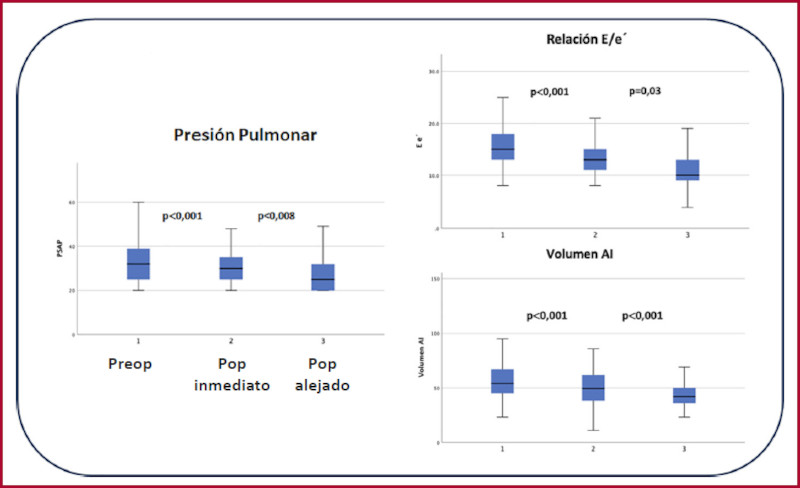
Fig. 2 Miectomía septal ampliada y cambios en el volumen de la aurícula izquierda y la relación E/e´ AI: aurícula izquierda; RIC: rango intercuartílico
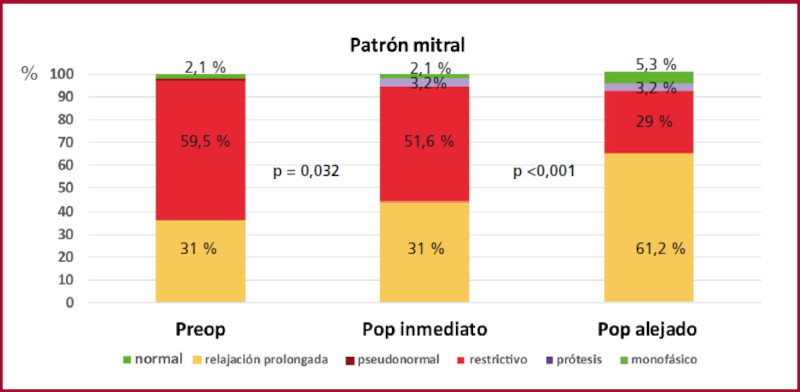
Respecto de los parámetros funcionales, los gradientes en reposo pasaron de 49,2 mmHg a 6,4 mmHg (p < 0,001), y de allí a 4,6 mmHg (p = 0,224) en los períodos inmediato y alejado, y con maniobra de Valsalva de 93,9 mmHg a 8,7 mmHg (p < 0,001), y a 7,2 mmHg (p = 0,226) respectivamente. La función diastólica fue valorada como grado II en el 59,3 % de los pacientes en el preoperatorio, en el 51,6 % en el postoperatorio inmediato y en el 29 % en el postoperatorio alejado (Figura 3). En la misma línea se evidenció un cambio en la relación E/e´ y la presión sistólica pulmonar. La insuficiencia mitral moderada a grave pasó de 53,1 % en el preoperatorio a 8,7 % en el postoperatorio alejado y la presión pulmonar de 32 mmHg a 27 mmHg respectivamente. La fracción de eyección del VI (FEVI) pasó de 65 a 60 % (p < 0,001) en el postoperatorio inmediato y se mantuvo en 60 % (p=0,953) en el postoperatorio alejado.
DISCUSIÓN
La importancia de los resultados obtenidos en este trabajo es la evidencia del impacto significativo de la MSA en los diferentes parámetros hemodinámicos estudiados por ecocardiografía, y la mejoría clínica de los pacientes. Nos gustaría resaltar 4 hallazgos de este trabajo.
Primero, desde el punto de vista estructural se evidenció una reducción del tamaño de la aurícula izquierda medida en todas sus formas, que impresiona acentuarse con el paso del tiempo. Los probables mecanismos que entendemos que están implicados en este fenómeno son la reducción de la insuficiencia mitral y la reducción de la presión de lleno del VI. En relación con la primera, los pacientes intervenidos de insuficiencia mitral aislada suelen mostrar este fenómeno, correlacionado en el caso de las plásticas mitrales con el grado de insuficiencia mitral residual. En relación con las presiones de llenado, la reducción del gradiente dinámico tiene un impacto demostrado a nivel de la presión de fin de diástole y contribuye a este fenómeno. Desde el punto de vista pronóstico, el tamaño de la AI es un factor de riesgo independiente de resultados adversos en pacientes con MCH, y el aumento del volumen de la AI se asocia con un mayor riesgo de fibrilación auricular, accidente cerebrovascular tromboembólico, insuficiencia cardiaca y mortalidad cardiovascular, lo que impresiona representar mucho más que un simple cambio estructural. 8),(9),(10),(11),(12),(13),(14),(15),(16),(17),(18 Nuestros hallazgos han sido reportados previamente por Tower-Rader y cols. que en una revisión de 25 pacientes observaron una disminución significativa de volumen auricular 2 años después de la miectomía. 19 De manera similar, Finocchiaro y cols. demostraron una marcada reducción del volumen de la AI en una cohorte de 40 pacientes que se sometieron a terapia de reducción septal (miectomía o ablación septal con alcohol). 20 Kyung Eun Ha y cols. en una cohorte de 44 pacientes intervenidos, observaron una reducción del volumen auricular y un aumento del strain de esta cámara, compatible no solo con la reducción del tamaño sino con una mejoría de la función de fibra. 21
Segundo, la valoración “hemodinámica” ecocardiográfica mostró una reducción de la variable E/e´ y cambios en el patrón de llenado transmitral. Estas modificaciones impresionan relacionadas con la reducción de la presión de fin de diástole del VI, secundaria a la reducción importante que el procedimiento logró en los gradientes dinámicos del tracto de salida del VI tanto en reposo como con Valsalva. Muestra de ello es que los cambios se notan en el período postoperatorio inmediato. Por su lado, ambas variables tienden a mejorar aún más en el postoperatorio alejado, hecho que pudiera explicarse por la mejoría de la función diastólica gradual que produce el alivio de la obstrucción. Este hecho ha sido reportado en otros trabajos como en la cohorte de Nguyen y cols. de 656 pacientes, también notaron una mejora en la relación E/e’, que se produjo en la fase postoperatoria temprana y se mantuvo en el seguimiento tardío. 22 Existe evidencia que correlaciona la obstrucción dinámica con el desarrollo de isquemia miocárdica y fibrosis intersticial, por lo que hipotetizamos que dicho alivio podría estar teniendo un fenómeno retrógrado. 23),(24
Tercero, la FEVI evidenció una caída en el postoperatorio inmediato que podría estar vinculada al impacto de la bomba de circulación extracorpórea utilizada durante la cirugía, pero sobre todo al desarrollo de bloqueo de rama izquierda por la miectomía. Este último fenómeno provoca disincronía mecánica y caída del volumen eyectivo, sin descartar que tenga un impacto en la reducción del gradiente dinámico. El análisis del postoperatorio alejado muestra una recuperación numérica, aunque no significativa que requiere un mayor seguimiento para su análisis. 23),(24),(25),(26 En la misma línea, Ha y cols. observaron una relación entre la duración del QRS postmiectomía y la caída de la FEVI, acompañado de una reducción del strain longitudinal no septal del VI. 21
Cuarto, los pacientes mostraron una reducción de la presión sistólica pulmonar medida ecocardiográficamente que se profundiza con el tiempo. Este hecho muestra que los cambios en las presiones de llenado izquierdas y la mejoría de la función diastólica tienen un impacto en el circuito pulmonar y las cámaras derechas, lo que probablemente contribuye a explicar la mejoría clínica de los pacientes. 25),(26
LIMITACIONES
El número de pacientes incluidos puede disminuir la confiabilidad de varios de los datos obtenidos. Sn embargo, la consistencia de los hallazgos hace pensar en la directa relación entre la intervención y los cambios observados. Entendemos por otro lado las limitaciones de los métodos para estimar con exactitud las presiones de llenado ventricular en este escenario; sin embargo, existe suficiente información para considerar que los cambios en dichas variables se asocian a mejoría de la función diastólica.
CONCLUSIÓN
En esta cohorte de pacientes con MCHO, la realización de una MSA se asoció a una mejoría significativa de la función diastólica del VI, reducción de las presiones de llenado y pulmonares y grados de insuficiencia mitral, y a un remodelado reverso de la aurícula izquierda.
Es posible que esta combinación de efectos explique los beneficios clínicos de la intervención.











 texto em
texto em