Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de endocrinología y metabolismo
versão On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.52 no.2 Ciudad Autónoma de Buenos Aires jul. 2015
TRABAJO ORIGINAL
Departamento infantojuvenil de SAEM
Características clínicas y etiología de la ginecomastia en pacientes en edad prepuberal
Clinical features and etiology of gynecomastia in patients at prepubertal age
Gottlieb S 1, Pasqualini T 2, Martínez A1, Bengolea SV 3, Azaretzky M 4, Ciaccio M 5, Finkielstain GP 1, Campeni S 6, Suárez M 4
1Hospital de Niños Ricardo Gutiérrez, 2Hospital Italiano, 3Hospital Juan A. Fernández, 4Hospital Teodoro Álvarez, 5Hospital Nacional de Pediatría Juan P. Garrahan, 6Hospital de Clínicas José de San Martín. UBA. CABA. Argentina
Correspondencia: Martha Suárez - Aranguren 2701 CABA (1406 FWY) Argentina - Teléfono: 54-11 - 4611-6666 Int.: 2283 Mail: masuarez11@gmail.com.ar - Fax: 54-11 - 4501-3066
Recibido: 18-11-2014
Aceptado: 04-12-2014
RESUMEN
La ginecomastia es la proliferación benigna del tejido glandular mamario del varón, generalmente aparece en ciertos periodos de la vida como la época neonatal, puberal o senil, siendo la expresión de cierto disbalance en la acción de estrógenos y andrógenos en la glándula mamaria. Es poco frecuente durante la prepubertad y se debe investigar exhaustivamente el origen de la misma.
Objetivo: evaluar las características clínicas y poder definir la etiología en un grupo de pacientes con ginecomastia prepuberal,
Materiales y métodos: es un estudio retrospectivo, descriptivo y multicéntrico. Se recolectaron datos de antecedentes familiares, personales, examen físico, laboratorio, evolución, conducta terapéutica y se determinaron las posibles etiologías.
Resultados: Fueron evaluados 53 pacientes con ginecomastia, con edad media de 8,4 años (0,88-13,72 años), se encontró mayor prevalencia en niños mayores de 7 años (79,2 %). La presentación bilateral fue la más frecuente en el 73,5 %, 17 (32 %) presentaron obesidad, siendo en 7 (13,7 %) severa (IMC ≥ 3 SDS). En 34 pacientes (64,1 %) no se encontró la etiología; en 12 pacientes (23,5 %) se constató fuente exógena de estrógeno; 2 pacientes con exceso de aromatasa; 1 con neurofibromatosis tipo I y glíoma del nervio óptico; 1 niño con tumor suprarrenal izquierdo productor de estrógenos y 1 paciente con síndrome de Peutz-Jeghers.
Conclusión: La ginecomastia prepuberal es poco común, en esta población el mayor porcentaje fue idiopática o por exposición a estrógenos exógenos, pero es una señal de alarma que obliga a descartar la presencia de un trastorno endocrinológico importante.
Rev Argent Endocrinol Metab 52:57-65, 2015
Los autores declaran no poseer conflictos de interés.
Palabras clave: Ginecomastia; Ginecomastia prepuberal.
ABSTRACT
Gynecomastia is the benign proliferation of male breast glandular tissue. The occurrence of gynecomastia at prepubertal ages is very uncommon and can be a sign of severe endocrine or systemic disease. The main underlying mechanism for the development of gynecomastia appears to be the imbalance between estrogen and androgen action.
Objective: to assess clinical characteristics, etiology and course of prepubertal gynecomastia in a group of patients regularly followed at the endocrinology clinic. We performed a retrospective, descriptive, multicenter study.
Materials and methods: data on family history, past history of the disease, physical examination, and clinical course were collected.
Results: 53 prepubertal patients were included. Median age at presentation was 8.4 years (0.88-13.72 years). An increased prevalence was observed in children > 7 years (79.2 %). Bilateral gynecomastia was the most common form of presentation, (73.5 %). Seventeen patients (32 %) were obese, 7 (13.7 %) with a BMI above 3 SDS. In 34 patients (64.1 %) the etiology of gynecomastia could not be identified (idiopathic). In 12 patients (23.5 %) estrogen exposure was detected; 2 patients suffered from aromatase excess syndrome, 1 had neurofibromatosis type I and optic glioma, 1 had a feminizing adrenocortical tumor and 1 had Peutz-Jeghers syndrome.
Conclusion: Prepubertal gynecomastia is rare. In this cohort of 53 children, the most common etiologies were idiopathic or exogenous estrogens exposure. Although gynecomastia may be due to benign causes, in the majority of patients evaluations should be performed to rule out a severe underlying systemic or endocrine disease.
Rev Argent Endocrinol Metab 52:57-65, 2015
No financial conflicts of interest exist.
Key words: Gynecomastia; Prepubertal Gynecomastia.
INTRODUCCIÓN
Se define ginecomastia como la proliferación benigna del tejido glandular mamario en el varón. El sustrato anatomopatológico se caracteriza por hiperplasia ductal epitelial, infiltrado inflamatorio periductal y aumento de tejido graso subareolar. La fibrosis periductal, hialinización estromal e infiltración grasa subareolar caracterizan la forma crónica. Tiene una incidencia etaria trimodal: 60-90 % en etapa neonatal, 50-60 % en la pubertad y 70 %, en edades avanzadas (entre 50-69 años)(1-3).
La aparición de ginecomastia en la etapa puberal es un hallazgo frecuente, considerándose como parte de la fisiología normal; en general se observa en los primeros estadios de desarrollo y es secundaria al desbalance de la relación andrógenos/estrógenos típica de esta etapa(4,5). En cambio, en etapa prepuberal es muy poco frecuente, a excepción de la que puede observarse en los primeros meses de vida relacionada a la producción de esteroides en la unidad feto-placentaria durante el embarazo. Si persiste o comienza después del primer año de vida, su origen debe investigarse exhaustivamente, realizando un interrogatorio completo, un examen físico cuidadoso y exámenes de laboratorio y radiológicos adecuados(1-3).
La ginecomastia prepuberal puede responder a distintas etiologías:
1. EXCESO DE ESTRÓGENOS
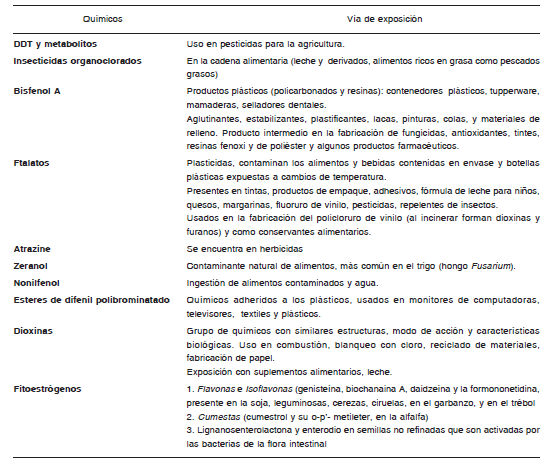
Ante la presencia de ginecomastia prepuberal se debe descartar en primer término, la exposición a estrógenos exógenos, ya sea por la ingestión de los mismos en medicamentos o en alimentos tratados con hormonas, preparaciones cosméticas (cremas con estrógenos y lociones). También puede ser por compuestos de similar acción, que actúan como disruptores endocrinos, que ingresan al organismo por ingestión, inhalación y/o exposición dérmica (ej.: productos que contienen lavanda o aceite de té(6-10) (Tabla I) e interfieren sobre el desarrollo glandular normal, vía interacción con los receptores estrogénicos (receptor de estrógeno nuclear (ERs), receptores de estrógenos unidos a la membrana, o el receptor de estrógeno acoplado a la proteína G (GPR30))(11).
TABLA I. Disruptores endocrinos, causantes de ginecomastia
Algunos medicamentos, drogas y el abuso de alcohol pueden causar ginecomastia. Tabla II(12-18).
TABLA II. Drogas causantes de ginecomastia (Adaptada de Bembo SA, y col. Clin J Med 2004)(18)

2. INCREMENTO DE LA PRODUCCIÓN ENDÓGENA DE ESTRÓGENOS
A) Por el testículo
Tumores productores de estrógenos o sus precursores
– El tumor de células germinales segrega gonadotrofina coriónica humana (β hCG) que produce disfunción de las células de Leydig a través de la inhibición de la enzima citocromo P450c17 que media la actividad 17-hidroxilasa y 17,20-liasa(19), causando una disminución de la producción de andrógenos. Por otra parte, laß hCG estimula la secreción de testosterona y la actividad aromatasa en las células de Leydig por lo que los precursores androgénicos se convierten a estrona y a estradiol. El resultado es un aumento relativo de la producción de estrógenos sobre testosterona.
– Los tumores de células de Leydig segregan mayor cantidad de estradiol y aromatizan más los precursores androgénicos a estrógenos(20,21).
– Los tumores de células de Sertoli se asocian con ginecomastia por aumento de la actividad aromatasa. Pueden ocurrir en forma aislada o estar asociados al síndrome de Peutz-Jeghers o al complejo de Carney(22,23).
B) Por la adrenal
– La mayoría de los tumores suprarrenales se asocian a aumento en la producción de andrógenos adrenales, androstenediona, y dehidroepiandrosterona. La producción de estrógenos está aumentada por la mayor disponibilidad de estos andrógenos que sirven como sustrato para la aromatización extraglandular o más raramente, el tumor segrega estrógenos por sí mismo(24,25).
– La hiperplasia suprarrenal congénita por deficiencia de la enzima 21 hidroxilasa ha sido referida muy raramente como posible causa de ginecomastia en pacientes prepuberales sin tratamiento(26).
C) Por un aumento de la aromatización de andrógenos a estrógenos
– Aumento de la actividad aromatasa se encuentra en el hiperestrogenismo familiar o síndrome de exceso de aromatasa secundario a mutaciones con ganancia de función del gen de la aromatasa. El gen p450 aromatasa, también llamado CYP19 se halla en el cromosoma 15q21.2(27).
La enzima cP450 aromatasa es la que cataliza la síntesis de estrógenos a partir de andrógenos. Su importancia biológica no solo se relaciona con la síntesis de estrógenos, sino que además influye en la relación andrógeno/estrógeno en diferentes tejidos. Se expresa en múltiples sitios: gónadas, tejido adiposo, hueso, cerebro (hipotálamo, hipocampo, amígdala) arterias coronarias, etc. Androstenediona y testosterona son sus sustratos fisiológicos más importantes, sin embargo, la dehidroepiandrosterona (DHEA) puede convertirse en androstenediona, estradiol y estrona en los tejidos periféricos dependiendo de la actividad de las enzimas 17[beta]-hidroxiesteroide dehidrogenasa, 5[alfa]-reductasa, y aromatasa). La DHEA puede ser fuente de estrógenos durante la adrenarca, dando origen a ginecomastia en esta etapa del desarrollo(28).
El tejido adiposo es un sitio activo de aromatización extraglandular de testosterona a estradiol y de androstenediona a estrona, por lo tanto la obesidad predispone al desarrollo de ginecomastia(29,30).
3. ALTERACIÓN DE LAS PROTEÍNAS TRANSPORTADORAS
Cambios en los niveles séricos de la globulina transportadora de andrógenos pueden producir alteración en el balance entre los niveles de testosterona y estrógenos libres, como ocurre en la ginecomastia del hipertiroidismo(31) y la enfermedad hepática crónica(32).
OBJETIVO
Evaluar características clínicas y definir etiología en un grupo de pacientes con ginecomastia prepuberal
SUJETOS Y MÉTODOS
Diseño del estudio
Estudio retrospectivo, descriptivo y multicéntrico de una cohorte de varones con ginecomastia prepuberal, en el que participaron profesionales integrantes del Departamento Infantojuvenil de la Sociedad Argentina de Endocrinología y Metabolismo.
Pacientes y procedimientos:
Criterios de inclusión: niños de sexo masculino, prepuberales, que presentan ginecomastia.
Criterios de exclusión: pacientes con genitales ambiguos
Procedimientos del estudio:
1. Se recolectaron los datos de antecedentes familiares, edad de comienzo y tiempo de evolución.
2. Se estimó el grado de desarrollo de la ginecomastia de acuerdo a los grados de Tanner de desarrollo mamario y en centímetros de diámetro mayor.
3. Se analizaron los datos de peso, talla y edad ósea, se calculó el índice de masa corporal (IMC).
4- Se registraron los datos, en condiciones basales o estimuladas, de los niveles de hormona luteinizante (LH), hormona folículoestimulante (FSH), estradiol (E2), estrona (E1), prolactina (PRL), sulfato de dehidroepiandrosterona (DHEA-S), androstenediona (A), testosterona (T),ß -HCG y a feto proteína.
5. Se evaluó la conducta asumida en cada caso: tratamiento o control clínico y la evolución.
6. Interpretación de los resultados de determinaciones hormonales. Debido a que los estudios hormonales fueron realizados con distintas metodologías, se interpretaron de acuerdo a los rangos de cada método.
7. Se evaluaron los datos para determinar posible etiología.
Consideraciones éticas
Por tratarse de un estudio retrospectivo la evaluación, tratamiento y seguimiento de estos pacientes fue el habitual en cuanto a los controles clínicos, ecográficos y de laboratorio que se han realizado.
Todos los procedimientos de este estudio se llevaron a cabo bajo el compromiso de los investigadores de cumplir estrictamente las normas éticas que rigen las investigaciones en humanos, enumeradas en la Declaración de Helsinki de la Asociación Médica Mundial.
Se aseguró la confidencialidad del uso de la información con resguardo de su privacidad.
RESULTADOS
Datos clínicos
– Se analizaron las historias clínicas de 53 pacientes con diagnóstico de ginecomastia: mediana de edad: 8,4 años (rango: 0,88-13,72 años). La mayor prevalencia se observó en niños mayores de 7 años (79,2 %) (Figura 1).

Figura 1. Distribución etaria al momento del diagnóstico.
La forma de presentación más frecuente fue la ginecomastia bilateral en el 73,5 % de los niños, de los cuales 45,3 % presentaban grado III de Tanner y 19 % grado IV.
A pesar que todos los pacientes eran prepuberales, 10 de ellos presentaban vello pubiano, 8 grado II y 2 grado III.
Diecisiete (32 %) de los pacientes presentaron obesidad con un IMC ≥ 2 SDS, en 7 (13,7 %) la obesidad era severa con un IMC ≥ 3 SDS. (Fig. 2).

Figura 2. Distribución etaria según IMC.
Todos los niveles hormonales se hallaron en rangos normales, excepto 14 pacientes que presentaron niveles estradiol ≥10 pg/ml, cuya etiología se muestra en la Tabla III.
TABLA III. Pacientes con niveles elevados de estrógenos. Etiología

Etiologías y evolución
1. En 34 pacientes (64,1 %) no se pudo determinar la etiología de la ginecomastia, 12 eran obesos de los cuales 7 presentaban IMC superior a 3 SDS. Durante la evolución 14 presentaron persistencia de la ginecomastia, 8 remitieron espontáneamente; 2 requirieron cirugía, 1 tratado con citrato de clomifeno sin resolución y 10 no retornaron a la consulta.
2. En 12 pacientes (23,5 %) se pudo constatar una fuente exógena (cremas, soja, ranitidina, etc.).
3. En 2 pacientes de 8,4 y 11,5 años se sospechó exceso de aromatasa, por presentar talla elevada (3,5 y 3,0 SDS), edad ósea adelantada, antecedentes familiares de ginecomastia y niveles de estradiol elevados (29,6 y 83,1 pg/ml). En uno de ellos se realizó la resección del tejido mamario y el otro no retornó a la consulta, luego de 18 meses de seguimiento.
4. En un paciente con neurofibromatosis tipo I y glíoma del nervio óptico y niveles elevados de estradiol (43,3 pg/ml) la ginecomastia persistió a los 18 meses de evolución.
5. En un niño con tumor suprarrenal izquierdo (12×15 mm en TAC) productor de estrógenos (estradiol: 16,6 y 38 pg/ml), la ginecomastia retrogradó luego de la resección de la masa tumoral.
6. Un paciente que presentaba pólipos del aparato digestivo, zonas hiperpigmentadas en la mucosa bucal y tumor de células de Sertoli se diagnosticó síndrome de Peutz-Jeghers. Al examen físico presentaba talla elevada (3,07 SDS), edad ósea adelantada, ginecomastia grado IV con una evolución de 4,5 años. Como único hallazgo bioquímico presentó niveles elevados de estradiol (43,3 pg/ml). Durante el seguimiento se decidió conducta quirúrgica.
DISCUSIÓN
La ginecomastia prepuberal es poco frecuente y su etiología no puede ser determinada en la mayoría de los casos (1-3), por lo general es asintomática y bilateral. Su incidencia no puede ser determinada, en 1983 Haibrach y col. reportaron 41 casos(33), y en 1985 Descamps y col. refirieron que entre 16 casos trece se consideraron de origen idiopático(34). Eivan-Bachard y col. en 2004 encontraron 27 idiopáticos entre 29 niños prepuberales con ginecomastia(2). En el 64 % de nuestra población no pudo encontrarse una causa determinante, siendo la forma de presentación más común la bilateral (73,5 %).
La ginecomastia es consecuencia del desbalance entre la acción estimulante de los estrógenos y la inhibitoria de los andrógenos o a una combinación de ambos factores, sobre la proliferación del tejido mamario. El aumento de la producción estrogénica (ya sea por un aumento de la actividad de la aromatasa, o por una disminución de la inactivación estrogénica), la disminución de la producción local de testosterona desde androstenediona o cambios en el receptor de estrógenos o andrógenos en el órgano blanco, son causas frecuentes de ginecomastia(3,35).
Se debe investigar el uso de fármacos o sustancias químicas ambientales (disruptores endocrinos) que producen ginecomastia. Se ha publicado que la aplicación tópica de aceites de lavanda y árbol de té (tienen acción estrogénica débil y propiedades antiandrogénicas) provocó ginecomastia en 3 chicos prepúberes de 3-10 años y que el cese en la aplicación condujo a una resolución espontánea de la misma. También se ha asociado ginecomastia con la ingestión de un té de hierbas(36). En 26,4 % de nuestros niños se pudo constatar uso de productos con actividad estrogénica.
La asociación entre ginecomastia y obesidad ya ha sido descripta. La prevalencia de obesidad en la población argentina normal en la última década oscila entre 4,1 % y 11 %, cifra menor que la encontrada en nuestro grupo ya que 32 % de los casos eran obesos; 18,8 % de niños con un IMC igual o mayor a 2 SDS y 13,2 % con obesidad severa. Nuestros hallazgos concuerdan con los descriptos por Einay-Bachar y col. los cuales hallaron similar porcentaje de obesidad (31 %) al estudiar 29 niños con ginecomastia prepuberal(2).
Aunque las etiologías más frecuentes en la ginecomastia prepuberal son en general benignas también puede ser un signo de una patología severa o un efecto colateral de una droga prescripta, por lo que una vez detectada se requiere una adecuada y rápida evaluación para identificar su causa. En el presente estudio en 5 niños la ginecomastia estuvo asociada a patología tumoral o defectos genéticos, dos con posible exceso de aromatasa, uno con un tumor suprarrenal productor de estrógenos, uno con neurofibromatosis(37) y uno con síndrome de Peutz-Jeghers y tumor de células de Sertoli(23).
El exceso de aromatasa se caracteriza por presentar aumento de la aromatización extraglandular de los andrógenos en varios tejidos como placenta, gónadas, cerebro, tejido adiposo y piel(27,35). La combinación de ginecomastia prepuberal, aceleración de crecimiento con talla alta en esta etapa del desarrollo, edad ósea acelerada y antecedentes familiares de ginecomastia, (herencia presumiblemente autosómica dominante) sugiere este síndrome(38). Dos de nuestros pacientes presentaron estas características clínicas con niveles elevados de estradiol sugiriendo esta posible etiología.
El paciente con diagnóstico de tumor suprarrenal presentó disminución de la ginecomastia y los niveles de estrógenos luego de la extirpación del mismo. Los tumores adrenales constituyen solo el 0,2 % de las neoplasias pediátricas, siendo más frecuentes en menores de 5 años y en niñas, la ginecomastia es una rara forma de presentación clínica(24).
El síndrome de Peutz-Jeghers se hereda en forma autosómica dominante, en los casos familiares el gen más frecuentemente mutado es el STK11, 19p13.3. Un 40 % de los casos pueden ser esporádicos. En nuestro paciente hallamos ginecomastia con aumento de estrógenos circulantes. Sin embargo algunos niños con tumor de células de Sertoli pueden no presentar aumento en los niveles circulantes de estradiol, como causa de la ginecomastia se ha postulado que pequeñas cantidades de estrógenos serían secundarias al exceso de aromatasa tumoral(24,25) o alternativamente un aumento de biodisponibilidad, síntesis tisular local o aumento de sensibilidad del órgano blanco pueden contribuir(35).
CONCLUSIONES
La ginecomastia es un hallazgo físico poco común en edad prepuberal, siendo generalmente de origen idiopático o por exposición a estrógenos exógenos. Su presencia en esta etapa puede ser debida a un trastorno endocrinológico grave por lo tanto es importante establecer el origen de la misma y realizar rápidamente un tratamiento médico seguro y eficaz.
1. Braunstein GD. Clinical practice. Gynecomastia. N Engl J Med. 357: 1229-37, 2007 [ Links ]
2. Einav-Bachar R, Phillip M, Aurbach-Klipper Y, Lazar L. Prepubertal gynaecomastia: aetiology, course and outcome. Clin Endocrinol (Oxf) 61:55-60, 2004 [ Links ]
3. Ma NS, Geffner ME Gynecomastia in prepubertal and pubertal men. Curr Opin Pediatr. 20:465-70, 2008 [ Links ]
4. Moore DC, Schlaepfer LV, Paunier L, Sizonenko PC. Hormonal changes during puberty: V. Transient pubertal gynecomastia: abnormal androgen-estrogen ratios. J Clin Endocrinol Metab; 58:492-9, 1984 [ Links ]
5. Large DM, Anderson DC. Twenty-four hour profiles of circulating androgens and oestrogens in male puberty with and without gynaecomastia. Clin Endocrinol (Oxf); 11:505-21, 1979 [ Links ]
6. Henley DV, Lipson N, Korach KS, Bloch CA. Prepubertal gynecomastia linked to lavender and tea tree oils. N Engl J Med 356:479-85, 2007 [ Links ]
7. Waring RH, Harris RM. Endocrine disrupters: a human risk? Mol Cell Endocrinol. 244:2-9, 2005 [ Links ]
8. Brody SA, Loriaux DL. Epidemic of gynecomastia among haitian refugees: exposure to an environmental antiandrogen. Endocr Pract 9:370-5, 2003 [ Links ]
9. Braunstein GD. Environmental gynecomastia. Endocr Pract 14:409-11, 2008 [ Links ]
10. Giampietro PG, Bruno G, Furcolo G, Casati A, Brunetti E, Spadoni GL, Galli E Soy protein formulas in children: no hormonal effects in long-term feeding. J Pediatr Endocrinol Metab 17:191-6, 2004 [ Links ]
11. Pellegrini M, Bulzomi P, Lecis M, Leone S, Campesi I, Franconi F, Marino M. Endocrine Disruptors Differently Influence Estrogen Receptorß and Androgen Receptor in Male and Female Rat VSMC. J Cell Physiol. 229:1061-8, 2014 [ Links ]
12. Goldman RD. Drug-induced gynecomastia in children and adolescents. Can Fam Physician. 56 (4):344-5, 2010 [ Links ]
13. Bowman JD, Kim H, Bustamante JJ. Drug-induced gynecomastia. Pharmacotherapy. 32 (12):1123-40, 2012 [ Links ]
14. Bera F, Jonville-Bera AP, Doustin P, Autret E. Impotence and gynecomastia secondary to hyperprolactinemia induced by ranitidine. Therapie. 49:361-2, 1994 [ Links ]
15. Goud BK, Devi OS, Nayal B, Devaki RN A rare case of unilateral gynecomastia during antituberculous chemotherapy with isoniazid.. Indian J Pharmacol. 44:521-2, 2012 [ Links ]
16. Malozowski S, Stadel BV. Prepubertal gynecomastia during growth hormone therapy. J Pediatr. 126:659-61, 1995 [ Links ]
17. Mieritz MG1, Sorensen K, Aksglaede L, Mouritsen A, Hagen CP, Hilsted L, Andersson AM, Juul A. Elevated serum IGF-I, but unaltered sex steroid levels, in healthy boys with pubertal gynaecomastia.Clin Endocrinol (Oxf). 80:691-8, 2014 [ Links ]
18. Bembo SA, Carlson HE. Gynecomastia: its features, and when and how to treat it. Cleve Clin J Med 71:511-7, 2004 [ Links ]
19. Forest MG, Lecoq A, Saez JM. Kinetics of human chorionic gonadotropin-induced steroidogenic response of the human testis. II. Plasma 17 alpha-hydroxyprogesterone, delta4-androstenedione, estrone, and 17 beta-estradiol: evidence for the action of human chorionic gonadotropin on intermediate enzymes implicated in steroid biosynthesis. J Clin Endocrinol Metab 49:284, 1979 [ Links ]
20. Bercovici JP, Nahoul K, Ducasse M, Tater D, Kerlan V, Scholler R. Leydig cell tumor with gynecomastia: further studies-the recovery after unilateral orchidectomy J Clin Endocrinol Metab. 61:957-62, 1985 [ Links ]
21. Kayemba-Kays S, Fromont-Hankard G, Lettelier G, Gabriel S, Levard G. Leydig cell tumour revealed by bilateral gynecomastia in a 15-year-old adolescent: a patient report. J Pediatr Endocrinol Metab. 23:1195-9, 2010 [ Links ]
22. Gourgari E, Saloustros E, Stratakis CA. Large-cell calcifying Sertoli cell tumors of the testes in pediatrics. Curr Opin Pediatr. 24:518-22, 2012 [ Links ]
23. Lefevre H, Bouvattier C, Lahlou N, Adamsbaum C, Bougnères P, Carel JC. Prepubertal gynecomastia in Peutz-Jeghers syndrome: incomplete penetrance in a familial case and management with an aromatase inhibitor. Eur J Endocrinol. 154:221-7, 2006 [ Links ]
24. Chen QL, Su Z, Li YH, Ma HM, Chen HS, Du ML. Clinical characteristics of adrenocortical tumors in children. J Pediatr Endocrinol Metab. 24:535-41, 2011 [ Links ]
25. Watanabe T, Yasuda T, Noda H, Wada K, Kazukawa I, Someya T, Minamitani K, Minagawa M, Wataki K, Matsunaga T, Ohnuma N, Kohno Y, Harada N. Estrogen secreting adrenal adenocarcinoma in an 18-month-old boy: aromatase activity, protein expression, mRNA and utilization of gonadal type promoter. Endocr J. 47:723-30, 2000 [ Links ]
26. Wasniewska M, Raiola G, Galati MC, Salzano G, Rulli I, Zirilli G, De Luca F. Non-classicl 21-hydroxylase deficiency in boys with prepubertal or pubertal gynecomastia. Eur. J Pediatr. 176:1083-4, 2008 [ Links ]
27. Stratakis CA, Vottero A, Brodie A, Kirschner LS, DeAtkine D, Lu Qing, Yue W, Mitsiades CS, Flor AW, Chrousos GP. The aromatase excess syndrome is associated with feminization of both sexes and autosomal dominant transmission of aberrant p450 aromatase gene transcription. J Clin Endocrinol Metab 83:1348–57, 1998 [ Links ]
28. Reed MJ, Purohit A, Woo LW, Newman SP, Potter BV. Steroid sulfatase: molecular biology, regulation, and inhibition. Endocr Rev. 26:171-202, 2005 [ Links ]
29. Ersöz Hö, Onde ME, Terekeci H, Kurtoglu S, Tor H. Causes of gynaecomastia in young adult males and factors associated with idiopathic gynaecomastia. Int J Androl. 25:312-6, 2002 [ Links ]
30. Dundar B, Dundar N, Erci T, Bober E, Büyükgebiz A. Leptin levels in boys with pubertal gynecomastia. J Pediatr Endocrinol Metab. 18:929-34, 2005. [ Links ]
31. Meikle AW. The interrelationships between thyroid dysfunction and hypogonadism in men and boys. Thyroid. 14 Suppl 1:17-25, 2004 [ Links ]
32. Pugeat M, Nader N, Hogeveen K, Raverot G, Déchaud H, Grenot C. Sex hormone-binding globulin gene expression in the liver: drugs and the metabolic syndrome. Mol Cell Endocrinol. 316:53-9, 2010 [ Links ]
33. Haibach H, Rosenholtz MJ. Prepubertal gynecomastia with lobules and acini: a case report and review of the literature. Am J Clin Pathol. 80:252-5, 1983 [ Links ]
34. Descamps H, Chaussain JL, Job JC. Les Gynecomasties du garcon aveant le puberte. Arch Fr Pediatr 42:87-9, 1985 [ Links ]
35. Miller WR, Mullen P, Sourdaine P, Watson C, Dixon JM, Telford J. Regulation of aromatase activity within the breast. J Steroid Biochem Mol Biol. 61:193-202, 1997 [ Links ]
36. Rudel RA, Fenton SE, Ackerman JM, Euling SY, Makris SL. Environmental exposures and mammary gland development: state of the science, public health implications, and research recommendations. Environ Health Perspect. 119:1053-61, 2011 [ Links ]
37. Metwalley KA, Farghaly HS. Aromatase excess syndrome presenting with prepubertal gynecomastia in an Egyptian child with type 1 neurofibromatosis. Indian J Hum Genet. 19:472-74, 2013 [ Links ]
38. Binder G, Iliev DI, Dufke A, Wabitsch M, Schweizer R, Ranke MB, Schmidt M. Dominant transmission of prepubertal gynecomastia due to serum estrone excess: hormonal, biochemical, and genetic analysis in a large kindred. J Clin Endocrinol Metab. 90:484-92, 2005 [ Links ]














