Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de endocrinología y metabolismo
versão On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.52 no.2 Ciudad Autónoma de Buenos Aires jul. 2015
TRABAJO ORIGINAL
PREMIO FASEN - Primer premio básico
Efecto del hiperandrogenismo prenatal sobre la fertilidad
Effect of Prenatal Hyperandrogenism on Fertility
Ferreira SR, Vélez LM, Motta AB
Laboratorio de Fisiopatología Ovárica, Centro de Estudios Farmacológicos y Botánicos (CEFYBO), UBA-CONICET
Correspondencia: Paraguay 2155 Piso 17. Ciudad Autónoma de Buenos Aires CP 1121, Argentina. TE 45083680 int.217 aliciabmotta@yahoo.com.ar
Recibido: 06-03-2015
Aceptado: 14-04-2015
RESUMEN
Introducción: El Síndrome de Ovario Poliquístico (SOP) es una de las endocrinopatías reproductivas más frecuente en mujeres en edad fértil. Dado que la infertilidad es un problema que afecta a numerosas parejas con deseo de concepción en el presente trabajo nos centramos en el estudio del útero, órgano encargado de mantener y proteger al feto en desarrollo durante la gestación.
Objetivo: Evaluar cómo la reprogramación fetal afecta la funcionalidad del tejido uterino durante la etapa puberal y durante la etapa adulta.
Material y Métodos: Se utilizó un modelo murino de hiperandrogenización prenatal (HA). Para ello se utilizaron ratas Sprague-Dawley las cuales fueron inyectadas en los días 16 a 19 de gestación de manera subcutánea con aceite vegetal (grupo Control -C-) o con 2 mg de testosterona (grupo -HA-). Un grupo fue sacrificado a los 60 días -etapa puberal- realizándose una caracterización de la funcionalidad uterina y otro grupo fue estudiado a los 90 días -etapa adulta- evaluándose la fertilidad por vía natural y bajo estimulación gonadotrófica.
Resultados: Durante la etapa puberal el grupo HA prenatalmente presentó un estado proinflamatorio elevado caracterizado por un aumento de la Prostaglandina E (PGE) uterina y la enzima limitante de la síntesis de PGs, Ciclooxigenasa 2 (COX2). El estrés oxidativo del tejido uterino evaluado a través de peroxidación lipídica no mostró diferencias entre C y HA como así tampoco el metabolito antioxidante, Glutation. El receptor activado por proliferadores peroxisomales gama (PPAR γ) se encontró aumentado con respecto al grupo C. En la etapa adulta el grupo HA presentó disminuida su capacidad reproductiva y esto se revirtió luego del tratamiento con gonadotrofinas.
Conclusiones: Bajo este modelo, el HA condiciona la funcionalidad uterina disminuyendo la capacidad reproductiva de animales HA. El tratamiento con gonadotrofinas restablece dicha función, permitiendo a los animales HA alcanzar la preñez.
Rev Argent Endocrinol Metab 52:73-78, 2015
Los autores declaran no poseer conflictos de interés.
Palabras Clave: Hiperandrogenización prenatal; Fertilidad; S índrome de ovario poliquístico.
ABSTRACT
Introduction: Polycystic ovary syndrome (PCOS) is a common endocrine-reproductive disorder that affects women in their reproductive age. Prenatal hyperandrogenism is able to induce polycystic ovary syndrome (PCOS) in rats. PCOS is the commonest cause of anovulatory infertility. PCOS is not only a reproductive pathology, since it includes metabolic disorders (insulin resistance, impaired glucose tolerance, type 2 diabetes mellitus, high risk factor for cardiovascular diseases) and psychological symptoms (depression, increased anxiety, low self-esteem). However; the pathophysiology of PCOS is complex and remains unclear.
Objectives: 1) To evaluate how hyperandrogenism (HA) affects the function of the uterine tissue at puber Pregnant Sprague-Dawley rats were prenatally injected daily with 2 mg free testosterone (HA group) or vehicle (Control group) from day 16 to day 19 of gestation. Female offspring were study at pubertal and adult age. The uterine oxidative stress was quantified by lipid peroxidation index (LP) and antioxidant glutathione (GSH) content. No differences were found between LP and GSH. The protein expressions of peroxisome proliferator-activated receptor gamma (PPAR γ), and the limiting enzyme of the PG synthesis, cyclooxygenase 2 (COX2) and the uterine PGE content increased in the HA group with respect to the C group.
We also studied fertility at adult stage with and without hormone induction. The fertility rate decreased in HA. Hormone induction reversed the fertility rate similarly to controls.
Conclusions: HA affects the uterine function in PCOS. HA increases protein levels of PPAR gamma, which modulates the pro-inflammatory status. The uterine oxidative stress was balanced. Fertility was decreased in the HA group and this was reversed by gonadotropin stimulation.
Rev Argent Endocrinol Metab 52:73-78, 2015
No financial conflicts of interest exist.
Key words: Prenatal hyperandrogenization; Fertility; Polycystic ovary syndrome.
INTRODUCCIÓN
El Síndrome de Ovario Poliquístico (SOP) es una patología heterogénea que afecta entre el 6-10 % de las mujeres en edad reproductiva(1). Esta se caracteriza por hiperandrogenismo, hirsutismo, oligo o amenorrea y/o quistes ováricos(2). Entre las manifestaciones reproductivas se incluyen infertilidad, diabetes gestacional, abortos espontáneos y también desórdenes hipertensivos, entre otras(3). Pero SOP no solo es una patología de índole reproductiva sino que genera anomalías a nivel endocrino y metabólico como insulinorresistencia, síndrome metabólico, obesidad y riesgo cardiovascular incrementado(4-6). En el desarrollo de la patología intervienen el estilo de vida además de un componente genético aún no completamente establecido(7).
Debido a la heterogeneidad de la patología fue necesario aunar criterios de diagnóstico y tratamiento mediante consensos. En el último realizado, en el año 2006, en la conferencia de la Sociedad de Exceso de Andrógenos, se concluyó que es necesario reunir al menos dos de las tres características que posee SOP, entre las cuales se encuentran: 1) Hiperandrogenismo clínico o bioquímico: hirsutismo o hiperandrogenemia. 2) Oligo o anovulación 3) Ovarios poliquísticos por ecografía(1-8).
A partir de estos criterios es posible clasificar 4 fenotipos de SOP: a) SOP severo con anovulación, hiperandrogenismo y ovarios poliquísticos. b) SOP con anovulación e hiperandrogenismo c) SOP con hiperandrogenismo y ovarios poliquísticos d) SOP normo-androgénico con ovarios poliquísticos y anovulación(9,10).
La etiología del SOP es aún desconocida, pero la hipótesis actual sostiene que durante la gestación un exceso de andrógenos genera un ambiente intrauterino desfavorable, lo que induce reprogramación fetal ocasionando consecuencias en la vida adulta del feto en desarrollo(10,11). Una de ellas es la infertilidad que afecta del 16 al 20 % de las parejas en edad reproductiva. La reducción de la cantidad y/o calidad de los folículos ováricos, ya sea por la edad o por las condiciones patológicas, causa disminución en la fertilidad femenina(12).
La mayoría de las mujeres que padecen SOP poseen infertilidad anovulatoria. Según las últimas estadísticas, del total de mujeres con problemas ovulatorios al 75 % le fue diagnosticado SOP, mientras que del total de mujeres con abortos recurrentes el 80 % presentan la patología quística de ovario(13). Existen diversos tratamientos para abordar la infertilidad o el deseo de concepción en pacientes SOP entre los cuales se encuentran estimulación ovárica con FSH, citrato de clomifeno y agonistas de GnRH, entre otros(14-16). En general, una de las primeras líneas de tratamiento en pacientes obesas es la pérdida de peso y el ejercicio físico, lo que podría restablecer la ovulación y favorecer el embarazo como así también prevenir o mejorar las complicaciones metabólicas que trae aparejado SOP(17,18). Pero en el caso de mujeres delgadas o aquellas mujeres obesas luego de haber realizado dieta y ejercicio es posible utilizar un protocolo de inducción de la ovulación con el objetivo de formar un solo folículo mediante el aporte de FSH adecuado(19-22). La inducción de la ovulación se puede obtener mediante dos mecanismos: acción directa sobre el eje hipotálamo-hipofisario incrementando la secreción endógena de gonadotrofinas (antiestrógenos o GnRH pulsátil) o por administración de gonadotrofinas exógenas que actúan directamente sobre el ovario(123-25).
MATERIAL Y MÉTODOS
Se utilizaron ratas Sprague-Dawley preñadas las cuales fueron inyectadas en los días 16 a 19 de gestación de manera subcutánea con aceite vegetal (grupo Control C) o con 2 mg de testosterona (grupo HA). Un grupo de crías hembras fue sacrificado a los 60 días (etapa puberal) (N = 10 animales/grupo) y otro grupo fue estudiado a partir de los 90 días (etapa adulta) con el que se realizaron estudios de fertilidad (N = 30 animales/grupo). Durante la etapa puberal, se analizó en el tejido uterino el estado inflamatorio vía cuantificación de Prostaglandina E (PGE) por Radioinmunoensayo (RIA) y de la enzima limitante de la síntesis de PGE, Ciclooxigenasa 2 (COX2) por Western Blotting (WB).
El estrés oxidativo fue evaluado a través de la peroxidación lipídica (LP) como medida del daño celular y la concentración de glutatión total (GSH) como antioxidante, por espectrometría.
Por otra parte, la regulación lipídica fue estudiada a través de los niveles circulantes del receptor activado por los proliferadores peroxisomales gama (PPARγ).
Durante la etapa adulta, se estudió la capacidad reproductiva por vía natural de las hembras, las cuales fueron puestas en apareo durante 3 días, los animales fueron ciclados cada día y se determinó preñez por presencia de espermatozoides en el extendido vaginal. Se obtuvieron los siguientes parámetros: Índice de Fertilidad (IF) como la cantidad de hembras que logró parir crías vivas del total que fue puesto en apareo y la capacidad materna como el cuidado de las crías por parte de la madre, hasta 72 h posnacimiento. Por otro lado, se evaluó la respuesta al tratamiento con gonadotrofinas. Los animales HA y C fueron sometidos a un protocolo de inducción de la ovulación. Al día 0 fueron inyectados con gonadotrofina coriónica equina (eCG) y al día 2 con gonadotrofina coriónica humana (hCG), en ese período los animales fueron ciclados para estudiar su ciclo estral, su respuesta a la inducción de la ovulación y para determinar preñez por presencia de espermatozoides en el extendido vaginal.
Los resultados fueron analizados mediante el programa Instat (GraphPad software, San Diego, CA, USA) e Infostat - a través de análisis de variables categóricas por tablas de contingencia.
RESULTADOS
En la etapa puberal, el grupo HA presentó un estado proinflamatorio caracterizado por aumento de PGE con respecto al grupo C (Gráfico 1A) y de la expresión proteica de COX2 con respecto al grupo C (Gráfico 1B).
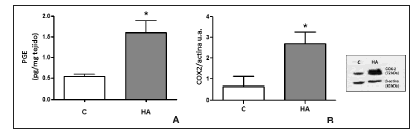
Gráfico 1. A) Contenido de PGE uterina cuantificado por radioinmunoensayo específico, p < 0,007 por t de student b) Expresión proteica uterina de COX2 de ratas por la técnica de Western Blotting, p < 0,05 por t de student.
El estrés oxidativo del tejido uterino a través de la peroxidación lipídica no mostró diferencias entre los grupos C e HA (Gráfico 2A) como así tampoco la concentración de GSH (Gráfico 2B).

Gráfico 2. Determinación de A) la LP como daño oxidativo y B) el antioxidante GSH en el útero, por t de student
Los niveles de PPARγ se encontraron aumentados en el grupo HA respecto del grupo C. (Gráfico 3)
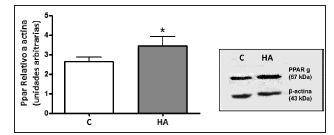
Gráfico 3. Expresión proteica uterina de los receptores PPAR gama p < 0,05
En la etapa adulta, se estudió la capacidad reproductiva por vía natural y se obtuvo que el grupo HA presenta disminuida su capacidad reproductiva respecto el grupo C (Gráfico 4A). Luego del tratamiento con gonadotrofinas, se observó que el grupo HA respondió de la misma manera que el grupo C al protocolo de inducción de la ovulación (Gráfico 4B). La cantidad de crías y la capacidad materna no se vio afectada en el grupo HA. (Gráfico 5A y B, respectivamente)

Gráfico 4. Índice de fertilidad - cantidad de hembras que logró parir crías vivas del total que fue puesto en apareo- A) Por vía natural p < 0,05 B) con estimulación gonadotrófica (protocolo de inyección a día 0 con eCG y día 2 con hCG)

Gráfico 5. A) Capacidad materna: Sobrevida de las crías hasta 72 h posnacimiento. B) Número de crías nacidas en promedio por madre
DISCUSIÓN
El Síndrome de Ovario Poliquístico (SOP) es una de las patologías más comunes asociadas a esterilidad femenina, además de ser considerada la endocrinopatía más frecuente en mujeres en edad reproductiva. El tratamiento de mujeres infértiles con SOP genera numerosas controversias, es por ello que se realizan consensos para establecer criterios de diagnóstico y tratamiento.
En el presente trabajo estudiamos el tejido uterino en un modelo murino, que nos permite estudiar SOP permitiéndonos evaluar la programación fetal. Nos focalizamos en el estudio de los mecanismos involucrados como PPAR gama, PGE y estado oxidativo durante la etapa puberal. Este mismo modelo fue utilizado para el estudio de la capacidad reproductiva durante la etapa adulta por vía natural y mediante el uso exógeno de gonadotrofinas que permitieron revertir la fertilidad, que se ve afectada por HA.
CONCLUSIÓN
Según los resultados expuestos en el presente trabajo, la HA establece durante la etapa puberal un estado proinflamatorio por alteración de los niveles proteicos de PGE y la enzima limitante de su síntesis, COX2. Los niveles proteicos del factor de transcripción PPAR gama se encuentran elevados modulando numerosas funciones uterinas. Por otro lado, sugerimos la existencia de un balance en el estado oxidativo del tejido uterino.
La HA condiciona la funcionalidad uterina, disminuyendo la fertilidad durante la etapa adulta. La utilización de gonadotrofinas permite la reversión de dicha afección.
Agradecimientos
Los autores quieren agradecer a Marcela Márquez y Enzo Cuba por el tratamiento de los animales de laboratorio empleados en el presente trabajo.
Los autores quieren agradecer al Ministerio de Ciencia y Tecnología por los subsidios mediante los cuales fue posible realizar este trabajo: PICT 71/2010
1. Rotterdam EA-SPCWG. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil. Steril. 81:19-25, 2004 [ Links ]
2. Azziz R. PCOS: a diagnostic challenge. Reprod Biomed Online 8:644-648, 2004 [ Links ]
3. Boomsma CM, Eijkemans MJ, Hughes EG, Visser GH, Fauser BC, Macklon NS. A meta-analysis of pregnancy outcomes in women with polycystic ovary syndrome. Hum Reprod Update 12:673-683, 2006 [ Links ]
4. Luque-Ramirez M, Escobar-Morreale HF. Polycystic ovary syndrome as a paradigm for prehypertension, prediabetes, and preobesity. Curr Hypertens Rep 16:500, 2014 [ Links ]
5. Abbott DH, Bruns CR, Barnett DK, Dunaif A, Goodfriend TL, Dumesic DA, Tarantal AF. Experimentally induced gestational androgen excess disrupts glucoregulation in rhesus monkey dams and their female offspring. Am J Physiol Endocrinol Metab 299:E741-751, 2010 [ Links ]
6. Heber MF, Ferreira SR, Velez LM, Motta AB. Prenatal hyperandrogenism and lipid profile during different age stages: an experimental study. Fertil. Steril. 99:551-557, 2013 [ Links ]
7. Diamanti-Kandarakis E, Piperi C, Spina J, Argyrakopoulou G, Papanastasiou L, Bergiele A, Panidis D. Polycystic ovary syndrome: the influence of environmental and genetic factors. Hormones (Athens) 5:17-34, 2006 [ Links ]
8. Amsterdam EA-SrPCWG. Consensus on women's health aspects of polycystic ovary syndrome (PCOS). Hum. Reprod. 27:14-24, 2012 [ Links ]
9. Panidis D, Tziomalos K, Misichronis G, Papadakis E, Betsas G, Katsikis I, Macut D. Insulin resistance and endocrine characteristics of the different phenotypes of polycystic ovary syndrome: a prospective study. Hum. Reprod. 27:541-549, 2012 [ Links ]
10. Abbott DH, Barnett DK, Bruns CM, Dumesic DA. Androgen excess fetal programming of female reproduction: a developmental aetiology for polycystic ovary syndrome? Hum. Reprod. Update 11:357-374, 2005 [ Links ]
11. Abbott DH, Dumesic DA, Franks S. Developmental origin of polycystic ovary syndrome - a hypothesis. J. Endocrinol. 174:1-5, 2002 [ Links ]
12. Franks S, Stark J, Hardy K. Follicle dynamics and anovulation in polycystic ovary syndrome. Hum Reprod Update 14:367-378, 2008 [ Links ]
13. Brassard M, AinMelk Y, Baillargeon JP. Basic infertility including polycystic ovary syndrome. Med Clin North Am 92:1163-1192, xi, 2008 [ Links ]
14. Consensus on infertility treatment related to polycystic ovary syndrome. Fertil Steril 89:505-522, 2008 [ Links ]
15. Fauser BC, Tarlatzis BC, Rebar RW, Legro RS, Balen AH, Lobo R, Carmina E, Chang J, Yildiz BO, Laven JS, Boivin J, Petraglia F, Wijeyeratne CN, Norman RJ, Dunaif A, Franks S, Wild RA, Dumesic D, Barnhart K. Consensus on women's health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil. Steril. 97:28-38 e25, 2012 [ Links ]
16. Leanza V, Coco L, Grasso F, Leanza G, Zarbo G, Palumbo M. Ovulation induction with clomiphene citrate and metformin in women with polycystic ovary syndrome. Minerva Ginecol. 66:299-301, 2014 [ Links ]
17. Moran LJ, Pasquali R, Teede HJ, Hoeger KM, Norman RJ. Treatment of obesity in polycystic ovary syndrome: a position statement of the Androgen Excess and Polycystic Ovary Syndrome Society. Fertil. Steril. 92:1966-1982, 2009 [ Links ]
18. Banu J, Fatima P, Sultana P, Chowdhury MA, Begum N, Anwary SA, Ishrat S, Deeba F, Begum SA. Association of infertile patients having polycystic ovarian syndrome with recurrent miscarriage. Mymensingh Med J 23:770-773, 2014 [ Links ]
19. Palomba S, Zullo F. Ovulation induction in infertile patients with polycystic ovary syndrome. Minerva Ginecol 58:115-135, 2006 [ Links ]
20. Palomba S, Orio F, Zullo F. Ovulation induction in women with polycystic ovary syndrome. Fertil Steril 86 Suppl 1:S26-27, 2006 [ Links ]
21. Hamilton-Fairley D, Kiddy D, Watson H, Paterson C, Franks S. Association of moderate obesity with a poor pregnancy outcome in women with polycystic ovary syndrome treated with low dose gonadotrophin. Br J Obstet Gynaecol 99:128-131, 1992 [ Links ]
22. Schoot DC, Hop WC, Pache TD, de Jong FH, Fauser BC. Growth of the dominant follicle is similar to normal in patients with gonadotrophin-stimulated polycystic ovary syndrome exhibiting monofollicular development during a decremental dose regimen. Acta Endocrinol. (Copenh). 129:126-129, 1993 [ Links ]
23. Donderwinkel PF, Schoot DC, Pache TD, de Jong FH, Hop WC, Fauser BC. Luteal function following ovulation induction in polycystic ovary syndrome patients using exogenous gonadotrophins in combination with a gonadotrophin-releasing hormone agonist. Hum. Reprod. 8:2027-2032, 1993 [ Links ]
24. Palomba S, Falbo A, La Sala GB. Metformin and gonadotropins for ovulation induction in patients with polycystic ovary syndrome: a systematic review with meta-analysis of randomized controlled trials. Reprod Biol Endocrinol 12:3, 2014 [ Links ]
25. Homburg R. Management of infertility and prevention of ovarian hyperstimulation in women with polycystic ovary syndrome. Best Pract Res Clin Obstet Gynaecol 18:773-788, 2004 [ Links ]














