Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciencia y Tecnología
versão On-line ISSN 1851-7587
Rev. cienc. tecnol. no.22 Posadas dez. 2014
ÁREA: INGENIERÍA, TECNOLOGÍA E INFORMÁTICA
Cinetica de absorcion de agua de tejidos de mandioca macerados con una poligalacturonasa microbiana
Kinetics of water absorption of cassava tissues macerated with a microbial Polygalacturonase
Maria M. Brousse1,*, Maria L. Vergara1, Emilce R. Zubreski1, Nancy E. Cruz1, Maria A. Martos1
1 Facultad de Ciencias Exactas, Quimicas y Naturales, Universidad Nacional de Misiones, Felix de Azara 1552, CP 3300, Posadas, Misiones, Argentina.
* E-mail: brousse.mariamarcela@gmail.com
Resumen
El objetivo del presente trabajo fue determinar la capacidad predictiva de los modelos de Pilosof y Exponencial, para describir la cinetica de absorcion de agua de tejidos de mandioca macerados con el extracto enzimatico de Wickerhamomycesanomalus. Los tejidos de mandioca fueron macerados en frascos erlenmeyers, a 45 oC, en agitador rotatorio (190 rpm), durante 1, 2 y 4 h, utilizando diferentes diluciones del extracto enzimatico. El tejido macerado fuefiltrado y secado.Se obtuvo un buen ajuste de los datos experimentales a los modelos de absorcion de agua evaluados. El mayor valor de C∞ (concentracion de agua en el equilibrio) se obtuvo a tiempos de maceracion de 1 h, utilizando extracto enzimatico sin diluir, con un menor dano celular respecto a los tratamientos efectuados a mayores tiempos. Al aumentar el tiempo del tratamiento enzimatico, la constante de velocidad de absorcion de agua (K) fue mayor, pero C∞ disminuyo.
Palabras clave: Poligalacturonasa; Maceracion; Mandioca; Absorcion de agua; Cinetica.
Abstract
The objective of the present work was to determine the predictive ability of Pilosof and exponential models to describe water absorption kinetics of cassava tissues macerated with the enzymatic extract of Wickerhamomycesanomalus. Cassava tissues were macerated in Erlenmeyers flasks at 45 oC, on a rotator shaker (190 rpm), during 1,2 and 4 h, with different extract enzymatic dilutions. Macerated cassava tissues were filtered and dried. A good fit of the experimental data to water absorption models evaluated was obtained. The highest value of C∞ (water concentration at equilibrium) was reached at 1 h of maceration, using undiluted enzymatic extract, with a lower cell damage respect to longer treatments. At higher enzymatic treatment times, water absorption rate constant (K) increased, but C∞ decreased.
Keywords: Polygalacturonase; Maceration; Cassava; Water absorption; Kinetic.
Introduccion
Las enzimas pécticas son las responsables de la degradación de las sustancias pécticas presentes en la laminilla media y en la pared celular primaria de las plantas superiores. Algunas pectinasas (denominadas PPasas, protopectinasas) tienen la capacidad de liberar sustancias pécticas cementantes de la pared celular de las plantas, produciendo la maceración de los tejidos vegetales [1]. La maceración es un proceso a través del cual los tejidos organizados de los vegetales, se transforman en una suspensión de células intactas, manteniendo de esta manera las propiedades nutritivas del alimento [2].
El puré de mandioca deshidratado es un producto obtenido a partir de raíces de mandioca (ManihotesculentaCrantz), mediante un proceso tecnológico en la Provincia de Misiones, Argentina. Su producción se realiza mediante procesos de secado y molienda, los cuáles ocasionan una gran ruptura celular [3]. Esta ruptura celular conduce a la pérdida de la integridad del tejido vegetal y se ve reflejada en la disminución de la capacidad de retención de agua del producto rehidratado [4, 5].
En algunos casos, la determinación de la velocidad de rehidratación sirve como medida de la calidad del producto [6]. En un intento de simplificar el modelado del proceso de adsorción de agua se han formuladodiversos modelos empíricos como el modelo propuesto por Pilosof y col., 1985 [7], y el modelo Exponencial, como herramientas de análisis precisas para la predicción y la optimización de la cinética de rehidratación. Una levadura pectinolítica fue aislada de frutas cítricas en la Provincia de Misiones, Argentina e identificada como Wickerhamomycesanomalus, reclasificación de la especie Pichiaanomala[8]. Esta levadura, al crecer en un medio compuesto por Yeast Nitrogen Base, glucosa y pectina de citrus, produce una endo-poligalacturonasa con capacidad macerante de tejidos vegetales (papa, mandioca, zanahoria) [9]. La maceración de tejidos de mandioca mediante el uso de enzimas pécticas, constituye una alternativa para la producción de puré de mandioca deshidratado, este método mejoraría las propiedades nutritivas y funcionales del producto al evitar el daño celular.
El objetivo del presente trabajo fue determinar la capacidad predictiva de los modelos de Pilosof y Exponencial, para describir la cinética de absorción de agua de tejidos de mandioca macerados con el extracto enzimático de W. anomalus.
Materiales y metodos
Microorganismo: W. anomalus, levadura aislada de cáscaras de frutas cítricas en la provincia de Misiones, Argentina[8].
Medios de cultivos
Medio de conservación: Extracto de levadura (Sigma Chemical Co., St. Louis, Mo, EE.UU.), 5 g/L; triptona (Difco-Becton Dickinson & Co., Sparks, MD, EE.UU.), 5 g/L; glucosa (Britania, Buenos Aires, Argentina), 10 g/L; agar (Britania), 15 g/L; pH 5.0. YNB medio: Base nitrogenada de levadura (YNB, Difco), 6.7 g/L; glucosa (Britania), 5 g/L; pectina de citrus (Parafarm, Buenos Aires, Argentina), 5 g/L; pH, 5.0. Pectina de cítricos se lavó con una (v/v) de etanol-HCl (0,05 N) en solución 70% para eliminar los azúcares solubles [10]. Todos los componentes del medio fueron esterilizados a 1 atm, durante 15 min, excepto en el caso de la solución de YNB, la que se esterilizó en forma separada por filtración a través de un filtro de celulosa de (0.22 μm, Sartorius).
Produccion del extracto enzimatico
Inóculo: A partir de cultivos jóvenes (24 h) de la levadura desarrollada en estrías de medio de conservación, se efectuaron diluciones decimales, de tal modo de ajustar la concentración celular a una Densidad Óptica de 0,96, medidos en un espectrofotómetro a 620 nm.
Fermentación: Se inocularon frascos Erlenmeyers de 500 ml, los que contenían 95 ml del medio de fermentación, con 5 ml del inóculo. Los mismos se incubaron a 30°C en baño termostatizado rotatorio a 180 rpm hasta 10 h. Las muestras se centrifugaron, a 2350 × g durante 10 min at 5 ºC para remover las células de levadura. Los sobrenadantes, denominados extractos enzimáticos (EE), se mantuvierona -18 °C hasta su utilización como fuente de enzima extracelular[8].
Maceracion de tejidos de mandioca con el EE de W. anomalus
La mandioca utilizada fue pelada y lavada con agua destilada. Posteriormente, se cortaron cilindros de 3 mm de diámetro y 4 mm de espesor con un sacabocado de laboratorio. El tejido de mandioca 3 g fue colocado inmediatamente después de obtenido en frascos Erlenmeyrs de 125 ml, a cada uno de los cuales se le agregó 3 ml del EE (51 UE/ml), sin diluir o dilución ½ y 27 ml de buffer acetato de sodio/ácido acético (BAc) 0,2 M, pH 5,0. Los frascos se incubaron en baño termostatizado rotatorio a 190 rpm, a diferentes tiempos (1 h, 2 h y 4 h) y a la temperatura de máxima estabilidad de la enzima (45 ºC). El tejido de mandioca macerado (TMM) fue filtrado con tela de muselina y luego secado en cámara de vacío a 40 ºC hasta peso constante. En todos los casos se realizaron blancos colocando 3 ml de BAc en lugar de la enzima. Los tratamientos aplicados fueron: A: Tejido de mandioca + buffer (Blanco). B: Maceración con el EE sin diluir, 1 h. C: Maceración con el EE sin diluir, 2 h. D: Maceración con el EE dilución ½ en BAc, 2 h. E: Maceración con el EE sin diluir, 4 h. F: Maceración con el EE dilución ½ en BAc, 4 h. Cada una de las experiencias se realizaron por triplicado y se tomaron para los cálculos los valores promedios. Una vez seleccionado el tratamiento de maceración más adecuado, se incluyó una etapa de cocción, en la cuál los TMM fueron sometidos a baño maría durante 3 min y luego la muestra fue secada en cámara de vacío a 40 ºC hasta peso constante.
Cinetica de rehidratacion: modelos matematicos
Entre los modelos más utilizados en la cinética de absorción de agua, podemos mencionar el propuesto por Pilosof y col., 1985[7], este modelo con la finalidad de describir la cinética de absorción de agua de alimentos en polvos, propone la ecuación de dos parámetros:
![]()
q: cantidad de agua absorbida en el tiempo t. Q: máxima capacidad de absorción de agua B: tiempo en que se absorbió la mitad de la máxima capacidad de absorción (Q/2). Diferenciando la ec. 1 respecto del tiempo, la velocidad de absorción de agua:
![]()
Esta ecuación es similar a una ecuación cinética de segundo orden donde la constante es:
![]()
La velocidad inicial de absorción viene dada por la ec.1, haciendo t = 0.
![]()
El otro modelo a aplicar es el Exponencial, que tiene la siguiente expresión
![]()
C(t): contenido de agua en el equilibrio a tiempo t, g de agua/g de puré seco. C∞: contenido de agua en el equilibrio a tiempo infinito, g de agua/g de puré seco. K:constante de velocidad de absorción de agua, min-1. t: tiempo de absorción de agua, min. Los parámetros cinéticos C∞ y K se obtuvieron a partir de los datos experimentales mediante regresión no lineal. La bondad de ajuste de los modelos se evaluó con los parámetros R2 (coeficiente de determinación), RMSE (raíz cuadrada del error medio cuadrático), MBE (error de desvío medio) y E % (error porcentual promedio) dado por las ecuaciones:
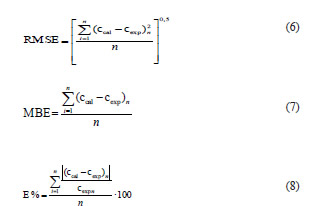
ccal: valor calculado; cexp: valor experimental n: número de determinaciones
Un buen ajuste es indicado por valores pequeños de RMSE y MBE, R2> 0,85 y E% < 10% [11]. El software estadístico utilizado fue Statgraphics Plus para DOS, versión 7.0 (Manugistics, Inc., USA). Las gráficas en la Figura 2 se elaboró con el software GraphPad Prism, versión 5.04 para Windows (GraphPad Software, Inc., La Jolla, CA, USA).
Resultados y discusion
Cinética de absorción de agua de tejidos de mandioca macerados: Modelo Exponencial y de Pilosof. El análisis de varianza (ANOVA) mostró que hubo diferencia significativa (p < 0,05) en los valores de absorción de agua de los TMM, sometidos a los distintos tratamientos de maceración (A, B, C, D, E, F). Los resultados de las distintas experiencias se modelaron a través de las ecuaciones dadas por el modelo Exponencial (ec. 5). Los valores obtenidos por regresión no lineal de los parámetros del modelo Exponencial se exponen en la Tabla 1. También se presenta la bondad del ajuste de este modelo a los datos experimentales.
Tabla 1: Parametros cineticos y de la bondad de ajuste del modelo Exponencial en relacion a los tratamientos aplicados (TA).
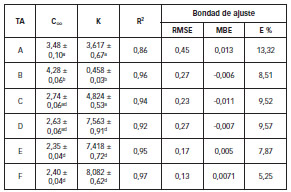
Los valores de C∞ y K son promedios de tres repeticiones error estandar.C∞: contenido de agua en el equilibrio a tiempo infinito. K: constante de velocidad de absorcion de agua. R2: coeficiente de determinacion. RMSE: raiz cuadrada del error medio cuadratico. MBE: error de desvio medio. E %: error porcentual promedio. Distintos superindices en la misma columna indica que existen diferencias significativas (p<0,05). TA: tratamientos aplicados.
El análisis de varianza (ANOVA) de los valores de C∞ y K, mostraron que existen diferencias significativas (p<0,05) entre el blanco (A) y los tratamientos C, D, E y F, con respecto al tratamiento B. Entre los tratamientos C, D, E y F, el ANOVA mostró que la concentración del EE y el tiempo de maceración no presentaron diferencias significativas (p > 0,05) (Tabla 1).
Si se comparan los valores obtenidos de C∞ (concentración de agua en el equilibrio) se observa en la Tabla 1, que a tiempos de maceración de 1 h (tratamiento B), el valor obtenido de C∞ es el más elevado. A menor tiempo de maceración, se produce menor daño celular lo que favorece la entrada de agua durante el proceso de absorción (mayor valor de C∞). Cuanto más dañada se encuentra la estructura celular del tejido vegetal, aumenta la posibilidad de ausencia de vías para la entrada de agua, con espacios intercelulares menos definidos que restringen la difusión de la misma. En la Tabla 1 también se observa que al aumentar el tiempo del tratamiento enzimático, la constante de velocidad de absorción de agua (K) fue mayor, pero la cantidad de agua en el equilibrio menor.
En la Tabla 2 se presentan los valores de los parámetros obtenidos por regresión no lineal del modelo cinético propuesto por Pilosofy col.,1985 [7] (ecuación 1) junto a la bondad de ajuste. Los ANOVAS sobre los valores de Q, B, K y Ro mostraron que hubo diferencias significativas (p<0,05) entre los distintos tratamientos aplicados.
Tabla 2: Parametros cineticosy de la bondad de ajuste del modelo de Pilosof en relacion a los distintos tratamientos aplicados (TA).
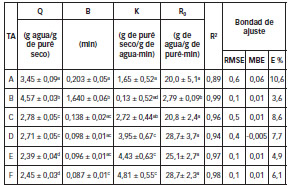
Los valores de Q, B, K y R0 son promedios de tres repeticiones error estandar.Q: capacidad de absorcion de agua. B: tiempo en que es absorbida la mitad de la capacidad total de absorcion (Q/2). K: constante de velocidad. R0: velocidad de absorcion de agua inicial. R2: coeficiente de determinacion. RMSE: raiz cuadrada del error medio cuadratico. MBE: error de desvio medio. E %: error porcentual promedio. Distintos superindices en la misma columna indica que existen diferencias significativas (p<0,05). TA se denomina a los diferentes tratamientos aplicados.
Para la velocidad de absorción de agua inicial (R0), se realizaron las pruebas de rangos múltiples, encontrándose que no hay diferencia significativa entre los tratamientos C, D, E, F y el blanco (A), pero todos los tratamientos presentaron diferencias significativas con el tratamiento B. En este modelo de Pilosof y col., 1985 [7], los valores de la capacidad de absorción de agua fueron similares al modelo exponencial discutido anteriormente.
Cinetica de absorcion de agua de tejidos de mandioca macerados con y sin coccion
En base a los resultados obtenidos en la etapa anterior, donde el tratamientos de maceración con el EE sin diluir por 1 h (B) absorbió mayor cantidad de agua, tejido de mandioca se trató enzimáticamente utilizando el mismo procedimiento pero en esta oportunidad, se realizó una cocción posterior por 3 minutos (B1), los resultados obtenidos ajustaron a los dos modelos Exponencial y Pilosof y col., 1985 [7]. El ANOVA sobre los valores de absorción de agua (Q) de las muestras A1 y B1, mostró que existen diferencias significativas entre ambos (p<0,05). El valor de Q para la muestra B1 fue de 5,23 ± 0,13, este resultadofue 15% mayor que la muestra B (Tabla 2) con el mismo tratamiento enzimático pero sin cocción.
En este tratamiento donde existe un calentamiento posterior a la maceración, existe una pre-gelatinización, donde el orden molecular dentro de los gránulos es destruido gradual e irreversiblemente y absorben mayor cantidad de agua que en los otros tratamientos donde no hay cocción posterior. Colonna y col., 1987 [12] reportaron que en almidones pre-gelatinizados donde no se aplica ninguna fuerza de corte a los gránulos hinchados, ocurre apenas una lixiviación parcial de la amilosa, los componentes del almidón se degradan levemente y probablemente siguen enlazados dentro de una matriz continua. Así, estos productos presentan una alta accesibilidad al agua. En la pre-gelatinización se ocasiona cambios marcados en las estructuras, los cuales se manifestaron como la pérdida de la integridad granular, debido a que los componentes del almidón pueden haberse degradado dando como resultado un aumento en la absorción de agua.
Podemos concluir que los mayores valores de Q para la maceración enzimática son por un tiempo de 1 hora seguida de una cocción. En trabajos anteriores se reportó que la capacidad de absorción de agua del puré de mandioca obtenido de manera mecánica por un proceso tecnológico en planta piloto por la Cooperativa Agrícola e Industrial San Alberto, Ltda., ubicada en Puerto Rico, Misiones, Argentina, absorbe mayor cantidad de agua en el equilibrio, que el puré de mandioca obtenido enzimáticamente, dentro de los parámetros estudiados. Este valor de Q es de 7,64 g agua/g de puré seco [3], mientras que en el presente trabajo se reportan valores del orden de 5,23 g agua/g de macerado de mandioca seco.
Conclusiones
Se logró un buen ajuste de los datos experimentales a los dos modelos evaluados (Exponencial y de Pilosof). El análisis de varianza mostró que hubo diferencia significativa en los valores de absorción de agua entre las muestras de mandioca sometidas a los distintos tratamientos de maceración.
El valor de C∞ (concentración de agua en el equilibrio) obtenido por regresión no lineal de los parámetros del modelo Exponencial, mostraron que a tiempos de maceración de 1 h y utilizando un EE sin diluir, se obtuvo el mayor valor, observándose un menor daño celular respecto a los tratamientos efectuados a mayores tiempos. Al aumentar el tiempo del tratamiento enzimático, la constante de velocidad de absorción de agua (K) fue mayor, pero la cantidad de agua en el equilibrio menor (C∞). En base a los resultados obtenidos se pudo concluir que el mejor tratamiento enzimático aplicado a los tejidos de mandioca fue utilizando un EE sin diluir, durante un tiempo de 1 h.Al realizar comparaciones entre las experiencias de macerados con cocción y sin cocción, se concluyó que al haber un calentamiento posterior, el almidón existente en la raíz, sufre una pre-gelatinización y esto da como resultado una mayor absorción de agua.
1. Nakamura, T.; Hours, R.A. y Sakai, T. Enzymatic maceration of vegetables with protopectinases. Journal of Food Science. 60: p. 468-472. 1995. [ Links ]
2. Costa, J.A.V.; Colla, E.; Magagnin, G.; Oliveria dos Santos, L.; Vendruscolo, M. y Bertolin T. E. Simultaneousamyloglucosidase and exo-polygalacturonaseproductionby Aspergillus nigerusingsolid-statefermentation. Brazilian Archives of Biology and Technology. 50 (5): p. 759-766. 2007. [ Links ]
3. Brousse, M.M.; Linares, R.A.; Nieto, A.B. y Vergara M.L. Cinética de absorción de agua en purés deshidratados de mandioca (ManihotesculentaCrantz). Revista Venezolana de Ciencia y Tecnología de Alimentos. 3 (1): p. 080- 096. 2012. [ Links ]
4. McMinn, W.A.M. y Magee, T.R.A. Physical characteristics of dehydrated potatoes-Part II. Journal of Food Engineering. 33(1-2): p. 49-55. 1997. [ Links ]
5. Ramos, I.N.; Brandao, T.R.S. y Silva, C.L.M. Structural changes during air drying of fruits and vegetables. Food Science and Technology International. 9 (3): p. 201-206. 2003. [ Links ]
6. Weerts, A.H.; Martin, D.R.; Lian, G. y Melrose, J.R. Modelling the hydration of foodstuffs. Simulation Modelling Practice and Theory. 13(2): p. 119-128. 2005. [ Links ]
7. Pilosof, A.M.R.; Boquet, R. y Bartholomai, G.B. Kinetics of water uptake by food powders. Journal of Food Science. 50(1): p. 278-279. 1985. [ Links ]
8. Martos, M.A.; Zubreski, E.R.; Combina, M.; Garro, O.A. y Hours, R.A. Isolation of a yeast strain able to produce a polygalacturonase with maceration activity of cassava tissues. Food Scienceand Technology. 33 (2): p.332-338. 2013a. [ Links ]
9. Martos, M.A.; Zubreski, E.R.; Garro, O.A. y Hours, R.A. Production of Pectinolytic Enzymes by the Yeast Wickerhanomycesanomalus Isolated from Citrus Fruits Peels. Biotechnology Research International. 1: p.1-7. 2013b. [ Links ]
10. Cavalitto, S.F.; Arcas, J.A. y Hours, R.A. Pectinase production profile of Aspergillusfoetidus in solid state cultures at different acidities. Biotechnology Letters, 18: p. 251- 256. 2013b. [ Links ]
11. Vega-Galvez, A.; Lara-Aravena, E. y Lemus-Mondaca, R. Isotermas de adsorción de harina de maíz. Ciência e Tecnologia de Alimentos (Brasil). 26(4): p. 821-827. 2006. [ Links ]
12. Colonna, P.; Buleon, A. y Mercier C. Physically modified starches. In Starch: Properties and potencial. Galliard, T. (ed). Crit. Rev. Appl. Chem. 13: p. 79-114.1987. [ Links ]
Recibido: 09/10/2013
Aprobado: 07/04/2014














