INTRODUCCIÓN
Las lagunas urbanas permiten realizar nu merosas actividades recreativas y educacionales, y a su vez, albergan diversos organismos tantos acuáticos como terrestres, migratorios como re sidentes, que incrementan su valor paisajístico. Constituyen además sumideros de agua de esco rrentía y también actúan como zonas buffer mi tigando la polución urbana (Mancini et al., 2012; Taborda et al., 2017).
Un componente importante de la biota que habita estos ambientes acuáticos es el zooplanc ton, constituido esencialmente por rotíferos y microcrustáceos cladóceros y copépodos, es decir organismos metazoos que viven en suspensión en la columna de agua.
Los ensambles de estos organismos represen tan un importante elemento de las redes tróficas acuáticas, cumpliendo un rol clave como princi pal alimento para las larvas de peces y pequeños peces planctívoros (Hutchinson, 1967). Además, poseen una valiosa función como controladores del crecimiento del fitoplancton (Lazzaro et al., 2003), características que le confieren al zoo plancton un alto valor ecológico (Battauz, 2016).
Si consideramos la distribución del zooplanc ton en ambientes lenticos, se ha estudiado que muestra cambios temporales y espaciales con variaciones en la abundancia. (José de Paggi & Paggi, 2007). Al respecto, en lagunas de inun dación se encuentra una baja densidad en los períodos de aislamiento (cuando las lagunas permanecen desconectadas del río), siendo más abundantes los rotíferos y copépodos calanoideos en el área limnética, y los copépodos cyclopoideos en la zona litoral. No obstante, la abundancia puede variar horizontalmente según la heteroge neidad del lago, determinada por la morfometría y la presencia de vegetación (José de Paggi et al., 2012).
En particular, en la provincia de Entre Ríos los antecedentes sobre estudios relacionados a la diversidad y estructura del zooplancton son escasos, representando una línea de traba jo que aún debe ser explorada. A la fecha solo existen publicados dos trabajos. Uno de ellos, describe la especie de copépodo Diaptomus su sanae (Paggi) y nombra la presencia de las es pecies Argyrodiaptomus denticulatus (Pesta) y Notodiaptomus anisitsi (Daday), en dos cuerpos de agua lenticos al norte de la provincia, en las cuencas de Feliciano y Concordia (Paggi, 1976). Por otra parte, en un estudio de revisión de es pecies argentinas del género Diaphanosoma se registró la especie de cladócero Diaphanosoma chilense (Daday) en charcas aledañas al Arroyo Ayui Grande en la localidad de Concordia (Paggi, 1978). Obtener este tipo de información toma aún más relevancia ante la constante pérdida y degradación de humedales en Argentina y el mundo (RAMSAR, 2018), la cual alimenta la necesidad creciente de realizar estudios que nos permitan conocer la estructura y composición de los organismos acuáticos que allí se desarrollan.
Los objetivos del presente trabajo son: i) de terminar la composición y estructura del ensam ble zooplanctónico de la laguna Escuela Rural Juan Bautista Alberdi ubicada en la localidad de Oro Verde, en el periodo primavera-verano (2017-2018); ii) Determinar variaciones estacio nales de la composición del zooplancton de la la guna; iii) Conocer el valor la importancia de las lagunas urbanas como sumidero de diversidad zooplanctónica.
MATERIALES Y MÉTODOS
Área de estudio
La laguna estudiada se localiza en el predio de la Escuela Normal Rural Nº 1 Juan Bautista Alberdi, ubicada en la localidad de Oro Verde (a 10 km de la ciudad de Paraná, 31° 50ʹ 32.68ʺ S - 60° 31ʹ 12.56ʺ O; Fig. 1). De origen antrópico, presenta una superficie aproximada de 2,6 hectá reas y una profundidad que no excede los 1,6 me tros. Recibe aportes de agua de la capa freática y por escorrentía superficial de las áreas lindan tes. Durante las precipitaciones abundantes, se comunica mediante un desagüe de origen antró pico a un pequeño curso de agua que finalmente vierte sus aguas al río Paraná. Se encuentra ca racterizada por una rica fauna de aves y se obser van otros vertebrados como Podocnemis lewyana Duméril, Caiman latirostris Daudin y Myocastor coypus Molina (observación personal).
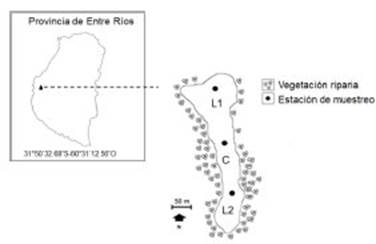
Fig. 1 Ubicación de las estaciones de muestreo (L1, C y L2) en la laguna de la Escuela Rural Juan Bautista Alberdi, Provincia de Entre Ríos, Argentina.
En cuanto a la vegetación acuática, se regis traron durante el período de estudio dos especies de macrófita flotante, Lemna minor (L) Griff y Wolffia sp. El área litoral de la laguna posee una moderada cobertura vegetal compuesta princi palmente por pasto pata de gallina (Paspalum dilatatum Poir), caña común (Arundo donax Linneo), juncos (Thypa latifolia Linneo), entre otras especies vegetales. La laguna, se encuentra lindante al Área Natural Protegida homónima a la Escuela Juan Bautista Alberdi (20 hectáreas).
Trabajo de campo
Se realizaron muestreos quincenales, du rante el período comprendido entre octubre 2017 y marzo 2018. Por cada sitio de muestreo, 2 litorales (L1 y L2) y 1 del centro (C) (Fig. 1), se tomaron tres muestras de agua a diferentes profundidades y se las integró, con la finalidad de obtener una mejor representación de la co munidad zooplanctónica. Se filtraron 30 litros de agua para cada muestra, a través de una red de monofilamentos de 54 μm de abertura de malla. El zooplancton concentrado en la red fue vertido a frascos de plástico de boca ancha de 100 ml y posteriormente fue fijado in situ con formalina al 10% y teñidos con eritrocina. Dichas muestras fueron etiquetadas y transportadas al laborato rio para su conteo e identificación taxonómica.
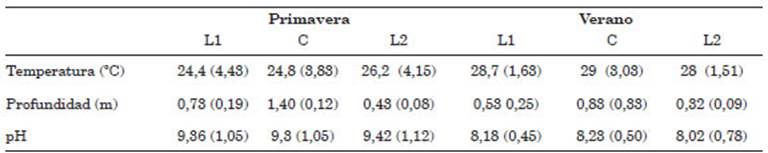
En cada sitio, se registraron las siguientes va riables físico-químicas: profundidad con varilla de madera graduada, transparencia mediante un disco de Secchi, temperatura del agua (°C) y pH con un pHmetro digital Hanna.
Trabajo en laboratorio
Los conteos del zooplancton (rotíferos, copé podos y cladóceros) se realizaron en cámaras del tipo Kolkwitz de 1 ml de capacidad. Las mues tras se observaron bajo microscopio óptico (Leica DM 500) y se efectuaron identificaciones taxo nómicas utilizando diferentes claves (Ruttner- Kolisko, 1974; Koste, 1978; Korovchinsky et al., 1992; Segers, 1995; Battistoni, 1995; Alekseev, 2002, Korínek, 2002; entre otros).
ANÁLISIS DE DATOS
Se calcularon los promedios, por estación (primavera-verano) y sitio de muestreo, de los parámetros físico-químicos registrados. Se cuan tificó la riqueza y la abundancia (Margalef, 1995) por sitio de muestreo, estación y grupo de zoo plancton. Con los datos del zooplancton presente en cada estación se estimó, el índice de diversi dad de Shannon-Weaver (Shannon & Weaver, 1964) el cual refleja la variedad dentro de una co munidad sobre la base de dos factores: el número de especies presentes y la abundancia relativa de cada una. Se utilizó este índice ya que el mismo asume que los individuos son seleccionados al azar y que todas las especies están representadas en la muestra.
También se determinó la equitatividad (J) y dominancia (U) (Brower & Zar, 1977), para el período estudiado y por estación (primavera y verano). Luego, se compararon las abundancias obtenidas entre primavera y verano para el zooplancton total, rotíferos, cladóceros y copé podos, usando el test no paramétrico de Mann- Whitney (Marqués, 2004). Se realizaron correla ciones entre variables biológicas y ambientales con el coeficiente de correlación no paramétri co de Spearman. Para los análisis se empleó el Software PAST (Hammer et al., 2001).
RESULTADOS
Variables físicas y químicas
En los meses correspondientes a primavera (2017) se registraron un total de 259,7 ml de pre cipitaciones y en los meses correspondiente al ve rano (2018) se registraron solo 43,4 ml, datos de la estación agropecuaria INTA Paraná. En con secuencia, la laguna redujo visiblemente su vo lumen de agua evidenciándose un retroceso de la línea de costa de 4,5 metros. La temperatura pro medio del agua fue de 25,1 °C (DS= 3,89) en la temporada de primavera y de 29,4 °C (DS=2,23) en la de verano.
La transparencia del cuerpo de agua dismi nuyo de 43,07 cm en la temporada de primavera hasta los 22,28 cm en la temporada de verano. Los datos físico químicos promedios por estación y sitio muestreado se observan en la tabla 1.
Riqueza del zooplancton
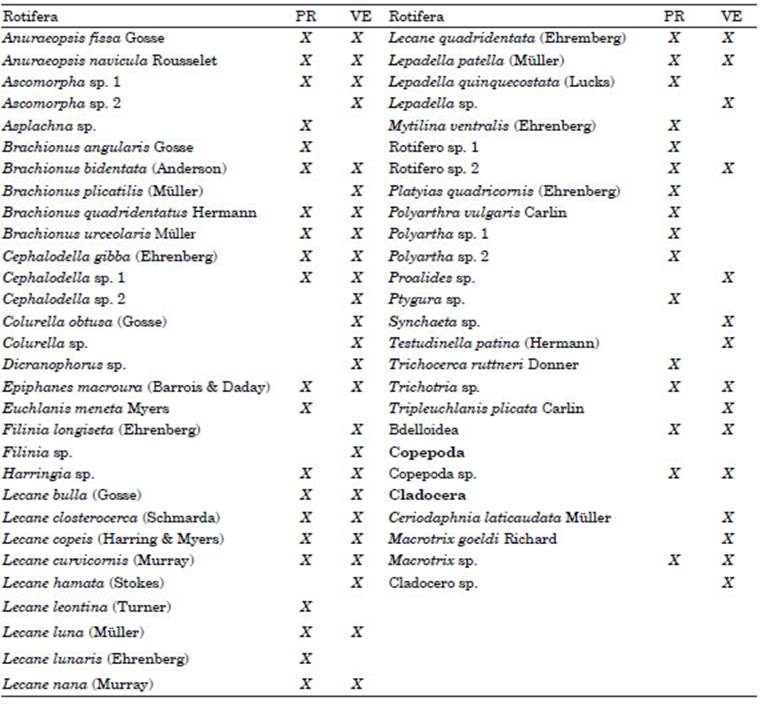
La riqueza registrada a lo largo de todo el es tudio fue de 54 especies de zooplancton (Tabla 2) de las cuales 49 correspondieron a rotíferos, una sola especie de copépodos (en estados de de sarrollo: nauplios, copepoditos y copépodos) y 4 de cladóceros (Fig. 2a). En cuanto a la riqueza por estación, fue mayor en verano (42 especies) que en primavera (39 especies). En ambas tem poradas la mayor riqueza de especies estuvo re presentada por rotíferos. Los copépodos fueron de presencia constante en ambas estaciones y los cladóceros fueron más ricos en especies en el ve rano (Fig. 2b).
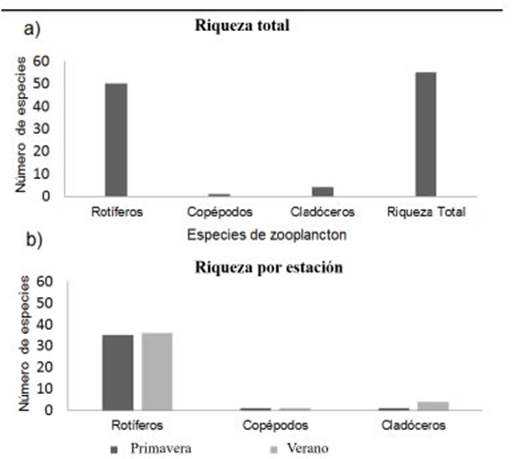
Fig. 2 a) Riqueza total de rotíferos, copépodos, cladóceros y zooplancton total. b) Riqueza específica en primavera y en verano de los principales grupos zooplanctónicos presentes en la laguna.
Respecto de la riqueza por sitio de muestreo, en primavera, fue mayor en L2 con 26 especies seguido por L1 y por C con 21 y 19 especies, res pectivamente. En verano, tanto en L1 como en L2 se registraron 25 especies, mientras que C presento una riqueza menor (22 especies).
Entre los rotíferos predominó el género Lecane con 10 especies, como se observa en la tabla 2. En el caso de los copépodos Calanoidea, como se describió anteriormente, se observó una sola especie (no identificada), en estadios de de sarrollo nauplios, copepoditos y copépodos. Los cladóceros se registraron esporádicamente, ya que Macrotrix sp. se encontró en tres ocasiones, entre noviembre y diciembre, Ceriodaphnia la ticaudata, dos veces, una en febrero y otra en marzo, Macrotrix goeldi una sola vez en el mes de marzo y, Cladócero sp. (no identificado), dos veces en el mes de febrero.
Abundancia del zooplancton
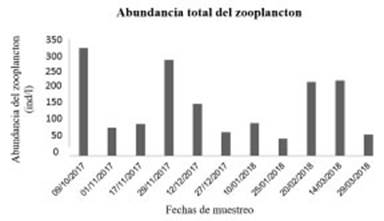
La abundancia promedio del zooplancton fue mayor en los meses de primavera (944,89 ind/l) que en los de verano (731,78 ind/l). Resultando el muestreo de octubre (322,89 ind/l) el más abun dante, seguido por el tercer muestreo de noviem bre (287,67 ind/l) (Fig. 3). El muestreo con me nor abundancia fue el segundo del mes de enero (51,70 ind/l), seguido por el segundo muestreo en el mes de marzo (63,04 ind/l).
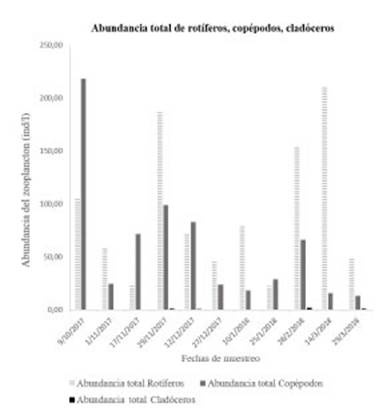
Los rotíferos fueron dominantes en todos los muestreos a excepción del primer muestreo de octubre y segundo muestreo de noviembre donde los nauplios fueron superiores en número de in dividuos registrados.
Los rotíferos de la clase Bdelloidea estuvie ron presente en ambas estaciones, en el 76% de los muestreos y en un promedio para todos los sitios de 766,10 ind/l. Lo mismo ocurrió con la especie Lecane bulla, pero el mayor número de individuos se registró en los meses de febrero y marzo con un total de 188,37 ind/l. Ambos ta xones, fueron los más abundantes en las dos es taciones muestreadas; en primavera Bdelloidea exhibió un total de 210,45 ind/l y L. bulla 113,78 ind/l, mientras que en verano fueron 567,85 ind/l y 638,96 ind/l, respectivamente. Los cladóceros no fueron abundantes en ningún momento del estudio (Fig. 4).
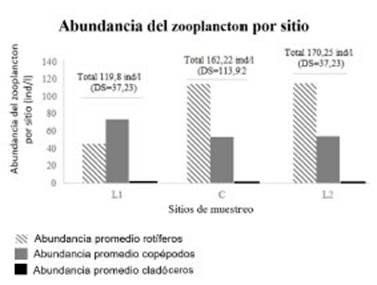
En cuanto a la abundancia promedio en cada sitio de muestreo, fue mayor en el L2, seguida por el sitio C y por último L1, como se observa en la figura 5, donde se muestra la composición de rotíferos, copépodos y cladóceros para cada sitio.
Al comparar las densidades de los tres grupos de zooplancton entre primavera y verano, solo se observó una diferencia significativa en el grupo de los copépodos (Z= -2,152, p= 0,031). Los ro tíferos (Z= 0,796, p=0,426) y los cladóceros (Z= 0,734, p=0,463) no mostraron diferencias signi ficativas.
Al confrontar los valores obtenidos con el índice de Shannon entre las dos temporadas es tudiadas, la diversidad de individuos fue baja, variando entre 1,90 en primavera y 2,39 en vera no. Por su parte, la equitatividad fue similar en ambas estaciones (0,50 y 0,60 respectivamente) y la dominancia osciló entre 0,23 en primavera y 0,15 en verano.
Por último, el coeficiente de correlación de Spearman mostró relaciones significativas y ne gativas, aunque no muy fuertes, entre la riqueza de rotíferos y la profundidad (p= 0,01 / Rho= -0,19), riqueza de cladóceros y la profundidad (p=0,04/Rho=-0,34), riqueza total y la profun didad (p=0,004/ Rho=-0,48), abundancia de cla dóceros y la profundidad (p= 0,004 /Rho= -0,34), y la abundancia de copépodos y la temperatura (p=0,008/ Rho=-0,44), y una relación significa tiva positiva entre la abundancia de copépodos y la transparencia del agua (p=0,01/Rho=0,41).
DISCUSIÓN
La información obtenida, constituye el pri mer registro de especies zooplanctónicas de la laguna urbana Escuela Juan Bautista Alberdi, y particularmente el primer estudio sobre la es tructura del zooplancton de un cuerpo de agua para la provincia de Entre Ríos.
La laguna Escuela Juan Baustista Alberdi es un cuerpo de agua somero, léntico y alcalino, rasgo que comparte con otras lagunas de la re gión de similares características como la Laguna urbana del Parque General Belgrano (Provincia de Santa Fe) (José de Paggi, 1976) y la Laguna El Mirador, ubicada en la Reserva Ecológica de la Universidad Nacional del Litoral, (Provincia de Santa Fe) (Battauz et al., 2014), entre otras.
El número total de especies zooplanctónicas de la laguna estudiada fue de 54, un valor mayor en comparación a la registrada por José de Paggi (1976) para la laguna urbana del Parque General Belgrano (Santa Fe), con 36 especies halladas du rante los 14 meses que duro su estudio. Empero, el número de especies, fue bajo, si se la compara con el exhibido por la laguna El Mirador de la Reserva ecológica de la UNL (Santa Fe) de 12 hec táreas, donde se registraron un total de 110 espe cies de rotíferos, cladóceros y copépodos, en 12 meses de estudio, (Battauz et al., 2014). No obs tante, la riqueza de la laguna en estudio es alta si consideramos la cantidad de meses de muestreo.
La riqueza total registrada fue levemente ma yor en verano que en primavera, lo cual difiere a lo observado por José de Paggi (1976) para la laguna del parque General Belgrano, quien ob tuvo su mayor riqueza en primavera. Asimismo, Keppeler & Hardy (2004), indican que la baja profundidad de un cuerpo de agua es un factor que disminuye la riqueza zooplanctónica en un hábitat. No obstante, en este estudio registramos en verano una relación significativa y negativa entre profundidad y riqueza de zooplancton, así como de cladóceros y rotíferos. Esto puede res ponder al aumento del área litoral y a la domi nancia de especies, en su mayoría rotíferos, con este hábito de vida.
En cuanto a la abundancia promedio, fue mayor en primavera, lo cual coincide con mayor abundancia de especies dominantes de rotíferos y de nauplios (como lo indican los índices de domi nancia). Este fenómeno coincide con altas densi dades de nauplios en primavera, como lo estable ció el test de Man-Whitney (marcando la única diferencia significativa entre estaciones) y el test de Spearman (que mostró una relación significa tiva y negativa entre copépodos y temperatura, con dominio de estadios de nauplios). El incre mento de nauplios en presencia de un elevado ni vel de agua, como se observó durante la primave ra, podría estar relacionado fundamentalmente con la eclosión de huevos de resistencia antes las condiciones favorables del ambiente (Holden & Green, 1960). Por otra parte, la relación positiva entre la densidad total del zooplancton y mayor transparencia del agua coinciden con lo explicado en José de Paggi & Paggi (2007, 2014), para am bientes de agua dulce.
Los rotíferos fueron el grupo con mayor ri queza taxonómica y abundancia durante el perio do de muestreo, en concordancia con los resulta dos encontrados en cuerpos de agua de similares características por Battauz et al. (2014) en la la guna El Mirador de la Reserva Ecológica (UNL) y José de Paggi (1976) en la laguna del Parque General Belgrano. Este patrón es común en am bientes dulceacuícolas tropicales y subtropicales. El mismo puede ser atribuido a que estos orga nismos son estrategas r, es decir, oportunistas, de tamaño pequeño, ciclo de vida corto y amplia to lerancia a una variedad de factores ambientales (Neves et al., 2003). Además, el amplio espectro de partículas alimenticias consumidas por los rotíferos (bacterias, algas y detritus de distintos tamaños), permite diferentes dietas para muchas especies presentes simultáneamente en los cuer pos de agua (Arora & Mehra, 2003).
Una de las particularidades encontradas en la laguna estudiada, fue que los individuos de la clase Bdelloidea estuvieron presentes en ambas temporadas, en la mayoría de los muestreos y en gran número. Es probable que su alta densidad este indicando alguna condición de la laguna, te niendo en cuenta que los bdelloideos son orga nismo que resisten diversas condiciones del am biente (Ricci, 2001). Asimismo, nos resulta difícil vincular estas densidades con las condiciones ambientales medidas, valores de concentraciones de oxígeno en el agua podría respaldar este com portamiento, pero no se midió este parámetro.
Por otra parte, en coincidencia con los re sultados obtenidos por Iannacone & Alvariño (2007) en 21 puntos de muestreo en humedales urbanos de los Pantanos de Villa (Lima, Perú), las familias Lecanidae (típicamente litorales) y Brachionidae (planctónica), fueron las familias de rotíferos más frecuentemente observadas en el presente trabajo. Estas familias son descriptas como predominantes en ambientes tropicales y subtropicales (Keppeler & Hardy, 2004; José de Paggi & Paggi, 2014).
Lecane bulla fue más abundante en verano, cuando la laguna redujo drásticamente su vo lumen y se observó la presencia de abundantes macrófitas sumergidas, lo cual favorecería la pre sencia de esta especie litoral (Martínez & José De Paggi, 1988), registrándose en mayor número en la estación de muestreo L2. Por otra parte, las especies de rotíferos encontrados concuerdan en su mayoría con las que han sido halladas en otros ambientes lenticos alcalinos de similares carac terísticas; así como también a las registradas en las lagunas de inundación del rio Paraná medio descriptas por José de Paggi & Paggi (2007).
Los copépodos calanoideos fueron el segun do grupo con mayor abundancia y con presencia continua en todas las fechas de muestreo, pero registrándose una sola especie. La predominan cia numérica de estados tempranos de desarrollo, nauplios y copepoditos, es el patrón común, regis trando también por Moreno (2003) y Iannacone & Alvariño (2007) en diferentes hábitats dulcea cuícolas. Las altas densidades de formas larvales son el resultado de una continua reproducción de estos organismos, en las regiones neotropi cales, con superposición de varias generaciones (Iannacone & Alvariño, 2007). Por otra parte, la existencia de formas inmaduras es de gran im portancia para la dinámica poblacional y también en los aspectos tróficos, debido a que las fa ses tempranas pueden ocupar nichos diferentes que los adultos (Neves et al., 2003).
Los cladóceros fueron el grupo de menor abundancia de especies; su registro en este tra bajo fue relativamente bajo teniendo en cuenta su significativa diversidad regional (Paggi, 2004). Nuestros resultados muestran que, en la tem porada de verano, cuando la laguna presentaba muy bajo nivel de agua, aparecieron mayor nú mero de cladóceros que en primavera, tal como lo describe José de Paggi & Paggi, (2007) en las lagunas de inundación del río Paraná en períodos de aislamiento.
Los cladóceros registrados son de talla me diana a pequeña, pertenecientes a los géneros Ceriodaphnia y Macrotrix, relacionados con aguas eutróficas (Santos-Wisniewski et al., 2002). Gilbert (1988) propone que la depredación por los grandes cladóceros tiene un rol modela dor y de control en las comunidades naturales del zooplancton, principalmente sobre los rotíferos; por lo tanto, los rotíferos pueden ocurrir en altas densidades solo en presencia de pequeños cladó ceros. No obstante, este grupo no fue dominante en número en ningún momento del estudio.
Nos resulta importante señalar que, si bien no se muestrearon las poblaciones de peces planctívoros, si se observaron en gran número a campo. Estos peces podrían controlar las poblaciones de zooplancton, especialmente de cla dóceros, como ha sido demostrado en numerosos estudios en cuerpos de agua continentales (e.j., Balseiro et al., 2007; Iglesias, 2010).
En cuanto a la distribución de los organismos, la mayor riqueza se registró en las estaciones de muestreo litorales. Como sostiene Iannacone & Alvariño (2007) y Rodriguez & Matsumura- Tundisi (2000), la zona litoral ha sido señalada como la que presenta una mayor diversidad de rotíferos en comparación a la zona limnética de bido a su mayor heterogeneidad.
La mayor abundancia registrada en L2, si bien no es un parámetro medido en este trabajo y no existen registros en trabajos previos, podría estar relacionada con el alto contenido de nu trientes que podría llegar a la laguna por las es correntías de los campos agrícolas lindantes, los cuales poseen siembra durante todo el año. Este ingreso favorecería el desarrollo del fitoplancton, aumentando la disponibilidad de alimento, ya que existe una correlación directa entre la tasa de producción primaria del fitoplancton y la del zooplancton no depredador (Maisterrena, 1999). Asimismo, el sitio L1 presentó la menor abun dancia de organismos, esto puede deberse a que el sitio está expuesto al accionar antrópico, por su fácil acceso es el más utilizada por los visitan tes del lugar, a diferencia de los sitios C y L2 los cuales poseen difícil acceso para su uso recreati vo. En este trabajo no se estimó la concentración de nutrientes, la composición y abundancia del fitoplancton, oxígeno disuelto y conductividad de la laguna, debiendo ser contemplados estos pará metros en estudios futuros de esta laguna.
En conclusión, la laguna urbana de la escue la rural Juan Bautista Alberdi posee condiciones físico químicas como temperatura, profundidad y turbiedad del cuerpo agua, entre otras, que condicionan su estructura zooplanctónica. Con presencia de organismos zooplanctónicos carac terísticos de la región Neotropical, con dominan cia de especies de rotíferos, principalmente de las familias Lecanidae y Brachionidae, y altas den sidades de la especie Lecane bulla y de la clase Bdelloidea.
La estructura de la laguna estuvo representa da por una mayor riqueza de especies zooplanctó nicas en verano y mayor abundancia de las mis mas en primavera.
Para finalizar, recomendamos la continuidad de estudios limnológicos en esta laguna urbana y en lagunas urbanas del resto de la provincia, teniendo en cuenta la relevancia de estos lugares como espacios públicos, recreativos y educativos donde los habitantes pueden conocer el funcio namiento de estos sistemas, revalorizando estos sitios como importantes sumideros de biodiver sidad.












 uBio
uBio