La prevalencia de los pólipos gástricos (PG) es del 6% en la videoendoscopia digestiva alta (VEDA)1-3; el 17% de estos está constituido por pólipos hiperplási cos gástricos (PHG)3. La incidencia de los PG es igual en ambos sexos3.
Los PHG suelen ser asintomáticos, generalmen te revelados de manera accidentaldurante la VEDA2,3.
No obstante, cuando aumentan su tamaño, pueden causar síntomas como anemia, hemorragia di gestiva, y, relacionados con la obstrucción del tracto de salida gástrica; progresar a un adenocarcinoma3.
Algunos estudios informan una prevalencia de metaplasia del 5,6% en los PHG, mientras que la displa sia y el cáncer gástrico (CG) corresponden a un 3,3% y 2,1%, respectivamente1-3.
El objetivo de este artículo es describir una for ma de presentación atípica de esta patología y realizar una revisión de la literatura.
Se presenta el caso de un paciente de sexo masculino, de 73 años, ex tabaquista, con antecedentes patológicos de hipertensión arterial, bloqueo trifasicu lar y fibrilación auricular con necesidad de marcapasos, diabetes mellitus tipo 2, hipotiroidismo, sobrepeso, in suficiencia renal crónica y nefrectomía radical derecha por oncocitoma renal.
Consultó por Guardia central por presentar dis nea progresiva de un mes de evolución, acompañada de palpitaciones. El examen físico no presentaba altera ciones. Como hallazgos positivos en el laboratorio pre sentó hemoglobina de 7,95 mg/dL, hematocrito: 27%, RIN: 1,23, APP: 67%; se realizó diagnóstico de anemia microcítica ferropénica, por lo que se decidió interna ción en Unidad Coronaria para su estudio.
Se realizó una VEDA donde se objetivó una lesión polipoide de 3 cm, pediculada, no ulcerada, en ángulo gástrico. La biopsia describió displasia severa con carcinoma in situ sin invasión de lámina propia. Se completó el examen con colonoscopia, la cual informó divertículos sin signos de complicación y hemorroides internas.
Se decidió realizar posteriormente la polipec tomía mediante resección endoscópica con asa efec tuando la resección de la pieza en 1 solo bloque (Fig. 1).
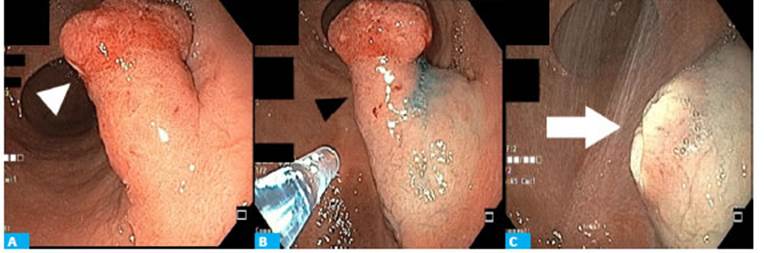
Figura 1 Resección endoscópica con asa. A. Lesión polipoide de 3 cm (cabeza de flecha blanca). B. Inyección de solución salina para realizar resección (cabeza de flecha negra). C. Lecho quirúrgico sin signos de sangrado (flecha blanca).
El estudio anatomopatológico reveló la presen cia de hiperplasia y adenocarcinoma, moderadamente diferenciado, intramucoso (pT1a), sin ulceraciones y con el pedículo tumoral libre de lesión. La lesión se re secó completamente con un margen mayor de 2 mm, sin evidencia de invasión linfovascular (Fig. 2).
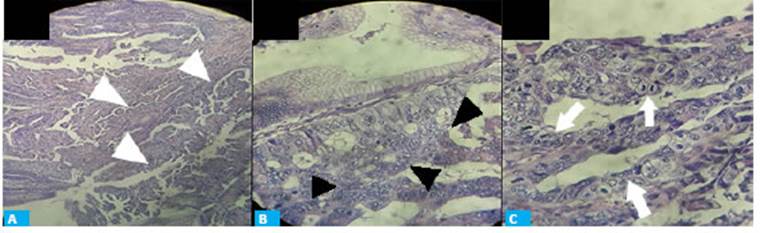
Figura 2 Examen histológico. A. Cambios histológicos compatibles con adenocarcinoma, alteración estructural del estroma (cabezas de flecha blancas), tinción hematoxilina-eosina, ×20. B. Glándulas estromales hiperplásicas. Cambios nucleares con atipia celular (cabezas de flecha negras), tinción hematoxilina-eosina, ×40. C. Células en mitosis, anisocariosis nuclear (flechas blancas), tinción hematoxilina-eosina, ×100.
La lesión polipoide con foco de adenocarcino ma se clasificó como cáncer gástrico temprano (CGT), pT1a según la clasificación TNM4,5. Por todo esto, la resección endoscópica con asa se consideró curativa al cumplir con los criterios de curación histológica4-6. Ade más, la evaluación histopatológica de la mucosa circun dante reveló gastritis crónica moderada en mucosa de cuerpo y el antro gástrico, sin evidencia de infección por Helicobacter pylori.
El paciente presentó buena evolución clínica y fue controlado a los 3 meses con una nueva VEDA con toma de biopsias que fueron normales. El paciente in gresó en un protocolo de seguimiento endoscópico.
El riesgo de desarrollar cáncer en PHG aumen ta con su tamaño 2, especialmente cuando son mayores de 2 cm1, aunque también se han descripto casos de CG en pólipos de 5-10 mm1. Otros factores de riesgo son que el pólipo sea pediculado, pacientes con estó mago remanente después de gastrectomía y displasia sincrónica3.
Actualmente se acepta que los PHG mayores de 2 cm de diámetro tienen indicación de resección2,3 así como también los pólipos sintomáticos, los pólipos con displasia focal y los CGT1-3.
Si mediante biopsia se confirma que los PHG poseen displasia, es fundamental determinar su grado y límite; además de evaluar si la displasia está limitada solo al pólipo o si este es un fragmento del proceso neoplásico1.
La profundidad de penetración del CGT en PHG se puede evaluar solo cuando se obtiene la imagen de sección transversal perpendicular a la lesión y la pared normal contigua1.
El riesgo de desarrollar cáncer gástrico en la mucosa gástrica que rodea a los PHG es del 7,1%; por esto las regiones vecinas de la mucosa gástrica también deben someterse a valoraciones endoscópicas, anato mopatológicas y verificación de la existencia de Helico bacter pylori1.
Existen protocolos para mejorar el diagnóstico precoz de CG, los cuales sugieren detectar y erradicar Helicobacter pylori en pacientes sometidos a VEDA, buscar atrofia gástrica o metaplasia gástrica en todo pa ciente sintomático mayor de 40 años y la identificación de lesiones focales mediante el uso de endoscopia de alta resolución y luz blanca6.
La resección endoscópica de los PHG con displasia o CGT limitados solo al pólipo se considera suficiente, si el endoscopista y el anatomopatólogo confirman, respectivamente, la integridad tanto ma croscópica como microscópica de la polipectomía1,2.
Con el uso del asa diatérmica para realizar la polipectomía existe menor probabilidad de pasar por alto algunas lesiones displásicas y neoplásicas; así es más probable que se logre la eliminación total1.
Si el cáncer no excede la mucosa gástrica, el margen de escisión libre de células cancerosas es ma yor de 2 mm a la microscopia, el grado de diferenciación del cáncer es bajo o moderado y no se observan signos compatibles con angioinvasión, entonces la resección se considera oncológicamente como radical1,2,4-6.
Por todo esto, la resección endoscópica con asa se consideró curativa al cumplir con los criterios de curación histológica1,4-6.
Se desconoce el porcentaje de recaída, poste rior a la resección radical del PHG con cáncer focal, aun que se considera menor que el de la resección endoscó pica del CGT no polipoideo, correspondiente al 1,2%1.
El seguimiento endoscópico oncológico de los pacientes con PHG que contienen focos de displasia y cáncer debe adaptarse al paciente, ya que no existen pautas generalmente aceptadas1. No obstante, algu nos estudios indican que este seguimiento debe incluir VEDA al año4,5 y a los tres años de la polipectomía inicial2.
El seguimiento debe ser realizado por un en doscopista entrenado, con endoscopio de alta resolu ción y luz blanca. Además, la cromoscopia puede me jorar la caracterización de las lesiones, dirigir biopsias y precisar los límites de una eventual resección6.
En conclusión, nos encontramos ante un caso con CGT en un PHG, que supone un desafío diagnóstico y terapéutico. Creemos que es fundamental tener en cuenta el tratamiento mínimamente invasivo mediante resección endoscópica, ya que se considera suficiente en este tipo de pacientes1,2,4-6.











 texto em
texto em 


