Introducción
La nutrición parenteral (NP) cambió el paradigma del entendimiento y tratamiento de los pacientes con fallo intestinal (FI). Su aplicación clínica la transformó en el principal soporte de pacientes agudos, y la nutrición parenteral domiciliaria (NPD) se constituyó en el soporte vital para pacientes crónicos1. El desarrollo del trasplante intestinal (TxI) proporcionó una alternativa para recuperar la suficiencia intestinal2,3,4 y se consolidó como terapéutica gracias a la introducción de los inhibidores de la calcineurina, inicialmente ciclosporina y, posteriormente, tacrolimus5,6.
La necesidad de dar respuesta quirúrgica a pacientes con síndrome de intestino corto (SIC) sin indicación de TxI ha dado origen a diferentes procedimientos de cirugía de rehabilitación intestinal (CRI).
Las técnicas de “elongación intestinal”, como el LILT (por las siglas en inglés de Longitudinal Intestinal Lengthening and Tailoring) desarrollada por Bianchi7, y la enteroplastia serial transversa o STEP (por las siglas en inglés de STEP, Serial Transverse Enteroplasty), descrita por Kim en 20038, contribuyeron a una mejora de la tasa de rehabilitación intestinal. La cirugía de reconstrucción autóloga del tracto gastrointestinal (CRATGI) agrupó los procedimientos que, además de restituir la continuidad intestinal, cambian la anatomía inicialmente desfavorable por otra más favorable, lo que resulta en un marcador pronóstico en adultos y niños9,10.
Messing y Amiot, en 1999 y 2013, respectivamente, determinaron que la dependencia de la NP en pacientes adultos con fallo intestinal crónico (FIC) por SIC dependía de factores anatómicos posquirúrgicos, como la longitud intestinal remanente (< 75 cm), ausencia de válvula ileocecal (VIC), < 57% de presencia de colon en continuidad y citrulina plasmática
A partir de 2012, la incorporación del análogo semisintético del péptido de GLP2 (sGLP2) para el tratamiento de pacientes adultos con FI por SIC y patología benigna cambió el curso del FI, y permitió que aquellos con anatomías posquirúrgicas desfavorables puedan alcanzar la autonomía intestinal13,14,15. En 2015, la Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN) redefinió el FI y lo diferenció de la insuficiencia intestinal, lo clasificó desde el punto de vista funcional, fisiopatológico y clínico, y determinó tres tipos de anatomías en el SIC 16. El FI ha sido el último fallo orgánico reconocido, considerado una enfermedad huérfana, cuya complejidad requiere que deba ser tratado por equipos especializados multi e interdisciplinarios17,18,19. En 2006, en Argentina establecimos el primer grupo multidisciplinario especializado en el manejo de estos pacientes.
El objetivo del presente estudio fue describir los resultados de 16 años en el tratamiento de pacientes con FIC secundario a SIC, y la evolución del papel de la cirugía, la rehabilitación médica y el TxI.
Materiales y métodos
Se realizó un análisis retrospectivo de una base de datos prospectiva de pacientes adultos y pediátricos tratados por FIC por SIC entre febrero de 2006 y marzo de 2022. Se incluyeron pacientes que recibieron CRI (CRATGI o STEP) o TxI. Se excluyeron pacientes rehabilitados médicamente sin cirugía o con anatomía digestiva reconstruida en otros centros.
Las variables analizadas en candidatos a CRI en la primera consulta fueron: edad, sexo, talla, peso (Z-score en pediatría), valoración global subjetiva (VGS) en adultos (A: bien nutridos; B: desnutrición moderada; C: desnutrición grave)20, causas de SIC, tipo de anatomía (tipo 1: yeyuno o ileostomía terminal; tipo 2: yeyuno/ ileo-colo anastomosis; tipo 3: yeyuno-íleo anastomosis con preservación de válvula ileocecal [VIC] y colon en continuidad total o parcial), y tiempo en NPD.
Luego de la CRI se analizó: cirugía realizada, tipo de anatomía y longitud intestinal posquirúrgica (LIPQ), considerando en adultos: A ≤ 50 cm, B: 51-99 cm, C: 100 cm; y en pediatría: A: ≤ 40 cm, B: 41-79 cm y C: ≥ 80 cm9 (la longitud intestinal se midió en el quirófano, según lo publicado por Gondolesi y cols.21), tratamiento médico posquirúrgico, porcentaje de pacientes y tiempo para suspender la NPD, supervivencia global y porcentaje de pacientes que requirieron TxI. En el grupo TxI se analizó: indicaciones y tipo de TxI realizado, tiempo para suspender la NPD, y supervivencia alejada del paciente y del injerto.
El tratamiento médico posquirúrgico se dividió en dos períodos: en el primero se utilizó medicación estándar (fármacos antimotilidad, antisecretores, antibióticos, enzimas pancreáticas y quelantes de las sales biliares), y en el segundo se agregó el uso de sGLP2 (en adultos desde 2014 y en pediatría desde 2016). Fueron candidatos para este tratamiento pacientes que cumplían los criterios de inclusión y exclusión de nuestro protocolo22.
Los resultados se analizaron según el grupo etario (adultos/pediátricos) y el período de tratamiento. El análisis estadístico se realizó con el software Social Package for Social Sciences (SPSS) v20.0, y se consideró significativo un valor de “p” o Log-Rank < 0,05; se utilizaron las pruebas de Student, Chi-cuadrado, ANOVA y Kaplan-Meier. Este estudio fue aprobado por el comité de ética del centro (DDI [1477] 1119).
Resultados
Se evaluaron 492 pacientes con FI, de los cuales 368 eran adultos y 124, pediátricos (Fig. 1).
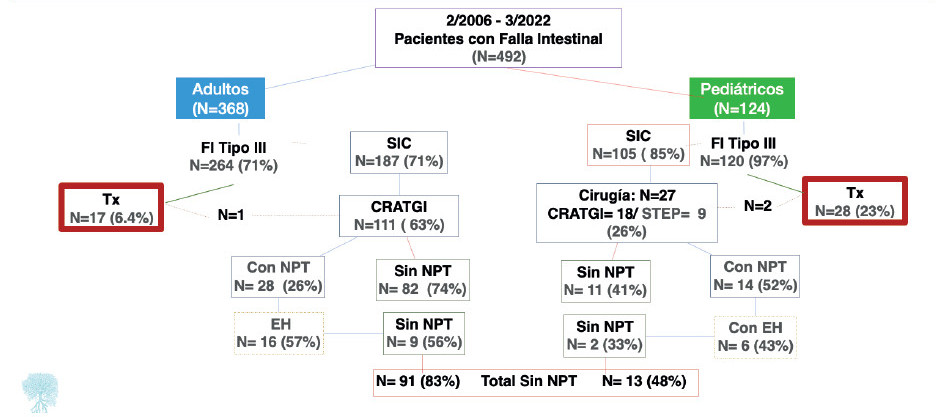
FIGURA 1. Diagrama de flujo. Diecisiete pacientes adultos recibieron 18 trasplantes, y 28 pediátricos recibieron 33 trasplantes.NPT: nutrición parenteral total; EH: enterohormonas; SIC: síndrome de intestino corto; CRATGI: cirugía de reconstrucción del tracto gastrointestinal; Tx: trasplante.
Pacientes adultos
Rehabilitación quirúrgica
De los 368 pacientes con FI, 264 (72%) eran portadores de FIC, 187 de ellos por SIC (71%) (Fig. 1).
Las etiologías más frecuentes fueron complicaciones posoperatorias (55%), isquemia intestinal (21%), trauma (5,4%) y complicación de cirugía bariátrica (5,4%).
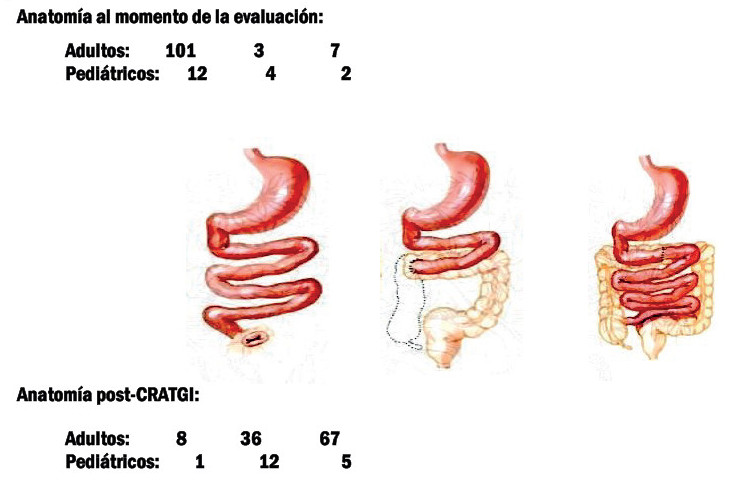
En 111/187 pacientes con SIC (59%) se realizó CRATGI (Fig. 2). La edad promedio fue de 49 ± 15 años y 61 (55%) eran varones. Para restituir la continuidad intestinal, 5 pacientes requirieron cirugía en dos tiempos y 1 en tres tiempos. En la primera consulta las anatomías fueron: de tipo 1 en 101 pacientes (90,1%); de tipo 3 en 7 pacientes (6,3%), y de tipo 2 en 3 pacientes (2,7%). Post-CRATGI, 67 pacientes (60,4%) se convirtieron a anatomía de tipo 3, 36 (32,4%) quedaron con anatomía de tipo 2 y solo 8 (7,2%) permanecieron con anatomía de tipo 1 (p < 0,00001) (Fig. 3).
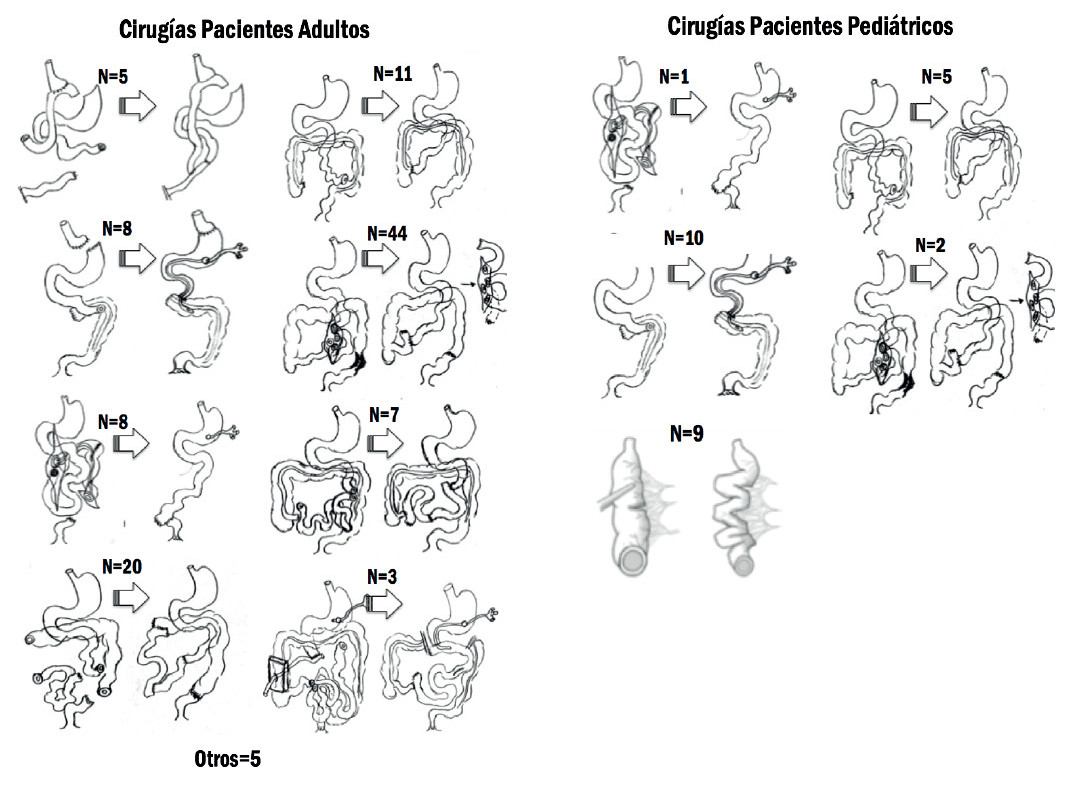
FIGURA 2 Tipos de cirugía de reconstrucción autóloga del tracto gastrointestinal (CRATGI) realizadas.
La longitud intestinal media posoperatoria fue de 155,3 ± 102,6 cm: “A” (20 ± 14 cm) en 23 pacientes, “B” (76,6 ± 13 cm) en 21 pacientes y “C” (208,4 ± 75 cm) en 67 pacientes. El tiempo en NPD prequirúrgico fue de 350,6 ± 296,4 días. Con el tratamiento médico estándar posquirúrgico, 82/111 pacientes (74%) suspendieron la NPD en 268,9 ± 416,3 días (vèase figura 1).
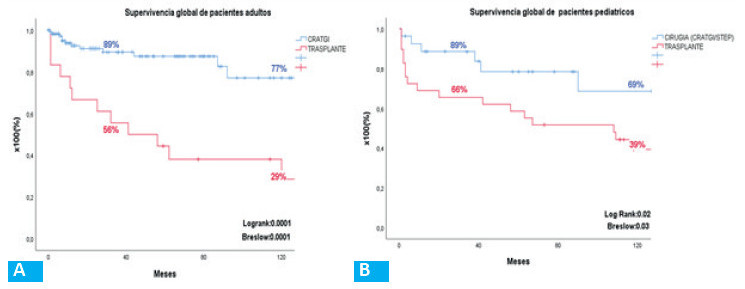
Sub-análisis por períodos (Fig. 4): en la primera consulta, la VGS mostró que la mayoría de los pacientes estaban desnutridos en ambos períodos: 77,8% en el primero (VGS “B”: 42,2%; “C”: 35,6%) y 78,8% en el segundo (VGS “B”: 37,9%; “C”: 40,9%). El tratamiento médico-nutricional mejoró esta condición y llevó la VGS “A” a 74,3% y 60,6% en cada período. La CRATGI se implementó en 45 pacientes en el primer período y en 66 en el segundo. En el primero, la NP fue suspendida en 32/45 pacientes (71,1%) en 409,5 ± 644,3 días, con una VGS “A” en 30 (93,8%) y “B” en 2 (6,2%). En el segundo período, 39/66 pacientes (59,1%) suspendieron la NP en 128,3 ± 188,3 días. La VGS fue “A” en 36 pacientes (92,3%) y “B” en 3 (7,7%) (Fig. 5). La supervivencia global fue del 89% a los 3 años y del 77% a los 10 años (Fig. 6). Cuarenta pacientes continuaron con NPD, de los cuales 13 correspondían al primer período y 27 al segundo (Figs. 4B y 5B). De estos, 16 (5 del primer período y 11 del segundo) fueron candidatos a recibir sGLP2 según los criterios de nuestro protocolo. Nueve pacientes (56,3%) suspendieron la NPD en 369,1 ± 363,8 días, con una LIPQ promedio de 57,2 ± 46,1 cm. Los 7 pacientes restantes respondieron al tratamiento y disminuyeron más del 20% el volumen inicial de la NPD o suspendieron 2 días/semana de NPD.
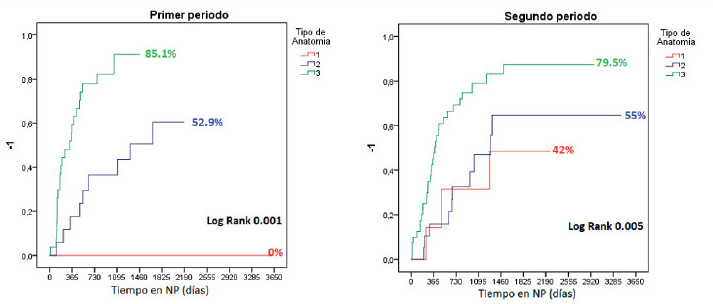
FIGURA 4 Tiempo para alcanzar independencia de la NP post-CRATGI, de acuerdo con el tipo de anatomía posoperatoria y el período de evaluado en pacientes adultos.
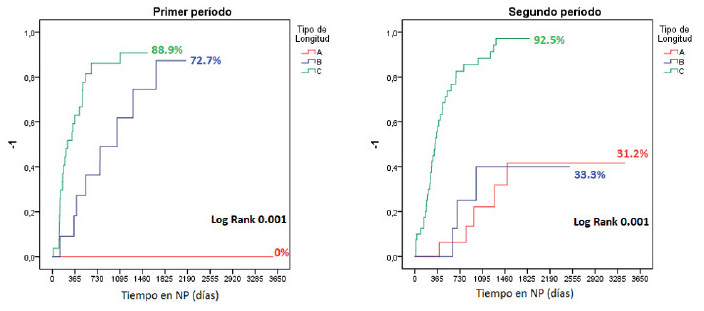
FIGURA 5 Tiempo para alcanzar independencia de la NP post-CRATGI, de acuerdo con la longitud intestinal posoperatoria y el período evaluado en pacientes adultos.
Trasplante intestinal
Se realizaron 18 TxI en 17 pacientes: 12 aislados, 3 multiviscerales (1 con riñón), 2 hepatointestinales (1 con riñón) y 1 multivisceral modificado. Las indicaciones fueron: pérdida de accesos venosos por trombosis en 9 pacientes (50%); enfermedad hepática asociada a la FI en 4 (22,2%); infecciones recurrentes de catéter en 2 (11%); trombosis portomesentérica difusa en 1 paciente, y otras indicaciones en 2 pacientes. Catorce trasplantes fueron realizados en el primer período y 4 en el segundo. El tiempo medio en NPD pre-TxI fue de 1760 ± 2064 días. La independencia de la NPD posterior al TxI se alcanzó a los 70 ± 56 días (p = 0,0001). La supervivencia post-TxI a los 3 y 10 años es del 56 y 29%, respectivamente. A 16 años, 6 pacientes están vivos, 5 de ellos con injerto funcionante y 1 en NPD en lista para retrasplante.
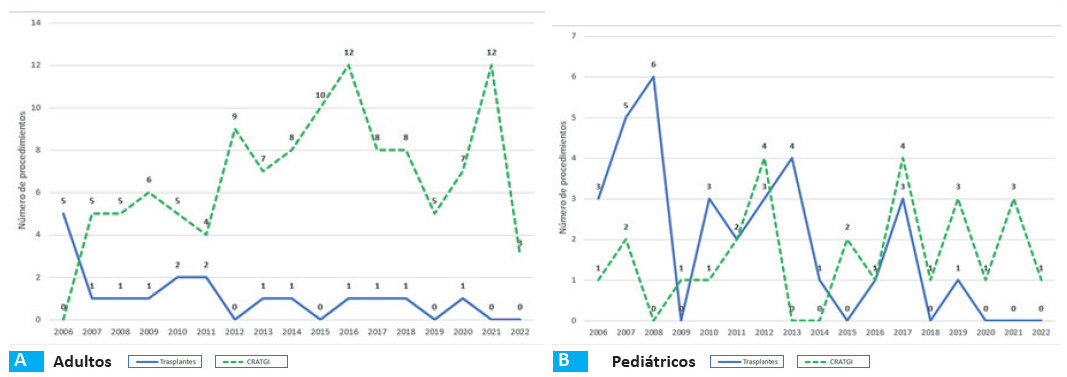
La supervivencia alejada post-CRATGI frente a post-TxI muestra una diferencia estadísticamente significativa (Log-Rank = 0,0001) (Fig. 6A). La figura 7A muestra la variabilidad en el tiempo de la indicación de los procedimientos quirúrgicos (CRATGI) y del TxI por año.
Pacientes pediátricos
Rehabilitación quirúrgica
De los 124 pacientes con FI, 120 tenían FIC (96,8%), 105/120 secundaria a SIC (87,5%) (Fig. 1). Las etiologías más frecuentes fueron: atresia intestinal (26%), gastrosquisis (18,5%), vólvulo (18,5%) y enteritis necrotizante (11%). Se realizaron CRI en 27/105 pacientes, 18 CRATGI y 9 STEP. La edad promedio fue de 8 ± 5 años, 17 (63%) eran varones, la talla fue de 84 ± 32 cm y el peso de 12,6 ± 11,5 kg (Z-score de talla/edad: -2,55 ± 1,9; Z-score peso/edad: -2,67 ± 2,02). Las cirugías realizadas se resumen en la figura 2. En la primera consulta, las anatomías de los candidatos a CRATGI fueron: de tipo 1 en 12 pacientes (66,7%); de tipo 2 en 4 (22,2%); de tipo 3 en 2 (11,1%). Posterior a la cirugía 12 pacientes (66,7%) tuvieron anatomía de tipo 2, 5 (27,7%) presentaron anatomía de tipo 3 y 1 paciente (5,5%) permaneció con anatomía de tipo 1 (p < 0,0003). De los candidatos a STEP, 4 tenían anatomía tipo 2 y en 5 estas eran de tipo 3. La LIPQ en ambos grupos fue de 31 ± 18 cm: “A” (21 ± 10 cm) en 10 pacientes, “B” (58 ± 12 cm) en 9 y “C” (111 ± 30 cm) en 8. El tiempo en NPD prequirúrgica fue del 684 ± 878 días y 11/27 pacientes (41%) suspendieron la NPD en 860 ± 1130 días poscirugía (Figs. 8 y 9).
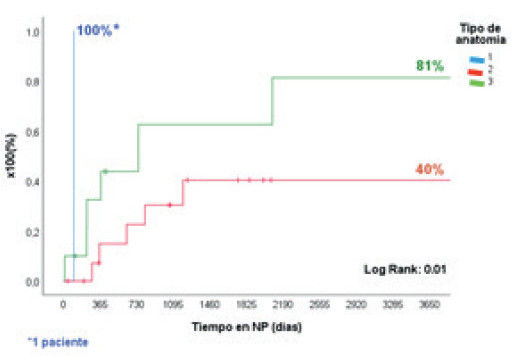
FIGURA 8 Tiempo para alcanzar la independencia de la NPD post-CRATGI + STEP, de acuerdo con el tipo de anatomía posoperatoria en pacientes pediátricos.
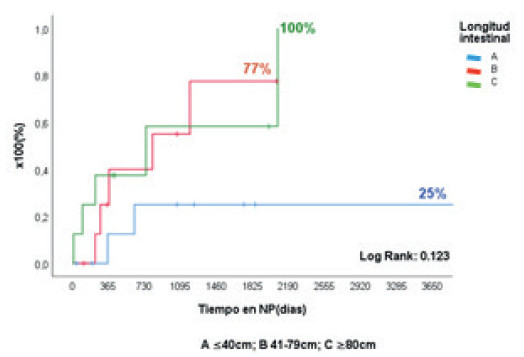
FIGURA 9 Tiempo para alcanzar la independencia de la NPD post-CRATGI + STEP, de acuerdo con la longitud intestinal posoperatoria en pacientes pediátricos.
Sub-análisis por períodos: de las 27 CRI realizadas, 13 (8 CRATGI y 5 STEP) fueron en el primer período y 14 (10 CRATGI y 4 STEP) en el segundo. En el primero, 9/13 pacientes (69%) suspendieron la NPD en 540 ± 328 días y, en el segundo, 2/14 pacientes (14,3%) lo hicieron en 58 ± 64 días con el tratamiento médico estándar posquirúrgico. La duración del seguimiento de este grupo no lo hace comparable con el primero. En el segundo período, 6 pacientes recibieron tratamiento con sGLP2. La LIPQ fue de 40 ± 10 cm, 5 pacientes tenían anatomía de tipo 2 y en 1 paciente esta era de tipo 3. La NPD fue suspendida en 2/6 pacientes (33%) en 275 y 204 días, respectivamente. Los 4 pacientes restantes (66%) respondieron al tratamiento con una baja del volumen inicial de la NPD del 20% o suspensión 2 días de NP/ semana. La supervivencia global posquirúrgica fue del 89% a los 3 años y del 69% a los 10 años (Fig. 6B). La talla fue de 113 ± 32 cm y el peso, 22 ± 13 kg (Z-score talla/edad: -2,21 ± 1,8 y Z-score peso/edad: -2,56 ± 2,1) en la última consulta.
Trasplante intestinal
En total, se realizaron 33 TxI: 28 primarios, 4 retrasplantes, y en 1 paciente se realizó un segundo re-trasplante. Los TxI primarios fueron: 24 aislados, 3 combinados (hepatointestinales), 1 multivisceral; mientras que los retrasplantes fueron: 3 aislados, 1 combinado (hepatointestinal con riñón) y 1 multivisceral con riñón.
Las indicaciones fueron: pérdida de accesos venosos en 15 pacientes (52%), enfermedad hepática asociada a la FI en 6 (20,7%), infecciones recurrentes de catéter en 3 (10,3%), y por otras indicaciones en 4 pacientes.
La longitud intestinal promedio implantada fue de 325 ± 59,4 cm. El tiempo medio en NPD pre-TxI fue de 1491 ± 1642 días y fue suspendida en 66 ± 57días post-TxI (p = 0,0001). Al final del primer año, el 69% mantuvo la independencia a la NPD. La supervivencia actuarial a los 3 y 10 años fue del 66% y 39%, respectivamente (Log-rank: 0,02) (Fig. 6B). Al cierre de la observación, 14 pacientes (48%) están vivos, 9 (31%) con injerto funcionante y 5 en NPD.
La figura 7B muestra la variabilidad en el tiempo de la indicación de los procedimientos quirúrgicos (CRATGI) y el trasplante por año para este grupo.
Discusión
Argentina fue el primer país de Latinoamérica en utilizar NP hospitalaria y domiciliaria en pacientes adultos y pediátricos23. En 2006, en el Hospital Universitario Fundación Favaloro se creó la primera unidad multidisciplinaria de soporte nutricional, rehabilitación y trasplante intestinal de nuestro país y Latinoamérica. Para ello, todas las áreas involucradas recibieron capacitación y se desarrolló una modalidad de trabajo clínico-quirúrgica, en la que se aplicaron protocolos de manejo prospectivo e incorporaron terapias disponibles a nivel internacional. Los primeros pacientes derivados a esta unidad fueron aquellos que ya habían desarrollado complicaciones asociadas con la NPD prolongada, con indicación de TxI. Fue así como entre 2006 y 2008 se realizó el mayor número de TxI, lo que permitió informar la primera serie exitosa en la región24. La implementación de la CRI consolidó a la CRATGI y el STEP como recursos quirúrgicos para mejorar la anatomía inicial e incrementar las posibilidades de rehabilitación, como lo han demostrado Abu Elgmad y cols.25, quienes publicaron su experiencia con 500 pacientes adultos portadores de FIC, y Gondolesi y cols. al analizar el manejo de la FI en los países emergentes26. Sin embargo, la introducción de sGLP2 en la rehabilitación intestinal fue la terapéutica que cambió definitivamente el curso de esta enfermedad, al lograr que pacientes con anatomías posquirúrgicas desfavorables alcancen la suficiencia intestinal. En 2019, nuestra unidad publicó su experiencia inicial y la primera fórmula capaz de predecir el pronóstico post-CRATGI en 88 pacientes adultos que recibían rehabilitación médica en base a un protocolo que incluía el uso de sGLP-2, y que logró la suspensión de la NP en el 83%27. Nuestro protocolo de rehabilitación posquirúrgica con el uso de sGLP2, publicado en 2020, determina que todos los pacientes deben recibir tratamiento médico-nutricional estándar posterior a la CRI, y solo aquellos en quienes no se pueda disminuir el volumen de la NP luego de 6 meses deben ser considerados candidatos para el tratamiento con sGLP222. Con este protocolo, solo el 14,4% de nuestros pacientes fueron candidatos a recibir sGLP-2, a diferencia de otros centros que informan 48 y 35,4%28,29, y hemos logrado una alta tasa de rehabilitación intestinal con pocos efectos adversos, incluso en pacientes con anatomías muy desfavorables (LIPQ < 10 cm, ausencia de VIC y colon parcial). Estos resultados fueron incluidos en el primer metaanálisis sobre el tema publicado en 202230.
En el área pediátrica, nuestra unidad recibe únicamente derivaciones complejas, y el 97% de los pacientes referidos son por FIC. Al igual que en los adultos, los primeros pacientes pediátricos derivados tenían complicaciones de la NPD prolongada e indicación de TxI. Lamentablemente, la escasez de donantes impactó la mortalidad en lista de espera31 y esto obligó a realizar un mayor número de CRI, lo que superó a la indicación del TxI. La LIPQ fue 31 cm, y esto refleja la gravedad de la patología en este grupo etario. Con la rehabilitación médica estándar posquirúrgica, el 44% de los pacientes suspendieron la NP; y con el uso de sGLP2, la rehabilitación intestinal alcanzó el 52%. Según lo publicado por el Hospital Necker, de 36 pacientes con longitud A, el 36% suspendió la NP y 12 requirieron TxI32. En la serie de 139 pacientes publicada por Belza y cols.33, el 68% alcanzó la autonomía nutricional, y la longitud intestinal > 100 cm, la presencia de VIC, el menor impacto hepático y el menor número de episodios de sepsis fueron factores favorables. Los resultados internacionales con el uso de sGLP-2 mostraron resultados similares a los nuestros34,35. En la primera revisión sistemática reciente en pediatría36 se incorporaron dos publicaciones de nuestro centro37,38. Los pacientes con TxI suspendieron la NP en menos tiempo que el requerido post-CRI, debido a que en el TxI se implanta un órgano con longitud y funcionalidad normal39,40. A largo plazo, el rechazo del injerto y su pérdida, y la mortalidad asociada con infecciones o enfermedades, como el linfoma postrasplante o la enfermedad de injerto contra huésped, impactan en la capacidad funcional del injerto y en la supervivencia alejada del paciente6,38,39.
El desarrollo de unidades de FI en nuestro país y el informe continuo de sus avances han permitido que la Argentina sea considerada hoy referente de la especialidad en la región y en el mundo18,41.











 texto em
texto em