Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista agronómica del noroeste argentino
versão impressa ISSN 0080-2069versão On-line ISSN 2314-369X
Rev. agron. noroeste arg. vol.35 no.1 San Miguel de Tucumán jun. 2015
ARTÍCULO CIENTÍFICO
Micorrizas vesículo-arbusculares, endófitos septados oscuros y anatomía radical en Fragaria ananassa var. Camino Real (Rosaceae), en la provincia de Tucumán, Argentina
Vesicular-arbuscular mycorrhizal, dark septate endophytes and root anatomy in Fragaria ananassa var. Camino Real (Rosaceae) in the province of Tucumán, Argentina
S.V. Lizarraga1; A.I. Ruiz1; S.M. Salazar2,3; J.C. Díaz Ricci4,5; P.L. Albornoz1,6
1Instituto de Morfología Vegetal, Fundación Miguel Lillo, Miguel Lillo 251, T4000JFE, Tucumán. E-mail: albornoz@csnat.unt.edu.ar
2INTA Famaillá.
3Cátedra de Horticultura, Facultad de Agronomía y Zootecnia, UNT.
4Instituto Superior de Investigaciones Biológicas (INSIBIO, CONICET-UNT).
5Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina.
6Cátedra de Anatomía Vegetal, Facultad de Ciencias Naturales e IML, UNT.
Resumen
En la provincia de Tucumán el cultivo de frutilla ocupa una superficie de 350 hectáreas. El mismo es invernal, con cosechas periódicas de fines de mayo a noviembre inclusive. Para evitar esta discontinuidad de producción, se incorporan al espectro de variedades precoces (Fortuna y Festival), variedades tardías, entre ellas Camino Real. Los objetivos de este trabajo fueron estudiar las micorrizas vesículo-arbusculares, los endófitos septados oscuros y caracterizar la anatomía radical en Fragaria ananassa var. Camino Real en cultivo comercial en la provincia de Tucumán. El muestreo fue realizado en el INTA-EEA Famaillá, Tucumán, Argentina. Se recolectaron los sistemas radicales correspondientes a un total de 20 individuos; los que fueron tratados con técnicas convencionales. Los sistemas radicales de la variedad Camino Real presentan las células del parénquima cortical colonizadas por micorrizas vesículo-arbusculares con dos tipos morfológicos simultáneos: Arum y Paris, siendo la morfología Arum la de mayor frecuencia. Además, el tejido cortical presenta endófitos septados oscuros. La anatomía radical de la estructura primaria presenta una histología típica con estelas de tipo diarca a tetrarca. Mientras que la estructura secundaria de la raíz muestra diferentes estadios de crecimiento, con restos de epidermis y parénquima cortical adheridos a la polidermis en formación. Se describen por primera vez, para Argentina, las micorrizas vesículo-arbusculares, los endófitos septados oscuros y la anatomía radical en Fragaria ananassa var. Camino Real.
Palabras clave: Micorrizas arbusculares; Septados oscuros; Anatomía radical; Frutilla
Abstract
In the province of Tucumán strawberry cultivation occupies an area of 350 hectares. It is a winter crop, with periodic harvests since late May to November inclusive. To avoid this discontinuity of production, a late variety (Camino Real) was added to the spectrum of early varieties (Fortuna and Festival). This paper aims to evaluate the vesicular-arbuscular mycorrhiza, dark septate endophytes and characterize the radical anatomy in Fragaria ananassa variety Camino Real in the province of Tucumán. The sampling was carried out at INTA-EEA Famaillá, Tucumán, Argentina. The radicals systems corresponding to 20 individuals were collected and treated with conventional techniques. The root systems of the variety Camino Real, show cortical parenchyma cells colonized by vesicular-arbuscular mycorrhizae which have two simultaneous morphological types: Arum and Paris. The Arum morphology is the most frequent. In addition, the cortical tissue has dark septate endophytes. The radical anatomy of the primary structure presents a typical histology with diarca to tetrarch stela, while the secondary root structure show different stages of growth with traces of epidermis and cortical parenchyma attached to the polidermis in development. The vesicular-arbuscular mycorrhizae, dark septate endophytes and radical anatomy of Fragaria ananassa var. 'Camino Real' were described for the first time for Argentina.
Keywords: Arbuscular mycorrhiza; Dark septate; Radical anatomy; Strawberry
Recibido 11/12/14; Aceptado 05/05/15.
Los autores declaran no tener conflicto de intereses.
Introducción
Los hongos formadores de micorrizas vesículo-arbusculares (MVA) pertenecen al Phylum Glomeromycota. Es frecuente encontrar a estos organismos en asociaciones simbióticas con plantas terrestres (Schübler et al., 2001). Las MVA mejoran el crecimiento de las plantas al facilitar la absorción de nutrientes limitados en el suelo tales como N, P, Zn y Cu (Sieverding, 1991). Además, confieren una mayor tolerancia al ataque de patógenos y a la sequía (Newsham et al., 1995). A cambio, los hongos reciben compuestos carbonados resultantes de la actividad fotosintética de la planta (Pfeffer et al., 1999). Las MVA se caracterizan por presentar dos morfologías diferentes, una tipo Arum:vesículas e hifas intercelulares que forman arbúsculos que invaden la célula colonizada, y otra tipo Paris:hifas intracelulares ovilladas que pueden desarrollar arbúsculos (Smith y Smith, 1997; Barker et al., 1998; Smith et al., 2008).
Otro grupo de hongos que se encuentran frecuentemente en raíces de plantas son los endófitos septados oscuros (ESO), pertenecientes a los Ascomycetes dematiáceos que colonizan inter e intracelularmente los tejidos radicales (Jumpponen, 2001; Barrow y Aaltonen, 2001; Barrow, 2003).
La familia Rosaceae incluye varias especies que son susceptibles a la colonización por micorrizas arbusculares (Ahulu et al., 2005; Menoyo et al., 2007). En Argentina el género Fragaria está representado por 74 especies, muchas de las cuales son apreciadas por sus frutos comestibles (Zardini, 1973 y 1999).
En la provincia de Tucumán, importante productora de frutilla de Argentina, el cultivo ocupa una superficie de 350 hectáreas (Agüero y Kirschbaum, 2013). El mismo es invernal, con cosechas periódicas desde fines de mayo a noviembre (Kirschbaum y Mamana, 2008). Para evitar discontinuidad de producción, se incorporan nuevas variedades al espectro cultivado, entre ellas Camino Real, la que ocupa actualmente el 25% del área cultivada en la provincia (Kirschbaum, Comunicación personal, 2014). El sistema radical de esta variedad se concentra en los primeros 30 cm del suelo, lo que permite grandes densidades de plantación y facilita la recolección del fruto (Angulo Carmona, 2009).
Los antecedentes sobre MVA en Fragaria son referidos fundamentalmente a su inoculación para mejorar el crecimiento y desarrollo de la planta (Niemi y Vestberg, 1992; Williams et al., 1992; Rivera-Chávez et al., 2012). En la provincia de Tucumán estudios previos sólo mencionan la presencia de MVA en los géneros Duchesnea, Fragaria y Potentilla (Brandán de Weht et al., 2002; Albornoz et al., 2007). Aunque Albornoz et al. (2014), describe los tipos morfológicos de la asociación endomicorrícica, la presencia de oscuros septados y un tercer endófito en raíces de Fragaria vesca, Duchesnea indica y Potentilla tucumanensis, son escasos los antecedentes referidos a la inoculación con MVA en distintas variedades de frutillas (Stewart et al., 2005). Salgado-Barreiro et al. (2012) evaluaron el efecto del crecimiento de plantas de la var. Camino Real inoculadas con Glomus intraradices. Debido a que no se registran antecedentes para la variedad mencionada en la provincia de Tucumán ni en el país, los objetivos de esta investigación fueron estudiar las MVA, los endófitos septados oscuros y la anatomía radical en Fragaria ananassa var. Camino Real en la provincia de Tucumán.
Materiales y métodos
Área de estudio
El muestreo fue realizado en la Estación Experimental Agropecuaria Famaillá, del INTA, en Tucumán (27° 03' S; 65º 25' W, 363 m.s.n.m.), en un suelo tipo franco limoso con 2,18 % de materia orgánica, durante las campañas 2010-2011. Las plantas fueron cultivadas en suelos sin desinfección (S/D). Dicho suelo tuvo como cultivo antecesor sorgo durante el período estival, rotando frutilla sorgo frutilla.
Plantación
Se realizó del 25 al 28 de abril, en camellones de 0,50 m de ancho en la mesada y 0,80 m en la base, distanciados a 1,30 m entre sí. Dentro de cada camellón, cubiertos por el mulch o acolchado plástico (AP) (Maynard y Hochmuth, 2007), se plantó en doble hilera a tresbolillo, a 0,30 m entre hileras y 0,30 m entre plantas.
Riego y fertilización
Se instaló una cinta de goteo, con cinco goteros por metro con un caudal de 1 l·h-1, por camellón para el aporte de agua. La frecuencia de riego fue de tres a cinco veces por semana, aportando la cantidad de agua para mantener el suelo a capacidad de campo (CC). La fertilización fue igual a 120 kg N·ha-1 en una relación de N:P2O5:K2O:CaO:MgO (1:0,7:2:0,4:0,2) aplicados a través del riego por goteo y fertilización de base durante el armado de los camellones con triple 15 (N:P:K).
Muestreo del sistema radical
Se recolectaron, al azar, los sistemas radicales completos pertenecientes a un total de 20 individuos, en dos estadios fenológicos: pico de fructificación y final del ciclo. El material obtenido se acondicionó en bolsas de nylon y se conservó en heladera a 4ºC hasta su procesamiento.
Para el estudio de las MVA, en el laboratorio, las raíces correspondientes a 15 individuos fueron tratadas según la técnica de Phillips y Hayman (1970), posteriormente fueron teñidas con azul de tripán en glicerina al 0,05%. La cuantificación de las micorrizas arbusculares se realizó siguiendo el método de intersección (McGonigle et al., 1990), utilizando un microscopio óptico Olympus con aumento de 200x. En cada sistema radical se seleccionaron al azar 30 fragmentos de 1 cm de longitud y en cada fragmento se examinaron 5 intersecciones (150 intersecciones por cada individuo).
Para el estudio de la anatomía radical se trabajó con el sistema completo de 5 individuos provenientes de estolones (raíces adventicias) y 5 individuos obtenidos por germinación de aquenios (raíces seminales). Se realizaron secciones transversales a mano alzada de raíces seminales y adventicias, las que fueron coloreadas con una doble tinción azul astral-safranina (D´Ambrogio de Argüeso, 1986). Las observaciones se realizaron en microscopio estereoscópico (Olympus) y óptico (Zeiss, Axiostar Plus). Las fotografías fueron tomadas con cámara digital (Canon A620, Power Shot 7,1 MP y Olympus SP-350 de 8MP). Los preparados de referencia se encuentran en la histoteca del Instituto de Morfología Vegetal de la Fundación Miguel Lillo.
Muestreo de suelo
Para cada período evaluado se extrajeron 8 muestras de suelo de los primeros 20 cm de profundidad, las que se almacenaron en bolsas plásticas etiquetadas. Las muestras fueron sometidas a un análisis físico-químico donde se evaluaron las siguientes variables: pH, Carbono y Nitrógeno (%), Potasio (meq/100g), Fósforo (ppm), textura, conductividad eléctrica (dS/m), capacidad de intercambio catiónico (meq/L), y relación absorción sodio (RAS) (Tabla 1).
Tabla 1. Análisis granulométrico y físico químico del suelo rizosférico de lotes pertenecientes a los ensayos colectados en 2010 y 2011, en la localidad de Famaillá, Tucumán.
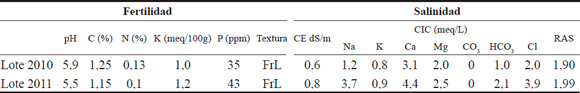
C, carbono; N, nitrógeno total; K, potasio; P, fósforo; FrL, franco limoso. CE, conductibilidad eléctrica; CIC, capacidad de intercambio catiónico; RAS, relación adsorción sodio. Lote 2010, muestras de suelo colectadas en 2010 y Lote 2011 muestras colectadas en 2011.
Análisis de datos
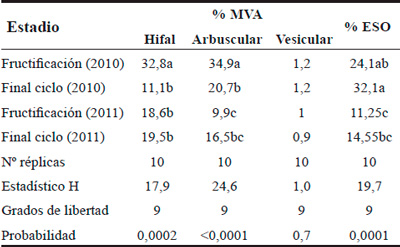
Para cada individuo se cuantificó el porcentaje de colonización por MVA (hifas, arbúsculos y vesículas) y ESO. Debido a la gran variabilidad en los porcentajes de colonización de cada parámetro se aplicó la prueba no paramétrica de Kruskal-Wallis (Quinn y Keough, 2002) para comparar las MVA y los ESO entre los estadios pico de fructificación y final del ciclo.
Resultados
Micorrizas vesículo-arbusculares
Los sistemas radicales de Fragaria ananassa var. Camino Real presentan las células corticales colonizadas por micorrizas arbusculares con dos tipos morfológicos simultáneos: Arum y Paris. La morfología Arum es la de mayor frecuencia y presenta hifas gruesas con estructuras en "H", que recorren paralelas a la superficie radical de manera intercelular (Figura 1A) y forma arbúsculos laterales intracelulares (Figura 1B), además estas hifas llevan vesículas terminales de forma elipsoidales (Figura 1C). La morfología Paris es de hifas gruesas intracelulares que forma circunvoluciones (Figura 1D, 1E). El tejido cortical presenta además, endófitos septados oscuros con hifas intercelulares (Figura 1F) y microesclerocios intracelulares (Figura 1G), ambas estructuras de color castaño. El porcentaje de colonización hifal y arbuscular presentó diferencia significativa en el estadio de fructificación en el primer año de análisis. La colonización vesicular no presentó diferencia en los estadios analizados. Los oscuros septados aumentaron al final del ciclo de la planta en los dos años evaluados, presentando diferencia significativa al final del ciclo en 2010 (Tabla 2).
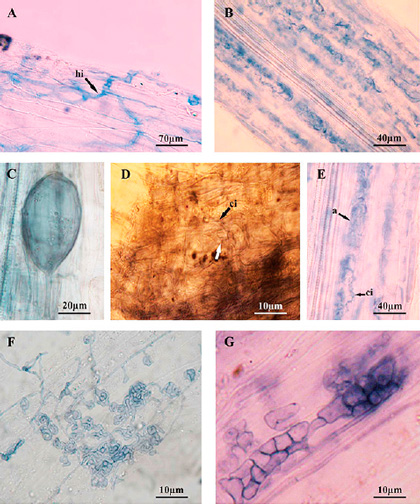
Figura 1. Fragaria ananassa var. Camino Real. Endófitos radicales. A. Hifas gruesas intercelulares con estructuras en "H" (tipo Arum); B. Arbúsculos laterales (tipo Arum); C. Vesícula terminal; D. Circunvoluciones intracelulares (tipo Paris); E. Circunvoluciones intracelulares con arbúsculos (tipo Paris); F. Endófitos septados oscuros con hifas intercelulares; G. Microesclerocios intracelulares. Referencias: a, arbúsculos; ci, circunvolución intracelular; hi, hifa intercelular.
Tabla 2. Porcentaje de MVA y ESO en Fragaria ananassa var. Camino Real en suelo sin desinfección (S/D).
Anatomía de la raíz
En sección transversal, la estructura primaria presenta epidermis unistrata; por debajo de ésta se desarrolla un parénquima cortical formado por 2-4 estratos de células isodiamétricas; se continúa con una endodermis con bandas de Caspary radiales, y un periciclo unistrato; internamente el sistema vascular se organiza en una estela de tipo diarca (Figura 2A). En algunas secciones se evidenciaron canales de aire longitudinales en el parénquima cortical (no se muestra en imagen).
En un estadio más avanzado del desarrollo se observa un crecimiento secundario temprano, donde la epidermis es unistrata; internamente la corteza parenquimática está formada por 15-16 estratos de células que reservan granos de almidón simple con hilo excéntrico; se mantiene la endodermis; el sistema vascular presenta el cambium continuo al igual que el xilema y el floema; internamente se observan de 3-4 puntos protoxilemáticos (estelas triarca y tetrarca), lo que indica la variación estelar que presentan los estadios primarios (Figuras 2B, C y D). Mientras que un estadio más avanzado aún, la estructura secundaria sigue teniendo crecimiento temprano con restos de epidermis y parénquima cortical adheridos a la polidermis en formación, internamente se distingue escaso parénquima cortical (3-4 estratos) y el sistema vascular continuo (Figura 2E).
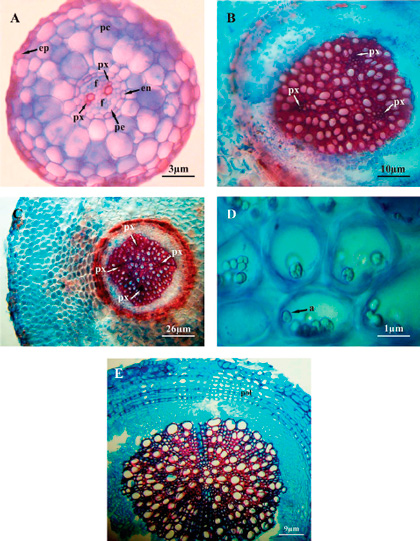
Figura 2. Fragaria ananassa var. Camino Real. Anatomía radical, secciones transversales. A. Raíz con crecimiento primario; B. Detalle raíz con crecimiento secundario temprano, estela triarca; C. Raíz con crecimiento secundario temprano, estela tetrarca; D. Detalle de gránulos de almidón simple con hilo excéntrico; E. Sección transversal de raíz con crecimiento secundario avanzado, polidermis en formación. Referencias: a, almidón; en, endodermis; ep, epidermis; f, floema; pc, parénquima cortical; pe, periciclo; pol, polidermis; px, protoxilema.
Discusión
En Argentina, diversos grupos de plantas, incluyendo helechos, mono y dicotiledóneas se encuentran simultáneamente colonizados por micorrizas vesículo arbusculares (MVA) y endófitos septados oscuros (ESO) (Urcelay et al., 2005; Hernández et al., 2010; Lugo et al., 2011), lo que sugiere que esto es más frecuente de lo esperado como sostiene Lugo et al. (2011).
El sistema radical de F. ananassa var. Camino Real presenta la co-ocurrencia de las morfologías Arum-Paris y los ESO, este tipo de asociaciones fue también observada por Kubota et al. (2005) y Albornoz et al. (2014); este último para Fragaria vesca, especie silvestre emparentada con la cultivada aquí estudiada.
Anatómicamente se analizaron raíces seminales y adventicias, éstas últimas presentaron variación en el tipo de estela de diarca a tetrarca, lo cual estaría relacionado con el origen estolonífero de algunas de las plantas. Mientras que las raíces seminales siempre presentaron estelas diarcas. La presencia de canales de aire longitudinales en la corteza primaria de la raíz responde a la asociación micorrícica arbuscular con morfología Arum. Consideramos que la presencia de polidermis y almidón en las raíces adventicias, con diferentes estadios de crecimiento secundario, son elementos de valor diagnóstico, en concordancia con lo propuesto por Albornoz et al. (2007), para el género Fragaria.
La disminución en el porcentaje de MVA y de ESO en el segundo año de análisis se correlaciona con los mayores valores de fósforo (43 ppm) encontrados para éste período; resultados similares fueron mencionados por Albornoz et al. (2014). Es importante mencionar que el contenido de fósforo disponible en el suelo es una de las variables, por la cual una especie vegetal depende de la asociación para subsistir; ese valor se estima por debajo de 20 ppm (Barea et al., 2002; Read y Pérez Moreno, 2003).
Salgado-Barreiro et al. (2012) inocularon plantas de la variedad Camino Real con MVA, las que fueron regadas con fertilizantes a distintas concentraciones y demostraron que si bien la inoculación promueve el crecimiento, la simbiosis se desarrolla mejor a concentraciones bajas de fertilizantes nitrogenados. Resultados similares fueron obtenidos por Salazar et al. (2012), quienes inocularon plantas de la misma variedad sin el aporte de fertilizantes, y lograron una producción significativa en relación a las plantas controles. La baja micorrización observada en los sistemas radicales de la variedad aquí estudiada se debería al alto contenido de fósforo, sumado a la fertilización con nitrógeno que se realizó a través de la fertilización de base y fertirriego; y no al tipo de ramificación del sistema radical como proponen Smith y Read (2008).
Conclusiones
Los resultados aportados en este trabajo sugieren que para favorecer la asociación planta-MVA-ESO se debería reducir la cantidad de fósforo y nitrógeno en el suelo. Además, esta reducción en el uso de fertilizantes se traduciría en una disminución en los costos de producción y la contaminación ambiental. Se citan y describen por primera vez para Argentina las MVA, los ESO y la anatomía radical en F. ananassa var. Camino Real.
Agradecimientos
Este estudio fue financiado por el Consejo de Ciencia y Técnica de la Universidad Nacional de Tucumán (CIUNT), en el marco del programa 26/D544 y el INTA a través de los proyectos PNHFA 061281 y 1106073.
Referencias bibliográficas
1. Agüero J.J., Kirschbaum D.S. (2013). Approaches to nutrient use efficiency of different strawberry genotypes. International Journal of Fruit Science 13: 139- 148. [ Links ]
2. Ahulu E.M., Nakata M., Nonaka M. (2005). Arumand Paris-type arbuscular mycorrhizas in a mixed pine forest on sand dune soil in Niigata Prefecture, central Honshu, Japan. Mycorrhiza 15: 129-136. [ Links ]
3. Albornoz P., Arias M., Castagnaro A., Díaz Ricci J.C. (2007). Comparative root anatomy of Duchesnea indica, Fragaria vesca and Potentilla tucumanensis (Rosaceae) in the province of Tucumán, Argentina. [ Links ]
4. Albornoz P.L., Varela O., Díaz Ricci J.C. (2014). Micorrizas arbusculares y endófitos septados oscuros en tres especies de Rosáceas de Argentina. Lilloa 51: 9-19. Adansonia 29: 255-267. [ Links ]
5. Angulo Carmona R. (2009). "Frutilla" Cartilla Técnica, Bayer Cropscience S.A. Mary Luz Ángel, Bogotá, p.12. [ Links ]
6. Barea J.M., Azcón R., Azcón-Aguilar C. (2002). Mycorrhizosphere interactions to improve plant fitness and soil quality. Antonie van Leeuwenhoek 81: 343- 351. [ Links ]
7. Barker S.J., Tagu D., Delp G. (1998). Regulation of root and fungal morphogenesis in mycorrhizal symbiosis. Plant Physiology 116: 1202-1207. [ Links ]
8. Barrow J.R., Aaltonen R.E. (2001). Evaluation of the internal colonization of Atriplex canescens (Pursh) Nutt. Roots by dark septate fungi and the influence of host physiological activity. Mycorrhiza 11: 199-205. [ Links ]
9. Barrow J.R. (2003). Atypical morphology of dark septate fungal root endophytes of Bouteloua in arid southwestern USA rangelands. Mycorrhiza 13: 239-247. [ Links ]
10. Brandán de Weht C.I., Brandán E.Z., Maidana J.R. (2002). Duchesnea sp. y Fragaria ananassa Duch. hospederos de endomicorrizas nativas y nemátodes en dos zonas en Tucumán, República Argentina. En: Manejo de sistemas microbianos para optimizar la producción agrícola y silvopastoril en algunas áreas del NOA. De Bellone, C.H., Carrizo de Bellone, S., Pedraza, R.O. (Eds.). Facultad de Agronomía y Zootecnia de la Universidad Nacional de Tucumán, Tucumán, Argentina, pp. 105-107. [ Links ]
11. D'Ambrogio de Argüeso A. (1986). Manual de Técnicas en Histología Vegetal. 1era ed., Hemisferio Sur, Buenos Aires, p. 83. [ Links ]
12. Hernández M.A., Terán G., Albornoz P.L. (2010). Morfología, Anatomía y Endomicorrizas en el esporofito de Doryopteris concolor (Pteridaceae). Lilloa 47: 74- 84. [ Links ]
13. Jumpponen A. (2001). Dark septate endophytes-are they mycorrhizal? Mycorrhiza 11: 207-211. [ Links ]
14. Kirschbaum D.S., Mamana R. (2008). Present and future of the strawberry industry in Argentina. VI International Strawberry Symposium. 3-7 marzo, Huelva, España. p.429. [ Links ]
15. Kubota M., Mc Gonigle T.P., Hyakumachi M. (2005). Co-occurrence of Arum- and Paris-type morphologies of arbuscular mycorrhizae in cucumber and tomato. Mycorrhiza 15: 73-77. [ Links ]
16. Lugo M.A., Giordano P., Urcelay C., Crespo E. (2011). Colonización radical por endófitos fúngicos en Trithrinax campestris (Arecaceae) de ecosistemas semiáridos de Argentina. Boletín de la Sociedad Argentina de Botánica 46: 213-222. [ Links ]
17. Maynard D.N., Hochmuth G.J. (2007). Knott's Handbook for Vegetable Growers. 5ta ed., John Wiley and Sons, New York, p. 134. [ Links ]
18. McGonigle T.P., Miller M.H., Evans D.G., Fairchild G.L., Swan J.A. (1990). A method which gives and objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi. New Phytologist 115: 495-501. [ Links ]
19. Menoyo E., Becerra A., Renison D. (2007). Mycorrhizal associations in Polylepis woodlands of central Argentina. Canadian Journal of Botany 85: 526-531. [ Links ]
20. Newsham K.K., Fitter A.H., Watkinson A.R. (1995). Multi-functionaly and biodiversity in arbuscular mycorrhizas. Trends in Ecology and Evolution 10: 407-411. [ Links ]
21. Niemi M., Vestberg M. (1992). Inoculation of comercially grown strawberry with VA mycorrhizal fungi. Plant and Soil 144: 132-142. [ Links ]
22. Pfeffer P.E., Douds D.D., Bécard G., Schachar-Hill Y. (1999). Carbon uptake and metabolism and transport of lipids in an arbuscular mycorrhiza. Plant Physiology 120: 587-598. [ Links ]
23. Phillips J.M., Hayman D.S. (1970). Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society 55: 158-161. [ Links ]
24. Quinn G., Keough M. (2002). Experimental Design and Data Analysis for Biologists. Cambridge University Press. Cambridge, p. 553. [ Links ]
25. Read D.J., Pérez-Moreno J. (2003). Mycorrhizas and nutrient cycling in ecosystems - a journey towards relevance? New Phytologist 157: 475-492. [ Links ]
26. Rivera-Chávez F.H., Vázquez-Gálvez G., Castillejo-Álvarez L.E., Angoa-Pérez M.V., Oyoque-Salcedo G., Mena-Violante H.G. (2012). Efecto de hongos micorrícicos arbusculares y extracto acuoso de Vermicompost sobre calidad de fresa. Ra Ximhai 8: 119-130. [ Links ]
27. Salazar S.M., Racedo Aragón D.N., Lovaisa N.C., Azcón R., Pedraza R.O. (2012). Uso de Azospirillum brasilense y Glomus mosseae en la multiplicación vegetativa de plantas de fresa (Fragaria ananassa Duch.). XVIII Congreso Científico Internacional del Instituto Nacional de Ciencias Agrícolas (INCA). VII Simposio de Caracterización y Manejo de Microorganismos Rizosféricos. 6-9 noviembre, San José de las Lajas, La Habana, Cuba. p. 103. [ Links ]
28. Salgado-Barreiro C.S., Bravo-Patiño A., Wang E.T., Cárdenas-Navarro R. (2012). Efecto de la inoculación con Glomus intraradices y de la fertilización nitrogenada en el crecimiento de plantas de fresa. Scientia Agropecuaria 2: 171-179. [ Links ]
29. Schüβler A., Schwarzott D., Walker C. (2001). A new fungal phylum the Glomeromycota: phylogeny and evolution. Mycological Research 105: 1413-1421. [ Links ]
30. Sieverding E. (1991). Vesicular arbuscular mycorrhizal management in Tropical agrosystems. Technical Cooperation, Eschborn, p. 371. [ Links ]
31. Smith F.A., Smith S.E. (1997). Structural diversity in (vesicular)-arbuscular mycorrhizal symbiosis. New Phytologist 137: 373-388. [ Links ]
32. Smith S.E., Read D.J. (2008). Mycorrhizal Symbiosis. Academic Press, San Diego, p. 82. [ Links ]
33. Stewart L.I., Hamel C., Hogue R., Moutoglis P. (2005). Response of strawberry to inoculation with arbuscular mycorrhizal fungi under very high soil phosphorus conditions. Mycorrhiza 15: 612-619. [ Links ]
34. Urcelay C., Tecco P.A., Chiarini F. (2005). Micorrizas arbusculares del tipo Arum y Paris endófitos radicales septados oscuros en Miconia ioneura y Tibouchina paratropica (Melastomataceae). Boletín de la Sociedad Argentina de Botánica 40: 151-155. [ Links ]
35. Williams S.C.K., Vestberg M., Uosukaine M., Dodd J.C., Jeffries P. (1992). Effects of fertilizers and arbuscular mycorrhizal fungi on the post-vitro growth of micropropagated strawberry. Agronomie 12: 851-857. [ Links ]
36. Zardini E.M. (1973). Los géneros de Rosáceas espontáneos en la República Argentina. Boletín de la Sociedad Argentina de Botánica 15: 209-228. [ Links ]
37. Zardini E.M. (1999). Rosaceae. En: Catálogo de las Plantas Vasculares de la República Argentina II. De Zuloaga, F.O. y Morrone, O. (Eds.). Monographs in Systematic Botany from the Missouri Botanical Garden, St. Louis, pp. 981-992 [ Links ]














