Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista agronómica del noroeste argentino
versão impressa ISSN 0080-2069versão On-line ISSN 2314-369X
Rev. agron. noroeste arg. vol.35 no.1 San Miguel de Tucumán jun. 2015
ARTÍCULO CIENTÍFICO
Aislamiento y caracterización de bacterias solubilizadoras de fosfatos del Noroeste Argentino y su efecto en la promoción de crecimiento en maíz (Zea mays L.)
Isolation and characterization of phosphate solubilizing bacteria in northwestern Argentina and its effect in promoting growth in maize (Zea mays L.)
R.A. García ; N.C. Lovaisa; E.L. Ulla
Microbiología Agrícola. Facultad de Agronomía y Zootecnia. Universidad Nacional de Tucumán. E-mail: elsaulla@hotmail.com
Avda. Néstor Kirchner 1900, (4000), San Miguel de Tucumán, Tucumán, Argentina.
Resumen
Las bacterias solubilizadoras de fosfatos desempeñan un importante papel en el suplemento de fósforo para las plantas. Este factor despertó la atención para su utilización como inoculante comercial o, el manejo de sus poblaciones para promover una mejor utilización del fósforo existente en el suelo o el adicionado como fertilizante. El objetivo general de este trabajo fue estudiar la actividad de bacterias solubilizadoras de fosfatos aisladas de tres localidades del Noroeste Argentino (NOA). Se planteó determinar su presencia, aislar las encontradas en mayor proporción, evaluar el potencial solubilizador de fosfatos, caracterizarlas por pruebas bioquímicas y de biología molecular y evaluar su capacidad para estimular el crecimiento en maíz (Zea mays L.). Se tomaron muestras compuestas de suelo de tres localidades del NOA, se realizó el aislamiento por la técnica de dilución en placa en medio de cultivo NBRIP y se purificaron en medio de cultivo TSA. Se determinó morfología, motilidad, pared celular, eficiencia de solubilización y se realizaron pruebas bioquímicas que permitieron identificarlas como Pseudomonas spp., Pseudomonas aurantiaca, Serratia fonticola, Proteus spp., Bacillus subtilis, Bacillus megaterium y Bacillus spp. Se realizó amplificación y secuenciación del gen 16S ADNr de las que presentaron mayor eficiencia de solubilización. Para comprobar el efecto promotor del crecimiento en maíz en condiciones controladas, se evaluaron longitud y peso seco de tallo y raíz. Los resultados mostraron que los tratamientos inoculados produjeron aumentos en las variables analizadas con respecto al testigo sin inocular, lo que permite inferir que las tres bacterias pueden ser utilizadas como estimuladoras del crecimiento vegetal.
Palabras clave: Bacillus; Solubilización de fosfatos; Promoción de crecimiento; Maíz
Abstract
Phosphate solubilizer bacteria perform an important role in the phosphorous supply for plants. This factor calls the attention for its use as commercial inoculate or the management of its population to promote a better use of phosphate present in soil or the one added as fertilizer. The aim of this work was to study the activity of the phosphate solubilizers bacteria isolated from three locations of Northwestern Argentina. Other objectives were to isolate the ones founded in biggest proportion, to evaluate solubilization efficiency, to characterize them through biochemical and molecular test and evaluate its capacity to promote the growth in corn (Zea mays L.). Rhizospheric soil samples were taken from three locations in the NWA region and the presence and counting of phosphate solubilizing bacteria was conducted by the plate dilution technique in NBRIP medium. Strains that showed solubilization halo were selected and purified on TSA medium. Morphology, motility, cellular wall, solubilization efficiency were determined and biochemical tests were made which allows to identify them as Pseudomonas spp., Pseudomonas aurantiaca, Serratia fonticola, Proteus spp., Bacillus subtilis, Bacillus megaterium and Bacillus spp. Amplification and sequencing of the 16S rDNA gene of the ones with higher efficiency of solubilization was performed. To prove the promoting effect of maize growth under controlled conditions, length and dry weight of stem and root were evaluated. The result showed that the inoculated plants produced increases in the analyzed parameters in relation to the control, allowing to infer that three bacteria can be used to stimulate plant growth.
Keywords: Bacillus; Phosphate solubilization; Plant growth; Corn
Recibido 19/04/15; Aceptado 03/06/15.
Los autores declaran no tener conflicto de intereses.
Introducción
El suelo es un sistema complejo que alberga una gran cantidad y variedad de especies vegetales, animales y de microorganismos. Estos organismos establecen relaciones entre sí en formas variables y complejas, que contribuyen también a generar las características propias de cada suelo mediante la modificación de las fases sólida, liquida y gaseosa del mismo. Los microorganismos resultan ser de gran importancia pues se relacionan con procesos de edafogénesis, ciclos biogeoquímicos de elementos como carbono, nitrógeno, azufre, fósforo, hierro y otros elementos, fertilidad de las plantas, protección frente a patógenos, y degradación de compuestos xenobióticos, entre otros (Nogales, 2005).
El fósforo es un elemento esencial para la vida; las plantas lo necesitan para crecer y desarrollar su potencial genético y forma la base de un gran número de compuestos de los cuales los más importantes son los fosfatos. Estos desempeñan un papel esencial en los procesos de transferencia de energía y en el metabolismo (Salazar, 2005).
El fósforo en el suelo se encuentra bajo forma orgánica y en menor medida bajo forma inorgánica. Las formas orgánicas provienen de restos vegetales, animales, microorganismos y de otros residuos orgánicos, que al ser degradados por los microorganismos del suelo liberan compuestos fosfatados; constituyendo del 29% al 65% del fósforo presente en la superficie del suelo, los cuales son, en su mayoría, compuestos de bajo peso molecular (Díaz et al., 2001). Las principales formas de fosfatos inorgánicos son: hidroxiapatita, fluoroapatita, fosfato tricálcico, etc. Los compuestos inorgánicos insolubles de fósforo no están totalmente disponibles para las plantas y la disponibilidad depende del pH del suelo, porque solo pueden ser tomados como ion ortofosfato, pero estos pueden convertirse, por bacterias solubilizadoras de fósforo, en fosfatos di y monobásicos, formas asimilables para las raíces de las plantas. Una insuficiencia de fósforo en el suelo puede influir en el retraso de la madurez y el desarrollo de la planta, disminuyendo el rendimiento de la cosecha, por esta razón los microorganismos solubilizadores de fosfatos desarrollan un papel fundamental en cuanto a la movilización de este elemento (Díaz et al., 2001). Los iones fosfatos son extremadamente reactivos, en suelos ácidos y precipitan con Fe+3 y Al+3, mientras que en suelos alcalinos precipitan con Ca+2 y Mg+2, causando una baja eficiencia de los fertilizantes que poseen fósforo soluble (Fankem et al., 2006). El uso de microorganismos benéficos, como biofertilizantes, presenta ventajas frente a los fertilizantes químicos, pues colaboran con la preservación del medio ambiente, ya que no implican sustancias tóxicas que afecten el sistema, generando de esta manera una agricultura sostenible (Chen et al., 2006).
Los fosfatos insolubles, que no pueden ser asimilados por las plantas, pueden ser llevados a formas solubles por la acción de muchos microorganismos. La vía principal de solubilización es mediante la producción de ácidos orgánicos tales como: acético, láctico, oxálico, cítrico, butírico, succínico, málico, glucónico, fumárico y 2-cetoglucónico (Khan et al., 2009; Fender et al., 2012).
Un mecanismo indirecto para la solubilización ocurre cuando los microorganismos asimilan directamente los fosfatos insolubles acumulándolos en sus células y liberándolos posteriormente (Khan et al., 2009). El mecanismo de solubilización en los suelos se favorece cuando éstos presentan pH ácidos , con bajo contenido de calcio y alto contenido de materia orgánica. La cantidad y tipo de ácidos orgánicos depende de los microorganismos presentes y de las condiciones del suelo. Los ácidos orgánicos permiten que haya solubilización debido a que la presencia de estos implica un descenso en el pH hasta valores aproximados a 2, valores necesarios para la solubilización. La producción de ácidos orgánicos a partir de la fermentación de glucosa da como resultado la acidificación de la célula y de sus alrededores (Hyland et al., 2005).
Algunas cepas de Bacillus como amyloliquefaciens y liqueniformis solubilizan el fosfato inorgánico por medio de la producción de dióxido de carbono, ácidos orgánicos, excreción de protones y acumulación de amonio (Ohtake et al., 1996).
Las bacterias solubilizadoras de fosfatos inorgánicos desempeñan un importante papel en el suplemento de fósforo para las plantas. Este hecho despierta la atención para la utilización de esos microorganismos como inoculante comercial, o el manejo de sus poblaciones como forma de promover una mejor utilización del fósforo existente en el suelo o el adicionado como fertilizante (Silva Filho y Vidor, 2001).
Las bacterias rizosféricas participan en los ciclos geoquímicos de nutrientes y determinan su disponibilidad para las plantas y la comunidad microbiana del suelo (Osorio-Vega, 2007). Se acepta que las reacciones de solubilización ocurren mayormente en la rizósfera presente en horizontes superficiales del suelo donde hay mayor concentración de oxígeno y los compuestos carbonados son liberados en gran cantidad. Sin embargo, en un estudio realizado en Colombia, se encontró una alta densidad de microorganismos solubilizadores de fosfatos en la rizósfera de diferentes coberturas y a distintas profundidades, indicando que aunque la mayor actividad se da en los horizontes superficiales ésta no se restringe a ellos (Daza et al., 2006).
Los microorganismos solubilizadores de fosfatos han sido estudiados en España, Brasil, Egipto, Estados Unidos de América, Canadá y otros países, en cultivos tanto de poáceas como de fabáceas y se han mostrado resultados favorables en relación a la producción (De Freitas et al., 1997; Wahid et al., 2000; Rivas et al., 2006; Souchie et al., 2007; Kannan y Wei, 2007; Taurian et al., 2010.
Sylvester-Bradley et al. (1982), al hacer un relevamiento cuantitativo de bacterias solubilizadoras de fosfatos en la rizósfera de especies forrajeras, determinaron que los mayores números de estas bacterias ocurrieron en las poáceas y los menores números en las fabáceas. Dentro del grupo de bacterias que solubilizan fosfatos se mencionan, entre otros, los géneros Alcaligenes, Arthrobacter, Enterobacter, Erwinia, Klebsiella, Serratia, Azotobacter, Azospirillum, Clostridium, Pseudomonas, Bacillus, Streptomyces, Acinetobacter, Burkholderia y Exiguobacterium (Kloepper et al., 1989; Bashan y Levanony, 1990; Okon y Lavandera, 1994; Maier et al., 2004; Collavino et. al., 2010).
En Argentina, en estudios realizados en la Facultad de Ciencias Exactas y Naturales de la Universidad Nacional de La Pampa sobre rizósfera de alfalfa, se obtuvieron nueve aislamientos de bacterias solubilizadoras de fósforo que fueron caracterizados fenotípica y metabólicamente, comprobándose también su efecto promotor de crecimiento (Grassano et al., 2003). Por otro lado, Mohammed et al. (1998), informaron que en la Pampa Húmeda la inoculación de trigo con Pseudomonas spp. produjo incrementos de rendimientos de grano y que estos fueron similares a los producidos por la aplicación de fósforo. En el caso de Pseudomonas aurantiaca SR1, cepa aislada de la rizósfera de soja en Rio Cuarto, Córdoba, se observó que tiene propiedades promotoras de crecimiento y la capacidad de inhibir el crecimiento de diversos hongos, tales como Macrophomina phaseolina, Rhizoctonia spp., Fusarium spp., Alternaria spp., Pythium spp., Sclerotinia minor y Sclerotium rolfsii (Rosas et al., 2001). En el NOA, se registró la presencia de microorganismos solubilizadores de fosfato en diferentes cultivos y suelos (Ulla et al., 2006). Collavino et al. (2010) inocularon en poroto común (Phaseolus vulgaris), bacterias que mostraban alta actividad solubilizadora de fosfatos in vitro y solo algunas produjeron promoción de crecimiento.
En la provincia de Tucumán, en investigaciones realizadas en caña de azúcar, se encontró que dos cepas de bacterias solubilizadoras de fosfatos produjeron incrementos en peso seco, ramificaciones, volumen y longitud del sistema radicular de plantas inoculadas con ellas (González-Bournonville, 2008). A su vez, en ensayos realizados en arroz inoculado con un producto comercial de microorganismos solubilizadores de fosfatos, se determinó un aumento en los parámetros de rendimiento (Mazza et al., 2009). Brito y Ulla (2012), aislaron microorganismos solubilizadores de fosfatos en rizósfera de soja en dos regiones agroecológicas de la provincia. Los aislamientos se caracterizaron como Pseudomonas fluorescens, Pseudomona aeruginosa, Klebsiella spp. y Serratia spp.
Sobre la base de los antecedentes enunciados se sugiere que las bacterias solubilizadoras de fosfatos presentan una morfología diversa y son importantes para aumentar la disponibilidad de este nutriente en el suelo y mejorar el desarrollo de las plantas.
El objetivo general de este trabajo fue estudiar la actividad de bacterias solubilizadoras de fosfatos aisladas de tres localidades del NOA. Como objetivos específicos se plantearon: aislar las bacterias solubilizadoras de fosfatos encontradas en mayor proporción, evaluar el potencial solubilizador de fosfatos de los aislamientos, caracterizar los aislamientos por pruebas bioquímicas y de biología molecular; evaluar su capacidad para estimular el crecimiento en maíz (Zea mays L.) en condiciones controladas.
Materiales y métodos
Se tomaron muestras compuestas de la rizósfera de pasturas en la localidad de Cachi Yaco (Ca), provincia de Tucumán y de maní y pimiento de dos localidades en la provincia de Catamarca, una ubicada en el complejo Nueva Coneta (NC) y la otra en Asociación Colonia del Valle (CV). Una parte se derivó al Laboratorio de Suelos de la Facultad de Agronomía y Zootecnia (FAZ) para los análisis físico-químicos, donde se realizaron determinaciones de pH (agua 1:2.5), conductividad eléctrica (ds/m), carbono orgánico (%), materia orgánica (%), nitrógeno total (%) y fósforo asimilable (mgL-1, Bray I). Una segunda parte, se usó para el aislamiento y recuento de los microorganismos solubilizadores de fosfatos, por la técnica de dilución en placa en medio de cultivo NBRIP (Nautiyal, 1999). Las bacterias se purificaron en medio de cultivo TSA y se identificaron a través de características microscópicas y propiedades bioquímicas, según el Bergey's Manual of Determinative Bacteriology (Holt et al., 1994). Se realizaron observaciones al estado fresco en microscopio óptico (40X y 100X) de cultivos de 24 horas de crecimiento a 28ºC y tinciones de pared celular y esporas. Se realizaron pruebas de hidrólisis del almidón, Voges-Proskauer, citrato, catalasa, citocromo oxidasa, hidrólisis de gelatina, rojo de metilo, crecimiento en elevadas concentraciones de sales, producción de pigmentos fluorescentes difusibles, producción de pigmentos ocre, fermentación de lactosa, producción de indol, de ácido sulfhídrico y presencia de ureasa (Harrigan y McCance, 1968; Alvarado et al., 2008).
Se determinó la eficiencia de solubilización de fosfatos (ES) como la relación entre el diámetro total (colonia + halo) / diámetro de la colonia (Edi-Premono et al., 1996).
Se realizó la amplificación y secuenciación del gen 16S ADNr, de los aislamientos que presentaron mayor ES, de acuerdo a lo descripto por Grifoni et al. (1995). La secuenciación se realizó mediante el método de didesoxi (Sanger et al., 1977). El análisis de las secuencias se realizó por comparación con secuencias de nucleótidos disponibles en el GenBank, utilizando el programa BLASTN 02.02.25, proporcionado por el servidor del NCBI (Zheng et al., 2000). Estos aislamientos se utilizaron para evaluar la promoción del crecimiento vegetal en condiciones controladas. Macetas con 100 gramos de suelo y vermiculita estériles se regaron con 10 mL de las suspensiones bacterianas (DO590 0,6), se sembraron semillas de maíz (Zea mays L.) previamente desinfectadas con H2O2 de 10 volúmenes y lavadas seis veces con agua destilada estéril. Las macetas se mantuvieron en invernadero durante 30 días, se regaron y se cambiaron al azar las posiciones periódicamente. Se determinaron las siguientes variables: longitud y peso seco en tallo y raíz. Los datos se analizaron con Infostat (Di Rienzo et al., 2013) y Statistix 8 (versión de prueba gratuita). Se utilizaron análisis de varianza y prueba LSD de Fisher con corrección de significación por comparaciones múltiples para detectar diferencias entre medias de tratamiento. Los supuestos en los que se basan las metodologías mencionadas fueron verificados.
Resultados y discusión
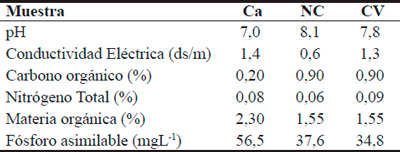
Los resultados de los análisis físico-químicos del suelo se muestran en la Tabla 1. En la misma se observa que el suelo de Nueva Coneta tiene un pH superior al de los otros dos y esa podría ser la causa del menor contenido de P asimilable con respecto al de Cachi Yaco.
Tabla 1. Análisis físico-químico de los suelos de Cachi yaco (Ca), Nueva Coneta (NC) y Colonia del Valle (CV).
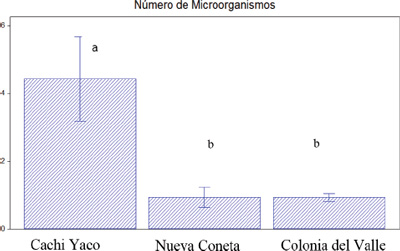
Los resultados del recuento y aislamientos de microorganismos solubilizadores de fosfatos se muestran en las Figuras 1 y 2. Analizando la cantidad de microorganismos con las propiedades del suelo, se infiere que el mayor número de microorganismos solubilizadores de fosfatos de Cachi Yaco podría ser el responsable de la mayor disponibilidad de P asimilable en ese suelo con respecto a los otros dos. La variabilidad en el número de microorganismos solubilizadores de fosfatos descripta previamente, puede responder a múltiples causas. Sylvester-Bradley et al. (1982) señalaron, al hacer un relevamiento cuantitativo en forrajes, que el número puede variar de acuerdo a los diferentes tipos de suelos. A la vez Lynch y Whipps, (1990) y Souchie et al. (2007) establecieron que la diferencia en el número de solubilizadores está influenciada por el clima y por el estado nutricional del suelo.
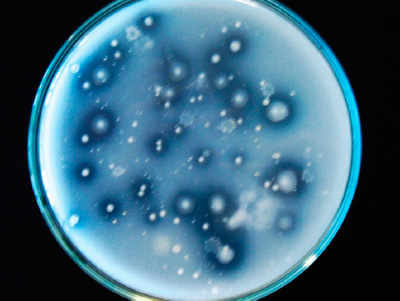
Figura 1. Microorganismos solubilizadores de fosfato de una suspensión de suelo en medio de cultivo NBRIP. Zonas claras alrededor de las colonias indican solubilización de fosfatos.
Figura 2. Número de microorganismos solubilizadores de fosfatos (media ± error estándar). Letras distintas indican diferencias significativas (p<0,05).
Los resultados de las observaciones microscópicas por contraste de fases, la caracterización de la pared celular, presencia de esporas y pruebas bioquímicas de los distintos aislamientos se observan en las Tablas 2, 3 y 4. De acuerdo a los resultados obtenidos, los aislamientos NC1, NC2 y NC4 de la localidad de Nueva Coneta provincia de Catamarca, que presentaron formas bacilares rectas o ligeramente curvadas, respuesta positiva a la tinción de Gram y activa motilidad, formadores de esporas y de crecimiento aeróbicos, pertenecen al género Bacillus. NC4 que hidroliza almidón, es Voges-Proskauer positiva y utiliza citrato como única fuente de carbono, se caracterizó como Bacillus spp. NC2 es amilasa, Voges-Proskauer y citrato positiva y crece a elevadas concentraciones de cloruro de sodio, lo que permitió ubicarla como Bacillus subtilis. NC1 es amilasa y citrato positiva pero Voges-Proskauer negativa, por lo que se estaría ante la presencia de Bacillus megaterium.
Tabla 2. Movilidad, morfología y pared celular de los aislamientos en estudio.
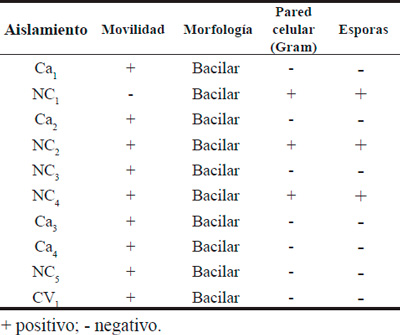
Tabla 3. Pruebas bioquímicas de los aislamientos en estudio.
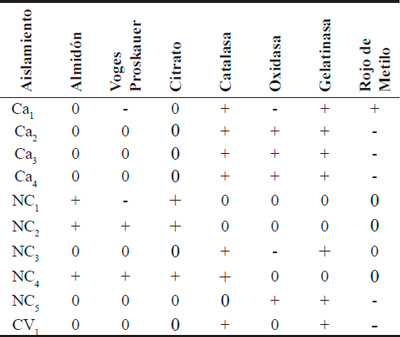
+ positivo, - negativo, 0 no determinado.
Tabla 4. Pruebas bioquímicas de los aislamientos en estudio.
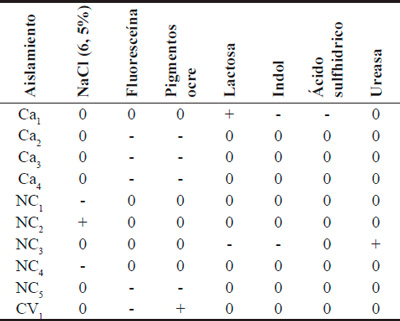
+ positivo, - negativo, 0 no determinado.
En el caso de los aislamientos Ca2, Ca3, Ca4, NC5 y CV1 de las localidades de Cachi Yaco, provincia de Tucumán, y Nueva Coneta y Colonia del Valle de la provincia de Catamarca respectivamente, presentaron formas bacilares rectas o ligeramente curvadas, respuesta negativa a la tinción de Gram y activa motilidad; pruebas de oxidasa, catalasa e hidrolisis de gelatina positivas y fermentación de glucosa (RM-) y producción de fluoresceína y pigmentos ocre negativa se clasificaría como Pseudomonas spp. CV1 que además, produce pigmento ocre en la colonia, se clasificaría como Pseudomonas aurantiaca. Rosas et al., (2001) aislaron una bacteria de la rizósfera de soja en Río Cuarto, Córdoba y fue clasificada como Pseudomonas aurantiaca SR1 y en trabajos posteriores fue reclasificada como Pseudomonas chlororaphis subsp. Aurantiaca (Peix et al., 2007). La presencia de Pseudomonas spp demostrada en los suelos analizados en este trabajo, concuerda con los informes de Grassano et al., (2003), Rivas et al., (2006), Trujillo et al., (2007), y Brito y Ulla (2012), quienes informaron haber realizado diferentes aislamientos en rizósfera de soja, alfalfa y otros cultivos, determinando en todos los casos la presencia de Pseudomonas spp.
Los aislamientos Ca1 y NC3, de Cachi Yaco y Nueva Coneta respectivamente, presentaron formas bacilares rectas o ligeramente curvadas, respuesta negativa a la tinción de Gram y activa motilidad. Dentro de las pruebas bioquímicas realizadas fueron oxidasa negativas y la prueba de fermentación de lactosa permitió dividirlas en dos subgrupos lac (+) y lac (-). La cepa Ca1 (lac+), no produce indoles ni ácido sulfhídrico, es Rojo de Metilo positiva y Voges-Proskauer negativa, por lo que pertenecería al género Serratia y especie fonticola. La cepa NC3 (lac-), no produce indoles y es ureasa positiva lo que permitiría clasificarla como Proteus spp, ambas de la familia de las Enterobacterias. La presencia de Enterobacterias solubilizadoras de fosfatos fue demostrada en Madrid, España por Fernández et al. (2008) y Cordero-Elvia et al. (2008). Burdman et al. (1998) determinaron que Serratia habita en el suelo de la región rizosférica. En investigaciones realizadas por Illmer y Schinner (1992) se demostró que Serratia al igual que otras bacterias son microorganismos que pueden solubilizar fósforo inorgánico en cantidades superiores a sus demandas.
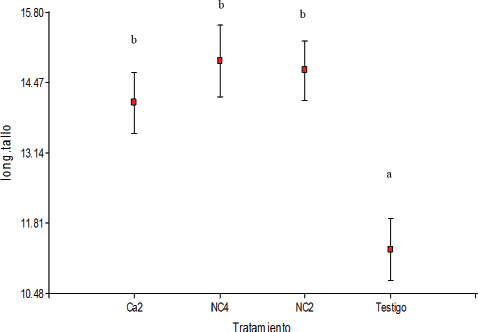
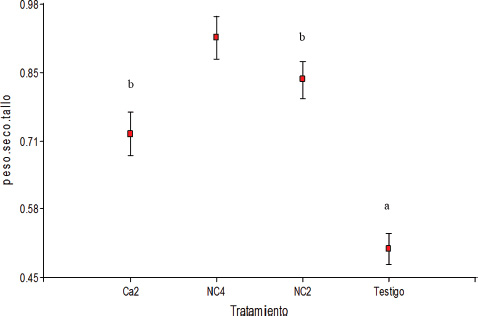
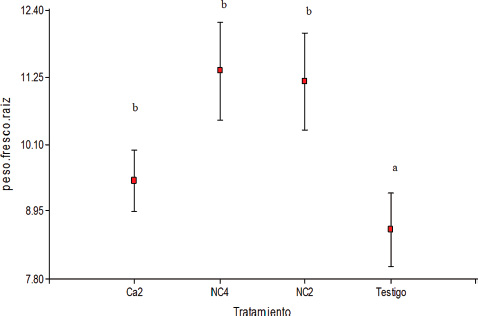
En el análisis de la secuencia nucleotídica del gen 16S de ADNr de los aislamientos que presentaron mayor eficiencia de solubilización, prosperaron solo NC2 (ES: 28%) y NC4 (ES: 37%) que fueron identificados como Bacillus subtilis (91 % de similitud) y Bacillus amyloliquefaciens (89 % de similitud) respectivamente y fueron utilizados en el ensayo de promoción de crecimiento en maíz junto al aislamiento Ca2 (ES: 60%). Los resultados mostraron que las plantas de maíz inoculadas presentaron longitud y peso seco de tallos y peso de raíz, significativamente superiores a las no inoculadas (Figuras 3, 4 y 5). Resultados que concuerdan con los obtenidos por varios investigadores que utilizaron B. amyloliquefaciens y B. subtilis para inocularen mangle negro (Nedwell, 1994), en diferentes cultivos (Tilak y Srinivasa, 2006), en maíz (Idriss et al., 2002), en diferentes cultivos (Arguelles-Arias et al., 2009), en diferentes variedades de maíz (Fan et al., 2011) y en soja (PrathuanWong et al., 2012).
Figura 3. Longitud del tallo (cm) de plantas de maíz inoculadas con Pseudomonas sp. (Ca2), B. amyloliquefaciens (NC4), B. subtilis (NC2) y testigo (media ± error estándar). Letras distintas indican diferencias significativas (p<0,05).
Figura 4. Peso seco del tallo (g) de plantas de maíz inoculadas con Pseudomonas sp. (Ca2), B. amyloliquefaciens (NC4), B. subtilis (NC2) y testigo (media ± error estándar). Letras distintas indican diferencias significativas (p<0,05).
Figura 5. Peso fresco (g) de raíz de plantas de maíz inoculadas con Pseudomonas sp. (Ca2), B. amyloliquefaciens (NC4), B. subtilis (NC2) y testigo (media ± error estándar). Letras distintas indican diferencias significativas (p<0,05).
Con respecto a la variable longitud de la raíz (Figura 6), los tres tratamientos inoculados mostraron diferencias sobre el testigo sin inocular, en coincidencia con estudios realizados por Sailaya et al., (1998) en plantas de Mostaza indica y en Cacahuate, González-Bournonville (2008) en caña de azúcar; y Tilak y Srinivasa (2006) en diferentes cultivos, Zaidi et al., (2006) en plantas de mostaza y cacahuate y Erturk et al., (2010) en plantas de kiwi obtuvieron índices más altos de enraizamiento y longitud de la raíz que los tratamientos sin inocular.
Figura 6. Longitud de raíces (cm) de plantas de maíz inoculadas con Pseudomonas sp. (2), B. amyloliquefaciens (3), B. subtilis (4) y testigo (1) (media ± error estándar). Letras distintas indican diferencias significativas (p<0,05).
La promoción sobre el crecimiento vegetal demostrada a través de los distintos parámetros analizados en este trabajo se corresponde con los resultados obtenidos por Lazada-Cuervo (2010) y Arias y Torres (2010), en donde B. subtilis y otras bacterias fueron probadas por su capacidad de solubilizar fosfato y se comprobó que su inoculación producía un aumento en el crecimiento y el contenido de fósforo en los tejidos de las plantas, al igual que Mena-Violente y Olalde-Portugal (2007) quienes inocularon raíces de tomate con B. subtilis y obtuvieron un mejoramiento en tamaño y textura de frutos. En Bolivia, Ortiño et al. (2003) formularon un fertilizante con B. subtilis que fue probado con resultados satisfactorios por productores de quinua.
En este trabajo se observó que con el aislamiento Ca2, Pseudomonas spp., se obtuvieron mayor longitud, peso fresco y seco de tallo y raíz que en el tratamiento control sin inocular, resultados que concuerdan con los de Santillana-Villanueva (2006) en frijol y maíz, mostrando aumentos de rendimiento en grano que fueron similares a los producidos por la aplicación de fósforo, en ambos casos se mostró un efecto promotor del crecimiento vegetal producido por esta bacteria.
Conclusiones
Se aislaron 10 bacterias y de acuerdo a la identificación fenotípica y pruebas bioquímicas corresponden a Pseudomonas spp, Pseudomonas aurantiaca, Bacillus subtilis, Bacillus spp, Bacillus megaterium, Serratia fonticola, Proteus spp.
Mediante el secuenciamiento del gen 16S ADNr se confirmó la identidad de Bacillus subtilis y de Bacillus spp. como Bacillus amiloliquefaciens.
Las inoculaciones con B. amiloliquefaciens produjeron plantas con la mayor longitud y peso seco en tallo y, mayor peso fresco y seco en raíz; las inoculaciones con B. subtilis produjeron plantas con la mayor longitud de raíz.
Las inoculaciones con Pseudomonas spp, produjeron plantas con mayor peso seco y longitud de tallo y raíz con respecto al testigo sin inocular.
Agradecimientos
Se agradece la colaboración desinteresada del M. Sc. Ing. Agr. Osvaldo Arce en los análisis estadísticos.
Referencias bibliográficas
1. Alvarado Y., Luzmila Y., Flores F. (2008). Evaluación de la colonización diferencial de fluoresceína modificada en Pseudomonas spp. aisladas de suelo. Kasmera 36: 295-301. [ Links ]
2. Arguelles-Arias A., Ongera M., Hallini B., Lara Y., Brans A., Joris B., Fickers P. (2009). Bacillus amyloliquefaciens GA1 as a source of potent antibiotics and other secondary metabolites for biocontrol of plant pathogens. Microbial Cell Factories 8: 1475-2859. [ Links ]
3. Arias C., Torres P. (2010). Solubilización de fosfatos por poblaciones bacterianas aisladas de un suelo del valle del Cauca. Estudio de biodiversidad y eficiencia. Facultad de Ciencias Agropecuarias. Coordinación General de Posgrado. Palmira, Colombia. [ Links ]
4. Bashan Y., Levanony H. (1990). Current status of Azospirillum as a challenge of agriculture. Canadian Journal of Microbiology 36: 591-608. [ Links ]
5. Brito J. E., Ulla E.L. (2012). Microorganismos solubilizadores de fosfato en dos regiones agroecológicas de la provincia de Tucumán. Revista Agronómica del Noroeste Argentino 32(1-2): 31-40. [ Links ]
6. Burdman S., Jurkevitch B., Orkon Y. (1998). Recent advanced in the use of plant growth promoting rhizobacteria (PGPR) in agriculture. En: Microbial interactions in agriculture and forestry. Subba Rao N., Dommergues Y. (Eds.). Science Publishers, Inc, 2: 229-250. [ Links ]
7. Chen Y., Rekha P., Arun A., Shen F., Lai W., Young C. (2006). Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Applied Soil Ecology 34: 33-41. [ Links ]
8. Collavino M.M., Sansberro P.A., Mroginsky L.A., Aguilar O.M. (2010). Comparison of in vitro solubilization activity of diverse phosphate-solubilizing bacteria native to acid soil and their ability to promote Phaseolus vulgarias growth. Biology and Fertility of Soils 46: 727-738. [ Links ]
9. Cordero-Elvia J., Ortega-Rodes P., Ortega E. (2008). La inoculación de plantas con Pantotea spp. Bacterias solubilizadoras de fosfatos, produce incremento en la concentración de fósforo en los tejidos foliares. Revista Colombiana de Biotecnología 10: 111-121. [ Links ]
10. Daza P.C., Pelaez J.A., Osorio N.W., León J.D. (2006). Aislamiento y evaluación de microorganismos solubilizadores de fosfatos de bosques alto andinos en Colombia. Suelos Ecuatoriales 35(2): 45-52. [ Links ]
11. De Freitas J., Banerjee M., Germida J. (1997). Phosphate solubilizing rhizobacteria enhance the growth and yield but not phosphorus uptake of canola (Brasica napus L.). Biological Fertilizer Soils 24: 358- 363. [ Links ]
12. Di Rienzo J.A., Casanoves F., Balzarini M.G., Gonzalez L., Tablada M., Robledo C.W. (2013). InfoStat versión 2013. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
13. Díaz P., Ferreira R., Almaraz G. (2001). Inoculation of plant growth-promoting bacteria in lettuce. Terra 19: 327-335. [ Links ]
14. Edi-Premono M., Moawad A.M., Vlek, P.L.G. (1996). Effect of phosphate-solubilizing Pseudomonas putida on the growth of maize and its survival in the rhizosphere. Indonesian Journal Crop Science 11: 13-23. [ Links ]
15. Erturk Y., Ercisli S., Haznedar A., Cakmakci R. (2010). Effects of plant growth promoting rhizobacteria (PGPR) on rooting and root growth of kiwifruit (Actinidia deliciosa) stem cuttings. Biological Research 43:91-98. [ Links ]
16. Fan B., Chen H.X., Budiharjo A., Bleiss W., Vater J., Borriss R. (2011). Efficient colonization of plant growth promoting bacterium Bacillus amiloliquefaciens FZB42, engineered to express green fluorescent protein. Journal of Biotechnology 151:303-311. [ Links ]
17. Fankem H., Nwaga D., Deubel A., Dieng L., Merbach W., Etoa F.X. (2006). Occurrence and Functioning of phosphate solubilizing microorganisms from oil palm tree (Elaeis guineensis) rhizosphere in Cameroon. African Journal of Biotechnology 5: 2450-2460. [ Links ]
18. Fender J.E., Bender C.M., Stella N.A., Lahr R.M. Kalivoda E.J. Shanks R.M.Q. (2012). Serratia marcescens quinoprotein glucose dehydrogenase activity mediates medium acidification and inhibition of prodigiosin production by glucose. Applied Environmental Microbiology 78: 6225-6235. [ Links ]
19. Fernández A.L., Villaverde M., Nicolás J.A., García-Gómez A. (2008). Pantoea dispersa Rhizobacteria promotora del crecimiento (PGPR). VIII Congreso SEAE Bullas. 16-20 de septiembre de 2008. Murcia, España. [ Links ]
20. González-Bournonville E. (2008). Selección de bacterias solubilizadoras de fósforo y azufre para incrementar el sistema radicular de la caña de azúcar. Segundas Jornadas de Jóvenes Investigadores. UNT- AUGM. 23-25 de junio de 2008. San Miguel de Tucumán. Argentina. [ Links ]
21. Grassano A., Ronchi A.L., García P., López M.L. (2003). Acción de bacterias solubilizadoras de fósforo sobre la simbiosis rizobio-leguminosa. IV Reunión Nacional Científico Técnica de Biología de Suelos y IV Encuentro sobre Fijación Biológica de Nitrógeno. 2-4 de julio de 2003. Termas de Río Hondo, Santiago del Estero, Argentina. [ Links ]
22. Grifoni A., Bazzicalupo M., Di Serio C., Fancelli S., Fani R. (1995). Identification of Azospirillum strains by restriction fragment length polymorphism of the 16S rDNA and of the histidine operon. FEMS Microbiology Letters 127: 85-91. [ Links ]
23. Harrigan W.F., McCance M. (1968). Métodos de laboratorio en Microbiología. Editorial Academia, León, p. 426. [ Links ]
24. Holt J.G., Krieg N.R., Sneath, P.H.A. (1994). Bergey`s Manual of determinative Bacteriology 9th ed. Williams e Wikins. Baltimore, USA: 175-222. [ Links ]
25. Hyland C., Kettering Q., Dewing D., Stoking R., Czymmek K., Albrecht G, Gehrig L. (2005). Im pact of phosphate-solubilizing fungi on the yield and phosphorus-uptake by wheat and faba bean plants. Microbiological Research 155(3): 221-227. [ Links ]
26. Idriss E.E.S. Makarewicz O. Farouk A., Rosner K., Greiner R., Bochow H., Richter T., Borriss R. (2002). Extracellular phytaseactivity of Bacillus amyloliquefaciens FZB 45 contributes to its plant- growth-promoting effect. Microbiology 148: 2097-2109. [ Links ]
27. Illmer P., Schinner F. (1992). Solubilization of inorganic phosphate by microorganisms isolated from forest soil. Soil Biology and Biochemistry 70: 222-234. [ Links ]
28. Kannan I., Wei S. (2007). Soil microbial community composition and structure residual effects of contrasting N fertilization of swine lagoon effluent versus ammonium nitrate. Plant and Soil 292: 233-242. [ Links ]
29. Khan A.A., Jilani G., Akhtar S.M., Naqvi-Saqlan M., Rasheed, M. (2009). Phosphorus solubilizing bacteria, Mechanisms and their role in crop production. Journal of Agricultural and Biological Science 48-58. [ Links ]
30. Kloepper J.W., Lifshitz R., Zablotowicz R.M. (1989). Free-living bacterial inoculate for enhancing crop productivity. Trends in Biotechnology 7: 39-49. [ Links ]
31. Lazada-Cuervo J.P. (2010). Aislamiento y caracterización de Bacillus subtilis como fijadores de nitrógeno y solubilizadores de fosfatos en dos muestras de biofertilizantes comerciales. Trabajo de grado para optar al título de Microbiólogo Agrícola y Veterinario. Pontificia Universidad Javeriana, Facultad de Ciencias Básicas. Bogotá, Colombia. [ Links ]
32. Lynch J.M., Whipps J.M. (1990). Substrate flow in the rhizosphere. Plant and Soil 129: 1-10. [ Links ]
33. Maier A., Riedlinger J., Fiedler H., Hampp R. (2004). Actinomycetales bacteria from a spruce stand: characterization and effects on growth of root symbiotic and plant parasitic soil fungi dual culture. Mycological Progress 3: 129-136. [ Links ]
34. Mazza J.P., Loréfice A., Ulla E.L. (2009). Comportamiento del arroz (Oriza sativa L.) inoculado con microorganismos solubilizadores de fosfatos en Tucumán. VII Reunión Nacional Científico Técnica de Biología del Suelo y Fijación Biológica del Nitrógeno. 1-3 de julio de 2009. San Miguel de Tucumán, Argentina. [ Links ]
35. Mena-Violente H.G., Olalde-Portugal V. (2007). Alteration of tomato fruit quality by root inoculation with plant growth-promoting rhizobacteria (PGPR): Bacillus subtilis BEB-13bs. Scientia Horticulturae 113: 103-106. [ Links ]
36. Mohammed M.J., Pan W.L., Kennedy A.C. (1998). Seasonal mycorrhizal colonization of winter wheat and its effect on wheat growth under drylan conditions. Mycorrhiza 8 (3): 139-144. [ Links ]
37. Nautiyal S.C. (1999). An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiology Letters 170: 265-270. [ Links ]
38. Nedwell D.B., Blackburn F.H. (1994). Wiebe dynamic nature of the turnover of organic carbon, nitrogen and sulphur in the sediments of a Jamaican mangrove forest. Marine Ecology Progress Series 110: 223-231. [ Links ]
39. Nogales B. (2005). La microbiología del suelo en la era de la biología molecular: descubriendo la punta del iceberg. Ecosistemas 2: 1-10. [ Links ]
40. Ohtake H., Wu H., Imazu K., Anbe Y., Kato J., Kuroda A. (1996). Bacterial phosphonate degradation, phosphite oxidation and polyphosphate accumulation. Resources, Conservation and Recycling 18: 125- 134. [ Links ]
41. Okon Y., Lavandera C. (1994). Agronomic Applications of Azospirillum: An evaluation of 20 years worldwide field inoculation. Soil Biology & Biochemistry 26: 1591-1601. [ Links ]
42. Ortiño N., Claros M., Angulo V., Navia O. Meneses E. (2003). Biofertilizantes artesanales con microorganismos rizosféricos nativos para la producción orgánica de quinua en Bolivia. Informe Fundación Promoción e Investigación de Productos Andinos (PROINPA). Cochabamba, Bolivia. [ Links ]
43. Osorio-Vega N.W. (2007). Efectos benéficos de bacterias rizosféricas en la disponibilidad de nutrientes en el suelo y la absorción de nutrientes por las plantas. Facultad Nacional de Agronomía. Medellín, Colombia. 60 (1): 3621-3643. [ Links ]
44. Peix A., Valverde A., Rivas R., Igual J.M., Ramírez-Bahena M.H., Mateos P.F., Santa-Regina I., Rodríguez-Barrueco C., Martínez-Molina E., Velázquez E. (2007). Reclassification of Pseudomonas aurantiaca as a synonym of Pseudomonas chlororaphis and proposal of three subspecies, P. chlororaphis subsp. chlororaphis subsp. nov., P. chlororaphis subsp. aureofaciens subsp. nov., comb. nov. And P. chlororaphis subsp. aurantiaca subsp. nov., comb. nov. International Journal of Systematic and Evolutionary Microbiology 57: 1286-1290. [ Links ]
45. Prathuanwong S., Buensanteai N. (2012). Bacillus amyloliquefaciens induced systemic resistance against bacterial pustule pathogen with increased phenols, phenylalanine ammoniolyase, peroxidases and 1 3 -β- glucanases in soybean plants. Acta Phytopathologica et Entomologica Hungarica. 42 (2): 321-330 [ Links ]
46. Rivas R., Peix A., Mateos P.F., Trujillo E.M., Martínez- Molina E., Velázquez E. (2006). Biodiversity of populations of phosphate solubilizing rhizobia that nodules chickpea in different Spanish soil. Plant and Soil 287: 23-33. [ Links ]
47. Rosas S.B, Altamirano F., Shroder E., Correa N. (2001). In vitro biocontrol activity of Pseudomona aurantiaca. Phyton-International Journal of Experimental Botany 67: 203-209. [ Links ]
48. Sailaya P.R., Podile A.R., Reddanna P. (1998). Strain biocontrol of Bacillus subtilis AF1 that rapidly induces Lipoxygenase peanut (Arachis lipoxigenasa) in comparison with the pathogenic Crown rot Aspergillus Niger. European Journal Plant Pathology 104(2):125-132. [ Links ]
49. Salazar J. (2005). El fósforo en los Sistemas Ganaderos de leche. Agronomía Mesoamericana 16:231-238. [ Links ]
50. Sanger F., Nicklen S., Coulson A.R. (1977). DNA sequencing with chain-terminating inhibitors. Proceeding of the National Academy of Sciences of the United States of America 74: 5463-5467. [ Links ]
51. Santillana-Villanueva N. (2006). Producción de biofertilizantes utilizando Pseudomonas spp. Ecología Aplicada 5: 1:2. [ Links ]
52. Silva-Filho G.N., Vidor C. (2001). Actividad de microorganismos solubilizadores de fosfato na presenca de nitrógeno, ferro, calcio e potasio. Pesquisa Agropecuaria Brasileira 36 (12): 1495-1508. [ Links ]
53. Souchie E.L., De Souza-Abboud A.C., Caproni A. (2007). Solubilizaçao de fosfato in vitro por microorganismos rizosféricos de guando. Bioscience Journal 23(2): 53-60. [ Links ]
54. Sylvester-Bradley R., Asakawa N., Torraca S.L.A., Magalhaes F.M.M., Oliveira L.A., Pereira R.M. (1982). Levantamento quantitativo de microorganismos solubilizadores de fosfatos na rizosfera de gramineas e leguminosas forrageiras na Amazonia. Acta Amazónica 12 (1): 15-22. [ Links ]
55. Taurian T., Anzuay M.S., Angelini J.G, Tonelli M.L., Ludueña L., Pena D., Ibáñez F., Fabra A. (2010). Phosphate-solubilizing peanut associated bacteria: screening for plant growth-promoting activities. Plant and Soil 329: 321-431. [ Links ]
56. Tilak K., Srinivasa B. (2006). Bacillus cereus and B. circulans novel inoculants for crops. Current Science 90: 642-644. [ Links ]
57. Trujillo M.E., Velázquez E., Mígueles S. Jiménez S., Mateos P.F., Martínez-Molina E. (2007). Characterization of a strain of Pseudomonas fluorescens that solubilizes phosphates in vitro and produced high antibiotic activity against several microorganisms. Plant and Soil 102: 265-268. [ Links ]
58. Ulla E.L., Ulla E.E., Sánchez H.H., Delgado J.A., Cortez J.D. (2006). Microorganismos solubilizadores de fosfato en la rizósfera de orégano en la provincia de Catamarca. III Simposio Latinoamericano en Producción de Plantas Aromáticas Medicinales y Condimentarías. 20-23 de setiembre de 2006. San Fernando del Valle de Catamarca. Argentina. [ Links ]
59. Wahid O. A. Mehana T.A. (2000). Impact of phosphate-solubilizing fungi on the yield and phosphorus-up- take by wheat and five bean plants. Microbiological Research 155(3): 221-7. [ Links ]
60. Zaidi S., Usmani S., Singh R.B., Musarrat J. (2006). Significance of Bacillus subtilis strain SJ-101 as a bioinoculant for concurrent plant growth promotion and nickel accumulation in Brassica juncea. Chemosphere 64: 991-997. [ Links ]
61. Zheng, Z.; Schwartz, S.; Wagner, L.; Miller, W. 2000. A greedy algorithm for aligning DNA sequences. Journal of Computational Biology 7: 203-14. [ Links ]