Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista agronómica del noroeste argentino
versão impressa ISSN 0080-2069versão On-line ISSN 2314-369X
Rev. agron. noroeste arg. vol.35 no.1 San Miguel de Tucumán jun. 2015
ARTÍCULO CIENTÍFICO
Datos de nivel básico de cuatro insecticidas con diferentes mecanismos de acción para Anastrepha fraterculus y Ceratitis capitata (Diptera: Tephritidae)
Baseline data of four insecticides with different modes of action for Anastrepha fraterculus and Ceratitis capitata (Diptera: Tephritidae)
P.G. Páez Jerez1; B.N. Carrizo2; R. Musse1; E. Varela1; A. Armiñana1; F. Milla3; M.T. Vera1,4; M.H. de la Vega1
1Cátedra de Terapéutica Vegetal, Facultad de Agronomía y Zootecnia,
Universidad Nacional de Tucumán (FAZ-UNT), Argentina. E-mail: paulapaezjerez@hotmail.com
Avda. Kirchner 1900, (4000) San Miguel de Tucumán. Tucumán, Argentina.
2INTA EEA Famaillá, Tucumán, Argentina
Ruta Prov. 301 Km 32, (4132) Famaillá, Tucumán, Argentina.
3Laboratorio de Genética de Insectos de Importancia Económica, Instituto de Genética 'Ewald A. Favret',
CICVyA, Instituto Nacional de Tecnología Agropecuaria (INTA)
Nicolas Reppetto y Los Reseros, (1686) Hurlingham, Buenos Aires, Argentina.
4Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina.
Resumen
La mosca de la fruta del Mediterráneo, Ceratitis capitata (Wiedemann), y la mosca sudamericana de los frutos, Anastrepha fraterculus (Wiedemann) son plagas de gran importancia económica en Argentina y el mundo. Una de las formas de control es el uso de insecticidas en pulverizaciones totales o en cebos. El uso reiterado de un determinado producto ejerce una fuerte presión de selección, pudiendo ocasionar la aparición de resistencia. El objetivo de este trabajo fue determinar el dato de nivel básico de cuatro insecticidas con diferentes mecanismos de acción mediante bioensayos en laboratorio. Los productos utilizados fueron formulaciones comerciales de ciantraniliprol, clorpirifos, lambdacialotrina y spinosad. La concentración letal media se estimó mediante un análisis de la curva dosis-respuesta. Para ciantraniliprol y clorpirifós los machos y las hembras de ambas especies fueron igualmente susceptibles. Para lambdacialotrina se detectaron diferencias entre las dos especies; la CL50 de A. fraterculus (0,058 y 0,074 para machos y hembras respectivamente) fue menor que la de C. capitata (0,523 y 0,624 para machos y hembras respectivamente). Para spinosad, los machos de A. fraterculus fueron igualmente susceptibles que los machos y las hembras de C. capitata. Estos resultados generan valores de referencia para Argentina y evidencian la necesidad de completar este tipo de estudios con evaluaciones de poblaciones naturales sobre las cuales se ejerce control químico así como con ensayos en campo y semi-campo. Asimismo muestran la necesidad de completar este tipo de estudios con evaluaciones de los niveles de ingesta en las distintas concentraciones.
Palabras clave: Mosca de la fruta del Mediterráneo; Mosca sudamericana de la fruta; Línea base; Susceptibilidad; Ciantraniliprol; Clorpirifós; Lamdbacialotrina; Spinosad
Abstract
The Mediterranean fruit fly, Ceratitis capitata (Wiedemann), and the South American fruit fly, Anastrepha fraterculus (Wiedemann) are pests of major economic importance in Argentina and worldwide. One way to control them is the use of insecticide in sprays or baits. The repeated use of a particular product exerts a strong selection pressure and can lead to development of resistance. The aim of this study was to determine baseline data of four insecticides with different mechanisms of action through laboratory bioassays. The products used were commercial formulations of cyantraniliprole, chlorpyrifos, lambdacyalothrin and spinosad. The mean lethal concentration was estimated by a dose-response curve analysis. Cyantraniliprole and chlorpyrifos were equally susceptible for males and females of both species. For lambdacyalothrin differences between the two species were detected; LC50 of A. fraterculus (0.058 and 0.074 for males and females respectively) was lower than that of C. capitata (0.523 and 0.624 for males and females respectively). For spinosad, A. fraterculus males were equally susceptible than males and females of C. capitata. These results generate reference values for Argentina and demonstrate the need to complete these studies with field evaluations of natural populations on which chemical control is exercised as well as with field and semi-field trials. It also shows the need to complete these studies in which the intake at different concentrations is measured.
Keywords: Mediterranean fruit fly; South American fruit fly; Base line information; Susecptibility; Cyantraniliprole; Chlorpirifos; Lambdacyalothrin; Spinosad
Recibido 10/03/15; Aceptado 03/06/15.
Los autores declaran no tener conflicto de intereses.
Introducción
Dentro del orden Diptera, la familia Tephritidae es una de las más numerosas, contando con aproximadamente 5.000 especies descriptas las cuales se agrupan en seis subfamilias y alrededor de 500 géneros (Norrbom, 2010; Uchôa y Nicácio, 2010). Entre ellos, los géneros Anastrepha (Schiner), Rhagoletis (Loew), Toxotrypana (Gerstaecker), Bactrocera (Macquart) y Ceratitis (MacLeay) son los de mayor importancia económica (Aluja y Liedo, 1993; Aluja, 1994). Las larvas de muchas de estas especies se desarrollan en el interior de los frutos ocasionando pérdidas en la producción (White y Elson-Harris, 1994). Además del daño directo que producen es importante considerar el impacto ocasionado al limitar la exportación de frutas y verduras frescas a países libres de estas plagas (Malavasi et al., 1994); estos costos, derivados de las restricciones cuarentenarias incrementan aún más el impacto sobre las economías regionales.
En la Argentina se encuentran presentes dos especies de la moscas de los frutos de importancia cuarentenaria, la mosca de la fruta del Mediterráneo, Ceratitis capitata (Wiedemann) y la mosca sudamericana de la fruta, Anastrepha fraterculus (Wiedemann). Ceratitis capitata se distribuye en zonas con diversos climas; esto le permite colonizar casi todas las regiones templadas y cálidas del mundo y ataca un gran número de especies (Liquido et al., 1990; Liquido et al., 2013). Por su parte, A. fraterculus tiene una distribución restringida a zonas más cálidas (Malavasi et al., 2000) y si bien es una especie altamente polífaga, presenta un menor número de plantas hospederas (Norrbom y Kim, 1988; Norrbom, 2004). En Argentina ambas especies coexisten especialmente en el noroeste (NOA), noreste (NEA) y ciertas regiones de Cuyo (Aruani et al., 1996, Putruelle, 1996; Ovruski et al., 2003; Segura et al., 2006; Oroño et al., 2008). El daño ocasionado por ambas especies se estima entre 15 a 20% de la producción frutícola sin contar la pérdida de mercados (Guillén y Sánchez, 2007).
El control en ciertas áreas de nuestro país se realiza con la aplicación de insecticidas en pulverizaciones totales o mediante la dispersión de cebos insecticidas líquidos. De los grupos químicos registrados en el Servicio Nacional de Sanidad Agropecuaria (SENASA), existe una predominancia de derivados órgano fosforados como el mercaptotión, inhibidor de la acetilcolinestarasa. Los productos dentro de este grupo químico tienen la desventaja de presentar alta residualidad y ser nocivos para el ambiente (banda amarilla o roja). Asimismo, se utilizan cebos a base de spinosad (banda verde), un modulador alostérico de los receptores acetil colínicos nicotínicos (Salgado, 1998).
Uno de los problemas ocasionados por el uso de plaguicidas de síntesis es la aparición de biotipos resistentes. El uso reiterado de un determinado producto ejerce una fuerte presión de selección donde aquellos individuos que portan una mutación que los hace resistentes a altas dosis de producto, aumentan su frecuencia dentro de la población. Cuando este proceso ocurre, las aplicaciones bajan su efectividad lo cual resulta en algunas ocasiones en un aumento de las dosis y/o disminución de los tiempos entre aplicaciones, aumentando la presión de selección (Robertson et al., 2007). Esto ocasiona daños en el agroecosistema e incrementa la acumulación de plaguicidas en los productos de cosecha.
La resistencia a plaguicidas se cuantifica mediante bioensayos que miden la potencia tóxica del plaguicida sobre una población de insectos de manera de determinar la dosis o concentración de un determinado producto requerida para controlar el 50% de la población de la especie en estudio (DL50 o CL50). La metodología empleada para la estimación de estos valores se basa en la construcción de curvas de dosis-respuesta donde los valores de estos índices serán menores en biotipos susceptibles y aumentarán a medida que los biotipos presenten mayor grado de resistencia. La razón de resistencia, relación entre las DL50 de los dos biotipos, indica el número de veces que es necesario aumentar la dosis del insecticida que se utiliza en un biotipo susceptible para lograr el mismo efecto en el biotipo resistente. Estos estudios permiten verificar sistemáticamente posibles cambios en las poblaciones de plagas y para poder llevarlos a cabo, es necesario establecer los datos de nivel básico que permitan comparar valores obtenidos a partir de muestreos en campo de poblaciones sometidas a una fuerte presión de selección con valores de una población o cepa susceptible no sometida a presión de selección (Robertson et al., 2007).
En el caso de moscas de los frutos, existen antecedentes de resistencia inducida en laboratorio y en el campo. En 1984, Korem et al., advirtieron sobre el potencial de C. capitata de generar resistencia a malatión. Posteriormente, se reportó el potencial de desarrollar resistencia al spinosad en la mosca oriental de los frutos, Bactrocera dorsalis (Hendel) (Hsu y Feng, 2006). En 2007, Magaña et al., reportaron la presencia de biotipos de C. capitata resistentes al malatión en varias localidad de España. En 2010 se reportó la presencia de poblaciones de la mosca del olivo, Bactrocera oleae (Rossi) resistentes a spinosad en Grecia y en Estados Unidos de América (Kakani et al., 2010) y de poblaciones de la mosca del durazno, Bactrocera zonata (Saunders) resistentes a triclorfón, malatión, lamdacialotrina y bifentrina (Ahmad et al., 2010). Si bien estos casos parecen pocos para el uso intensivo que se hace de los insecticidas para el control de moscas de los frutos, no dejan de mostrar la necesidad de hacer monitoreos en campo y de establecer estrategias para el manejo de la resistencia, incluyendo la rotación de productos (Vontas et al., 2011). En este sentido, debe ser considerado también el impacto de los productos sobre los enemigos naturales y la salud humana (Botton et al., 2003; Scoz et al., 2004; Nondillo et al., 2007; Dominiak y Hekman, 2013).
En base a lo expuesto, el objetivo de este estudio fue estimar datos de nivel básico (CL50) de cuatro insecticidas con diferente mecanismo de acción para A. fraterculus y C. capitata y determinar si existen diferencias en la respuesta entre especies y entre sexos.
Materiales y Métodos
Los experimentos fueron realizados en el laboratorio de la Cátedra de Terapéutica Vegetal, Facultad de Agronomía y Zootecnia, Universidad Nacional de Tucumán, Tucumán, Argentina.
Insectos. Los adultos de C. capitata fueron obtenidos de una línea de laboratorio que se mantiene en el Laboratorio de Genética de Insectos de Importancia Económica, Instituto de Genética 'Ewald A. Favret', Instituto Nacional de Tecnología Agropecuaria (IGEAF-INTA). Esta línea se originó a partir de material colectado en la provincia de Mendoza y no tuvo contacto con insecticidas por más de 300 generaciones. Los adultos de A. fraterculus fueron provistos de una línea que se cría también en el IGEAF-INTA. En este caso, la línea fue establecida a partir fruta infestada (Psidium guajaba) colectada en las cercanías de Tafí Viejo, Tucumán, Argentina (Jaldo, 2001).
Productos. Los productos evaluados fueron ciantraniliprol, clorpirifós, lambdacialotrina y spinosad. En todos los casos se utilizaron formulaciones comerciales. Para el caso de ciantraniliprol se empleó Benevia® (Dupont, 10% de ingrediente activo), para clopirifos se utilizó Lorsban® (Dow AgroSciences, 48% de i.a.), para lambdacialotrina se utilizó Kendo® (Syngenta, 5% de i.a.) y para spinosad se utilizó Flipper® (Dow AgroSciences 0,024 de i.a.).
Bioensayos. La unidad experimental consistió en un recipiente plástico de 750 cm3 donde se colocaron 10 individuos separados por sexo y especie de mosca. En el interior de cada recipiente se colocaron paños embebidos con el producto correspondiente en la dosis estipulada dentro de recipientes de papel encerado (3cm diámetro y 2 cm alto). Los recipientes se taparon con tela tipo voile para evitar la fuga de las moscas. Para la aplicación de los productos se utilizaron pipetas plásticas de 5 ml y se colocaron 4 ml de caldo en cada recipiente de papel encerado. Se evaluaron 6 concentraciones de spinosad, 7 de ciantraniliprol y lambdacialotrina y 8 de clorpirifos (Tabla 1). Las diluciones se hicieron sobre una solución acuosa al 10% de una mezcla de azúcar y levadura de cerveza (CALSA, Tucumán, Argentina) en una relación 3:1 (p/p). Después de la aplicación de los tratamientos, las moscas fueron mantenidas en cámara de cría con temperatura y humedad controlada (23 ± 2°C, 60 – 70% HR) por un período de 48 horas, momento en el cual se procedió a determinar la supervivencia de los individuos. Los individuos incapaces de volar fueron considerados como muertos al momento del análisis. Los ensayos se repitieron entre 5 a 6 veces dependiendo de la especie y/o producto. La mortalidad natural se estimó a partir de recipientes con 10 individuos a los cuales se les brindó solamente la solución acuosa de azúcar y levadura de cerveza.
Tabla 1. Concentraciones en ppm de los insecticidas evaluados en bioensayos de laboratorio, FAZ-UNT, 2015.

Análisis de datos.Para cada tratamiento se estimó el porcentaje de mortalidad y se aplicó la corrección de Abbott (Abbott 1925). El cálculo de las CL50 y CL99 y sus respectivos intervalos de confianza al 95% (IC95) se realizó mediante un análisis probit de la curva dosis-respuesta con el programa estadístico POLO Plus (Leora Software, 2002). Las concentraciones letales fueron consideradas diferentes entre las dos especies de mosca o entre sexos cuando los intervalos de confianza no se superpusieron.
Resultados y Discusión
Los valores de CL50 y CL99 obtenidos mediante el análisis probit con los datos de mortalidad corregida para C. capitata y A. fraterculus se muestran en la Tabla 2. Para ciantraniliprol los intervalos de confianza para ambas especies y ambos sexos se superpusieron por lo que machos y hembra de las dos especies presentan la misma susceptibilidad (Figura 1a). Esta diamida de segunda generación activa los receptores de la rianodina (Cordova et al., 2006). Al unirse a estos receptores provocan la liberación de calcio lo cual impide la contracción muscular llevando a la muerte del insecto. Al ser un producto con actividad sistémica y translaminar es recomendando para insectos suctores y defoliadores. Sin embargo, estudios recientes muestran su efectividad para B. dorsalis (Zhang et al., 2015) con valores de CL50 similares a los obtenidos en nuestro trabajo. Para clorpirifos las CL50 fueron iguales en las hembras de ambas especies (Figura 1b). Para los machos no fue posible estimar la CL50 ya que para las menores concentraciones (0,24 y 0,48 ppm de i.a.) la mortalidad fue mayor que para las concentraciones intermedias (1,2 y 2,4 ppm de i.a.) y por lo tanto, el modelo no ajustó. Al comparar los valores de mortalidad dentro de cada concentración, no se detectaron diferencias significativas entre especies ni sexos (datos no mostrados). Para lambdacialotrina, un modulador de los canales de sodio, las dos especies se diferenciaron (Figura 1c). Ceratitis capitata presentó mayores valores de CL50 que A. fraterculus. En ambas especies los dos sexos tuvieron la misma susceptibilidad. Para spinosad, las CL50 de los machos y hembras de C. capitata y de los machos de A. fraterculus fueron similares. Para las hembras de A. fraterculus no fue posible estimar la CL50 porque todas las concentraciones salvo la más alta tuvieron valores de mortalidad similares al testigo (Figura 1d). Borges et al., (2015) estudiaron la mortalidad de los adultos de A. fraterculus comparando spinosad y malatión y determinaron que ambos productos resultaron igualmente tóxicos aún cuando la dinámica de mortalidad fue diferente. Al inicio del ensayo, para spinosad había menor mortalidad; lo cual se corresponde con el hecho que spinosad actúa solo por ingestión (Salgado, 1998).
Tabla 2. Concentración letal (CL50) e intervalo de confianza al 95% (IC95) de cuatro insecticidas para el control de Ceratitis capitata y Anastrepha fraterculus en bioensayos de laboratorio, FAZ-UNT, 2015.
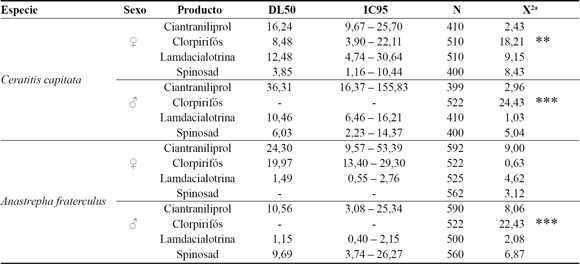
aValor de ajuste del modelo, ** p < 0,01.
Figura 1. Mortalidad observada en machos (triángulos) y hembras (círculos) de Ceratitis capitata (blanco) y Anastrepha fraterculus (negro) y ajuste a un modelo probit a partir de bioensayos en laboratorio, FAZ-UNT, 2015. a) ciantraniliprol, b) clorpirifos, c) lamdacialotrina, d) spinosad.
Las diferencias encontradas entre ambas especies así como la falta de ajuste al modelo en algunos casos muestra la necesidad de profundizar los estudios realizados; por ejemplo, mediante evaluaciones donde se mida la ingesta por parte de las moscas. Nestel et al. (2004) encontraron para C. capitata y para la mosca de Etiopía, Dacus ciliatus, un impacto del estado nutricional previo en la tasa de ingesta de una formulación comercial de spinosad; hecho que repercutió en la mortalidad registrada para las distintas concentraciones. Asimismo, observaron diferencias entre especies y un mayor consumo en bajas concentraciones en comparación con el control. Por su parte Flores et al. (2011) encontraron, para el mismo ingrediente activo, diferencias en el consumo entre machos y hembras para tres especies del género Anastrepha. Determinar el consumo para cada una de las especies y sexos permitirá entender posibles diferencias en el control ejercido por los productos y asociarlas a efectos estimulantes o disuasivos de la alimentación de los formulados.
Conclusión
El manejo adecuado de una plaga requiere del uso de todas las herramientas disponibles de manera tal que se minimice el impacto negativo de las mismas y se maximice el control ejercido. En lo que respecta al uso de insecticidas esto involucra considerar el impacto en otros organismos y en el ambiente, así como monitorear en campo posibles casos de resistencia. Este trabajo estimó datos de nivel básico de cuatro insecticidas con diferentes mecanismos de acción para C. capitata y A. fraterculus, dos plagas de importancia económica en Argentina y otras regiones del mundo. En su conjunto, nuestros resultados generan valores de referencia para Argentina y brindan información de base para el inicio de estudios a campo tendientes a monitorear poblaciones naturales sobre las cuales se ejerce control químico y detectar así la presencia de poblaciones resistentes. Asimismo, muestran la necesidad de realizar estudios donde se mida la ingesta del producto. Esta información es de relevancia al momento de proponer estrategias para el manejo de la resistencia basada en la rotación de productos con distintos modos de acción así como para proponer formulaciones eficientes.
Agradecimientos
Este trabajo fue financiado por el proyecto PIUNT 2014 A508 a nombre de M. H. de la Vega. Agradecemos los comentarios de M. Laura Juárez y dos revisores anónimos que permitieron mejorar el manuscrito. Asimismo, agradecemos a Daniel López por su asistencia en la elaboración de las figuras.
Bibliografía citada
1. Abbott W.S. (1925). A method of computing the effectiveness of an insecticide. Journal of Economic Entomology 18: 265-267. [ Links ]
2. Ahmad S.F., Ahmed S., Khan R.R., Nadeem M.K. (2010). Evaluation of insecticide resistance in two strains of fruit fly, Bactrocera zonata (Saunders) (Tephritidae: Diptera), with fruit dip method. Pakistan Entomologist 32: 163-167. [ Links ]
3. Aluja M., Liedo P. (1993). Fuit Flies. Biology and management, Springer, Verlag, New York, p. 492. [ Links ]
4. Aluja M.R. (1994). Bionomics and management of Anastrepha. Annual Review of Entomology 39: 155-178. [ Links ]
5. Aruani R., Ceresa A., Granados J., Tared G., Peruzzoti P., Ortiz, G. (1996). Advances in the National Fruit Fly control and Eradication Program in Argentine. En: Fruit Fly pests: A world Assessment of biology and management. McPheron B., Steck G.J. (Eds.). St. Lucie Press, Delray Beach, pp. 521-530. [ Links ]
6. Borges R., Machota Jr. R., Boff M.I.C., Botton M. (2015). Efeito de Iscas Tóxicas sobre Anastrepha fraterculus (Wiedemann) (Diptera: Tephritidae). Bioassay 10(3) Available online: www.bioassay.org.br/ojs/ index.php/bioassay/article/view/134, consulta: mayo 2015. [ Links ]
7. Botton M., Hickel E.R., Soria S.J. (2003). Pragas, Uva para processamento. En: Embrapa Informação Tecnológica. Fajardo T.V.M. (Ed.). Brasília, pp. 82-105. [ Links ] Cordova D., Benner E.A., Sacher M.D., Rauh J.J., Sopa J.S., Lahm, G.P. Selby T.P., Stevenson T.M., Flexner L., Gutteridge S., Rhoades D.F., Wu L., Smith R.M., Tao Y. (2006). Anthranilic diamides: a new class of insecticides with a novel mode of action, ryanodine receptor activation. Pesticide Biochemistry and Physiology 84:196-214.
8. Dominiak B.C., Hekman J.E. (2013). The rise and demise of control options for fruit fly in Australia. Crop Protection 51: 57-67.
9. Flores, S., Gomez L.E., Montoya P. (2011). Residual control and lethal concentrations of GF-120 (Spinosad) for Anastrepha spp. (Diptera: Tephritidae). Journal of Economic Entomology 104: 1885-1891.
10. Guillen D., Sanchez R. (2007). Expansion of the natural fruit fly control programme in Argentina. En: Area-Wide control of Insect pests, From Research to Field Implementation. Vreysen M.J.B., Robinson A.S., Hendrich J. (Eds.). Springer, New York. pp. 653-660.
11. Hsu J.C, Feng H.T. (2006). Development of Resistance to Spinosad in Oriental Fruit Fly (Diptera: Tephritidae) in Laboratory Selection and Cross-Resistance. Journal of Economic Entomology 99: 931-936.
12. Jaldo H.E. (2001). Estudios biológicos y poblacionales de Anastrepha fraterculus (Wiedemann) (Diptera: Tephritidae). Tesis de Doctorado, Facultad de Agronomía y Zootecnia, Universidad Nacional de Tucumán, Argentina.
13. Kakani E.G., Zygouridis N.E., Tsoumani K.T., Seraphides N., Zalomc F.G., Mathiopoulos K.D. (2010). Spinosad resistance development in wild olive fruit fly Bactrocera oleae (Diptera: Tephritidae) populations in California. Pest Management Science 66: 447-453.
14. Korem B., Yawetz A., Pery A.S. (1984). Biochemical properties of characterizing the development of tolerance to malation in Ceratitis capitata Wiedmann (Diptera: Tephritidae). Journal of Economic Entomology 77: 864-867.
15. Leora Software. 2002. Polo-PC: a user's guide to probit or logit analisys. Berkeley. p. 20.
16. Liquido N.J., Shinoda L.A., Cunningham, R.T. (1990). Host plants of the Mediterranean fruit fly (Diptera: Tephritidae): an annotated world review. Miscelanea Publication Entomological Society of America 77: 1-52.
17. Liquido N.J., Barr P.G., Cunningham R.T. (2013). MEDHOST, an encyclopedic bibliography of the host plants of the Mediterranean fruit fly, Ceratitis capitata (Wiedemann), version 1. Fruit fly expert identification system and systematic information database, Diptera dissemination disk, vol. 1.
18. Magaña C., Hernández-Crespo P., Ortego F., Castañera P. (2007). Resistance to malation in field population of Ceratitis capitata. Journal of Economic Entomology. 100(6): 1836-1843.
19. Malavasi A., Rohwer G.G., Campbell D.S. (1994). Fruit Fly Free areas: strategies to develop them. En: Fruit Flies and the sterile insect technique. Calkins C.O., Klassen W., Liedo P. (Eds.). CRC, Boca Raton, pp. 165-180.
20. Malavasi A., Zucchi A., Sugayama R. (2000). Biogeografía. En: Moscas-Das-Frutas de importancia Econômica no Brasil. Malavasi A., Zucchi R.A. (Eds.). Holos, Riberão Preto. pp. 93-98.
21. Nestel D., Nemny-Lavy E., Zilberg L., Weiss M., Akiva R., Gazit Y.(2004). The fruit fly PUB: a phagostimulation unit bioassay system to quantitatively measure ingestion of baits by individual flies. Journal of Applied Entomology 128: 576-582.
22. Nondillo A., Zanardi O., Afonso A.P., Benedetti A.J., Botton M. (2007). Efeito de inseticidas neonicotinóides sobre a mosca-das-frutas sul-americana Anastrepha fraterculus (Wiedemann) (Diptera: Tephritidae) na cultura da videira. Bioessays 2: 1-9.
23. Norrbom A.L., Kim K.C. (1988). A list of the reported host plant of the species of Anastrepha (Diptera: Tephritidae). U.S. Dept. Agric. Animal Plant Health Inspection Service Miscellaneous Publication 81 (52).
24. Norrbom A.L. (2004) Host plant database for Anastrepha and Toxotrypana (Diptera: Tephritidae: Toxotrypanini), Diptera Data Dissemination Disk. North American Dipterist's Society Washington, DC.
25. Norbom A.L. (2010). Tephritidae (Fruits Flies, mosca de las frutas). En: Manual of Central American Diptera. Brown B.V., Borkent A., Cumming J.M., Wood D.M., Woodley N.E., Zumbado M.A. (Eds.), NRC-CNRC Research Press, Ottawa, pp. 909-954.
26. Oroño L.E., Albornoz-Medina P., Núñez-Campero S., van Nieuwenhove G.A., Bezdjian L.P., Martin C.B., Schliserman P., Ovruski S.M. (2008). Update of host plant list of Anastrepha fraterculus and Ceratitis capitata in Argentina. En: Fruit flies of economic importance: from basic to applied knowledge. Proceedings of the 7th International Symposium on Fruit Flies of Economic Importance Sugayama R.L., Zucchi R.A., Ovruski S.M., Sivinski J. (Eds.). Color Press, Salva dor, pp. 207–225.
27. Ovruski S.M., Schliserman P., Aluja, M. (2003). Native and introduced host plants of Anastrepha fraterculus and Ceratitis capitata (Diptera: Tephritidae) in Northwestern Argentina. Journal of Economic Entomology 96: 1108-1118.
28. Putruelle M.T.G. (1996). Host for Ceratitis capitata and Anastrepha fraterculus in the Northeastern province of Entre Rios, Argentina. En: Fruit fly pests: a world assessment of their biology and management. McPheron B.A., Steck G.J. (Eds.). St. Lucie Press, Delray Beach, pp. 343-345.
29. Robertson J. L., Savin N.E., Preisler H.K., Russell, R.M. (2007). Bioassays with arthropods. CRC press, Neva York, p. 199.
30. Salgado, V.L. 1998. Studies on the mode of action of spinosad: Insect symptoms and physiological correlates. Pesticide Biochemestry and Physiology 60: 91-102.
31. Scoz P.L., Botton M., Garcia M.S. (2004). Controle químico de Anastrepha fraterculus (Wied.) (Diptera: Tephritidae) em laboratório. Ciência Rural 34: 1689- 1694.
32. Segura D.F., Vera T., Cagnotti C., Vaccaro N., de Coll O., Ovruski S., Cladera J. (2006). Relative abundance of Ceratitis capitata and Anastrepha fraterculus (Diptera: Tephritidae) in diverse host species and localities of Argentina. Annals of the Entomological Society of America 99(1): 70-83.
33. Uchôa M.A., Nicácio J.N. (2010). New records of Neotropical fruite flies (Tephritidae), Lance flies (Lonchaeidae) (Diptera: Tephritoidea), and the host plants in the south pantanal and adjacent areas, Brazil. Annals of the Entomological Society of America 103(5): 723-733.
34. Vontas J., Hernández-Crespo P., Margaritopoulos J.T., Ortego F., Feng H-T, Mathiopoulos K.D., Hsu J.C. (2011). Insecticide resistance in Tephritid flies. Pesticide Biochemistry and Physiology 100 (3): 199-205.
35. White I.M., Elson-Harris M.M. 1994. Fuit Flies of economic significance: their identification and Bionomics. CAB International-ACIAR. Wallingford, p. 601.
36. Zhang R., Jang E.B., He S., Chen J. (2015). Lethal and sublethal effects of cyantraniliprole on Bactrocera dorsalis (Hendel) (Diptera: Tephritidae). Pest Management Science 71: 250-256.














