Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista agronómica del noroeste argentino
versão impressa ISSN 0080-2069versão On-line ISSN 2314-369X
Rev. agron. noroeste arg. vol.35 no.2 San Miguel de Tucumán dez. 2015
ARTÍCULO CIENTÍFICO
Estudios genéticos en Aloysia gratissima (Gill. et Hook) Tronc., Chenopodium mandonii (S. Watson) Aellen y Clinopodium gilliesii (Benth.) Kuntze
Genetic studies in Aloysia gratissima (Gill. et Hook) Tronc., Chenopodium mandonii (S. Watson) Aellen and Clinopodium gilliesii (Benth.) Kuntze
A. Pastoriza*; L. Martínez Pulido; C.J. Budeguer; A. Nasif; B. Andrada Mansilla.
Cátedra de Genética, Facultad de Agronomía y Zootecnia, Universidad Nacional de Tucumán. Av. Kirchner 1900, (4000), San Miguel de Tucumán, Tucumán, Argentina. *Email: adrianapastoriza@yahoo.com.ar
Resumen
En Tucumán existen poblaciones de aromáticas nativas con propiedades terapeúticas, como Aloysia gratissima (Gill. et Hook) Tronc., Chenopodium mandonii Willd. y Clinopodium gilliesii (Benth.) Kuntze. Estas dos últimas comparten nicho ecológico y crecen entre los 2.200 y 4.500 msnm. Aloysia gratissima y C. mandonii son requeridas por sus propiedades digestivas. Clinopodium gilliesii se destaca por su potencial antifúngico y antioxidante. El objetivo de este trabajo fue caracterizar genética y reproductivamente a A. gratissima, C. mandonii y Clinopodium gilliesii. El material vegetal fue originario de Tafí del Valle (Tucumán). Se usaron técnicas citogenéticas tradicionales de mitosis, meiosis y viabilidad de grano de polen para evaluar el potencial reproductivo. Los resultados mostraron para A. gratissima 2n=54 con irregularidad en meiosis y 92,4% de inviabilidad de polen, valores similares que en C. gilliesii, en este caso no se pudo confirmar número cromosómico por su tamaño (0,2 μ aprox.). Los cromosomas en diacinesis indican que sería poliploide con x=5, e infértil. En C. mandonii la meiosis fue regular, con 2n=54 y 93,4% de viabilidad de polen. Esta situación alude a un proceso evolutivo de diploidización que justifica la regularidad de la meiosis y buen poder germinativo de semillas, condición provechosa para la conservación ex situ de su germoplasma. En las otras dos especies, se deben continuar con los trabajos de clonación tendientes a la preservación de su genética.
Palabras clave: Aromáticas; Reproducción; Conservación germoplasma.
Abstract
In Tucumán, there are aromatic native populations with therapeutic properties like Aloysia gratissima (Gill. et Hook) Tronc, Chenopodium mandonii Willd. and Clinopodium gilliesii (Benth.) Kuntze. The last two share ecological niche and grow between 2,200 and 4,500 masl. Aloysia gratissima and C. mandonii are required for their digestive properties. Clinopodium gilliesii stands out for its antifungal and antioxidant potential. The objective of this work was to characterize genetically and reproductively A. gratissima, C. mandonii and C. gilliesii. Materials came from Tafí del Valle (Tucumán). Traditional cytogenetic techniques of mitosis, meiosis and pollen grain viability to evaluate reproductive potential were used. Results revealed for A. gratissima a 2n=54 with irregularity in meiosis and 92.4% of pollen inviability. These values were similar to those of C. gilliesii, but the chromosomal number was not confirmed in the last case because of its size (0.2 μ approx.). Chromosomes at diakinesis indicate it could be a polyploid with x=5, infertile. In C. mandonii meiosis was regular, with 2n=54 and 93.4% of pollen viability. The situation found in C. mandonii refers to an evolution process of diploidization that explains the regularity in meiosis and the good seed germinating power, useful condition for the conservation of its germplasm. In the other two species, clonation tasks aimed to the preservation of their genetics must continue.
Keywords: Aromatics; Reproduction; Germplasm conservation.
Recibido 16/10/15; Aceptado 19/11/15.
Los autores declaran no tener conflicto de intereses.
Introducción
Aloysia gratissima (Gill. et Hook) Tronc., Chenopodium mandonii Willd. y Clinopodium gilliesii (Benth.) Kuntze, (syn. Satureja parvifolia), son aromáticas nativas que habitan la zona de Tafí del Valle, Tucumán. Mientras que A. gratissima se encuentra en poblaciones aisladas respecto de las otras especies, C. mandoni y C. gilliesii comparten el nicho ecológico y crecen entre los 2.200 y 4.500 msnm.
Aloysia gratissima, conocido en la provincia de Tucumán como cedroncillo, pertenece a la familia de las Verbenaceae, con amplia distribución en zonas áridas y semiáridas de Argentina y en países vecinos. Es un arbusto aromático que puede alcanzar hasta 3 m de altura, ampliamente ramificado y con pubescencia densa en sus ramas. De hojas opuestas, subsésiles, con un fascículo de hojas más pequeñas en sus axilas, Flores blancas subsésiles en verticilos irregulares, pequeñas de 1 a 1,5 mm de longitud, también pubescentes (Troncoso, 1952 y 1974; Botta 1979). Rica en aceites esenciales, los componentes más importantes citados para muestras provenientes de Brasil, Uruguay y Argentina, son: para las hojas: 1,8- cineol (3%), limoneno, sabineno (30%), â-pineno (9,7%), â-bisaboleno (5,8%) y copaenol (4,3%); para flores: pulegona (65,8%), limoneno (3,6%), espatulenol (2,1%), á- y â-tuyona (1,1% y 0,8% respectivamente), dihidrocarvona (2,1%) y mentona (2,0%) (Toursarkissian; 1980), destacándose su alto porcentaje de pulegona (65,8%), y por sus propiedades medicinales (Zygadlo et al., 1998). De lo dicho anteriormente, resulta interesante el conocimiento de sus características reproductivas para su introducción en cultivos y su potencial uso en la medicina y la industria. La infusión de sus hojas es usada como digestivo en dolores estomacales y como medicinal para combatir resfríos y como sedante. Por otro lado, se la menciona como tóxica para el ganado (Botta, 1979), aunque se sabe que aun así es consumida por los animales por la escasez de alimentos, en zonas marginales.
Chenopodium mandonii (n.v. arca yuyo) es una planta herbácea perteneciente a la familia de las Chenopodiaceae, de porte erguido, anual, con pelos vesiculosos de color blanco o púrpura, plantas poco ramificadas, de 0,3 a 1 m de altura en algunos casos. Hojas pecioladas, elípticas, sinuado-dentadas, de ápice mútico. Flores reunidas en glomérulos (raro en cimas dicótomas), perfectas o imperfectas, dispuestas en dicasios, algo laxos, completamente ebracteados y con las últimas ramificaciones transformadas en aristas. Semilla globosa, horizontal, de 0,8 a 1,0 mm de diámetro, de color castaño, poco lustroso. Radícula prominente (Tolaba, 2006). Se distribuyeen las altas montañas y mesetas del noroeste argentino, desde Jujuy a La Rioja. Sus hojas y sus tallos son de uso culinario y medicinal y son comercializadas en herboristerías y en la industria para la obtención de aceites esenciales. La cosecha se realiza con características de extracción destructiva en las regiones en las que se encuentran, lo que trae como consecuencia una importante erosión genética (Parodi, 1975; Pastoriza et al., 2006; Zuloaga et al., 2008).
Clinopodium gilliesii (n.v. muña-muña) es un arbusto aromático caduco que se distribuye desde Bolivia y Perú, en las altas montañas y mesetas, desde Jujuy a La Rioja (Cabrera, 1993; Ratera y Ratera, 1980). Es una especie perenne perteneciente a la familia Labiaceae. Es aromática y medicinal nativa de la región andina del noroeste de Argentina, suele ser abundante en cercanías de ríos, aunque en los últimos tiempos se observa disminución en la densidad de las poblaciones naturales. Es de interés etnobotánico, farmacéutico y económico, debido a los aceites aromáticos encontrados en las glándulas de hojas y tallos. Tradicionalmente se recolectan las plantas para condimentar o para aplicaciones medicinales. Sus hojas son muy requeridas por su potencial antifúngico, antiparasitario y antioxidante, además de sus cualidades óptimas para la fabricación de bebidas sin alcohol. También es aromatizante de sopas y de las bebidas elaboradas a base de leche, como la "leche piri" y leche hervida (Vignale y Gurni, 2012). Respecto a sus componentes químicos principales, se ha informado sobre la evaluación de doce poblaciones de C. gilliesii, con al menos cinco quimiotipos de interés para la industria y la medicina en seis provincias de la Argentina (Juárez et al., 2012). La determinación de aceites esenciales y aplicación de la química fina a constituyentes aislados para lograr, mediante modificaciones útiles de estructuras, la conversión a productos con alto valor agregado, resulta aún más interesante (Retamar, 1995).
El aislamiento geográfico de las comunidades y los pueblos que habitan toda la región ha contribuido a la conservación y el mantenimiento de sus tradiciones ancestrales. La farmacopea herbaria de los pueblos andinos es rica y variada aun cuando la flora del ambiente semidesértico de la región bajo consideración (provincia biogeográficas de la Puna) es relativamente pobre (Cabrera, 1993).
Con el aumento y empobrecimiento de los pobladores de la región, las especies en estudio han sido sometidas en forma creciente a una sobre explotación antrópica y a sobrepastoreo. Ello conduce a una pérdida de variabilidad genética, pues se ha observado una alarmante disminución del número de especímenes que se atribuye a estas causas (Pastoriza et al., 2012). La destrucción de la biodiversidad y la creación de uniformidad genética en los cultivos simultáneamente, conducen a la inestabilidad y aumento de la vulnerabilidad de los sistemas (Shiva, 1991). Esta situación continúa en forma alarmante sin que existan indicadores económicos que den cuenta de los costos ambientales que ello significa (Montecinos y Altieri, 1992).
Teniendo como finalidad la conservación de la biodiversidad, resulta importante la caracterización genética. Se ha informado que en poblaciones naturales puede producirse una fuerte selección direccional, que en algunos casos puede devenir en escasa variabilidad (Mitchell-Olds, 1992), de lo que surge como relevante la realización de estudios genéticos y modos reproductivos para estimar variabilidad, en pos de futuros planes de selección y mejora.
Desde el punto de vista genético, también se debe analizar el complemento cromosómico en mitosis, el comportamiento cromosómico en meiosis, su relación con el aspecto reproductivo y la capacidad de propagación en pos de su aprovechamiento. Por lo tanto, no sólo es importante conocer el número de cromosomas, sino también el tamaño de los mismos, la relación de brazos, la posición de constricciones primarias y secundarias y otras características que permitan realizar un estudio profundo del cariotipo (Poggio, 1994). El comportamiento de los cromosomas en meiosis y la viabilidad del grano de polen, son importantes elementos para valorar la fertilidad, complementando con un cuidadoso seguimiento del comportamiento fenotípico de las distintas poblaciones. Otro aspecto relevante es la determinación del nivel de ploidía, si se tiene en cuenta que la poliploidía es una de las formas más importantes en la evolución de los vegetales (Stebbins, 1971). Para A. gratissima, C. mandonii se ha señalado un número básico x=8 y x=9 y para C. gilliesii un x= 5 (Darlington, 1955). Así, se ha reportado para A. gratissima un 2n=54 (Andrada et al., 1998) y para C. mandonii un 2n=54 (Pastoriza et al., 2006, Pastoriza et al., 2015), sin datos para C. gilliesii. El estudio del cariotipo incluye la determinación del tipo del mismo. Un cariotipo bimodal podría resultar de translocaciones por medio de las cuales ciertos cromosomas podrían contribuir con segmentos a otros del mismo complemento, donde el tamaño del cromosoma donante se reduciría y el del receptor aumentaría (Levitzky en Stebbins, 1971). Este autor sugiere que, para entender la simetría del cariotipo, se debe asociar el aumento de asimetría con otras características citológicas como número cromosómico, hábito de crecimiento (anual o perenne) y la presencia o ausencia de caracteres morfológicos especializados. Por otro lado, Sáez y Cardoso (1978), señalan que a medida que se avanza en la evolución, la asimetría de los cariotipos se va modificando hasta llegar a producir tipos asimétricos asociados generalmente a los vegetales más especializados. Las variaciones en el número de cromosomas, frecuentes en el reino vegetal, traen como consecuencia modificaciones en los ritmos fisiológicos y en las divisiones celulares, los que provocan cambios en su capacidad adaptativa. Los poliploides son tenidos en cuenta por los fitomejoradores por sus características particulares: mayor tamaño de la planta en general, de las hojas, de las flores y del fruto, lo que podría traducirse finalmente en un mayor rendimiento. Pero, por otro lado, también podrían presentar problemas de fertilidad por lo que, para poder sobrevivir en un ambiente determinado, deben recurrir a mecanismos de propagación vegetativa como la apomixis (Stebbins, 1971).
Por lo expuesto, el objetivo de este trabajo fue caracterizar citogenética y reproductivamente a A. gratissima, C. mandonii y C. gilliesii, para propender a la conservación de su germoplasma.
Materiales y métodos
El material vegetal de A. gratissima fue recolectado de El Mollar (26º 33' de L. S. y 65º 72' de L. O.) y el de C. mandonii y C. gilliesii de Tafí del Valle, Tucumán (Figuras 1 y 2), altura del km 90, (26º 33' de L. S. y 65º 68' de L. O.).
Para el análisis de los cromosomas mitóticos se utilizaron meristemas radicales y de hojas pequeñas. Se realizó una hidrólisis en HCl N a 58-60 ºC, la coloración con hematoxilina acética al 2% empleando citrato férrico al 1% como mordiente, marcha técnica según Andrada et al. (1998). Luego se obtuvieron las microfotografías para el análisis de los cariotipos, teniendo en cuenta el índice centromérico (Levan et al., 1964).
Figura 1. Aloysia gratissima (Gill. et Hook) Tronc., proveniente de El Mollar, Tafí del Valle, Tucumán, a) ejemplar herborizado; b) planta en su ambiente natural.
Figura 2. a) Chenopodium mandonii Willd.; b) Clinopodium gilliesii (Benth.) Kuntze (syn. Satureja parvifolia), Tafí del Valle, Tucumán.
Para el análisis de los cromosomas en meiosis, se fijaron las flores pequeñas en una solución de Newcomer. Los preparados se realizaron con el aplastado de anteras utilizando la misma técnica de coloración que para cromosomas mitóticos. Se analizó el comportamiento de los cromosomas en las distintas fases de la meiosis y su relación con la fertilidad y con la variabilidad genética. Se observó con microscopio ZEISS Primo Star y se fotografió con objetivo de inmersión con un aumento de 1000 x.
Para estimar la viabilidad de los granos de polen se utilizó como colorante Azul de algodón en lactofenol. Se llevaron a ebullición durante un minuto flores cercanas a la antesis, con granos de polen maduros, luego se extrajeron las anteras, se las colocó en una gota de colorante durante 12 horas, necesarias para que tome la coloración. Se contaron entre 600 y 1500 granos por muestra considerándose como normales a los granos turgentes y bien coloreados y como anormales a los deformes que no se tiñeron o lo hicieron débilmente (D' Ambrogio de Argüeso, 1986; Singh, 2002).
Resultados
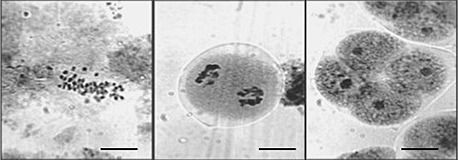
Los resultados fueron: para A. gratissima 2n=54, con un tamaño de cromosomas que varió de 0,5 a 2 μ. El tamaño pequeño de los cromosomas y su gran número dificultó la realización del cariotipo. El comportamiento de los cromosomas en meiosis fue irregular y la viabilidad de los granos de polen dio un valor de 92,4% de granos de polen inviable (Figura 3).
Figura 3. Cromosomas obtenidos de meristemas de hoja y de flores en Aloysia gratissima 2n=54. a) mitosis, b) Telofase I (meiosis), con presencia de numerosos micronúcleos señalados con la flecha (la barra representa 10 µm).
En C. gilliesii, se observaron las mitosis con alto número cromosómico y de tamaño pequeño (0,2 μ aprox.). Los cromosomas en meiosis presentaron un comportamiento altamente irregular. Las configuraciones en diacinesis indican que sería poliploide con x=5. En la división I, se detectó la presencia de monovalentes en número variado y de cromosomas rezagados en Anafase I y Telofase I. En la división II de la meiosis, la irregularidad se manifestó por la presencia de rezagados en Anafase II y micro núcleos en Metafase II y Telofase II. La viabilidad de polen fue del 7% de polen viable (Figuras 4 y 5).
Figura 4. Meiosis en Clinopodium gilliesii (Benth.) Kuntze (syn. Satureja parvifolia). División I de meiosis (la barra representa 10 µm).
Figura 5. Meiosis en Clinopodium gilliesii (Benth.) Kuntze (syn. Satureja parvifolia). División II de meiosis (la barra representa 10 µm)..
En C. mandonii se logró un 2n=54, con un tamaño de cromosomas que varió entre 0,2 a 0,6 aproximadamente, siendo una constante para las tres especies el tamaño pequeño de los cromosomas. La meiosis fue altamente regular, como lo muestran las configuraciones en división I y II de meiosis. La viabilidad de polen fue de 93,4% de granos de polen normales (Figura 6).
Figura 6. Cromosomas obtenidos de meristemas radiculares y de flores en Chenopodium mandonii Willd. 2n=54, a) mitosis, b) División I de meiosis (la barra representa 10 µm).
Discusión y conclusiones
Del análisis del cariotipo de A. gratissima surge que la especie presenta un cariotipo asimétrico, con un grupo de cromosomas con tamaño promedio de 0,5 μ y otro grupo con un promedio de 2 μ, lo que supone un cariotipo bimodal, asociado a una especialización creciente En este caso la asimetría podría asociarse a la característica de poliploide, a su hábito de crecimiento (perenne) y a la presencia de caracteres morfológicos especializados relacionados principalmente a su modo de multiplicación vegetativa para adaptarse a condiciones ambientales adversas (Stebbins, 1971; Sáez y Cardoso 1978). En relación con el comportamiento de los cromosomas en meiosis, la hexapoliploidía (considerando x=9) se considera como la causa de una meiosis altamente anormal, con formaciones de multivalentes, univalentes, rezagados y puentes en Anafase I, típico de especies autopoliploides donde la fertilidad se ve severamente afectada. Ello conduce a que la viabilidad de los granos de polen sea muy escasa, 7, 50% de viabilidad.
Del mismo modo, en C. gilliesii, la alta irregularidad meiótica explica la baja viabilidad del grano de polen, con la consiguiente disminución en la fertilidad. El número cromosómico numeroso indica que se trata de un poliploide, considerando el número básico x=5. La multiplicidad de figuras irregulares en meiosis, tales como rezagados en Telofase I, micronúcleos, univalentes entre otras configuraciones, son la causa de este fenómeno.
Considerando por un lado la escasa capacidad reproductiva detectada en A. gratissima y en C. gilliesii, y por otro lado, la excesiva extracción a la que son sometidas con fines comerciales, se concluye que la permanencia de estas especies en el tiempo está en grave riesgo. Por ello, se deben considerar alternativas para un uso sostenible y propender a la conservación de este valioso recurso fitogenético, para lo cual se propone la multiplicación clonal o micro propagación de estas especies a fin de aportar como reservorio de diversidad genética. Ante las desventajas reproductivas descriptas, el carácter poliploide de estas especies influye para su adaptación a condiciones ambientales severas, por lo que su valor selectivo compensa sus deficiencias en reproducción y recurren a mecanismos apomícticos para sobrevivir y establecerse.
En C. mandonii la situación es diferente. Aunque se trata de un poliploide (x=9) como los anteriores, la regularidad del comportamiento de los cromosomas en meiosis, alude a un proceso evolutivo de diploidización que justifica esta regularidad reproductiva y el buen poder germinativo de semillas, condición provechosa para la conservación de su germoplasma, lo que urge concretar pues es una especie altamente sobrepastoreada.
Agradecimientos
Al Consejo de Investigaciones de la Universidad Nacional de Tucumán, por el subsidio al Proyecto PIUNT A/520.
Referencias bibliográficas
1. Andrada A.B., Pastoriza A., Martínez Pulido L. (1998). Citogenética en tres especies de Verbenaceae. Revista de la Facultad de Agronomía 15(4): 253-2. [ Links ]
2. Botta S. M. (1979). Las especies argentinas del género Aloysia (Verbenaceae). Darwiniana 22 (1-3):67-108. [ Links ]
3. Cabrera A.L. (1993). Flora de la Provincia de Jujuy. Instituto Nacional de Tecnología Agropecuaria, Buenos Aires, Argentina. [ Links ]
4. Darlington C.D., Wyle A. P. (1955). Chromosome Atlas of flowering plants. George Allen & Unwin Ltd., London, UK. [ Links ]
5. D' Ambrogio de Argüeso A. (1986). Manual de Técnicas en Histología Vegetal. Hemisferio Sur, Buenos Aires, Argentina. [ Links ]
6. Juárez M.A., Viturro C.I., Elechosa M.A., Heit C.I., Molina A.C., Martínez A.J. Molina, A.M. (2012). Quimiotipos en los aceites esenciales de de poblaciones naturales de aloysia citriodora, Aloysia polystachya y Clinopodium gilliesii. Dominguezia 28(2): 79-80. [ Links ]
7. Levan A., Fredga, K., Sandeberg A. (1964). Nomenclature for centromeric position on chromosomes. Hereditas 52: 201-220. [ Links ]
8. Mitchell-Olds T. (1992) Does environmental variation maintain genetic variation? A question of scale. Trends in Ecology and Evolution 7(12): 397-398. [ Links ]
9. Montecinos C., Altieri M. (1992). Situación y tendencias en la conservación de recursos genéticos a nivel local en América Latina. Agroecología y Desarrollo 2: 25-34. [ Links ]
10. Dimitri M.J. (192). Enciclopedia de Agricultura y Jardinería. Acmé, Buenos Aires, Argentina.
11. Pastoriza A., Nasif A.M.M., Martínez Pulido L., Andrada Mansilla B., Andrada AB. (2006). Comportamiento cromosómico de dos especies del género Chenopodium L. Journal of Basic & Applied Genetics SII-102. [ Links ]
12. Pastoriza A., Budeguer C.J., Herrero Nasif P., Elechosa M.A., Juárez M.A., Molina A.M. (2012). Genética en peperina y cedroncillo: efecto de la acción antrópica sobre poblaciones naturales de Tucumán. Dominguezia 28(2): 59-60. [ Links ]
13. Pastoriza A., Martínez Pulido L., Budeguer C.J., Nasif, A., Andrada Mansilla B. (2015). Estudios genéticos preliminares tendientes a la conservación de germoplasma de aromáticas del Dpto. Tafí del Valle, Tucumán. 3ra. Reunión Conjunta de Sociedades de Biología de la República Argentina. 9-11 septiembre, Tucumán, Argentina p.72. [ Links ]
14. Poggio L. (1994). La citogenética en la organización del genoma y la especiación. Mendeliana 10 (2): 77-95. [ Links ]
15. Ratera E.L., Ratera M.O. (1980). Plantas de la flora argentina empleadas en medicina popular. Editorial Hemisferio Sur. S.A., Buenos Aires, Argentina. [ Links ]
16. Retamar J. A., Malizia R. A., Molli J.S., Risso G.A. (1995). Modificaciones fitoquímicas en especies aromáticas. Tercera comunicación. Essenze Derivati Agrumari 1: 45-49. [ Links ]
17. Saez F.A, Cardozo H. (1978). Citogenética Básica y Biología de los cromosomas. Programa Regional de Desarrollo Científico y Tecnológico. Serie de Biología. Monografía de la Organización de los Estados Americanos 20. [ Links ]
18. Shiva V. (1991). The violence of the green revolution: "Miracle seeds" and the destruction of genetic diversity. Third World Agriculture, Ecology and Politics. Third World Network. Zeed. [ Links ]
19. Singh R. J. (2002). Plant Cytogenetics. 2nd. ed. CRC Press, Boca Ratón, USA. [ Links ]
20. Stebbins G. L. (1971). Chromosomal evolution in higher plants. Edward Arnold (Publishers), London, UK. [ Links ]
21. Tolaba J. A. (2006). Flora del Valle de Lerma Chenopodiaceae Vent. Aportes Botánicos de Salta. Aportes Botánicos de Salta-Serie Flora 18: 1-48. [ Links ]
22. Toursarkissian M. (1980). Plantas de la Medicina Popular Argentina. Hemisferio Sur, Buenos Aires, Argentina. [ Links ]
23. Troncoso N.S. (1974). Los géneros de Verbenáceas de Sudamérica extratropical (Argentina, Chile, Bolivia, Paraguay, Uruguay y Sur de Brasil). Darwiniana 18(3-4): 295-413. [ Links ]
24. Troncoso N.S. (1952). Descripción de algunas especies nuevas o críticas de Lippia de la Flora Argentina. Darwiniana 10(1): 69-89. [ Links ]
25. Vignale N.D., Gurni, A.A. (2012). Parámetros micrográficos foliares de ocho especies de la flora aromática andina de Jujuy, Argentina: su aplicación en al análisis de calidad botánica. Dominguezia 28(2): 65-66. [ Links ]
26. Zygadlo J.A., Lamarque A.L., Guzmán, C.A. (1998). Composition of the flower oil of some Lippia and Aloysia species from Argentina. Journal of Essential Oil Research 95: 593-595. [ Links ]
27. Zuloaga F.O., Morrone O., Belgrano M.J. 2008. Catalogue of the vascular plants of the southern cone (Argentina, southern Brazil, Chile, Paraguay and Uruguay). Volume 2: Dicotyledoneae: Acanthaceae-Fabaceae (Abarema-Schizolobium). Missouri Botanical Garden Press, Missouri, USA. [ Links ]