Introducción
Las especies del género Cedrela están distribuidas a lo largo de América Latina, desde México hasta la Argentina. Su madera es empleada tradicionalmente en la región desde tiempos precolombinos. Según Zapater et al. (2004), las especies del género Cedrela en la Argentina son cinco: Cedrela angustifolia, Cedrela balansae y Cedrela saltensis, exclusivas del noroeste, y Cedrela fissilis y Cedrela odorata, presentes en la Selva Paranaense. El cedro rosa, Cedrela fissilis Vell. (Meliaceae), está entre las más importantes maderas de interés económico de Brasil (Dos Santos y Takaki, 2005). En el continente, C. fissilis se extiende desde Colombia hacia el sur, a través de la Sud América tropical hacia el este y sur de Brasil, Paraguay y el norte de la Argentina (Pennington y Muellner, 2010).
La madera de C. fissilis puede ser ampliamente utilizada en compensados, contrachapado, esculturas y obras talladas, maquetas y marcos, muebles en general, carpintería, en la construcción civil, construcción naval y aeronáutica, y en la producción de pequeñas cajas, lápices e instrumentos musicales (Lorenzi, 1992). También se lo emplea para la obtención de colorantes y resinas (Rodríguez et al., 2006). El aprovechamiento sin control y el avance de la frontera agropecuaria causaron una drástica disminución de la presencia de esta especie en los bosques nativos. Además, gran parte de las poblaciones remanentes no presentan buenas características de forma y sanidad, debido a la extracción selectiva de los mejores ejemplares. De manera general, se observa una tendencia declinante de la actividad productiva en cuanto a superficies de aprovechamiento forestal, al igual que un cambio en el volumen cosechado por especie, en especial de especies tradicionales como el cedro, lapacho y quina colorada, y un aumento de los volúmenes de cebil moro (Eliano et al., 2009). Los atributos de su madera hacen de C. fissilis una especie amenazada (IUCN, 2016).
Para incrementar la población de esta especie y garantizar la disponibilidad futura de su madera, es necesario implantar árboles en sistemas convencionales en macizo, o enriquecer las masas boscosas con ella. El precio de las maderas valiosas utilizadas en forestaciones bajo cubierta es diez veces superior al de las especies exóticas usadas tradicionalmente en forestaciones a cielo abierto, como Eucalyptus y Pinus. En la provincia de Misiones las experiencias de enriquecimiento de bosques degradados datan de la década de los 1960 (Montagnini et al., 2006), donde una de las especies más plantadas fue C. fissilis. El Instituto Nacional de Tecnología Agropecuaria (INTA) llevó a cabo un proyecto de domesticación para promover el cultivo y la conservación de las especies de Cedrela que crecen en las selvas subtropicales argentinas. Los ataques de la plaga clave, Hypsipylla grandella, siguen representando el mayor riesgo y continúan siendo una limitante para las plantaciones de cedro en la provincia de Misiones. Entre las alternativas para disminuir los daños por el ataque de esta plaga que mencionan los antecedentes disponibles, se encuentran estrategias con diseños de plantación y densidades adecuadas, utilizando la cobertura del bosque como dosel protector de heladas y de los ataques del insecto, además de plantaciones mixtas con especies definidas (Cristobal et al., 2016). Según los mapas de ordenamiento de bosques realizados en las regiones de selvas por las respectivas provincias, actualmente en el NOA (Salta, Jujuy y Tucumán) y Misiones, existen alrededor de un millón y medio de hectáreas con buena aptitud para el enriquecimiento con especies de maderas nobles en zonas amarillas (Fornes, 2012).
La producción de especies forestales en contenedor tiene como objetivo obtener plantas grandes y vigorosas en una sola estación, tomando como criterios el tamaño del tallo y el follaje. Sin embargo, es de mayor importancia el sistema radical, el cual proporciona soporte y es fundamental en la obtención de los nutrientes y el agua (Rodríguez et al., 2008). Se sabe que algunas bacterias son capaces de estimular el crecimiento de las plantas, las cuales se denominan PGPR por sus siglas en inglés (plant growth promoting rhizobacteria) (Kloepper y Schroth, 1978). Las PGPR se interrelacionan con la planta huésped a través de mecanismos de promoción directa del crecimiento, tales como la disponibilidad de nutrientes y la producción de compuestos reguladores de crecimiento vegetal (fitohormonas y compuestos para minimizar el estrés); y mecanismos de promoción indirecta, que engloban procesos de protección de la planta contra patógenos (biocontrol y resistencia sistémica inducida), estimulación en la formación de micorrizas y remoción de sustancias fitotóxicas del suelo (Lugtenberg y Kamilova, 2009; Moreno Reséndez et al., 2018). En la mayoría de los casos, el efecto de las PGPR sobre una planta huésped puede no estar asociado a un único mecanismo de acción, sino a una combinación de ellos (El-Tarabily et al., 2010). Las PGPR representan alrededor del 2 al 5 % de las bacterias rizosféricas (Jha y Saraf, 2015) y se han reportado muchos géneros con capacidad de mejorar el crecimiento de las plantas a través de uno o más mecanismos. Destacandose Agrobacterium, Arthrobacter, Azospirillum, Azotobacter, Bacillus, Burkholderia, Caulobacter, Chromobacterium, Enterobacter, Erwinia, Flavobacterium, Klebsiella, Micrococcus, Pantoea, Pseudomonas, Rhizobium y Serratia (Ahemad y Kibret, 2013).
Pseudomonas fluorescens tiene varias características de una PGPR efectiva y puede funcionar como estimuladora del crecimiento de las plantas, ya que promueve eficientemente la germinación de las semillas, acelera el crecimiento en las primeras etapas, induce el inicio de la raíz, estimula la formación de raíces y pelos radiculares, facilita la regeneración de las raíces y ayuda a controlar patógenos en ciertas especies forestales (Dominguez Nuñez et al., 2015). Bacillus spp. ha sido reportado como inhibidor del crecimiento de una serie de patógenos vegetales a través de antagonismo y se lo considera un agente potencial de biocontrol, debido a su alta capacidad de producción de esporas y su resistencia y capacidad para sobrevivir a la desecación, al calor, a la irradiación ultravioleta y a los disolventes orgánicos (Romero et al., 2007). Actualmente especies del género Bacillus, tales como B. subtilis, B. pumilus, B. amyloliquefaciens y B. licheniformis, son ampliamente estudiadas para atenuar la incidencia de enfermedades de importancia agrícola (Raaijmakers y Mazzola, 2012). Entre los principales mecanismos de biocontrol de estas bacterias se incluyen la excreción de antibióticos, sideróforos, enzimas líticas y toxinas y la inducción de resistencia sistémica en la planta (Layton et al., 2011; Tejera- Hernández et al., 2011).
Si bien se conocen algunos trabajos de inoculación en otras especies del género Cedrela, como la de Rhizophagus intraradices y Azospirillum brasilense en Cedrela odorata (Aguirre Medina, 2014), además de conocerse acerca de la respuesta de Cedrela odorata L. a diversos inoculantes micorrízicos procedentes de dos ecosistemas tropicales (Méndez Cortés et al., 2013), o acerca de la inoculación de plantines de Cedrela fissilis con endomicorrizas del género Glomus, Azospirillum sp., o una mezcla de ambos, con una solución de rizósfera de cedros nativos (Fornes et al., 2015), no se conoce el efecto de Bacillus amyloliquefaciens y Pseudomonas fluorescens en el desarrollo de plantines de cedro misionero.
En base a lo expuesto, el objetivo de este trabajo fue determinar la respuesta de C. fissilis a la inoculación con dos rizobacterias promotoras del crecimiento vegetal en condiciones de vivero.
Materiales y métodos
El ensayo se desarrolló en el vivero forestal de la Cátedra de Silvicultura y en el laboratorio de la Cátedra de Microbiología Agrícola de la Facultad de Agronomía y Zootecnia de la Universidad Nacional de Tucumán, ubicados en Finca El Manantial.
Se emplearon semillas de cedro misionero (Cedrela fissilis) que fueron cosechadas de árboles destacados de una plantación comercial establecida en la localidad de El Naranjo, Departamento Burruyacu, provincia de Tucumán. Las semillas se sembraron en macetas plásticas de 1 L de capacidad. Se empleó sustrato convencional compuesto por una mezcla de tierra (70 %) con mantillo (30 %). A la mezcla de sustratos se agregó fertilizante de liberación lenta, compuesto por macro y micronutrientes de la marca comercial Plantacote Plus, con una dosis de 4 g/L de sustrato. La siembra se realizó directamente en el contenedor. Los plantines se dispusieron en canteros bajo sombra de malla del 60 %.
A los 25 días de la siembra, se realizó la inoculación con las suspensiones de dos bacterias capaces de promover el crecimiento vegetal en cultivos como tabaco y pimiento (Buono y Ulla, 2016) y garbanzo (Aldonate et al., 2019). Los inóculos se prepararon a partir de cultivos crecidos hasta fase estacionaria en medio TSA (Tripteína Soja Agar), se lavaron, centrifugaron y resuspendieron en agua destilada estéril hasta obtener un título de 108 UFC/ml. Cada planta recibió un volumen de 10 ml de inóculo en la maceta. El ensayo se dispuso usando un diseño completamente aleatorizado, con 10 repeticiones por cada tratamiento. Los tratamientos fueron T0: control inoculado con agua destilada; T1: plantas inoculadas con Bacillus amyloliquefaciens; y T2: plantas inoculadas con Pseudomonas fluorescens. A los cinco meses de la inoculación, se analizaron las siguientes variables: diámetro de cuello medido con calibre metálico de acero inoxidable con escala en milímetros, con precisión de 0,02 mm; altura de parte aérea medida en cm desde la base del tallo; peso seco de parte aérea y peso seco de raíz por secado en estufa a 65 °C hasta peso constante.
Para la interpretación de los resultados se realizó un análisis de la varianza, seguido de la prueba LSD de Fisher, a fin de determinar diferencias entre medias para los distintos tratamientos. Se trabajó con el paquete estadístico Infostat (Di Rienzo et al., 2011), con un nivel de significación del 5 %.
Resultados y discusión
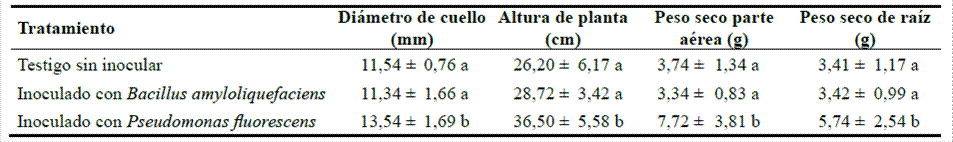
A partir de las mediciones (diámetro del cuello y altura total) y determinaciones (peso seco de copa y raíces) realizadas a todos los plantines de la muestra, se obtuvieron los valores medios para cada tratamiento (Tabla 1).
El análisis estadístico mostró diferencias significativas en las cuatro variables que se evaluaron en los individuos inoculados con Pseudomonas fluorescens, con respecto a los tratados con Bacillus amyloliquefaciens y al testigo (Figura 1). Las diferencias más marcadas se apreciaron en la variable peso seco de la copa, donde los valores medios del tratamiento con Pseudomonas fluorescens duplicaron al resto (Figura 2). Entre los restantes tratamientos (Bacillus amyloliquefaciens versus testigo), no existeron diferencias significativas.
El efecto benéfico de la inoculación con PGPR ha sido demostrado en varias especies. La acción de los fijadores de nitrógeno en P. patula ha sido reportada por varios investigadores en otras coníferas (Orozco Jaramillo y Martínez Nieto, 2009). Por su parte, al evaluar el efecto de la inoculación de los biopreparados de Pseudomonas fluorecens, Pseudomonas putida y Bacillus licheniformis sobre la biomasa de la raíz y la biomasa del follaje en Anacardium excelsum,Barreto et al. (2007) determinaron que el mejor tratamiento se evidenció utilizando la bacteria Pseudomonas putida y Pseudomonas fluorescens, respectivamente. No obstante, no se encontraron referencias relacionadas con los efectos de PGPR en Cedrela fissilis.
Cedrela fissilis es una de las especies recomendadas para cultivos en sistemas de enriquecimiento en la provincia de Misiones (Mangieri, 1965; Cozzo, 1969; Maiocco et al., 2009). En el noroeste argentino (NOA), más del 90 % de las plantaciones de cedro fueron realizadas en el marco de tratamientos de enriquecimiento del bosque nativo. En Tucumán, Cedrela fissilis ha demostrado una buena adaptación y crecimiento en diferentes ambientes (González Morenghi, 2006; Fornes et al., 2015), siendo una de las especies más cultivadas de este género. Esta modalidad de plantación implica cultivar dentro de un bosque degradado, que aún presenta cobertura arbórea, arbustiva y/o herbácea. Al destinar estos plantines a este tipo de plantación, bajo el dosel del bosque, debe asegurarse la supervivencia de los mismos, ya que ahí tendrán que competir con la vegetación nativa por agua, nutrientes y luz. Para ello, los plantines de cedro deben llegar al campo con un óptimo estado sanitario, una buena masa radicular y una parte aérea bien desarrollada. La competencia con la vegetación nativa preexistente (especialmente especies trepadoras) obligará a las plantas introducidas a optimizar los recursos disponibles.
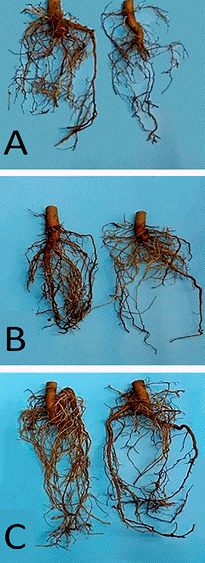
Figura 1 Desarrollo de raíces en plantas tipo de cada tratamiento. (A) Testigo; (B) B. amyloliquefaciens; (C) P. fluoerscens.
Para fortalecer al plantín de Cedrela fissilis, puede recurrirse a su inoculación con bacterias, tales como Pseudomonas fluorescens, dada la estimulación del crecimiento vegetal que se observa con su aplicación. Esto demuestra el potencial que tienen estos microorganismos como promotores del crecimiento de esta especie forestal vegetal, además de sugerir que es posible su uso como biofertilizantes.
Tabla 1. Diámetro de cuello (media ± error estándar), altura de planta (media ± error estándar) y peso seco de parte aérea y raíces (media ± error estándar) de plantines de cedro (Cedrela fissilis), a los 150 días del tratamiento con bacterias promotoras del crecimiento vegetal.
Letras distintas dentro de cada columna indican diferencias significativas (test de LSD de Fisher, p < 0,05)