Introducción
En diciembre de 2019 un nuevo virus, posteriormente denominado síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV-2), fue identificado como el responsable de la enfermedad por coronavirus 2019 (COVID-19). Afecta en forma diferente a la población pediátrica y adulta, y su expresión clínica suele ser más leve en niños.1,2 Una revisión sistemática informó que los síntomas más comunes en niños son la fiebre, tos, faringitis, rinorrea y manifestaciones gastrointestinales.3 Los casos de enfermedad grave parecen estar relacionados con una respuesta inflamatoria inmunomediada.2,4
Se ha reportado una estrecha vinculación entre el virus SARS-CoV-2 y las complicaciones neurológicas que afectan al sistema nervioso central. Asimismo, se lo vincula a manifestaciones en el sistema nervioso periférico, como el síndrome de Guillain-Barré (SGB). El término “neuro-COVID” se utiliza para describir estas complicaciones.1,2,3,4,5,6
El SGB es una polineuropatía inmunomediada, desencadenada principalmente por infecciones respiratorias o gastrointestinales, que pueden darse hasta 4 semanas previo al inicio de la enfermedad. Se caracteriza por una parálisis flácida, arrefléxica y aguda. La recuperación es tan rápida como ocurra la remielinización. Si la degeneración axonal es importante, la recuperación es más lenta y existe mayor grado de daño residual.7,8,9
Hasta el momento, la evidencia científica publicada informó 6 reportes de casos asociando SGB con infección por SARS-CoV-2 en pediatría.10,11,12,13,14,15
El objetivo de este trabajo es describir la evolución y tratamiento kinésico implementado en un niño con SGB asociado a infección por SARS-CoV-2, con afectación de músculos respiratorios, durante su internación en una unidad de cuidados intensivos pediátricos (UCIP).
Presentación del caso
Niño de 2 años de edad, previamente sano, que el día 23 de abril de 2021 ingresó a la UCIP del Hospital Pediátrico de Malvinas Argentinas, derivado de otro hospital, con diagnóstico presuntivo de SGB. Presentaba un hisopado negativo para SARS-CoV-2.
El cuadro había comenzado el 11 de abril con disminución progresiva de la fuerza muscular, evolucionando desfavorablemente con parálisis flácida generalizada asociada a dificultad respiratoria. Por deterioro del cuadro, el 14 de abril se procedió a intubación orotraqueal (IOT) y asistencia ventilatoria mecánica (AVM). Se realizó una tomografía axial computada, informada como normal. Por sospecha de SGB, comenzó tratamiento con inmunogammaglobulina y pulsos de corticoides. Fue derivado a nuestro hospital por requerimiento de mayor complejidad.
Al ingreso a la UCIP, el niño presentaba apertura ocular espontánea y se encontraba conectado con el medio. Se verificó parálisis flácida generalizada y valoración de la fuerza muscular con puntuación en la escala Medical Research Council (MRC) de 0/5 para miembros superiores (MS) y miembros inferiores (MI), reflejos osteotendinosos abolidos, reflejos cremasteriano y musculocutáneo ausentes.16) Se encontraba conectado a AVM y alimentado por sonda nasogástrica.
El 26 de abril se realizó resonancia magnética nuclear cerebral y de columna. Se observó hiperintensidad de la sustancia blanca subcortical occipital, por falta de mielinización completa, acorde a la edad. El 27 de abril se realizó electromiografía, con hallazgos compatibles con SGB, con características predominantes de daño axonal. Recibió nuevamente pasaje de inmunogammaglobulina y posteriormente metilprednisolona por 5 días. Al séptimo día posterior al pasaje de inmunogammaglobulina, se observaron movimientos proximales en ambas cinturas escapulares (MRC 2/5).
En una anamnesis posterior, los padres refirieron que el niño había estado al cuidado de familiares con infección por SARS-CoV-2. Por tal motivo, al día siguiente se realizó serología, la cual reveló anticuerpos IGG e IGM positivos para SARS-CoV-2. Además, se realizó muestra de secreciones nasofaríngeas, que revelaron la presencia de adenovirus en el panel viral. Posteriormente, se realizó estudio de anticuerpos antigangliósidos, que reveló GT1a y GQ1b positivo, característico del síndrome de Miller-Fisher, variante poco frecuente de SGB. En este caso no se pudo constatar en el inicio de la enfermedad la tríada clínica que caracteriza a este síndrome (oftalmoparesia, hipo-arreflexia y ataxia), dado que el niño se encontraba en otra institución, y los datos no fueron informados en la epicrisis.17,18
Plan de tratamiento
El paciente fue atendido diariamente por el equipo de guardia de kinesiología de la UCIP, que consiste en un kinesiólogo/a permanente exclusivo del servicio los 7 días de la semana, de 8 a 20 horas.
Como objetivo general de tratamiento se planteó lograr la supervivencia del paciente evitando las complicaciones derivadas de la parálisis consiguiendo el mayor grado de recuperación funcional esperado para la edad y la evolución de la enfermedad.
Se tomó como guía el bundle o conjunto de medidas ABCDEFGH para definir los objetivos específicos. Los componentes incluidos fueron: evaluación, prevención y manejo del dolor; despertar y pruebas de respiración espontánea; elección de sedación/analgesia; evaluación, prevención y tratamiento del delirio; movilidad y ejercicio tempranos; participación y empoderamiento de la familia; nutrición y humanización.19,20,21,22
La línea de tiempo esquematiza los sucesos más relevantes durante la internación (Figura).
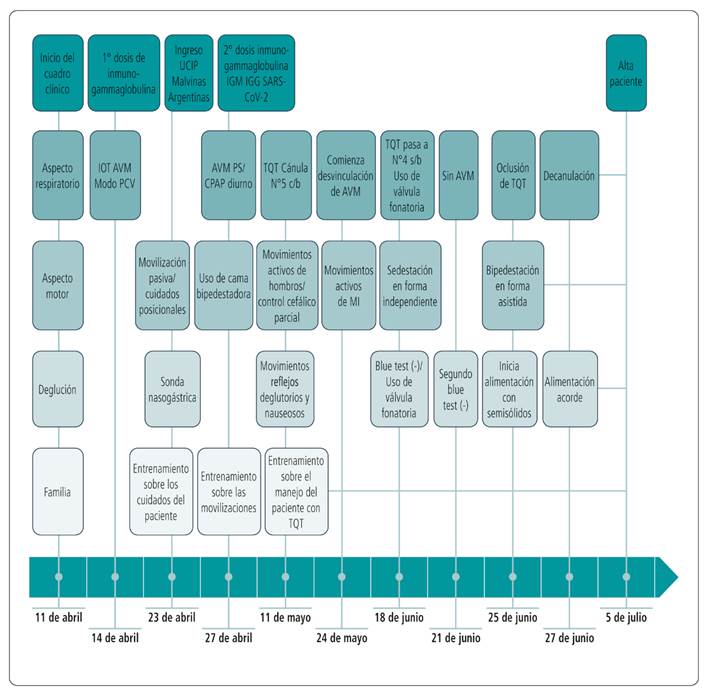
IOT: intubación orotraqueal; AVM: asistencia ventilatoria mecánica;PCV: ventilación controlada por presión; UCIP: unidad de cuidados intensivos pediátricos; PS/CPAP: presión soporte/presión positiva continua en la vía aérea; TQT: traqueostomía; c/b: con balón; MI: miembros inferiores; s/b: sin balón.
Figura. Linea de tiempo.
En la Tabla se puede observar la evaluación kinésica a los 15 días, 45 días, 60 días y 80 días de tratamiento.
Aspecto respiratorio
Al ingreso, el niño se encontraba en AVM, modalidad controlada por presión. Permaneció con un nivel 0/1 de la escala de sedación-agitación de Richmond (RASS).23 Se implementó la escala para valoración del dolor en cuidados críticos Critical Care Pain Observation Tool (CPOT), obteniendo un valor de 0.23 Se observó únicamente activación de músculos inspiratorios accesorios (escalenos e intercostales externos). La ecografía diafragmática realizada el 26 de abril reveló hipokinesia diafragmática bilateral con excursión del diafragma derecho de 5 mm e izquierdo de 8 mm. El 27 de abril, debido al estado de alerta y al drive central conservado, se decidió valorar tolerancia en modalidad espontánea diurna, con buena respuesta. Inicialmente, el niño requirió presiones más elevadas para sostener un volumen corriente ideal. Estas presiones se fueron descendiendo progresivamente con la mejoría en la clínica. Debido a su debilidad muscular generalizada, a los 28 días de AVM se realizó traqueostomía (TQT) y se colocó cánula n.° 5 con balón.24 Los padres fueron entrenados en el manejo de la TQT. Luego de alcanzar las 24 horas en modalidad espontánea (presión soporte/CPAP), el 24 de mayo, acompañado de la aparición de valores musculares de tronco y MS, comenzó con la desvinculación de la presión positiva, realizando desconexiones progresivas a aire ambiente. El 31 de mayo se repitió ecografía diafragmática que informó excursión del diafragma derecho de 7 mm y 9 mm el izquierdo. El 15 de junio pasó a cánula N° 4 sin balón para aumentar el flujo pericánula y favorecer su pasaje hacia vía aérea superior, estimulando la musculatura laríngea y faríngea.25,26 Días más tarde comenzó el uso progresivo de válvula fonatoria durante las desconexiones. El 21 de junio logró permanecer 24 horas sin AVM. A los 56 días de entrenamiento consiguió la desvinculación completa. Luego de 7 días se realizó decanulación electiva. Requirió en total 68 días de AVM.
Evolución del cuadro motor
Recibió tratamiento kinésico motor desde su llegada. El mismo consistió en movilizaciones pasivas, cuidados posicionales, y bipedestación progresiva con camilla bipedestadora, la cual comenzó a utilizar a los 7 días de su ingreso, con una angulación inicial de 45°, durante períodos de 30 minutos, evaluando tolerancia según registros de tensión arterial y confort.
Se entrenó a los padres en el proceso de rehabilitación a través de las movilizaciones y cuidados posicionales. Una semana posterior a la aplicación de la segunda dosis de inmunoglobulina, a un mes de iniciado el cuadro, se observaron valores musculares a nivel proximal, que permitieron el control cefálico parcial y cierta actividad en músculos elevadores de hombros, que posibilitaron la sedestación asistida y la activación de grupos musculares de MS en actividades lúdicas. Asimismo, 20 días después de la segunda dosis de inmunoglobulina, aparecieron valores musculares en MI, siguiendo el mismo patrón de evolución de proximal a distal (Tabla).
Tabla. Evaluación y reevaluación kinésica
| Evaluación | Evaluación/ escala | 15 días de evolución de la enfermedad | 45 días de evolución de la enfermedad | 60 días de evolución de la enfermedad | 80 días de evolución de la enfermedad |
|---|---|---|---|---|---|
| Estado de conciencia | RASS | 0-1 | 0 | 0 | 0 |
| Dolor | CPOT/FLACC | 0 | 0 | 0 | 0 |
| Respiratorio | Pimáx Pemáx | -4 cmH2O | -25 cmH2O | -30 cmH2O | Vía aérea natural, sin posibilidad de ser evaluada por la edad del niño |
| 5 cmH2O | 15 cmH2O | 20 cmH2O | |||
| TET | TQT | TQT | |||
| Deglución | Blue dye test | Negativo (1°) | |||
| Negativo (2º) | |||||
| Negativo (3º) | |||||
| Motor | MRC | MS: 0/5 | Ab de hombros 2/5 | Ab de hombros 4/5 | Ab de hombros 4/5 |
| Flex codo 0/5 | Flex codo 2/5 | Flex codo 3/5 | |||
| Ext muñeca 0/5 | Ext muñeca 0/5 | Ext muñeca 0/5 | |||
| MI: 0/5 | Flex cadera 0/5 | Flex cadera 2/5 | Flex cadera 4/5 | ||
| Ext de rodilla 0/5 | Ext de rodilla 0/5 | Ext de rodilla 2/5 | |||
| Dorsiflexión tobillo 0/5 | Dorsiflexión tobillo 0/5 | Dorsiflexión tobillo 0/5 | |||
| Control cefálico | No logra | Parcial | Normal | Normal | |
| Sedestación | No logra | Asistida | Asistida | Normal | |
| Bipedestación sin equipamiento | No logra | No logra | No logra | Asistida | |
| Alta: escala de estado funcional FSS= 8 | |||||
RASS: escala de sedación-agitación de Richmond; CPOT: Critical Care Pain Observation Tool; FLACC: escala de dolor Face, Leg, Activity, Cry, Consolability; Pimáx: presión inspiratoria máxima; Pemáx: presión espiratoria máxima; TET: tubo endotraqueal; TQT: traqueostomía; MRC: Medical Research Council; MS: miembros superiores; Ab: abducción; Flex: flexión; Ext: extensión; MI: miembros inferiores; FSS: Functional State Scale.
Al alta hospitalaria, el niño lograba sedestación independiente y bipedestación sin equipamiento con apoyo anterior. Persistía debilidad distal de MS y MI, evaluada en forma analítica con la escala MRC.16 A nivel funcional se observaba dificultad para realizar movimientos de prensión y al intentar realizar un paso, no lograba aún flexión dorsal de tobillos con caída de antepie.
Deglución y fonación
Con estimulación orolinguofacial, el niño logró realizar sello labial y tragar la saliva. Se favorecieron las praxias linguales para mejorar la amplitud de movimiento y la fuerza para manejar el bolo alimenticio.
Luego del pasaje a una cánula de TQT n.° 4 sin balón, el 15 de junio, se utilizaron las ventajas de la ventilación a fuga, y en la última etapa de la desvinculación de la AVM, comenzó con el uso de válvula fonatoria.24
Se verificó que el niño presentara una función motora orofacial adecuada y las fases de la deglución se encontraran respetadas.25 Se complementó la evaluación con dos pruebas de azul Blue Dye Test (BDT), las cuales fueron negativas. Una tercera prueba con alimento semisólido (yogurt teñido) también arrojó un resultado negativo.27 Comenzó con alimentación oral progresiva y supervisada a partir del 25 de junio (Figura).
Asimismo, se valoró la eficacia de la protección de la vía aérea al momento de la decanulación (Tabla).
En la última etapa de su internación, el niño se alimentaba por vía oral con dieta acorde a la edad y se comunicaba en forma verbal con lenguaje apropiado.
Evaluación funcional
Al alta, se verificó valoración de la escala de estado funcional Functional State Scale (FSS) con una puntuación de 8.28) Esta escala evalúa el estado funcional general de los pacientes pediátricos al alta de UCIP, y se compone de 6 dominios: estado mental, función sensorial, comunicación, función motora, alimentación y función respiratoria. El estado funcional para cada dominio se clasifica de normal (1) a disfunción grave (5). La puntuación de la escala oscila entre 6 y 30. Los puntajes de la FSS se clasifican: 6-7 normales; 8-9 disfunción leve; 10-15 disfunción moderada; 16-21 disfunción severa; y más de 21, disfunción muy severa. (28,29,30 Dado que el paciente era sano previamente, su puntuación al ingreso fue de 6 puntos, ya que se valora el estado funcional previo a la enfermedad actual.
Discusión
Se expuso la evolución y tratamiento de un niño con diagnóstico de SGB asociado a infección por SARS-CoV-2. En el desarrollo de la enfermedad, no presentó antecedentes de infecciones respiratorias o gastrointestinales previas que pudieran haber desencadenado el SGB. El hallazgo de adenovirus en el panel viral aparenta no ser significativo por falta de sintomatología y por ser un virus que no se asocia a SGB en la literatura.7,8,9
Tanto en este caso como en los demás reportes de SGB pediátricos asociado a SARS-CoV-2 publicados, la enfermedad afectó al sistema respiratorio en forma indirecta por debilidad neuromuscular (falla de bomba) y no por lesión del tejido pulmonar.
De los 7 casos, incluido el nuestro, 3 requirieron IOT.10,11,12,13,14,15 Uno de ellos, se manifestó en un niño de 8 años como neuropatía axonal sensitiva motora aguda, con debilidad ascendente progresiva y arreflexia, requiriendo IOT por debilidad generalizada y mal manejo de las secreciones.10 El mismo cursó 4 días con AVM y evolucionó favorablemente (no especifica su cuadro motor al alta). El otro caso refiere a un niño de 6 años, con un cuadro de debilidad progresiva simétrica de rápida progresión, que afectó a músculos respiratorios, con la variante de neuropatía axonal motora aguda. De tórpida evolución, requirió TQT y 60 días de internación. Al momento del alta continuaba con requerimiento de AVM, con valores musculares de MS y MI de MRC 2/5.16
En nuestro caso, dada la severidad del cuadro clínico con afección multisistémica, especialmente el sistema respiratorio que requirió soporte vital, se originó una estadía prolongada con mayor riesgo de morbilidad. Fue necesario abordar al paciente en forma integrada. La estrategia utilizada fue la rehabilitación temprana en el contexto de área crítica. Esta estrategia, acompañada de un conjunto de medidas basadas en la evidencia del Bundle ABCDEFGH, tiende a disminuir las enfermedades adquiridas en UCIP y la duración de la estadía.19,20,21,22,23 Los datos disponibles acerca de la movilización temprana en UCIP indican que son actividades seguras y factibles para el niño críticamente enfermo y que pueden tener beneficios a corto y largo plazo.28,29,30
El paciente presentó al alta una puntuación de 8 en la escala FSS, 2 puntos por encima del valor normal (FSS normal = 6), que correspondían a un déficit en el aspecto motor, y egresó de la UCIP con una morbilidad en proceso.
Las enfermedades neurológicas asociadas con el SARS-CoV-2 en los niños están en desarrollo y existe escasez de información sobre las implicancias a largo plazo.3,5 Sería de relevancia considerar el seguimiento de los niños afectados.
Conclusión
Se describe la evolución de un paciente con SGB asociado a infección por SARS-CoV-2, con afectación motora severa, requerimiento de AVM y TQT. Fue dado de alta alcanzando la desvinculación del soporte ventilatorio, decanulación, alimentación oral y persistencia de déficit motor distal en los 4 miembros.














