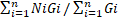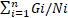1. INTRODUCCIÓN
Pterogyne nitens (tipa colorada, viraró) perteneciente a la familia Fabaceae, es nativa de bosques chaqueños de Argentina, en las provincias de Salta, Jujuy, Chaco, Formosa, Corrientes hasta Misiones. Habita en la selva pedemontana de 400-800 msnm y en los bosques ribereños y madrejones del bosque chaqueño (Legname, 1982). Se encuentra en un estado de conservación “casi amenazado” según UICN (Unión Internacional para la Conservación de la Naturaleza), (APN-SIB, 2010). En Brasil es considerada en riesgo de extinción y se recomienda su conservación genética (Nassif y Perez, 2000; Nascimento et al., 2006).
Esta especie además de ser utilizada como ornamental por la belleza de sus inflorescencias exuberantes, produce madera apta para la fabricación de muebles de estilo (Dimitri et al., 2000), herramientas como arados, bateas, mangos de hachas y utensilios de cocina (Moraes et al., 2006). Como producto forestal no maderero se incluye como fuente de extracción de tanino, tintas y alimentos. Como medicinal, se destaca su empleo como expectorante, antigripal y para combatir la presencia de parásitos, el dolor de hígado y estómago (Regasini et al., 2008).
En plantaciones, P. nitens prefiere suelos fértiles, con buen drenaje y textura arcillosa; y soporta una estación seca de hasta seis meses (Carvalho, 1994). Es apta para ser utilizada en planes de forestación, reforestación o enriquecimiento de los bosques naturales del noroeste argentino, que han sufrido intensas explotaciones (Del Castillo et al., 1997; Dimitri et al., 2000). Según Carvalho et al. (1980) el éxito de la reforestación depende principalmente de la calidad de las plántulas; por ello cuando la especie se propaga a partir de semillas como el caso de P. nitens, es necesario que la emergencia sea rápida y pareja, para lograr homogeneidad en el material producido (Tapia et al., 2014).
La calidad de semilla está definida por cuatro propiedades que restringen la capacidad de dar origen a una planta de alta productividad y están vinculadas a atributos físicos, fisiológicos, genéticos y sanitarios- (Popinigis, 1972). Los caracteres fisiológicos, que en este análisis son los de mayor importancia, están relacionados por la capacidad de las semillas para germinar y crecer con buen vigor. La germinación en laboratorio se define como la emergencia y desarrollo de una plántula hasta una etapa donde el aspecto de sus estructuras esenciales indica la posibilidad de que se desarrolle una planta normal bajo condiciones favorables en el campo (ISTA, 2014).
Los factores ambientales, como la luz y temperatura, son reguladores primarios que afectan el proceso de germinación. La temperatura determina directamente la velocidad de las reacciones bioquímicas que participan en el proceso, afecta la tasa y la capacidad de germinación, y cuando la temperatura es desfavorable promueve la latencia primaria o secundaria (Bewley y Black, 1994). Por lo tanto, estudios de germinación de las semillas y establecimiento de las plántulas de especies forestales son fundamentales para mejorar las técnicas que permiten el manejo adecuado, ya sea en un ambiente natural o en bosques implantados (Nassif y De Andrade, 1997; Jordano et al., 2002).
El objetivo del presente fue determinar el efecto de la temperatura de incubación en la germinación de semillas de P. nitens.
2. MATERIALES Y MÉTODOS
Se recolectaron frutos maduros de 12 árboles adultos de P. nitens seleccionados al azar del arbolado urbano de la ciudad de Bella Vista, ubicada al oeste de la provincia de Corrientes, Argentina (sobre las costas del Río Paraná y a 143 kilómetros de la ciudad Capital). Los individuos seleccionados cuentan con una altura de 15 m en promedio. Los frutos se conservaron a temperatura de heladera (8±2°C) en bolsas de papel previamente identificadas. Las semillas se extrajeron manualmente de los frutos antes de los ensayos y se dejaron extendidas en bandejas durante 10 días en el laboratorio, para garantizar su secado total (contenido de humedad aproximado 10-12 % según lo propuesto por Morandini et al., 2013). Los ensayos de germinación se realizaron en el Laboratorio de Biotecnología Aplicada y Genómica Funcional de la Facultad de Ciencias Agrarias - Universidad Nacional del Nordeste-IBONE-CONICET.
2.1 Determinación de viabilidad de las semillas
Se realizó la prueba topográfica por tetrazolio para evaluar viabilidad del lote de semillas. Se trabajó con 4 repeticiones de 25 semillas que se acondicionaron realizando una imbibición durante 48 h. Para realizar la tinción, se utilizaron frascos de vidrio de 100 ml con tapa hermética donde se colocaron las semillas totalmente sumergidas en la solución de tetrazolio. Se incubaron en estufa a 28 °C y en oscuridad durante 24 h. Una vez concluida la tinción, las semillas se enjuagaron con abundante agua corriente y se realizaron las observaciones sobre cada semilla individualmente. Los resultados se expresaron en porcentaje (%) de semillas viables (semillas mayormente teñidas) y semillas no viables (embrión sin tinción), utilizando para determinar el área de tinción, el editor de imágenes ImageJ (Rasband, 2016).
Para la descripción de las clases de viabilidad en el test de tetrazolio se utilizó el patrón propuesto por Fogaça et al. (2006) (Tabla 1).
Tabla 1. Patrón de clasificación de viabilidad de las semillas mediante el test de tetrazolio (tomado de Fogaça et al. 2006)

La precisión de la estimación se determinó mediante una matriz de confusión que es una forma de verificar la exactitud del método utilizado; la coincidencia hace referencia al porcentaje de semillas que fue correctamente asignada a las diferentes categorías (semillas viables y no viables).
2.2 Tratamiento pre-germinativo y condiciones de incubación
Las semillas fueron sometidas al protocolo propuesto por Tapia et al. (2014) fundamentado en una escarificación física (cubriendo la semilla con agua inicialmente a 80 °C, hasta alcanzar temperatura ambiente, completando luego 24 h en inmersión); ya que como la mayoría de las semillas de las especies de Fabaceae, ésta posee testa dura y presenta dormición física (Baskin y Baskin, 2001; Colombo-Speroni y de Viana, 2002). Las semillas fueron colocadas en placas de Petri sobre dos láminas de papel de filtro humedecido con agua destilada (Nascimento et al., 2006).
Los germinadores fueron cubiertos con papel film para reducir la pérdida de humedad e incubados a diferentes temperaturas: T1: 8±2 °C con condiciones de luz de 17 Lux (heladera), T2: 27±2 °C y 3.728 Lux (cámara climatizada), ambos con un fotoperiodo de 14 h.; T3: temperatura ambiente registrada diariamente en condiciones de invernadero; en promedio 29±2,5 ºC) y T4: T1 por 21 días (estratificación en frio-8±2 °C) y luego T2 (27±2 °C) por 21 días. En cada ensayo se utilizaron cuatro réplicas de 25 semillas cada una.
2.3 Parámetros evaluados
Se consideró como germinada a la semilla con emergencia de una radícula que superara los 2 mm de largo (Soto Gonzales y Valiengo Valeri, 2011; Perissé et al., 2011; Ruiz y Terenti, 2012). El recuento de la germinación se realizó cada 3 días, hasta haber completado los 21 días; humedeciendo el sustrato (papel absorbente) cuando fue necesario. Las variables evaluadas, fueron porcentaje de germinación y numero de semillas germinadas en diferentes fechas de conteo para confeccionar la curva de germinación acumulada; además se evaluaron los siguientes indicadores indirectos de vigor: la Energía Germinativa (EG), Período de energía (PE), Velocidad de germinación (VG) e Índice de velocidad de germinación (IVG), entendiéndose por dichos indicadores a:
Energía Germinativa (EG): Porcentaje de germinación acumulado diario, obtenido al momento en que la tasa de germinación alcanza su valor máximo (González et al., 2008).
Periodo de Energía (PE): Cantidad de días requeridos para alcanzar la máxima tasa de germinación (González et al., 2008).
Velocidad de Germinación (VG): Nakagawa (1999). Se calculó mediante la Ecuación 1.
Donde: N1, N2,…, Nn: representan el número de días desde la iniciación del ensayo de germinación, G1, G2,…, Gi: representan el número semillas germinadas en el día i-ésimo. Se observa que el valor G es una media aritmética de los Ni (días necesarios para la germinación) ponderada por los Gi y por ello las unidades que corresponden a esta velocidad son días.
Índice de Velocidad de Germinación (IVG) (Maguire, 1962; Villagra, 1997; Nakagawa, 1999). Se calculó mediante la Ecuación 2.
Donde: Ni y Gi tienen el mismo significado que en la fórmula anterior.
2.4 Análisis estadístico
Se utilizó análisis de varianza y pruebas de comparaciones múltiples de Tukey con un nivel de significación α del 5 % para detectar diferencias entre los promedios del número de semillas germinadas, EG, PE, VG e IVG, mediante el uso de Infostat (Di Rienzo et al., 2016). Las pruebas de Shapiro Wilks y de Levene se utilizaron para comprobar el cumplimiento de los supuestos, de normalidad y homogeneidad de varianzas. Cuando dichos supuestos no se cumplieron, se empleó la prueba no paramétrica de Kruskal-Wallis (Kuehl, 2001).
3. RESULTADOS Y DISCUSIÓN
Con el test de tetrazolio se identificó un 41,67±23,84 % de semillas viables en promedio (Tabla 2). En ocasiones se recomienda este test como buen predictor de la germinación, tanto para semillas de Quercus como de otras especies forestales; aunque presenta algunos inconvenientes (Bonner, 1984; ISTA, 2014; Moreno-Álvarez et al., 2001). Posiblemente la mayor dificultad es encontrar un protocolo adaptado a cada especie, de forma que las tinciones sean lo suficientemente homogéneas para asegurar una buena interpretación de los resultados. Los mismos, pueden verse afectados por la cantidad de lípidos, tiempo de tinción, condiciones de temperatura en las que se lleva a cabo la reacción, o incluso experiencia del analizador en dicha especie y en el método (Benito-Matías et al., 2004). Si bien esta prueba ha sido utilizada en numerosas especies forestales como ser Bombacopsis quinata y Tabebuia rosea (Cordero, 1994); Enterolobium cyclocarpum, Gliricida sepium y Delonix regia (Pivaral Leiva, 1999), Pinus pinea (Benito-Matías, 2004); Schinopsis balansae (Alzugaray et al., 2005); Aspidosperma quebracho-blanco (Alzugaray et al., 2006); Rubia fruticosa (Marrero et al., 2007); Maytenus vitis-idaea (Bueno et al., 2009); Cedrela fissilis (Barone et al., 2016) entre otras, para la especie en estudio no existen antecedentes acerca del uso de este test de viabilidad; no así para el test de conductividad eléctrica masal, que ha sido ajustado para la misma por varios autores (Ataíde et al., 2012; Guollo et al., 2017).
Tabla 2. Determinación de viabilidad promedio de las semillas de P. nitens mediante la prueba topográfica de tetrazolio; clasificadas según el patrón propuesto por Fogaça et al., (2006)

En la Tabla 3 se presenta la evaluación de la clasificación final de las semillas con la matriz de confusión mediante el test de tetrazolio y el ensayo de germinación a temperatura ambiente (T3); tomado éste último como referencia por ser el registro más semejante al utilizado en la incubación de la prueba de viabilidad; los resultados obtenidos muestran que la coincidencia en semillas no viables fue del 79,12 %. Por ello, en este estudio, el test de tetrazolio ha sido de alta eficiencia para caracterizar semillas no viables.
Tabla 3. Evaluación de la clasificación final del sistema de determinación de viabilidad promedio en semillas de P. nitens (Viables/No viables), por matriz de confusión

De acuerdo con Bidwell (2000) el envejecimiento es un factor que generalmente disminuye la viabilidad en las semillas, y es de suma importancia para determinar el periodo de tiempo en el que conservan su capacidad para germinar y así lograr una propagación exitosa (Hartmann y Kester, 1994). Carvalho y Nakagawa (2012) argumentan que el porcentaje de viabilidad está influenciado por las características genéticas de la planta progenitora y por factores ambientales como las condiciones climáticas durante la floración, formación, desarrollo y maduración del fruto, el grado de madurez de la semilla al momento de la cosecha y el manejo durante la colecta y la poscosecha, a pesar de que estos factores no se analizaron en el presente trabajo.
Existieron árboles cuyos valores de porcentaje germinación estuvieron por encima del valor promedio sugiriendo la influencia del genotipo en la calidad de la semilla. Existen diversos estudios de la influencia de la procedencia geográfica de las semillas sobre la germinación y el crecimiento de especies forestales; e inclusive muchos de ellos indican diferencias en cuanto al vigor de crecimiento de las plántulas (Juárez-Agis et al., 2006; Viveros-Viveros et al., 2017). Del mismo modo las condiciones de almacenamiento pueden afectar generando variaciones del vigor con el transcurso del tiempo (Fontana et al., 2016). En nuestro trabajo, la procedencia y el tamaño de los árboles fueron semejantes, lo que refuerza la idea de la variabilidad genotípica del lote ensayado.
Como se observa en la curva de germinación acumulada (Figura 1), la respuesta a los diferentes tratamientos fue muy variable; pero en general el tratamiento T1 no fue efectivo para ninguna de las semillas sin importar de qué individuo provengan. La temperatura a la que se deben mantener las semillas es aquella en la que se obtenga la germinación más rápida y más completa posible. Las temperaturas para pruebas de especies tropicales oscilan entre 15 y 35 °C y puede ser constante o alterna (Thomson, 1979); por ello el crecimiento suele verse detenido con temperaturas por debajo de los 10 ºC. Las especies de la familia fabaceae se caracterizan por presentar la testa dura, condición que afecta la germinación. Para mejorar este proceso y acelerar la obtención de plántulas existen diversos tratamientos pre-germinativos como la escarificación mecánica, química o física entre otras (Atencio et. al. 2003).
El tratamiento T4, que combina el tratamiento T1 (heladera 8±2 °C) y T2 como estratificación en frio, tuvo el menor tiempo en el proceso de desencadenar la germinación respecto a los demás tratamientos; como se observa en la curva de germinación acumulada (Figura 1). Mediante la estratificación en frío no sólo se supera la latencia fisiológica, sino que se puede reducir también la sensibilidad de las semillas durmientes y no durmientes a sus necesidades óptimas de luz y temperatura, de lo que se deriva un incremento de la tasa de germinación y de la uniformidad de ésta en condiciones diversas (Wilan 1991; Patiño et al., 1983; Hartmann y Kester, 1994; Donoso, 1993). Los resultados sugieren que la estratificación en frío actúa como un promotor de la germinación y se puede deber a adaptaciones al ambiente natural, en los cuales, se originó la especie (Manjkhola et al. 2003). Es aplicada en diversas especies forestales como ser Pinus, (Basil et al., 2001), Pinus taeda (Krugman y Jenkinson, 1974), Fraxinus excelsior, Crataegus monogyna (Gordon y Rowe, 1982), Nothofagus pumilio, Nothofagus antárctica, Nothofagus obliqua, Pinus ponderosa, Pseudotsuga menziesii y Pinus jeffreyi (Varela y Arana, 2011; Donoso et al., 2013), entre otras.
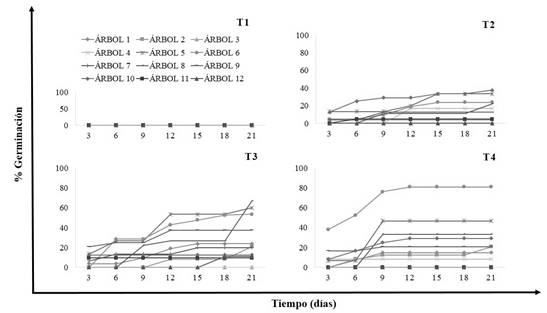
Figura 1. Curva de germinación acumulada para las semillas de los diferentes individuos de P. nitensReferencias: T1= 8±2 °C (heladera), T2= 27 °C (cámara climatizada); T3=Temperatura ambiente invernadero (29 ºC) y T4= T1 por 21 días (estratificación en frío) y luego T2 por 21 días.
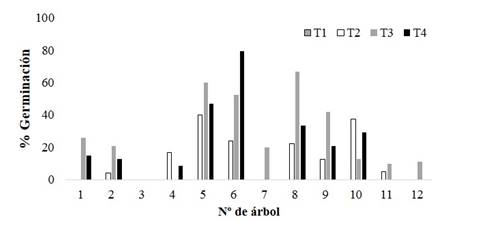
Los valores máximos de porcentaje de germinación se alcanzaron en general con los tratamientos T3 y T4; donde se han registrado valores de hasta 66,60±5,24 % de germinación en el árbol Nº 8 y 79,50±5,24 % en el árbol Nº 6 para los respectivos tratamientos (Figura 2). Como así también otros individuos no registraron germinación alguna para los mismos tratamientos. En el tratamiento T3 la mayoría de los individuos manifestaron su menor periodo de energía (PE) 3±1,59 días. Para esta variable se encontraron diferencias significativas para el tratamiento T3 con respecto a los demás (Tabla 4). En promedio con T3 se ha conseguido mejorar los resultados reportados por Pece et al. (2010) que lograron un periodo de energía de entre 5,75 y 9,75 días con tratamientos pre-germinativos mucho más agresivos, utilizando acido.
Por otra parte, para energía germinativa (EG) si bien no se mostraron diferencias significativas (P<0,05) entre los tratamientos T3 y T4; con el tratamiento de estratificación en frío (T4) se logró los mayores valores (40±2,76 %); estos resultados indican que cuando las semillas recibieron frío previo a la siembra aumentaron su energía, lo cual es coincidente con lo obtenido en la investigación de Mann y colaboradores (2008). El tiempo estipulado para calcular el porcentaje de semillas que germinó en general varía con la especie, y para la especie se registran datos de referencia generados por Pece et al. (2010) que varían entre 3,50 y 22 % para distintos tratamientos pre-germinativos.
Igual comportamiento se observó para velocidad de germinación (VG), no encontrándose diferencias significativas entre T3 y T4; Pece et al. (2010) sostiene que cuánto menor es el valor de VG, menor es el número de días utilizados en la germinación, por lo tanto, mayor es la energía de germinación; en T3 se ha logrado registrar el menor valor siendo este de 3±1,61 días, muy similar al reportado por el mismo autor. Generalmente la velocidad de germinación aumenta en forma directa con la temperatura, respondiendo a fluctuaciones estacionales y cotidianas (Taylor et al., 1999). El valor óptimo en la condición alternante para la germinación en la mayoría de las semillas varía de 20 a 35 °C, y difiere entre poblaciones de una misma especie y entre árboles de un mismo rodal (Patiño et al., 1983).
En cuanto al índice de velocidad de germinación (IVG) lo fue en T3 con 0,71±0,04 semillas germinadas por día (Tabla 4); aunque no se encontraron diferencias significativas entre T3 y T4. Este índice expresa la velocidad en número de semillas germinadas por día. Por lo tanto, cuanto mayor es, mayores son la velocidad y el vigor del lote. Si bien estos resultados no se comparan a los obtenidos por Pece et al. (2010), el mayor valor del índice corresponde al tratamiento con temperaturas más próximas al óptimo registrado para la especie (Nassif y Perez, 2000).
En cuanto a estudios relacionados con la germinación de P. nitens, Rovira et al. (2001) comparando la germinación bajo condiciones de laboratorio y de campo, refieren mayor variabilidad en laboratorio. Pece et al. (2010) aconsejan una temperatura de estufa constante de 30 °C durante todo el ensayo, para estimular la germinación y Tapia et al. (2014) proponen escarificación física como tratamientos pre-germinativos con el propósito de acelerar y uniformizar la germinación. Álvarez Tonin et al. (2005) estudiaron la influencia de la temperatura y el acondicionamiento osmótico en la viabilidad y el vigor de semillas sugiriendo que el acondicionamiento osmótico a 10 ºC es más eficiente que a 27 ºC; Peres Biruel et al. (2007), han estudiado la eficiencia del acondicionamiento de las semillas expuestas a envejecimiento acelerado y su influencia sobre la germinación; mientras que Morandini et al. (2013) analizaron la tolerancia a la desecación de las semillas para su almacenamiento y su posterior influencia en la germinación. Nassif y Perez (2000), por su parte determinaron que esta especie germina en un rango de temperatura con valores mínimos entre 12 y 15 °C, óptimos entre 18 y 30 °C y máximos entre 39 y 42 °C. Su velocidad de germinación es dependiente de la temperatura, ocurriendo los mayores valores de entre 24 y 30 °C. En esta experiencia si bien se manejaron temperaturas más específicas y el método de escarificado propuesto por Tapia et al. (2014), la germinación de las semillas se desencadenó dentro del mismo rango reportado por los últimos autores mencionados.
4. CONCLUSIONES
Este estudio básico permite obtener información acerca del efecto de la temperatura de incubación en la germinación de semillas de P. nitens; aunque no se identificó un patrón claro de desarrollo con diferentes condiciones de incubación, se puede mencionar que P. nitens necesita temperaturas promedio de 29 ºC para desencadenar el proceso. Además, con la estratificación en frío se logró un efecto favorecedor en algunos indicadores de vigor.
Las semillas de P. nitens perdieron viabilidad en un corto tiempo, por ello si bien los resultados presentados en este trabajo son preliminares, se reconoce necesario realizar más estudios en la temática para desarrollar una metodología de trabajo de estimación de la viabilidad en esta especie. La calidad del lote de semillas estudiado podría considerarse baja dado el elevado porcentaje de semillas no viables. Con los resultados presentados se contribuye al conocimiento del manejo adecuado de semillas de P. nitens para favorecer la supervivencia de las plantas en condiciones naturales y útiles también para la toma de decisiones al momento de iniciar la producción en vivero; destacando la importancia de complementar los ensayos de germinación con pruebas o test de viabilidad que además de ser fáciles, prácticas y económicas, se usan para obtener más información acerca de la calidad de semillas.