Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciencia y Tecnología
versão On-line ISSN 1851-7587
Rev. cienc. tecnol. no.31 Posadas jun. 2019
Ingeniería, Tecnología e Informática
Descomposición de óxido nitroso sobre las perovskitas de La-Fe-Co en presencia de O2 y H2O
Decomposição de óxido nitroso sobre perovskitas de La-Fe-Co na presença de O2 e H2O
Decomposition of nitrous oxide on perovskites of La-Fe-Co in the presence of O2 and H2O
Ana Paula N. M. Santos1; Marcelo S. Batista1*
1- Universidade Federal de São Joáo del-Re¡ - CAP/UFSJ - Rod. MG 443, Km 05 - Ouro Branco-MG, Brasil.
* E-mall: marcelobatlsta@ufsj.edu.br
Resumen
La descomposición de N20 (de-N20) es la ruta simple y económica para reducir las emisiones de este gas de efecto invernadero en procesos industriales. En este trabajo catalizadores LaCo03, LaFe05Co05O3 y LaFe03 fueron preparados, caracterizados por DRX, MEV/EDS y RTP-H2 y evaluados en la de-N20 en presencia de 02 y H20. Los resultados mostraron la formación de estructuras perovskita con simetría ortorrómbica y romboédrica, morfología irregular y también óxidos de cobalto y hierro. La reducción de las especies de cobalto ocurre a temperaturas entre 300-800 °C y, solamente las especies de óxido de hierro se reducen por debajo de 600 °c. La orden de actividad en de-N20 fue LaCo03> LaFe05Co05O3 > LaFe03. Los catalizadores LaFe03 y LaFe05Co05O3 mostraron desactivación en presencia de 02 y H20. Por otro lado, el catalizador LaCo03 fue poco afectado con la adición de 02 y H20 y mantuvo la conversión por encima del 60%.
Palabras clave: Contaminante; Óxido nitroso; Descomposición de N20; Catalizador; Perovskitas.
Abstract
Decomposition of N20 (de-N20) is a simple and economical way to reduce emissions of this greenhouse gas in industrial processes. In this work, LaCo03, LaFe05Co05O3 and LaFe03 catalysts were prepared, characterized by XRD, SEM/DES and TPR-H2 and evaluated in de-N20 in the presence of 02 and H20. The results showed the formation of perovskite structures with orthorhombic and rhombohedral symmetry, irregular morphology and also cobalt and ¡ron oxides. Reduction of cobalt species occurs at temperatures between 300-800 °C and only the iron oxide species are reduced below 600 °c. The order of activity in de-N20 was LaCo03> LaFe05Co05O3 > LaFe03. The catalysts LaFe03 and LaFe05Co05O3 showed deactivation in the presence of 02 and H20. On the other hand, the catalyst LaCo03 was slightly affected with the addition of 02 and H20 and, kept the conversión above 60%.
Keywords: Pollutant; Nitrous oxide; N20 decomposition; Catalyst; Perovskites.
Resumo
A decomposicáo de N20 (de-N20) é a rota simples e económica para reduzir as emissóes desse gás de efeito estufa em processos industriáis. Neste trabalho catalisadores LaCo03, LaFe05Co05O3 e LaFe03 foram preparados, caracterizados por DRX, MEV/EDS e RTP-H2 e, avaliados na de-N20 na presença de 02 e H20. Os resultados mostraram a formacáo de estruturas perovskita com simetría ortorrómbica e romboédrica, morfología irregular e também óxidos de cobalto e ferro. A reducáo das espécies de cobalto ocorre em temperaturas entre 300-800 °C e, somente as espécies de óxido de ferro se reduzem abaixo de 600 °c. A ordem de atividade na de-N20 foi LaCo03 > LaFe05Co05O3 > LaFe03. Os catalisadores LaFe03 e LaFe05Co05O3 mostraram desativacáo na presença de 02 e H20. Por outro lado, o catalisador LaCo03 foi pouco afetado com a adicáo de 02 e H20 e, manteve a conversáo ácima de 60%.
Palavras-Chave: Poluente; Óxido nitroso; Decomposicáo de NO; Catalisador; Perovskitas.
Introdugáo
O óxido nitroso (N20) é um gás de efeito estufa com potencial de aquecimento global cerca de 310 vezes maior do que o CCL e, ao mesmo tempo, contribui significati-vamente para a deplegao de ozono estratosférico [1, 2]. A maior quantidade de N20 são de origem natural, e 35% de todas as emissões são originadas de fontes antropogénicas, especialmente de processo químico, como a produgao de ácido adípico e ácido nítrico. O aumento contínuo de sua concentragáo na atmosfera atraiu grande atengáo para desenvolvimento de um método eficiente para a remogáo de N20. Urna série de métodos, como a decomposigáo térmica, adsorgáo seletiva e decomposigáo catalítica, foram empregadas para diminuir as emissões de N.O. Entre eles, a decomposigáo catalítica é considerada a escolha mais promissora devido aos menores consumos de energía e, consequentemente, menor custo [3].
A decomposigáo de N20 (de-N20) usando catalisador é urna rota simples que apresenta altas conversões. Para essa reagáo, as pesquisas tém focado no desenvolvimento de catalisadores, entre eles: metáis nobres [4,5], íons trocados em zeólitas [6, 7, 8] e óxidos de metáis de transigáo [9, 10, 11]. Os metáis nobres, como Rh e Ru, apresentam altas conversões na de-N20, em baixas temperaturas. No entanto, os metáis nobres apresentam alto custo e queda de atividade na presenta de 02 e vapor de água, fatores que dificultam a sua aplicagáo em processos industriáis [4, 5]. Os catalisadores á base de ferro-zeólita foram bastante estudados e mostram alta atividade na de-N20 [12-14]. Os óxidos de metáis de transigáo apresentam baixo custo, esta-bilidade térmica e atividade significativa na de-N20. Por outro lado, a atividade desses óxidos é afetada na presenta de gases co-alimentados (O,, ELO, CO, CH,, NO e outros), comumente encontrados na composigáo dos gases de efuentes industriáis [15,16].
Os catalisadores á base de perovskita (AB03) são atraentes devido ao menor custo e á flexibilidade de sua composicáo. Perovskita do tipo LaCoO,, preparada pelo método de combustáo, apresentou 50% de conversáo na de-N20 a 455 °C e 490 °C, na ausência e presenta de 5% de oxigénio, respectivamente [3]. Normalmente, os gases de exaustáo contém 02 e H20, que geralmente induzem fortes efeitos inibidores, dependendo das propriedades superficiais dos sólidos [17]. Entretanto, a presenta de Fe na perovskita contribui para a estabilidade do catalisador em altas temperaturas e a atividade de perovskitas LaCo, Fe O, depende da concentracáo relativa de Co 181.
As perovskitas podem ser modificadas pela substituigáo parcial dos sítios A e/ou B, de modo a obter catalisadores mais ativos, seletivos e estáveis [19]. O uso de dois metáis de transigáo como cátions B na perovskita de lantánio pode aumentar a atividade na de-N20 [20-21]. O método de preparagáo da perovskita também infuencia a atividade catalítica de-N.O [16]. O método de polimerizacáo (também conhecido como citrato ou Pechini) tem sido amplamente usado, pois oferece muitas vantagens sobre os outros métodos de síntese, incluindo a mistura de componentes em escala atómica, elevada homogeneidade, bom controle estequiométrico, alta pureza e baixas temperaturas de tratamento térmico [21].
Neste contexto, o objetivo desse trabalho foi ava-liar o desempenho catalítico de perovskitas LaFe03, LaFe05Co05O3 e LaCo03 na de-N20, na presenta de 02 e H20. As perovskitas foram preparadas pelo método de polimerizagáo e caracterizadas por difratometria de raios X (DRX), microscopía eletrónica de varredura acoplada com sistema de dispersáo de energía (MEV-EDS) e redugáo com EL a temperatura programada (RTP-HA
Materiais e Métodos
Preparagáo dos Catalisadores
Os catalisadores LaFe03, LaCo03 e LaFe05Co05O3 foram preparados pelo método de polimerizagáo conforme descrito por Lima et al. [22], utilizando os sais de nitrato de lantánio III (La(N03)3.6H20; VETEC), nitrato de cobalto II (Co(N03)2.6H20; VETEC) e nitrato de ferro III (Fe(N03)3.9H20; VETEC) como precursores metálicos. Ñas soluQóes desses sais foi adicionado ácido cítrico e etilenoglicol em quantidades equimolares. A mistura foi agitada e o excesso de água foi evaporado até a formagáo de material com aspecto esponjoso. O material foi submeti-do a tratamento térmico sob fuxo de ar em duas etapas para obtengáo da estrutura perovskita: 550 °C por 3 h e 800 °C por 5 h (taxa de aquecimento de 10°C/min).
Caracterizagáo dos Catalisadores
As análises de difratometria de raios X (DRX) foram realizadas pelo método do pó em um difratómetro Rigaku (Minifex 600) operando com radiagáo CuKa, tensáo de 40 KV e corrente de 15 mA. A velocidade do goniómetro foi de 2° (29)/min e variagáo do ángulo na faixa de 5o a 80°(29). As estruturas foram identificadas por comparagáo dos difratogramas com o banco de dados do X'Pert HighS-core [23].
As análises de Microscopía Eletrónica de Varredura acoplada com Espectroscopia de Raios X por Energía Dispersiva (MEV/EDS) foram realizadas em um equipamento modelo Hitachi TM3000 em conjunto com o Bruker Sean Genérater, equipamento utilizado na EDS. O equipamento foi operado com tensáo de 50 KV, corrente de 30 mA e profundidade de foco de 100 u.m. Ñas análises foram utilizados 10 mg de amostra previamente secadas em mufa por 3 h na temperatura de 150 °C.
As análises de redugáo com hidrogénio á temperatura programada (RTP-H2) foram realizadas em um equipamento SAMP3 (Termolab equipamentos Ltda.). A amostra foi acondicionada em leito de lã de quartzo, em reator tipo "U", onde passou um fuxo de 30 mL/min da mistura de 2% H2 em argônio. A amostra foi aquecida da temperatura ambiente até 1000 °C. O consumo de H2 foi monitorado com um detector de condutividade térmica.
Avaliacáo Catalítica
Nos ensaios catalíticos foi utilizado 50 mg de catali-sador, o qual foi acondicionado em leito de lã de quartzo, em reator de quartzo tipo "U" (h=150 mm e 0=10 mm), alimentado com fluxo contínuo de 50 mL/min de urna mistura gasosa contendo 10% de N20 em He (v/v). As vazóes dos gases de alimentacáo foram controladas através de um controlador de fuxo da Brooks Instrument (modelo 0254). O reator foi colocado em um forno e a temperatura controlada por um controlador PID e a temperatura de reaçáo foi variada de 25 °C até 600 °C, utilizando rampa de 10 °C/min. Para avaliar a decomposicáo de N20 a 600 °C, na presença de outros gases, foram adicionados 10% de 02 e 10% de vapor de água (via saturador), maniendo constante o fuxo total de 50 mL/min. A saída do reator foi acoplada em linha a um espectrómetro de massas da Pfeifer (modelo ThermoStar GSD 320 T) para a análise de: N. (28), O. (32 e 16), N.O (44 e 30) e He (4).
Resultados e Discussáo
A Figura 1 apresenta os resultados de difratome-tria de raios X dos catalisadores LaFe03, LaCo03 e LaFe05Co05O3. A formaçáo da estrutura perovskita foi confrmada pela identificacáo dos picos característicos entre 5 a 80°, não sendo observados picos referentes a outros óxidos como La^O,, Fe^O, e Co,0". No entanto, pequeñas partículas (< 4 nm) desses óxidos podem estar presentes e não serem detectadas por DRX. A perovskita LaCo03 apresenta simetría romboédrica com picos de difraçáo (29) em 23,4°, 33,0°, 33,5°, 40,8°, 47,8°, 59,3° (PDF 84-0846). Enquanto que a perovskita LaFe03 apresenta simetría ortorrómbica com picos de difracáo (29) em 22,6°, 32,2°, 39,7°, 46,2°, 52,0°, 57,4°, 67,4°, 72,1°, 76,7° (PDF 74-2203) [21]. Na perovskita LaFe0 5Co0 503 o sistema cristalino pode mudar com a ocupaçáo dos sítios B pelo Fe3+. Considerando a forma LaFe. Co O,, a simetría da perovskita é ortorrómbica para x < 0,5 e romboédrica para x > 0,5 [18, 24-25]. Os ángulos observados na perovskita LaFe0 5Co0 503 são intermediários entre os observados para as perovskitas não substituídas LaFeC" e LaCoO,.
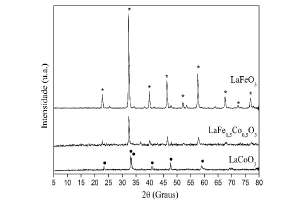
Figura 1: Difratogramas de raios X dos catalisadores. Picos (*) LaFeO3, (.) LaCoO3.
A Figura 2 apresenta as micrografas dos catalisadores LaCoO3, LaFeO3 e LaFe0,5Co0,5O3 obtidas por MEV. Pode-se observar que as perovskitas obtidas pelo método de polimerização são constituídas por partículas com morfologia irregular, não homogênea e que apresentam superfície esponjosa [26].

Figura 2: Micrografas das perovskitas: (a) LaCoO3 (b) LaFeO3 (c)
Na Tabela 1 são apresentados os resultados da com-posição química dos catalisadores LaCoO3, LaFeO3 e LaFe0,5Co0,5O3 obtidos por EDS. A perovskita LaCoO3 apresentou composição elementar (71,9% La, 16,9% Co e 11,2% O) que diverge da composição nominal (56,5% La, 24,0% Co e 19,5% O). Esse mesmo desvio foi observado na composição elementar de LaFeO3 (76,7% La, 13,6% Fe e 9,7% O) e LaFe0,5Co0,5O3 (69,4% La, 10,1% Co e 10,7% O) com relação à composição nominal esperada para La-FeO3 (57,2% La, 23,0% Fe e 19,8% O) e LaFe0,5Co0,5O3 (56,9% La, 11,4% Fe, 12% Co e 19,7% O). A diferença observada entre a composição elementar (experimental) e nominal pode estar associada à particularidade do ponto analisado, uma vez que a técnica utilizada é pontual e não representa a amostra em sua totalidade.
Tabela 1: Análise elementar dos catalisadores obtida por espectroscopia de energia dispersiva.
| Catalisador | Composigao Elementar (% m/m) | |||
| Co | Fe | La | O | |
| LaCo03 | 16,9 | - | 71,9 | 11,2 |
| LaFe03 | - | 13,6 | 76,7 | 9,7 |
| LaFeO,5CoO,503 | 10,1 | 9,8 | 69,4 | 10,7 |
A Figura 3 apresenta os perfs de RTP-FL dos catali-sadores LaFe03, LaCoO3 e LaFe05Co05O3. As espécies de lantánio não são reduzidas na faixa de temperatura em que foram realizadas as análises de RTP [27]. No perfl do LaCo03 pode-se observar que a reduçáo do cobalto ocorre em duas etapas. O consumo de hidrogénio entre 350 e 530 °C corresponde á reduçáo de espécies Co+3 a Co+2 e, na segunda etapa os picos em 652 °C e 724 °C estáo relacionados á reducáo de Co+2 a Co°. Note que LaCo03 se reduz junto com outra espécie de cobalto, provavelmente nanopartículas de Co30. (< 4 nm) não detectadas por DRX, conforme relatado na literatura [18].
No perfil de LaFe03 pode-se observar um pico em 428 °C atribuído á reduçáo de espécies Fe+3 a Fe+2 e, em seguida, outro pico em 578 °C referente á reduçáo de Fe+2 a Fe0. Essa reduçáo foi bastante ampliada para ser visualizada e foi atribuída a traeos de pequeñas partículas de Fe O , não detectadas por DRX. LaFeO é reduzido em altas temperaturas (>900 °C) de acordó com a literatura [28]. Os dois estágios de reduçáo de cobalto na estrutura perovskita podem ser descritos ñas Equaçóes 1 e 2.
2 LaCoO + H -> 2 LaCoO + HO (l)
2 LaCoO +2 H -^LaO + 2 Co° + 2 H O (2)
No nerfl de LaFe Co O node-se observar um üico de consumo de hidrogénio entre 420 e 480 °C atribuído á reduçáo de espécies Co+3 a Co+2 (na estrutura perovskita e Co O ) e Fe3+ nara Fe2+ (de Fe O ") O nico a 562 °C está associado á reduçáo de Fe+2 a Fe0 e a calda observada em torno de 663 °C está associada á reduçáo de Co+2 a Co° Note aue LaFe Co O foi deslocado nara menor temperatura de reduçáo comparado com LaCoO devido ao efeito spill over [29].
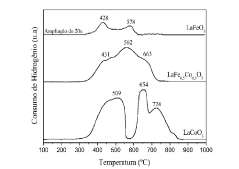
Figura 3: Perfs de RTP-H2 dos catalisadores LaCoO3, LaFeO3 e LaFe0,5Co0,5O3.
A Figura 4 apresenta os resultados de conversão na de-N2O em função da temperatura sobre as perovskitas LaCoO3, LaFeO3 e LaFe0,5Co0,5O3. Esses resultados mos-tram que as perovskitas estudadas, independente da sua composição, apresentaram atividade na de-N2O em altas temperaturas (>450 ºC). A ordem de atividade foi LaCoO3 LaFe0,5Co0,5O3 > LaFeO3. LaCoO3 e LaFe0,5Co0,5O3 foram
os catalisadores mais ativos, evidenciando que essa melhor atividade catalítica está associada à presença de cobalto na perovskita. Assim, o catalisador LaCoO3 apresentou o melhor desempenho e alcançou 74% de conversão de N2O na temperatura de 600 °C. Note que LaFe0,5Co0,5O3 e LaCoO3 apresentaram conversões de 12 e 22% (500 ºC), 20 e 39% (550 ºC) e 37 e 72% (600 ºC), respectivamente, e essas conversões são proporcionais ao teor de cobalto. Foi possível observar que atividade catalítica inicia em temperaturas (>450 ºC) próximas daquelas de redução das espécies de cobalto observada por RTP. Esse resultado indica que a atividade na de-N2O depende das propriedades redox do catalisador.
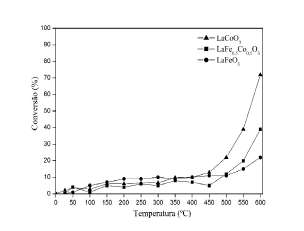
Figura 4: DecomDosicáo de N O sobre catalisadores LaCoO LaFeO e LaFe0,5Co0,5O3.
A Figura 5 mostra a conversão de N2O a 600 °C sobre os catalisadores LaCoO3, LaFe0,5Co0,5O3 e LaFeO3 na presença de O2 e H2O. Note que os catalisadores LaFeO3 e LaFe0,5Co0,5O3 que utilizam ferro na sua composição foram os mais afetados na de-N2O quando se adicionou O2 e H2O. Essa queda da conversão na de-N2O na presença de O2 pode ter sido causada pela adsorção competitiva entre N2O e O2 nos sítios ativos do catalisador. Enquanto que a queda na presença de H2O pode estar associada à hidroxilação dos sítios de ferro e, a estabilidade esperada na presença de Fe não foi observada devido às menores temperaturas usadas nesse trabalho. Especula-se que a hidroxilação nos sítios de cobalto III (KPS (25oC) = 7,8 x10-12) não ocorra ou não é tão afetado como no caso dos sítios de ferro III (KPS (25oC) = 2,8 x10-39). Os grupos HO- formados são os responsáveis pelo bloqueio seletivo dos sítios ativos tanto para a ativação de N2O quanto para a recombinação difusiva de oxigênio [7, 30]. O catalisador LaCoO3 foi pouco afetado, apresentando conversão ácima de 60% na presença de 0o e FLO.

Figura 5: Decomposigao de N20 sobre catalisadores LaCo03, LaFe03 e LaFe05Co05O3 na presenta de 02 e H20.
Conclusóes
De acordó com os resultados obtidos pode-se concluir que os catalisadores LaCo03, LaFe0 5Co0 503 e LaFe03 preparados pelo método de polimerização levaram a for-macao da estrutura perovskita com simetría ortorrómbica e romboédrica e, a presença de Fe203 e Co304 f°i observada somente ñas análises de RTP-FL. Essas perovskitas foram constituídas por partículas com morfologia irregular, não homogénea e apresentam superfície esponjosa. A reducao das espécies de cobalto ocorre em temperaturas entre 300-800 °C e, somente as espécies de óxido de ferro se reduzem abaixo de 600 °C. A ordem de atividade na de-N20 foi La-Co03 > LaFe0 5Co0 503 > LaFe03. Os catalisadores LaCo03 e LaFe0 5Co0 503 foram os mais ativos, evidenciando que essa melhor atividade está associada à presença de cobalto. Os catalisadores LaFeO^ e LaFe" 5Co" 0^ mostraram desativacao na presença de 0o e FLO. O catalisador LaCoO, foi pouco afetado com a adicao de 0o e FLO e, manteve a conversão ácima de 60%.
Referências
1. Granger, P. and Parvulescu, VI. Catalytic NOx abatement systems for mobile sources: from three-way to lean burn after-treatment technologies. Chemical Reviews, vol. 111 (5): p. 3155-3207. 2011. [ Links ]
2. Li, L; Xu, J.; Hu, J. and Han, J. Reducing nitrous oxide emissions to mitígate climate change and protect the ozone layer. Environmental Science & Technology. vol. 48 (9): p. 5290-5297. 2014. [ Links ]
3. Russo, N.; Mescia, D.; Fino, D.; Saracco, G. and Specchia, V. N20 Decomposition over Perovskite Catalysts. Industrial & Engineering Chemistry Research. Vol. 46, p. 4226-4231. 2007. [ Links ]
4. Komvokis, V. G.; Marnellos, G. E.; Vasalos, I. A. and Triantafyllidis, K . S. Efect of pretreatment and regeneration conditions of Ru/γ-Al2O3 catalysts for N2O decomposition and/or reduction in O2-rich atmospheres and in the presence of NOX, SO2 and H2O. Applied Catalysis B: Environ-mental. Vol. 89, p. 627-634. 2009. [ Links ]
5. Pachatouridou, E.; Papista, E.; Iliopoulou, E. F. ; Delimitis A.; Goula G.; Yentekakis, L. V.; Marnellos, G. E. and Konsolakis, M, Ni-trous oxide decomposition over Al2O3 supported noble metals (Pt, Pd, Ir): Efect of metal loading and feed composition. Journal of Environmental Chemical En-gineering, vol. 3 (2): p. 815-821. 2015. [ Links ]
6. Zhang, R.; Liu, N.; Lei, Z. and Chen, B. Selective transformation of various nitrogen-containing exhaust gases toward N2 over zeolite catalysts, Chemical Reviews. Vol. 116 (6): p. 3658-3721. 2016. [ Links ]
7. Xie, P.; Luo, P. ; Ma, Z.; Huang, C.; Miao, C.; Yue, Y. ; Hua, W. and Gao, Z. Catalytic decomposition of N2O over Fe-ZSM-11 ca-talysts prepared by diferent methods: Nature of active Fe species. Journal of Catalysis. Vol. 330. p. 311 - 322. 2015. [ Links ]
8. Wang, J.; Xia, H.; Ju, X.; Fan, F. ; Feng, Z. and Li, C. Catalytic performance of diferent types of iron zeolites in N2O decomposition. Chinese Journal of Catalysis. Vol. 34, p. 876 -888. 2013. [ Links ]
9. Obalová, L.; Karásková, K.; Wach, A.; Kustrowski, P.; Mamulová- Kutláková, K.; Michalik, S. and Jirátová, K. Alkali metals as promoters in Co-Mn-Al mixed oxide for N2O decom-position. Applied Catalysis A: General. Vol. 462 - 463. p. 227-235. 2013. [ Links ]
10. Franken, T. and Palkovits R. Investigation of potassium do-ped mixed spinel's CuxCo3-xO4 as catalysts for an ef-cient N2O decomposition in real reaction conditions, Applied Catalysis B: Environmental. Vol. 176. p. 298 - 305. 2015. [ Links ]
11. Wang, J.; Feng, M.; Zhang; H. J. and Xu, X. Catalytic decompo-sition of N2O over Mg-Fe mixed oxides. Journal of Fuel Chemistry and Technology. Vol. 42. p. 1464 - 1469. 2014.
12. Zhang, R.; Liu, N.; Lei, Z. and Chen, B. Selective transfor-mation of various nitrogen-containing exhaust gases toward N2 over zeolite catalysts. Chemical Reviews. Vol. 116 (6): p. 3658 - 3721. 2016.
13. Jísa, K.; Nováková, J.; Schwarze, M.; Vondrová, A.; Sklenák, S. and Sobalik, Z. Role of the Fe-zeolite structure and iron state in the N2O decomposition: Comparison of Fe-FER, Fe-BEA, and Fe-MFI catalysts. Journal of Ca-talysis. Vol. 262 (1): p. 27-34. 2009.
14. Yu, H.; Tursun, M.; Wang, X. and Wu, X. Pb0.04Co catalyst for N2O decomposition in presence of impurity gases. Applied Catalysis B: Environmental. Vol. 185. p. 110-118. 2015.
15. Liu, Z.; He, F. ; Ma, L. and Peng, S. Recent advances in catalytic decomposition of N2O on noble metal and metal oxide catalysts. Catalysis Surveys from Asia. Vol 21. p. 1-12. 2016.
16. Dacquin, J. P. ; Lancelot, C.; Dujardin, C.; Costa P. ; Djega-Mariadas-sou, G.; Beaunier, P. ; Kalianguine, S.; Vaudreuil, S.; Royner, S. and Granger, P. Infuence of preparation methods of LaCoO3 on the catalytic performances in the decomposition of N2O. Applied Catalysis B: Environmental. Vol. 91, Is-sues 3 - 4. p. 596-604. 2009.
17. Brackmann, R.; Perez, C. A. and Schmal, M. LaCoO3 pero-vskite on ceramic monoliths - Pre and post reaction analyze of the partial oxidation of methane. Interna-tional Journal of Hydrogen Energy. Vol. 39. p. 13991 - 14007. 2014.
18. Wu, Y.; Cordier, C.; Berrier, E.; Nuns, N.; Dujardin, C. and Gran-der, P. Surface reconstructions of LaCo1-xFexO3 at high temperature during N2O decomposition in realis-tic exhaust gas composition: Impact on the catalytic properties. Applied Catalysis B: Environmental. Vol. 140-141, p. 151 - 163. 2013.
19. Medkhali, H. A.; Narasimharao, K.; Basahel, S. N. and Mokthtar, M. Divalente transition metals substituted LaFeO3 Perovskite Catalyst for Nitrous Oxide Decomposition. Journal of Membrane and Separation Technology. Vol. 3, p. 206 - 212. 2014.
20. Kumar, S.; Vinu, A.; Subrt, J.; Bakardjeva, S.; Rayalu, S.; Terao-la, Y. and Labhsetwar, N. Catalytic N2O decomposition on Pr0,8Ba0,2MnO3 type perovskite catalyst for industrial emission control. Catalysis Today. Vol. 198, p. 125 -132. 2012.
21. Gaki, A.; Anagnostaki, O.; Kioupis, D.; Perraki, T.; Gakis, D. and Kakali, G. Optimization of LaMO3 (M: Mn, Co, Fe) synthesis through the polymeric precursor route. Jour-nal of Alloys and Compounds. Vol. 451. p. 305 - 308. 2008.
22. Lima, R.K.C.; Batista, M.S.; Wallau, M.; Sanches, E.A.; Mascaren-has, Y.P. and Urquieta-González, E.A. High specific surface area LaFeCo perovskites -Synthesis by nanocasting and catalytic behavior in the reduction of NO with CO. Applied Catalysis B: Environmental, 90(3-4), p.441-450, 2009.
23. X`PERT HighScore. Philips Analytical B. V., version 1, The Netherland, 2001.
24. Liu, F. X.; Ma, H. W.; Li, Z. P. and Gao, Z. M. Competitive Oc-cupyng of Fe3+ and Co3+ Ions into the Lattice B-Sites of Perovskite Crystalline Structure. Chinese Journal Chemical. Vol. 36, 2, p. 217 - 228. 2017.
25. Roseno, K. T. C.; Brackmann, R.; Silva, M. A. and Schmal, M. In-vestigation of LaCoO3, LaFeO3 and LaCo0.5Fe0.5O3 pe-rovskites as catalyst precursors for syngas production by partial oxidation of methane. International Journal of Hydrogen Energy. Vol. 41. p. 18178 -18192. 2016.
26. Pan, K.L.; Yu, S.J.; Yan, S.Y. and Chang, M.B., 2014. Direct N2O decomposition over La2NiO4-based perovskite-type oxides. Journal of the Air & Waste Management As-sociation, 64(11), p.1260-1269, 2014.
27. Huang, L.; Bassir, M. and Kaliaguine, S. Reducibility of Co3+ in perovskite-type LaCoO3 and promotion of copper on the reduction of Co3+ in perovskite-type oxides. Applied Surface Science. Vol. 243. p. 360 - 375. 2005.
28. Goldwasser, M.R.; Rivas, M.E.; Lugo, M.L.; Pietri, E.; Perez-Zurita, J.; Cubeiro, M.L.; Griboval-Constant, A. and Leclercq, G. Combi-ned methane reforming in presence of CO2 and O2 over LaFe1-xCoxO3 mixed-oxide perovskites as catalysts precursors. Catalysis Today, vol. 107, p.106-113. 2005.
29. Varga, E.; Pusztai, P.; Óvári, L.; Oszkó, A.; Erdohelyi, A.; Papp, C.; Steinrück, H.P.; Kónya, Z. and Kiss, J. Probing the interaction of Rh, Co and bimetallic Rh-Co nanoparticles with the CeO2 support: catalytic materials for alternative ener-gy generation. Physical Chemistry Chemical Physics, vol 17(40), p. 27154-27166, 2015.
30. Rutkowska, M.; Piwowarska, Z.; Micek, E. and Chmielarz, L. Hierarchical Fe-, Cu- and Co-Beta zeolites obtained by mesotemplate-free method. Part I: Synthesis and catalytic activity in N2O decomposition. Microporous and Mesoporous Materials. Vol. 209. p. 54 - 65. 2015.
Recibido: 06/12/2017. Aprobado: 31/10/2018.














