Introducción
El compromiso aórtico puede deberse a diferentes causas que se clasifican en infecciosas y no infecciosas. Dentro de las causas no infecciosas, se engloba a un grupo de trastornos caracterizados por una inflamación crónica dentro de la pared y/o alrededor de la aorta. Se describe en la literatura como una complicación de las enfermedades reumatológicas, con sintomatología y manifestaciones clínicas diversas, determinadas por el segmento aórtico afectado; se observa con mayor frecuencia en la aorta torácica, particularmente en la aorta ascendente, y puede deberse a trastornos como vasculitis sistémicas (arteritis de células gigantes (ACG), arteritis de Takayasu (AT)) y, en menor frecuencia, la artritis reumatoide, espondilitis anquilosante y enfermedad de Behçet, enfermedad de Cogan, lupus eritematoso sistémico (LES), sarcoidosis, granulomatosis con poliangitis, poliarteritis nodosa, síndrome antifosfolipídico, enfermedad de Erdheim-Chester (ECC) y enfermedad relacionada con IgG4 (ER-IgG4).
Sin embargo, en un gran porcentaje de casos, la aortitis se encuentra inesperadamente en el examen patológico de segmentos aórticos resecados de pacientes sometidos a reparación de aneurismas o disecciones de la aorta torácica. En muchas de estas situaciones, no hay una condición reumatológica sistémica obvia.
Se describen ocho casos clínicos (Tabla 1) con distintos diagnósticos que afectan a la aorta y/o sus ramas, con especial referencia a dos entidades que no se tienen en cuenta hasta el momento, como la ER-IgG4 y la EEC, y sus diagnósticos diferenciales en pacientes con otras enfermedades encontradas en nuestro Servicio, como la ACG y AT.
Tabla 1: Resumen de casos clínicos y compromiso aórtico.


M: masculino; F: femenino; FOD: fiebre de origen desconocido; VSG: velocidad de sedimentación globular; HTA: hipertensión arterial; TA: tensión arterial; VN: valor normal; PCR: proteína C reactiva.
Caso clínico 1
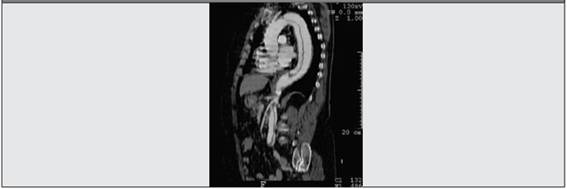
Paciente femenina, de 55 años, con fiebre de 3 semanas de evolución, sin foco aparente, fatiga, hiporexia y pérdida de peso, diagnosticada 3 meses previos de aneurisma disecante de aorta tipo B. En la anamnesis se describe cefalea de localización temporal izquierda, amaurosis fugaz, fotopsias, dolor y rigidez en la cintura pelviana. El examen físico revela una curva térmica con fiebre remitente, una arteria temporal izquierda palpable dolorosa y a la auscultación, soplo sistólico más intenso en el mesocardio. La presión arterial y los pulsos son normales junto con el resto del examen físico. Laboratorio: anemia (Hb: 9,6 g/dl) eritrosedimentación (velocidad de sedimentación globular, VSG) aumentada: 108 mm (valor normal (VN) ≤40 mm/h), glóbulos blancos, función renal y hepática normales. Serología negativa para sífilis y VIH, urocultivo y hemocultivo negativos. Radiografía de tórax normal y ecocardiograma transtorácico sin vegetaciones. Al examen ocular no se evidencia neuritis óptica isquémica. En la tomografía computarizada (TC) doble helicoidal se observa aneurisma de aorta tipo B hasta la raíz de las ilíacas primitivas (Figura 1); con angiorresonancia magnética de vasos de tórax se descarta compromiso de la subclavia y ramas principales. Se realiza biopsia de arteria temporal izquierda sin presencia de infiltrados inflamatorios; se propone biopsia contralateral, pero la paciente se niega. Se asume como ACG (según criterios del American College of Rheumatology (ACR) 1990), se inicia tratamiento con 1 mg/k/día de prednisona y aspirina 81 mg/día con franca mejoría a las 24 horas y desaparición de síntomas oculares, fiebre y la VSG desciende a 50 mm. La paciente cumple con el tratamiento durante 2 años con glucocorticoides, sin nuevas recaídas.
Caso clínico 2
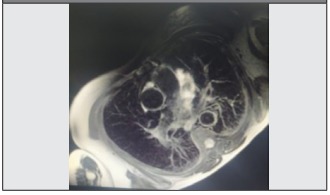
Paciente femenina, de 36 años de edad, con hipertensión arterial durante el segundo trimestre de embarazo. Se constata presión arterial 150/100 mm Hg con asimetría de mediciones, soplo carotideo bilateral; en miembros superiores, pulso radial izquierdo; en miembros inferiores, pulso femoral, pedio derecho disminuido y ausentes en el miembro contralateral. La arteriografía objetiva obstrucción total de la arteria subclavia izquierda luego del nacimiento de la arteria mamaria, con recanalización por circulación colateral, obstrucción de la aorta abdominal infrarrenal con llenado de ilíacas por circulación colateral, por lo cual se arriba al diagnóstico de AT en 1996 (según criterios del ACR 1990), iniciando tratamiento con esteroides que abandona al año. Progresa con estrechamiento de arteria carótida común derecha desde el tronco braquiocefálico, obstrucción total de la subclavia derecha y aorta abdominal. Examen ocular: retinopatía hipertensiva grado I en el ojo izquierdo. Ecocardiograma transtorácico, hipertrofia del ventrículo izquierdo (2005-2007). Durante una nueva internación (2015), se ausculta un soplo en la aorta abdominal y en las arterias renales, sumado a VSG elevada y alteración de la función renal sin proteinuria; se realiza angiorresonancia que advierte compromiso de la aorta por debajo del tronco celíaco, con franca estenosis que se extiende hasta las arterias ilíacas primitivas, estenosis de ambas arterias renales con reducción del trofismo del riñón izquierdo. Se inicia prednisona 1 mg/k/día por un mes, luego dosis decrecientes y metotrexato 15 mg/semana. A los 6 meses presenta astenia, disfagia a sólidos, edemas de miembros inferiores, alteración de la función renal y se decide tratamiento con ciclofosfamida según esquema NIH (National Institutes of Health) lográndose la inactividad de la enfermedad por 5 años. Al cabo de ese tiempo, se refiere disnea CF I/II, tos sin expectoración, astenia y VSG aumentada. Se realiza angiorresonancia que evidencia engrosamiento de la pared de la aorta torácica y arteria pulmonar por inflamación; a nivel de la aorta abdominal distal, estenosis arrosariada tipo V (según clasificación angiográfica de Numano) (Figura 2 y Figura 3). En cateterismo derecho, gasto cardíaco aumentado y resistencia vascular pulmonar aumentada. Se inicia inmunodepresión con metilprednisolona y ciclofosfamida según esquema NIH que se suspende por cuadro infeccioso; se continúa con dosis decrecientes de corticoides. Se efectúa TC por emisión de positrones con 18-fluordesoxyglucosa (PET-TC 18 FDG) posterior que no evidencia actividad de la enfermedad. Se reinicia con metotrexato 15 mg/semanal. Hasta la fecha se encuentra inactiva.
Caso clínico 3
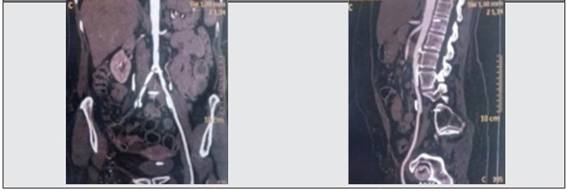
Paciente femenina, de 47 años de edad, con diagnóstico de hipertensión arterial, tabaquista, que inicia con fenómeno de Raynaud trifásico en mano izquierda, claudicación del brazo izquierdo, asimetría de mediciones de presión arterial en miembros superiores, carotidinia bilateral; refiere, además, dorsalgia asociada a astenia y adinamia de un año de duración. Al examen físico presenta soplo carotideo, subclavio derecho y en arterias femorales; ausencia de pulso carotideo izquierdo, pulso radial izquierdo disminuido, pedios no palpables. Presión arterial del brazo derecho 170/80 mm Hg, izquierdo 110/80 mm Hg, miembros inferiores: derecho: 140/80 mm Hg, izquierdo 120/80 mm Hg. En laboratorio, VSG aumentada. En estudios de imágenes presenta obstrucción total de la subclavia izquierda y de las arterias vertebrales, estenosis significativa en el tronco arterial braquiocefálico y carótidas, disminución del calibre de la aorta torácica y abdominal en todo su trayecto tornándose máxima a nivel infrarrenal, ilíacas primitivas y mesentérica superior (Figura 4). Se diagnostica AT según criterios ACR 1990 y se inicia tratamiento con pulsos de metilprednisolona 1 g/día por 3 días, luego prednisona 1 mg/kg/día por un mes, posteriormente dosis decreciente, metotrexato 15 mg/semana y atenolol 50 mg/día. Evoluciona con mejoría clínica sin recaídas hasta la actualidad.
Caso clínico 4
Paciente masculino, de 68 años, comienza con dolor abdominal que irradia al dorso, asociado a náuseas y vómitos. En estudios de imágenes se observa páncreas aumentado de tamaño de forma difusa, que afecta el cuerpo, cola y proceso uncinado del mismo, con halo hipointenso que lo rodea y pequeñas dilataciones segmentarias del conducto pancreático principal y leve estenosis de la porción intrapancreática del colédoco. Con supresión grasa, se observa caída en la señal de la glándula, y en la fase de contraste endovenoso, retardo en la captación de contraste por todo el parénquima pancreático. Esto, asociado al aumento de IgG4 sérica tres veces el valor normal, conduce al diagnóstico de ER-IgG4 (según los criterios diagnósticos 2002 de la Japan Pancreas Society para la pancreatitis autoinmune, de la clasificación del ACR y de la European Alliance of Associations for Rheumatology (EULAR) para ER-IgG4 2019) puntuación 25; se realiza tratamiento con glucocorticoides 0,5 mg/kg durante un mes, luego pautas de descenso hasta 5 mg/día, asociado con metrotexato 10 mg/semana, ácido fólico 5 mg/semana por mejoría clínica, serológica e imagenológica (PET-TC normales).
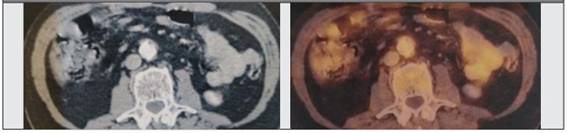
Permanece estable hasta el año 2021 donde se evidencia elevación de IgG4 sérica (cinco veces el valor normal), aumento del tamaño de las glándulas submaxilares y fibrosis retroperitoneral que rodea aorta por resonancia magnética (RM) de imagen de abdomen y en PET-TC 18 FDG con captación de las glándulas submaxilares (SUV 8.6), adenopatía axilar derecha (SUV 5.8), adenopatía mediastinal parahiliar derecha (SUV 6), tejido sólido rodeando aorta en su cara infrarrenal con forma de medialuna y actividad metabólica aumentada (SUV 6.9) (Figura 5). Se asume como recaída de la enfermedad y se inicia tratamiento con rituximab 1 g día 0-15 mg y a los 6 meses con respuesta favorable objetivada por nueva imagen de PET-TC 18FGD que no evidencia captación hipermetabólica a ese nivel (Figura 6).

Figura 5: PET-TC 18 FDG tejido sólido rodeando aorta en su cara infrarrenal con forma de medialuna y actividad metabólica aumentada (SUV 6.9).
Caso clínico 5
Paciente masculino, de 57 años, con adenopatías retroperitoneales y mesenteritis de 3 años de evolución con biopsia no concluyente. Derivado por presunto diagnóstico de vasculitis versus LES. Antecedentes de rinitis y asma del adulto, espirometría (patrón obstructivo leve) de un año de evolución. Presenta síndrome febril acompañado de astenia y pérdida de peso de 15 kg en 3 meses aproximadamente, asociado a aumento de glándulas submaxilares con síntomas sicca. Al examen físico se constata disminución del lago sublingual, xeroftalmia con examen cular con test Schirmer positivo >10 mm, aumento de la glándula submaxilar y dacrioadenits bilateral. Al examen cardíaco se ausculta soplo aórtico y respiratorio, disminución de la entrada bilateral de aire. En análisis de laboratorio: anemia, VSG 56 mm/h (VN: ≤30 mm/h) PCR 8 mg/dl (VN: 6 mg/dl), no presenta leucopenia, linfopenia ni plaquetopenia. FAN (HEP2), anti-DNA (crithidie), anti-Sm, anti-Ro, anti-La, anti-RNP, ACL, AL, ANCA C, ANCA P y ECA negativos, proteinograma electroforético con hipergamapoliclonal, aumento de IgE 1230 U/I (VN: hasta 100), IgM 980 mg/dl, IgG 5476 mg/dl, subclases de IgG1 5489 mg/dl (VN: 3,824-9,286 mg/dl), IgG2 1560 mg/dl (VN: 2,418.7,003 mg/dl) e IgG4 1560 mg/dl (VN: 0,038-0,864 mg/dl). En ecocardiograma Doppler y angiotomografía axial computada (angio TC) se detecta aneurisma de aorta ascendente de 47,3 mm de diámetro asintomático (Figura 7). En imágenes tomográficas, infiltrado intersticial bilateral, líquido intra asa a predominio del intestino delgado asociado a aumento de la densidad grasa del mesenterio llamando la atención un incremento del diámetro del sistema venoso, tanto en la mesentérica superior como mesentérica inferior a predominio de la primera. Múltiples imágenes compatibles con adenomegalia y pequeños ganglios retroperitoneales latero-aórticos e infra aórticos y cava. Al reevaluar la muestra de biopsia ganglionar de 3 años previos, se observa hiperplasia folicular reactiva e infiltrado linfoplasmocitario, infiltrado eosinofílicos y centros germinales con inmunohistoquímica: IgG4 53 cel./CAP (campo de alto poder) y un rango IgG4/IgG >50. Diagnóstico: ER-IgG4 con compromiso de adenopatías, mesenteritis esclerosante, compromiso pulmonar y aneurisma de aorta torácica. Se comienza con pulsos de metilprednisolona 1 g/día por 3 días, luego prednisona 60 mg/día, hidroxicloroquina 400 mg/día y se inicia con ciclofosfamida. El paciente evoluciona favorablemente. Ingresa 2 años después con equivalentes febriles, insuficiencia respiratoria, test COVID positivo, evoluciona de manera tórpida y posteriormente fallece.
Caso clínico 6
Paciente femenina, de 42 años de edad, con diagnóstico a los 33 años de LES según criterios del ACR 1997 (6/11 criterios), con compromiso renal (nefritis lúpica clase III), articular, serositis (pleural y pericárdica) y cutáneo por lo cual se encontraba en tratamiento con hidroxicloroquina.
Presenta cuadro clínico de 5 días de evolución caracterizado por dolor y palidez de la pierna derecha que empeora al elevar el miembro. Al examen físico no se constata pulso poplíteo, pedio ni tibial posterior con acrocianosis, diagnosticándose por arteriografía obstrucción trombótica de la arteria poplítea derecha, iniciando anticoagulación e infusión de trombolíticos.
En la angiografía por tomografía de abdomen se evidencia arteria renal derecha de pequeño tamaño con riñón derecho atrófico. A nivel infrarrenal se observa disminución del diámetro aórtico central por engrosamiento de la pared hasta un diámetro de 6 mm con disminución de la luz de un 50% que se extiende hasta la bifurcación ilíaca con una longitud de 6 cm; la grasa periaórtica presenta cambio de densidad, también se encuentra comprometida la pared de la arteria femoral derecha con densificación de la grasa periférica. Se interpreta como aortitis iniciando pulsos de metilprednisolona 1 g/día por 3 días, luego prednisona 60 mg/día y rituximab 1 g 0-15 días. Presenta mala evolución de la isquemia arterial con necrosis del miembro por lo cual requiere amputación infrapatelar derecha. En imágenes tomográficas de control presenta mejoría de la aortitis por lo que no se necesita una cirugía vascular. Continuando con estudios etiológicos, se efectúa radiografía de hueso largo y se evidencia engrosamiento cortical; en centellograma óseo se destaca un aumento de la captación a nivel del fémur derecho. Evoluciona presentando exantema maculopapular eritematoso no pruriginoso en tronco y brazos. Se realiza biopsia que evidencia infiltrado histiocitario dérmico e inmunohistoquímica CD68+, CD1a- y proteína s100+ arribando al diagnóstico de ECC.
Caso clínico 7
Paciente masculino, de 44 años, con antecedente de fibrosis retroperitoneal, diagnosticada por biopsia de 12 años de evolución por lo que se coloca catéter doble j con múltiples recambios.
En tomografía de abdomen se evidencian masas de aspecto fibroso que comprometen retroperitoneo y peritoneo, ambos riñones envueltos por masa de densidad de partes blanda con dilatación cólico piélica (riñones peludos) y fibrosis que envuelve a la aorta, con compromiso de la grasa periaórtica (periaortitis, coated aorta). La radiografía de huesos largos presenta osteoesclerosis de ambos fémures en forma distal, y a nivel de ambas tibias compromete metáfisis y diáfisis. En el centellograma óseo se evidencia imagen redondeada de borde irregular con actividad focal del trazador en proyección de la articulación sacroilíaca derecha, distribución heterogénea del trazador en fémures distales y diáfisis tibiales.
Se solicita revisión de biopsia de fibrosis retroperitoneal que muestra tejido fibroadiposo con abundantes macrófagos espumosos, linfocitos dispersos y en acúmulos, ocasionales plasmocitos y áreas de fibrosis laxa. Inmunohistoquímica con proteína S100, CD1a e IgG4 negativa, CD 163 positivo en macrófago arribando al diagnóstico de ECC.
Caso clínico 8
Paciente masculino, de 41 años, ingresa por dolor en miembros superiores e inferiores de 2 años de duración y nódulos de 20 años de evolución, antecedente de hipercolesterolemia. Al examen físico se constatan nódulos en codos, manos, rodillas y tobillos, xantelasmas en los párpados superiores e inferiores, y adenopatías submaxilares; los signos vitales son normales, así como el resto del examen físico.
El examen de laboratorio evidencia hipercolesterolemia e hipertrigliceridemia, con resultados normales de ácido úrico en suero y orina; el factor reumatoide, los anticuerpos antinucleares, el anticuerpo antipéptido cíclico citrulinado y el anticuerpo DNAds resultan negativos. Radiografías de manos, pies y huesos largos (húmero, cubito, radio, fémur, tibia y peroné), normales. La histología del nódulo demuestra la presencia de múltiples granulomas rodeados de histiocitos, células gigantes, linfocitos, plasmocitos y cristales de urato dispersos. En imagen de tomografía axial (TA) de cabeza, cuello, tórax, abdomen y pelvis se evidencian ganglios no adenommegálicos submandibulares y axilares bilaterales, también bronquiectasias bibasales. La gammagrafía ósea con tecnecio 99 (Tc99) muestra hipercaptación bilateral y simétrica en húmero proximal. Una nueva biopsia de los nódulos, con tinción con hematoxilina-eosina, revela histiocitos espumosos los cuales resultan positivos para CD60 y negativos para S100, y citoqueratina. Durante el seguimiento presenta dolor precordial evidenciando infarto de cara inferior por electrocardiograma y en angiografía coronaria, compromiso del tronco de la arteria coronaria izquierda y derecha que requiere cirugía cardiovascular con colocación de bypass (Figura 8).
Discusión
El compromiso de la aorta y sus ramas en las vasculitis de grandes vasos se ha descripto dentro de las manifestaciones consideradas atípicas de la ACG1. Puede presentarse en cualquier etapa de la enfermedad o de forma aislada, como insuficiencia valvular aórtica, estenosis, disección de la pared o aneurisma (10-15%). Tanto la disección de la pared como los aneurismas afectan más a la aorta torácica (11%) que abdominal (5%); a su vez son más frecuentes en las pacientes con ACG (17 veces) que en la población en general, y se presentan al inicio de la enfermedad (7%). Nuestra primera paciente presentó estas características2-4, circunstancia que, y como también en ausencia de manifestaciones clásicas de la ACG, generan retraso en el diagnóstico. Este hecho puede tratarse de una variante de la patología “arteritis de grandes vasos o aortitis” que se caracteriza por ser más frecuente en mujeres y por compromiso predominantemente de la arteritis de grandes vasos, con ausencia de síntomas craneales (y por ende de los síntomas predictores como diplopía y claudicación mandibular), de una biopsia positiva (se espera que un 42% de la misma sea negativa) como lo fue en nuestro caso. En este grupo existe además una alta concentración de IL-2 y sobreexpresión de HLA-DRB1*0404. Clínicamente la disnea de esfuerzo y el dolor torácico son categóricos.
El síndrome de arco aórtico con claudicación de miembros superiores y soplos vasculares con alteración en la medición de pulsos, sobre todo en etapas tempranas de la enfermedad, junto con otras manifestaciones como el fenómeno de Raynaud, parestesias o gangrena digital en miembros inferiores, pueden darse de forma inusual. Las complicaciones aórticas en pacientes con ACG son preocupantes porque pueden ser asintomáticas hasta la muerte súbita por rotura aneurismática o cardiopatía isquémica. Se identificaron predictores de aneurismas; autores como Nuenninghoff et al y González Gay et al3 nombran a la hiperlipemia, la enfermedad coronaria, la hipertensión, la polimialgia reumática (PMR), la presencia de soplo de insuficiencia aórtica y las alteraciones de laboratorio de respuesta inflamatoria persistente, estando estos dos últimos parámetros presentes en la primera paciente. En cambio, las alteraciones en los pulsos y la presión arterial, claudicación de miembros, accidente isquémico transitorio o accidentes cerebrovasculares y diplopía en el momento del diagnóstico de ACG se asociaron con estenosis u oclusiones arteriales (de paredes lisas), alternando con zonas de calibre normal (sin placas ni úlceras) y localizadas especialmente en la arteria carótida, subclavia, axilar y braquial.
En la AT es bien conocido el compromiso aórtico (hasta un 65%), principalmente con estenosis u oclusión, presentando una heterogeneidad clínica según la variable de extensión vascular4 que a su vez se emplea para clasificar a la patología en subgrupos. La clasificación de Numano es una modificación de la clasificación de Nasu y se basa en diferentes patrones angiográficos, pero presenta limitaciones en cuanto a la diferenciación (subóptima) de pacientes clasificados en un mismo grupo. Recientemente un estudio observacional5 que incluyó 806 pacientes de dos cohortes, identificó tres grupos distintos definidos por el daño arterial. El grupo 1 mostró significativamente más enfermedad en la aorta abdominal, las arterias renales y mesentéricas, con manifestaciones clínicas como hipertensión arterial, claudicación de miembros inferiores, síntomas isquémicos afectando a pacientes más jóvenes; el grupo 2, pacientes con afectación predominantemente simétrica de los vasos del arco aórtico, con más probabilidades de tener antecedentes de accidente cerebrovascular, carotidinia y mareos, y menos posibilidades de lograr la remisión clínica; y el grupo 3 con predominio del compromiso focal asimétrica, sobre todo de la arteria subclavia izquierda, con menos riesgo de enfermedad oclusiva. Ellos notaron que esta asignación por grupos se mantuvo estable en el curso de la enfermedad, sin mostrar diferencias significativas en cuanto a la duración de la misma, descartando la teoría que se tratase de distintas etapas de la enfermedad.
Las pacientes descriptas en el segundo y tercer caso podrían ser parte del fenotipo del grupo 1 por los síntomas clínicos y el compromiso aórtico abdominal, con estenosis en el 93% y oclusiones en el 56% de los casos. Los segmentos estenosados suelen medir varios centímetros y pueden verse seguidos de zonas de dilatación, dándole un aspecto arrosariado como se observa en el segundo caso (Figura 2). Así como las lesiones por debajo y por encima del diafragma, descriptas en un 53% de los casos, presentes en las pacientes del segundo y tercer caso, donde el compromiso vascular progresó hasta la afección de la aorta torácica y en el caso de la segunda paciente afectó a la arteria pulmonar (expresándose clínicamente con tos y disnea), sí es inusual (3%). La dilatación de la raíz aórtica se expresa como insuficiencia aórtica que lleva a una dilatación ventricular izquierda (constatado en el estudio ecocardiográfico de la paciente), representa aproximadamente el 20% de los casos4. La RM cardíaca permitió objetivar el diagnóstico temprano de nuevos signos de actividad (engrosamiento de la pared, hiperintensidad en secuencias en T2 y captación de contraste en T1 a nivel parietal posiblemente debido a hiperemia intraparietal por inflamación) iniciando así el tratamiento inmunosupresor que permitió el control de la arteritis.
Más allá de descartar estas vasculitis, sobre todo en mujeres de edades menores de 40 años en caso de AT o mayores de 50 en ACG, debemos también considerar la afectación de la aorta y/o sus ramas en entidades como la ER-IgG4, cuyo espectro a nivel cardiovascular afecta a las arterias coronarias, las válvulas cardíacas, el miocardio, el pericardio, la aorta y la vasculatura periférica. A diferencia de las vasculitis de grandes vasos, la ER-IG4 afecta más a los hombres, y principalmente a mayores de 60 años. Dentro de las lesiones de la arteria coronaria, se describen lesiones estenóticas inducidas por una formación tumoral que rodea la arteria o por el engrosamiento del tejido blando periarterial a lo largo de la misma que llevan a isquemia miocárdica. En cuanto a las afecciones de las válvulas cardíacas, sobre todo válvula mitral y aórtica, sufren la infiltración de células plasmáticas positivas para IgG4, que alteran el funcionamiento y se expresan como estenosis, regurgitación y/o bloqueo cardíaco. Se comunicaron, además, casos de masas cardíacas asociadas a niveles elevados de IgG4 en sangre y dolor torácico. Las masas intracardíacas se han descripto en la pared inferolateral del ventrículo izquierdo, en el tracto de salida del ventrículo derecho y en la aurícula derecha, y pueden diagnosticarse mediante TC, RM y ecocardiografía. Estos hallazgos deben relacionarse con la presencia de lesiones extracardíacas por ER-IgG4 y análisis anatomopatológicos de las mismas que consisten en células fusiformes dentro de un estroma mixoide infiltrado con linfocitos, células plasmáticas y eosinófilos, donde abundan las células plasmáticas positivas para IgG46,7.
El infiltrado en el pericardio puede generar pericarditis, derrame pericárdico y taponamiento cardíaco. Los pacientes presentan disnea progresiva y fiebre, asociado a aumento de IgG4 sérica, y en la mayoría de los casos el tratamiento consiste en pericardiectomia, seguida de terapia con esteroides8.
La inflamación relacionada con la ER-IgG4 puede causar diferentes cambios morfológicos en la aorta, como aortitis, dilataciones aneurismáticas y/o periaortitis9-12. En cuanto a la aortitis, es mayor el compromiso de la aorta abdominal infrarrenal, mientras que en la AT el compromiso puede ser a cualquier nivel, y en la ACG es más frecuente la afección de arterias temporales y aorta torácica.
Stone propone tres criterios diagnósticos para el compromiso arterial relacionado a IgG4: una histología general que sea consistente con una aortitis o periaortitis (que no se explica fácilmente por otro proceso como la aterosclerosis), relación de células plasmáticas IgG4+/IgG total mayor al 50%, y al menos 50 células plasmáticas IgG4+ por campo de 400X en al menos tres campos13. Serán necesarios más estudios para determinar la sensibilidad y especificidad de estos criterios aún no validados. En 2019, Mizushima et al presentaron los criterios diagnósticos específicos de órgano, periaortitis/periarteritis y fibrosis retroperitoneal14.
La periaortitis relacionada con IgG4 se definió por la presencia de tejido blando perivascular anormal, con realce en los estudios contrastados y estrechamiento luminal mínimo. Las lesiones se forman alrededor de las arterias de mediano a gran calibre. Las lesiones pueden ocurrir en cualquier parte del arco ascendente, periaorta torácica y abdominal, así como alrededor de la arteria ilíaca. El sitio más común de la enfermedad involucra la aorta abdominal infrarrenal, como ocurrió en nuestro paciente del caso 4, y a la arteria ilíaca. En la aorta torácica, el arco es el más afectado. También se han documentado lesiones alrededor de las arterias mesentérica superior e inferior y la esplénica. Al igual que en nuestro caso, estas lesiones suelen presentarse en hombres de mediana edad y diagnosticarse por estudios de imágenes, donde se observan lesiones de densidad de partes blandas rodeando a los vasos sanguíneos. La periaortitis puede progresar a la ruptura de la arteria. Ozawa et al realizaron una investigación sobre 179 pacientes con ER-IgG4 y determinaron que la periaortitis/periarteritis se produjo en el 36% de los pacientes, principalmente masculinos con inicio tardío y mayor actividad de la enfermedad, predominantemente en la porción infrarrenal de la aorta abdominal9.
En cuanto a la aortitis, el compromiso de la pared arterial se caracteriza por inflamación de la capa adventicia, pudiendo extenderse hasta la media e íntima del vaso, a diferencia de la hiperplasia intimal que es constante en la AT y también hallada en la ACG. Se describe incluso que pueden progresar a dilataciones aneurismáticas (lesión más frecuente) como lo ocurrido en el caso 5, o disección9-14. Rara vez provocan estenosis o formación de trombos. Los pacientes con aortitis por ER-IgG4 suelen ser más añosos que aquellos con otras enfermedades inflamatorias (Takayasu o Behçet) y con predilección por el sexo masculino. Las manifestaciones clínicas suelen ser sutiles o inespecíficas como dorsalgia o dolor abdominal, por lo que al realizar TC que evidencia el compromiso arterial, este suele ser un hallazgo accidental. En 2014 Koo et al11 describieron en 1418 casos de cirugías de aneurismas o disecciones aórticas, la frecuencia, características clínicas y diagnóstico del compromiso aórtico en ER-IgG4, demostrando concordancia con series previas (hombres, mayores de 65 años). De los 41 casos de aortitis no infecciosa, tres tenían aortitis por ER-IgG4 (7%), dos aneurismas de la aorta torácica y uno aneurisma de la aorta abdominal. Los recuentos de células plasmáticas positivas para IgG4 fueron 60/CAP o más, infiltración linfoplasmocítica y/o fibrosis, pero no flebitis obliterante. Como método diagnóstico se propone la angio TC, angiorresonancia magnética (angio RMI) y PET-TC 18-fluorodesoxiglucosa (18-FDG). La aortitis relacionada con IgG4 se definió por la presencia de engrosamiento de la pared del vaso con realce en la fase de contraste o avidez de 18-FDG en PET, requiriéndose que la intensidad de estos hallazgos excediera la de la enfermedad aterosclerótica típica12. Con respecto al tratamiento de las lesiones aórticas y periaórticas, existen reportes de casos con buenos resultados luego de la administración de glucocorticoides más exéresis quirúrgica. No existe consenso sobre la dosis de corticoides en enfermedades cardiovasculares asociadas a IgG4, por lo que debe individualizarse (Tabla 2).
Otra entidad poco frecuente a tener en cuenta es la EEC, una rara histiocitosis de células no Langerhans, descrita inicialmente en 1930, que afecta principalmente a adultos (edad media 55 años), con predominio masculino (3:1).
En 2010, se descubrió la mutación BRAF V600E con lo que puede definirse como un trastorno clonal marcado por hiperactivación frecuente de la señalización de la proteína quinasa activada por mitógeno en la que un medio inflamatorio es importante en la patogénesis y en las manifestaciones clínicas de la enfermedad, siendo estas variadas según los órganos o sistemas afectados. La afección ósea (96%) es prácticamente constante, osteoesclerosis metafisodiafisaria de huesos largos, y el dolor esquelético aparece en cerca de la mitad de los pacientes (50%), así también la infiltración retroperitoneal, afección cardiovascular, del sistema nervioso central, exoftalmos y enfermedades pulmonares intersticiales son parte de las manifestaciones15,16.
El compromiso del sistema cardiovascular (CV) es uno de los más frecuentes (75%), aunque habitualmente asintomático. Entre las alteraciones observadas se encuentra la característica “coated aorta” (aorta recubierta) en un 40%. La infiltración periaórtica también puede afectar la porción torácica o abdominal de la aorta y puede extenderse a sus ramas principales. La infiltración de las arterias coronarias se observa en el 23% y puede complicarse con estenosis coronaria e infarto de miocardio como sucedió en el último caso descripto. La afección cardíaca es de mal pronóstico y puede provocar la muerte en el 31% de los casos. La insuficiencia respiratoria secundaria al compromiso intersticial pulmonar y el fallo cardíaco son las causas más frecuentes de muerte en estos pacientes.
Nuestro paciente presentaba insuficiencia cardíaca izquierda con una fracción de eyección (FEY) de 52%, la cual se diagnosticó por ecocardiograma Doppler programado. Haroche et al (2004)17 demostraron que las manifestaciones CV en la EEC son subdiagnosticadas. Se analizaron 178 pacientes con diagnóstico de EEC, de los cuales 72 presentaron afectación CV y 54 (75%) compromiso cardíaco: infiltración pericárdica en 32 pacientes (44%) con taponamiento cardíaco en 5 de ellos, 22 (31%) casos de infiltración de miocardio, tumor de la aurícula derecha en 6 pacientes y valvulopatía cardíaca sintomática en 6 (3 aorticas y 3 mitrales); 19 pacientes (26%) tuvieron insuficiencia cardíaca provocando la muerte en 8 pacientes, 6 casos de infarto agudo de miocardio responsable de dos muertes. Cuarenta de 72 pacientes (56%) presentaron fibrosis periaórtica y 20 de ellos mostraron la característica aorta “recubierta”. Durante su evolución, 58 pacientes (81%) fueron seguidos en el tiempo, 35 (60%) fallecieron. La muerte se produjo por afección cardiovascular en el 31% de los casos. Esto confirma el severo pronóstico de la EEC con compromiso cardiovascular.
La infiltración pericárdica es la manifestación cardíaca más frecuente de la EEC, y se presenta en aproximadamente del 42% al 45% de los casos. Esta afección puede observarse por TC y ecocardiograma. Haroche et al18 describieron los hallazgos de 37 pacientes con EEC con patología cardíaca estudiados mediante RM cardíaca, TC o ambas. Nueve pacientes (24%) presentaron derrame pericárdico y 5 (14%) engrosamiento pericárdico. Gupta et al presentaron un caso clínico de una mujer de 30 años de edad, con taponamiento cardíaco cuya biopsia pericárdica reveló lesiones xantogranulomatosas compuestas por células espumosas y macrófagos cargados de lípidos; la tinción inmunohistoquímica fue positiva para CD68 y negativa para CD1a. Tanto la TC como el ecocardiograma de nuestro paciente mostraron ausencia de compromiso pericárdico.
El compromiso miocárdico le sigue en frecuencia y se presenta principalmente con hipertrofia y engrosamiento miocárdico. Pueden afectarse las paredes ventriculares, auriculares, surco coronario y septum interauricular. La presencia de una lesión pseudotumoral en la aurícula derecha se ha comunicado en un 30% de los casos19, siendo el mixoma auricular el principal diagnóstico diferencial asociado a EEC. Nuestro paciente tampoco presentó engrosamiento miocárdico ni pseudotumor auricular.
Puede existir insuficiencia aórtica o insuficiencia mitral aproximadamente en un 17% de los casos, y durante los recambios valvulares se ha encontrado infiltración por histiocitos19-20.
Entre las características electrocardiográficas más frecuentes en pacientes con EEC se encuentran: segmentos PR cortos, bloqueo sinoauricular, bradicardia sinusal, presencia de ondas Q compatibles con isquemia miocárdica, anomalías en los segmentos ST y onda T. Nuestro paciente presentó ondas Q y ondas T negativas en las derivaciones DIII y AVF compatibles con lesiones isquémicas.
La infiltración vascular se ha identificado en un gran número de vasos adyacentes a la aorta, incluyendo el tronco braquiocefálico, la arteria carótida común, subclavia, coronarias, tronco pulmonar, tronco celíaco, arteria mesentérica superior y las arterias renales. Esto podría ocurrir por la naturaleza difusa del proceso xantogranulomatoso que afecta a los vasos. También puede presentarse estenosis arteriales asociada a dichas lesiones. Por lo tanto, la participación de las lesiones vasculares en la EEC puede conducir a consecuencias clínicas graves, principalmente cuando se presenta estenosis arterial. Esto puede llevar a isquemia cerebral por compromiso de las arterias carótidas, infarto agudo de miocardio debido a la afección coronaria, isquemia mesentérica por compromiso de la arteria mesentérica superior e hipertensión renovascular por estenosis de las arterias renales. El infarto agudo de miocardio secundario a la infiltración pericoronaria se ha comunicado en aproximadamente 15 casos, produciendo en algunos la muerte19-20.
Nuestro paciente del caso 8 presentó un síndrome coronario agudo, caracterizado por dolor retroesternal opresivo, junto con cambios electrocardiográficos y aumento de enzimas cardíacas. En la cinecoronariografía se observó obstrucción de un 80% del seno coronario y afección de la arteria coronaria derecha. El paciente recibió un bypass cardíaco.
Cuando se afectan las arterias de mediano y gran calibre puede simular una vasculitis. Existe información limitada sobre la afectación de la arteria iliofemoral y de las extremidades inferiores en la EEC (compromiso objetivado en la paciente del caso 6) debido a que se realizan menos exploraciones para evaluar sistemáticamente estos segmentos arteriales. Aunque la mayoría de los pacientes con hallazgos iliofemorales presenta una extensión contigua desde la aorta abdominal infrarrenal, la afectación de los vasos iliofemorales y poplíteos puede ocurrir en forma aislada de los hallazgos aórticos20.
El diagnóstico requiere de datos clínicos, hallazgos radiográficos de osteosclerosis diafisaria y metafisaria simétrica en las piernas que se visualiza mejor mediante la captación del radiotrazador en los extremos distales de los fémures y la tibia proximal y distal mediante gammagrafía ósea, y con menos sensibilidad mediante PET/TC, TC o RM. Es importante no pasar por alto la realización de radiografías simples. Algunos pacientes con EEC pueden no presentar necesariamente una afectación típica de los huesos largos (ya sea morfológica o metabólicamente) como fue el caso del último paciente descripto. En tales situaciones (menos del 5%), el diagnóstico requiere resultados histológicos como infiltración xantogranulomatosa, histiocitos espumosos, células gigantes multinucleadas de Touton, pudiendo presentar áreas de fibrosis circundante e infiltrado linfoplasmocitario, mientras que la inmunohistoquímica evidencia células no Langerhans CD1a negativas, CD 68 y CD 163 positivas, con variabilidad para la proteína S10021. Últimamente está teniendo mayor relevancia la prueba mutacional BRAF V600E, la cual puede apoyar el diagnóstico y tiene implicaciones para la terapia con inhibición de BRAF21.
Conclusiones
El compromiso cardiovascular en entidades como la ER-IgG4 y la EEC es variado y puede comprometer cualquier sitio anatómico con escasas manifestaciones clínicas; pueden confundirse con otras patologías reumatológicas como las vasculitis de mediano o grandes vasos, donde es necesario, pero no siempre posible, el examen histológico. Por lo tanto, valerse de ciertas características clínicas o imagenológicas puede orientar al momento del diagnóstico, sabiendo que la AT es más frecuente entre los 20 y 30 años, cursando con compromiso aórtico en forma de estenosis u oclusión, también la afección de la arteria pulmonar es orientativa. La ACG se sospecha en pacientes mayores de 50 años, con compromiso de arterias temporales y aorta torácica en forma de aneurisma. Así también, la aortitis torácica en pacientes jóvenes debe alertar a otras entidades como Behçet, sífilis o espondilitis anquilosante.
En cambio, la afección vascular en hombres mayores de 60 años y el mayor compromiso a nivel de la aorta abdominal infrarrenal, si bien pueden darse en forma aislada, es importante investigar el compromiso de otros órganos ya que la presencia de fibrosis retroperitoneal, el compromiso de huesos largos, la hidronefrosis, la injuria renal aguda posrrenal asociada a hipertensión arterial, la presencia de tejido fibrótico perirrenal, el engrosamiento de la fascia renal y del tejido adiposo perirrenal (signo del riñón peludo), además del tejido blando concéntrico que recubre la aorta (aorta recubierta), orientan al diagnóstico de ER-IgG4 y EEC.