El obinutuzumab es un anticuerpo monoclonal com pletamente humanizado dirigido contra el receptor CD20 presente en células B, aprobado por la Food and Drug Administration de EE.UU. para el tratamiento de la leu cemia linfocítica crónica (LLC) no tratada y refractaria. Usualmente es bien tolerado y sus efectos adversos más frecuentes son las reacciones relacionadas con la infusión (RRI) y la mielotoxicidad1. Se han descrito even tos cardiovasculares fatales, pero solo en pacientes con antecedentes cardiovasculares conocidos2.
Presentamos el caso de un hombre adulto con diag nóstico de LLC de alto riesgo que, poco después del inicio de su primera infusión de obinutuzumab, desarrolló angor y elevación de troponina, pero sin evidencia de lesiones ateroscleróticas coronarias, necrosis ni miocarditis.
Caso clínico
Varón de 67 años que fue internado en nuestro hospital para recibir de forma programada su primera infusión de obinutu zumab como parte del tratamiento de una LLC de alto riesgo, diagnosticada pocos meses antes a raíz de adenomegalias e hiperleucocitosis.
Dentro de sus antecedentes médicos se destacaban en fermedad pulmonar obstructiva crónica, tabaquismo (100 paquetes/año) y hepatitis B crónica que estaba siendo tratada con tenofovir. No tenía ningún antecedente cardiovascular conocido.
Al momento del ingreso estaba hemodinámicamente esta ble, y en el examen físico se constató palidez, hepatoespleno megalia y adenopatías generalizadas. Los datos de laboratorio relevantes eran anemia (hemoglobina 7 g/dl), hiperleucocitosis (133 570 células/μl) y elevación de lactato deshidrogenasa (598 U/l). El electrocardiograma (ECG) obtenido antes del inicio de tratamiento era normal.
Luego de la administración de premedicación (paraceta mol, hidrocortisona y difenhidramina) se inició la infusión de 100 mg de obinutuzumab a razón de 25 mg/h, regulada por bomba de infusión continua.
Transcurridos 30 minutos, el paciente se quejó de la apari ción repentina de un dolor retroesternal opresivo, no irradiado, con una intensidad 9/10, asociado a sudoración profusa. Un nuevo ECG mostró rectificación global del segmento ST y negativización de ondas T en la cara inferolateral. Se detuvo la infusión y a los pocos minutos el dolor desapareció. La Figu ra 1 muestra el electrocardiograma inicial, el obtenido durante el dolor y el correspondiente a la remisión de los síntomas.

Fig. 1 Electrocardiogramas. A: Al ingreso, con repolarización normal. B: Durante la infusión de obinutuzumab. Se observa aplanamiento de las ondas T e infradesnivel del segmento ST en cara inferolateral. C: Remisión de los cambios electrocardiográficos luego de la suspensión de la infusión con el paciente asintomático
La troponina basal fue de 11 ng/l, y alcanzó un pico de 273 ng/l a las 3 horas. El ecocardiograma Doppler informó función sistólica del ventrículo izquierdo normal sin trastornos de la motilidad parietal global ni segmentaria. Se realizó una cineangiocoronariografía que no demostró lesiones ateroscle róticas (Fig. 2). Una cardiorresonancia posterior fue negativa para necrosis o signos de miocarditis.
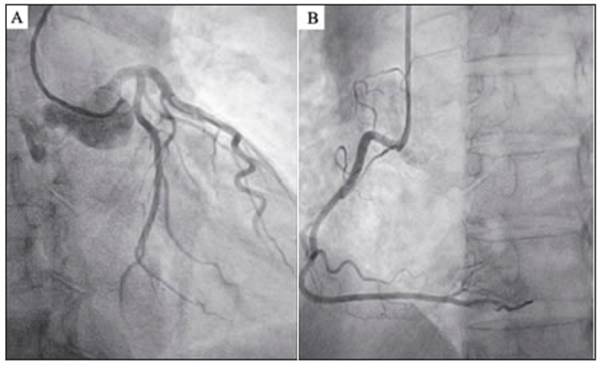
Fig. 2 Cinecoronariografía sin lesiones. A: Arteria coronaria izquierda y sus ramas. B: Arteria coronaria derecha dominante
El tratamiento con obinutuzumab fue suspendido y re emplazado por ibrutinib, un inhibidor de la tirosina quinasa, con lo que el paciente alcanzó la remisión completa de su enfermedad sin efectos adversos asociados. En controles posteriores a los 6 meses y al año, se encontraba asintomático y libre de enfermedad.
Discusión
Históricamente, el tratamiento de la LLC era principalmen te paliativo. La introducción del anticuerpo monoclonal contra la proteína CD20 rituximab, combinado con fluda rabina y ciclofosfamida (régimen DCR) o bendamustina (esquema BR), modificó el pronóstico e incrementó la supervivencia3.
CD20 es una proteína expresada en la superficie de las células B desde el estadio pre-B hasta que las células post-germinales se diferencian a células plasmáticas. Como CD20 no se libera ni internaliza en las células B normales, sirve como un blanco ideal para el tratamiento de malignidades de células B maduras como la LLC1.
Los anticuerpos monoclonales pueden actuar por tres mecanismos: 1) citotoxicidad dependiente de anticuerpos, 2) citotoxicidad dependiente del complemento, y 3) muerte celular directa mediante inhibición de la proliferación y apoptosis1. A su vez, los anticuerpos monoclonales contra CD20 se clasifican en dos grupos. Los del tipo I, como rituximab y ofatumumab, provocan la translocación y es tabilización de CD20 en microdominios lipídicos (rafts, en inglés) de la membrana plasmática, e inducen una potente citotoxicidad dependiente de anticuerpos. Los anticuerpos monoclonales del tipo II, como obinutuzumab, actúan me diante la muerte celular directa y citotoxicidad dependiente de anticuerpos4. La mayor capacidad de obinutuzumab para generar muerte celular, con menor activación del complemento, radica en el fragmento cristalizable (Fc) modificado mediante glicoingeniería5.
Freeman y col. demostraron que la primera infusión de obinutuzumab como tratamiento de LLC genera una rápida destrucción de células B circulantes que se asocia a un pico plasmático de citoquinas como interleucina 6 (IL-6), interleucina 8 (IL-8) y factor de necrosis tumoral alfa (TNF-α), lo que probablemente explique sus efectos adversos6.
Las reacciones relacionadas a infusión (RRI) de fárma cos son aquellas que aparecen durante la administración de una droga o agente biológico7. Los efectos adversos más frecuentes del obinutuzumab son neutropenia, trombocitopenia, infecciones y RRI. De hecho, en un estudio aleatorizado, las RRI fueron la principal razón de abandono del tratamiento8. Ha habido comunicaciones de infarto agudo de miocardio como RRI de rituximab, pero en pacientes con enfermedad coronaria preexistente. Los mecanismos propuestos fueron vasoconstricción coronaria, la generación de un ambiente protrombótico y proinflamatorio, e inestabilidad de placa causados por la liberación de citoquinas y endotelina 1 (ET-1)9,10.
Nuestro paciente era portador de algunas de las características propuestas por Freeman para predecir mayor riesgo de experimentar una RRI con obinutuzu mab: esplenomegalia, leucocitosis y enfermedad pul monar preexistente. El riesgo también es mayor cuando se cumplen: expresión de CD20 en células de LLC con inmunofenotipo CD19+CD5+, mayor expresión de CD16 en células NK CD56+, neutropenia y un genotipo de FcγR con mayor afinidad5.
Según las recomendaciones del estudio CLL118, la primera dosis de obinutuzumab debe administrarse divi dida en 2 días consecutivos: 100 mg el día 1, y 900 mg el día 2. Los restantes tratamientos se administran como dosis completa11. La eficacia y seguridad de obinutuzu mab como tratamiento de LLC también se demostró en estudios posteriores12-14.
Con la presentación clínica de nuestro paciente, con sistente en angor, apoyada por la franca elevación de la troponina, hicimos el diagnóstico provisorio de infarto agudo de miocardio sin elevación del ST. La ulterior de mostración mediante cinecoronariografía de arterias co ronarias sanas nos llevaron a considerar la posibilidad de que la presentación se enmarcara en el concepto infarto de miocardio con arterias coronarias sin lesiones obstruc tivas (MINOCA, por sus siglas en inglés)15. No obstante, por la ausencia de necrosis y de miocarditis, el cuadro clínico fue compatible con una injuria subendocárdica. Esto aconteció en un paciente con arterias coronarias sin lesiones demostrables por cineangiocoronariografía, y se relacionó temporalmente a la infusión de obinutuzumab.
El hecho de que los síntomas y los cambios electrocar diográficos se desencadenaran poco después del inicio de la administración del anticuerpo monoclonal, respaldado por la desaparición casi inmediata luego de su suspen sión, nos llevaron a sospechar que el obinutuzumab po dría haber sido el desencadenante. Si fuera el caso, y en la misma línea de pensamiento que en informes similares relacionado a rituximab, creemos que la liberación de citoquinas y ET-1 habrían tenido un papel fundamental.














