PUNTOS CLAVE
• No hay suficiente evidencia científica de la respuesta inmuno-oncológica del cáncer de mama triple negativo y la comprensión del microambiente tumoral en poblaciones latinoamericanas.
• En el estudio analizamos en una pobla ción del caribe colombiano la expresión de puntos de control inmunológico PD-L1 e infiltración linfocitaria intratumoral es tromal en cáncer de mama de endofeno tipo triple negativo de forma comparativa con los grupos luminales A, B y HER-2, así como otras características histopatológicas y clínicas con el fin de aproximarnos en la comprensión del comportamiento biológi co de esta enfermedad.
El cáncer de mama es la neoplasia maligna más común a nivel mundial, con 2.3 millones de casos nuevos, alcanzado una incidencia de 11.7% y ocupando el quinto lugar en mortali dad por cáncer para el año 2020, con un incre mento progresivo en países de América del Sur1. Aunque se conocen mecanismos asociados a la progresión tumoral con el advenimiento de la inmuno-oncología se consideraron relevantes otras características como el microambiente tu moral, en particular la infiltración por linfocitos intratumorales2,3, para evaluar la respuesta fisio patológica del huésped ante la célula tumoral, lo que ha contribuido al desarrollo de la inmunote rapia3,4. A pesar de que el cáncer de mama no es considerado un tipo de tumor con alta inmuno genicidad4, los productos alterados de la proteína originados por las mutaciones genéticas en las células cancerosas pueden funcionar como neoantígenos y estimular la respuesta inmune adaptativa5,6. En las últimas décadas, se ha de mostrado la asociación entre los linfocitos infil trantes de tumores (TIL) y la alta expresión de ligando de muerte celular programada (PD-L1) en multiplicidad de cánceres7, constituyéndose en una prometedora opción terapéutica en neo plasias como el cáncer de mama, principalmen te en los grupos etarios de jóvenes y carcinomas infiltrantes triple negativo (TNBC)8-10. En ese sen tido, las proteínas como el PD-1 y su ligando PD-L1 han alcanzado importancia biológica, debido a la ubicación de PD-1 en la membrana celular en los linfocitos T y de PD-L1 de forma consti tutiva transmembrana en células presentadoras de antígenos (APCs), en linfocitos en reposo, cé lulas endoteliales, entre otras y de manera inducida en células tumorales de ovario, mama, riñón, melanomas, colorrectales, pulmonares y pancreáticas11-13, estableciendo microambientes tumorales inmunosupresores que inducen a la tolerancia inmunológica y limitan la respuesta a las neoplasias o infecciones mediante interacciones con los demás miembros de la familia de receptores de la familia CD28 en los linfocitos T y B al cual pertenece a través de señales coinhi bitorias y coestimuladoras9,11.
A continuación, presentamos un estudio de casos y controles realizados en 88 muestras de cáncer de mama infiltrante, donde se evaluó el microambiente tumoral a través de la cuantifi cación de linfocitos intratumorales y la expre sión de PD-L1 en el cáncer de mama de endofe notipo triple negativo (TNBC).
Materiales y métodos
Grupo de estudio: Se realizó un estudio retrospectivo de casos y controles en el departamento de patología de una institución prestadora de servicios de salud en el ca ribe colombiano durante un año de atención (diciembre 2021- diciembre 2022), identificando los casos reportados como carcinoma infiltrante de la mama, a los cuales se realizó el perfil inmunofenotípico evaluando la expresión de receptor de estrógeno (RE), receptor de progesterona (RP), el receptor 2 del factor de crecimiento epidérmico humano (HER-2) y KI-67 para categorizar en grupos mo leculares Luminal A, Luminal B, HER-2, TNBC. Se seleccio nó el tamaño de la muestra con 31 casos de carcinoma infiltrante de la mama triple negativo teniendo en cuen ta el porcentaje de positividad de TNBC informados en Colombia, que oscila entre 13 y 20%, y se tomaron como controles no pareados 57 casos categorizados en los en dofenotipos moleculares Luminal A, B y HER-2 positivo, calculados según Fleiss con corrección de continuidad a partir de un nivel de confianza del 99%, una potencia (% de probabilidad de detección) de 95, una razón de contro les por caso 1, una proporción hipotética de controles con exposición de 87% y una proporción hipotética de casos con exposición de 13 y 20%. Se incluyó en el estudio los carcinomas de mama infiltrantes y se analizaron las si guientes variables: el tipo histológico, grado histológico, infiltración linfocitaria intratumoral, expresión de PD-L1, invasión linfovascular, tamaño tumoral, compromiso de ganglios linfáticos y metástasis a otros órganos.
Cuantificación de linfocitos intratumorales estromales (TILs): Se realizó el análisis histopatológico en tejido mamario tumoral embebido en parafina según las reco mendaciones del Grupo de Trabajo Internacional para TIL en cáncer de mama. Se realizaron cortes histológi cos con tinción de hematoxilina y eosina, evaluando en el área del estroma tumoral el porcentaje de infiltrado inflamatorio mononuclear y excluyendo los leucocitos polimorfonucleares, los TIL fuera del borde tumoral, de tritus celular, necrosis, puntos calientes y zonas tumora les con artificios por aplastamiento. Teniendo en cuenta el porcentaje de infiltración se realizó la clasificación por grupos: A mínimo o ausente infiltrado inflamatorio (0- 10% TILs estromal), B infiltrado inflamatorio intermedio (10-40% TILs estromal), C infiltrado inflamatorio elevado (40-90% TILs estromal)14,15.
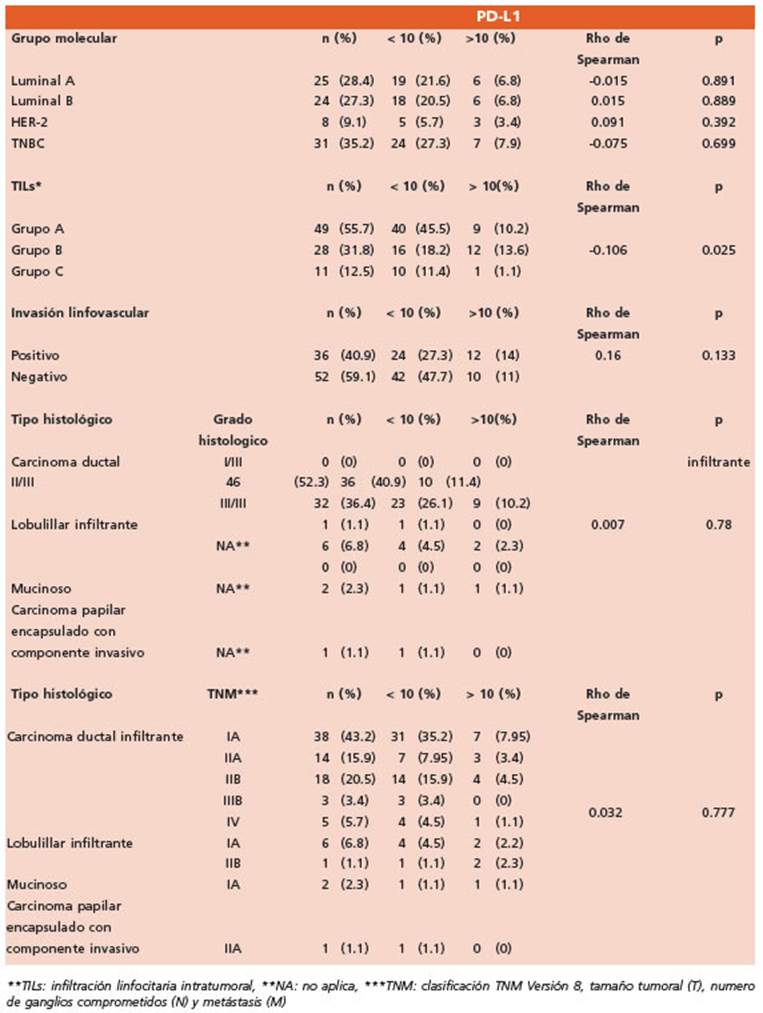
Evaluación de la expresión de PD-L1: Se realizó la estima ción de la expresión por inmunohistoquímica de PD-L1 con el clon 22C3 (DAKO PharmaDx). Para la evaluación de la inmunomarcación se empleó el Puntaje Positivo Com binado (Combined Positive Score, CPS), la cual incluye las células tumorales, linfocitos, macrófagos/histiocitos, di vidido por el número total de células tumorales viables, multiplicado por 100, teniendo en cuenta el punto de cor te positivo ≥ 10 para TNBC (Fig. 1). Se tomó como control el epitelio de superficie de las amígdalas.
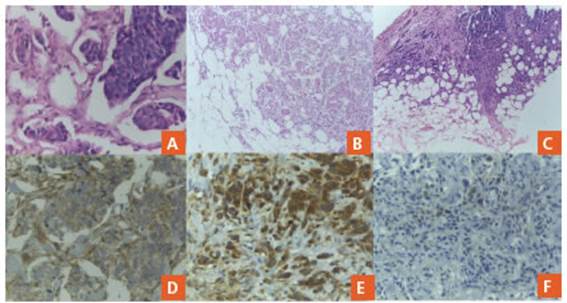
Figura 1 A: H&E 400x TILs Grupo A. B: H&E 200x TILs Grupo B. C: H&E 200x TILs Grupo C. D: 200x PD-L1 positivo CPS >10 con patrón de membrana celular en linfocitos y células tumorales. E: 200x PD-L1 positivo CPS >10 con patrón de citoplasmático en linfocitos y células tumorales. F: 200x PD-L1 negativo CPS < 10 en linfocitos y células tumorales
Análisis estadístico: Para el análisis se empleó el paque te estadístico SPSS en V.27.0. Se realizaron dos estadísti cos, en primera instancia la prueba de independencia de chi cuadrado tomando como nivel de significancia <0.05 en todos los casos. Posteriormente, se ejecutó la prueba de coeficiente de correlación de Spearman para variables no paramétricas, tomando como hipótesis nula (rho = 0) y alternativa (rho ≠ 0), por tanto, si se rechazaba la hipó tesis nula las variables estarían correlacionadas. El rango de interpretación de coeficiente de Spearman varía desde -1 correspondiente a correlación negativa alta y perfecta, 0 correlación nula, hasta +1 correlación negativa alta y perfecta16.
El presente estudio fue aprobado por el comité de ética en investigación de la División Ciencias de la Salud de la Universidad del Norte, Acta de Evaluación N° 188 del 23 de mayo de 2019 en Barranquilla-Colombia. Todos los pacientes participantes en el estudio firmaron consenti miento informado para autorizar la participación en la investigación.
Resultados
En el estudio se evaluaron la expresión de PD-L1, TILs, invasión linfovascular, grado histológi co, tipo histológico, grupo molecular y estadio tumoral. Los resultados de esta investigación se muestran en las Tablas 1, 2 y 3.
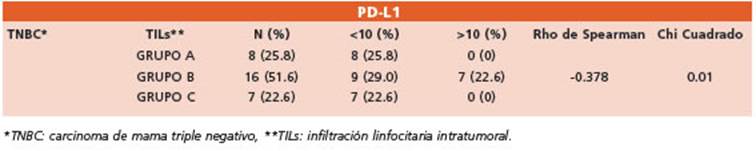
Tabla 2 Análisis estadístico de la infiltración linfocitaria intratumoral estromal en el endofenotipo TNBC * y expresión de PD-L1
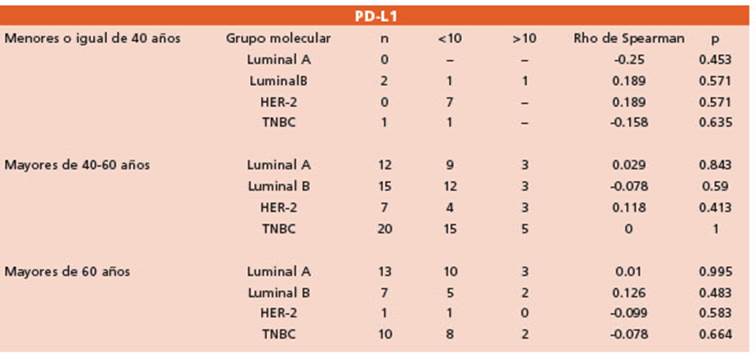
Tabla 3 Análisis estadístico por edades de los grupos moleculares y la correlación con la expresión de PD-L1
Expresión de PD-L1 y características clínicas e histopatológicas: En la población estudiada, in cluyendo todos los subtipos moleculares, se ob servó positividad en 22 casos (25%) para PD-L1 tomando como punto de corte CPS mayor de 10, encontrando un coeficiente de correlación de Spearman (rho) muy bajo en el grupo de ca sos TNBC y en el grupo control conteniendo los inmunofenotipos luminal A, luminal B y HER-2. Con respecto a TILs y PD-L1, se identificó una correlación negativa estadísticamente signifi cativa, lo cual indica que a mayor expresión de PD-L1, es menor la infiltración linfocitaria in tratumoral. En relación con la evaluación de los valores obtenidos en la cuantificación de TILs, en los grupos B y C donde se presenta marcado infiltrado inflamatorio intratumoral se eviden ció mayor número de pacientes negativos para PD-L1 (CPS <10).
En cuanto a la presencia de invasión linfovas cular, en la mayoría de los tejidos tumorales eva luados fue negativa y en estos casos predomi nantemente no hubo reactividad para PD-L1, sin embargo, no se demostró un nivel de correlación relevante entre estas variables.
Analizando el tipo y grado histológico se en contraron 4 variantes morfológicas, siendo el más frecuente el tipo ductal infiltrante seguido de lobulillar infiltrante, mucinoso y de forma in usual 1 caso de carcinoma papilar encapsulado con componente invasivo. El grado histológico equivalente (Clasificación Richardson-Bloom en carcinomas ductales infiltrantes y grado nuclear para los demás tipos histológicos) que predomi nó fue el grado II. En la evaluación estadística no se encontró un coeficiente de correlación es tadísticamente significativo con la expresión de PD-L1.
Con respecto al estadio tumoral se definió con la clasificación TNM Versión 8, la cual incluye el tamaño tumoral (T), número de ganglios com prometidos (N) y metástasis (M). La mayoría de las pacientes se categorizó en estadio IA seguido de IIB y IIA, sin establecer una correlación entre estos y la reactividad para PD-L1.
La edad media de las pacientes ingresadas al estudio fue de 55 años. No se registró asociación entre la edad y PD-L1 en las células tumorales en los distintos grupos moleculares.
Infiltración de linfocitos intratumorales (TILs), ex presión de PD-L1 y TNBC: Evaluando la correlación de los 31 casos TNBC y los TILs, se identificó que la mayor población de pacientes presentaba ni veles intermedios a elevados de linfocitos intra tumorales (grupos B y C), los cuales se asociaron principalmente con ausencia de expresión de PD-L1 (CPS < 10). Estadísticamente se estableció un coeficiente de asociación negativa (rho -0.378) con alto nivel de significancia (p 0.01).
Discusión
En las últimas dos décadas la investigación científica con relación al cáncer de mama per mitió la identificación de perfiles moleculares basados en la expresión de RE, RP, HER-2 y el ín dice de proliferación celular17,18, los cuales otor gan características distintivas desde el punto de vista clínico, epidemiológico, genético, inmuno lógico y pronóstico17,19. Particularmente el cán cer de mama de endofenotipo triple negativo es un subtipo molecular que alcanza una frecuen cia entre los grupos moleculares de 12% al 20% en Norteamérica20,21, mientras que en Latinoa mérica se ha diagnosticado predominantemen te en mujeres jóvenes con edades menores a 45 años seguido de la edad postmenopáusica con una prevalencia que varía entre 17.8%, 19%, 22% y 35% en los países de Chile, Perú, Costa Rica, y México respectivamente21,22. En Colombia oscila en el rango de 13.5% a 20.6%23,24.
Analizando la patogénesis del cáncer de mama triple negativo, esta es una entidad hete rogénea que presenta distintos tipos histológi cos, perfil inmunológico y expresión genómica que derivan en subgrupos fisiopatológicos de tumores basal-like - 1 (BL1), tumores basal-like - 2 (BL2), mesenquimatoso (M) y receptor de an drógenos luminales (LAR), con comportamien to biológico clínicamente agresivo y carente de diana terapéutica específica24,25. En los últimos años, con el auge del análisis inmunológico en neoplasias, la infiltración linfocitaria intra tumoral ha sido considerada relevante en la patogenia de los TNBC debido a la interacción que establece los linfocitos con algunas células como los fibroblastos y el endotelio en los va sos sanguíneos linfáticos conformando el mi croambiente tumoral y determinar la evolución del tumor, considerando estas características distintivas del grupo M10. En el estudio actual, 23 casos diagnosticados como TNBC exhibieron niveles de TILs intermedio y alto, concordando con lo reportado en la literatura científica13,26-29, asociando esta característica en investigacio nes recientes con mejor evolución y respuesta a la quimioterapia tanto en la modalidad neoad yuvante como adyuvante10. Sin embargo, revi sando los resultados obtenidos en la totalidad de los casos y grupos moleculares, se observó una tendencia a niveles de TILs bajos (grupo A), con una media de 55.6% coincidiendo con otros grupos científicos13,26,30,31, quienes concluyeron que el aumento de TILs en tumores con ausen cia de expresión de HER-2 se constituyó en un factor pronóstico adverso para la supervivencia, a diferencia de lo observado en los grupos TNBC y HER-2 positivo, donde se relacionó con beneficio en la supervivencia31-33.
Otro componente relevante en la fisiopatolo gía del TNBC, es el PD-L1 por su capacidad para estimular un punto de bloqueo inmunológico y su utilidad como diana terapéutica9,11. En el cán cer de mama se han reportado bajos niveles celu lares de PD-L134, como se observó en este estudio con 25% de positividad en la población analizada; aunque, es evidente la variabilidad en series de casos con un rango amplio que oscila entre 20%26, 36.7%35, 40.9%36, 41.828, 56.137, alcanzando valores de 58%13. Este fenómeno puede explicarse bioló gicamente debido a los diferentes mecanismos regulatorios que controlan la expresión de PD-L1 en la membrana celular y que se han explorado experimentalmente11. Entre éstos, el control ge nético con alteraciones en el promotor del gen PD-L1 (ampliaciones, translocaciones y polimor fismos), regulación mediante vías metabólicas como RAS/RAF/MEK/MAPK-ERK y PI3K/AKT/ mTOR, intervenciones postranscripcionales me diante la ruta Janus kinase/STAT/interferon‐γ, el factor inducible por hipoxia y microARNs, y final mente señales de ubiquitinación que intervienen en la fase postraduccional del PD-L19,11.
Desde el punto de vista técnico, esta fluctua ción en las cifras se ha relacionado con factores como el tipo de clon utilizado para la evalua ción histopatológica por inmunohistoquímica que deriva en un sistema de puntuación dife rente para reconocer la reactividad de PD-L1 en las células tumorales, macrófagos / histiocitos y linfocitos. De igual forma, se plantea que el tipo de muestra evaluada (tissue microarrays, biopsias con aguja trucut y especímenes de re sección fijadas y embebidas en parafina, entre otras) y la técnica empleada para su detección pueden impactar en la identificación de PD-L1, siendo mayor el porcentaje de expresión en aquellos donde se utilizó la técnica de ARN mensajero in situ13,35. En la práctica clínica es relevante, ya que en la actualidad existen me dicamentos aprobados para diana terapéutica del eje PD-L1/PD-1. Algunos de ellos poseen ensayos clínicos aprobados para su utilización en el cáncer de mama triple negativo avanza do metastásico en primera línea combinados con otros agentes farmacológicos y como tera pia neoadyuvante. Por ejemplo, atezolizumab para PD-L1 y pembrolizumab quien cumple la función anti-PD-1, observando en la mayoría de ellos actividad clínica con beneficio de una supervivencia libre de progresión y potencial mente aceptable para su uso38-40.
Con respecto a los grupos moleculares lumina les, la proporción de positividad de PD-L1 encon trada en la investigación fue de 24% con niveles de TILs predominantemente bajos (Grupo A), y con escaso nivel de correlación coincidiendo con lo evidenciado en la literatura científica41. La ex presión de PD-L1 no se ha relacionado con una mejor supervivencia, independiente de los efec tos atribuidos a la positividad del RE y RP en cán ceres de mama de fenotipo luminal41. En el grupo HER-2 observamos mayor número de casos PD-L1 negativo y niveles de TILs bajos sin encontrar una correlación importante entre estas variables; no obstante, se ha planteado en ensayos clínicos que la inmunorreactividad para PD-L1 asociado a TILs bajos se constituye un indicador independiente de mal pronóstico y peor supervivencia41.
Basado en la interacción de PD-L1 y TILs en diversos tipos de tumores, se han propuesto 4 microambientes tumorales con el objetivo de ampliar nuevos enfoques que permitan diseñar terapias combinadas acordes con la inmunolo gía tumoral, estableciendo las siguientes aso ciaciones con significado clínico y frecuencia (F) variable principalmente en pacientes con melanoma: cáncer tipo I (F:38%), resistencia in mune adaptativa (PD-L1+,TILs+), cáncer tipo II (F: 41%), ignorancia inmunológica ( PD-L1- TILs- ), cáncer tipo III ( F: 1%), inducción intrínseca (PD-L1+ TILs-), y cáncer tipo IV (F: 20%), tole rancia inmune (PD-L1- TILs+)42. En ese sentido, revisando los resultados obtenidos en todos los grupos moleculares, los niveles de TILs y PD-L1 negativos fueron la mayor proporción encon trada, perteneciendo al grupo de ignorancia inmunológica (cáncer tipo II), el cual ha sido descrito con mayor frecuencia y con pronósti co desfavorable debido a su falta de reacción inmune detectable43,44. No obstante, en el sub tipo TNBC los niveles de TILs observados fue ron categorizados principalmente en el grupo B (Infiltración linfocitaria heterogénea e inter media) correspondiente al 51.61% de los casos estudiados concordando con lo expresado por otros investigadores en poblaciones latinoame ricanas29 y asociado a positividad para PD-L1 con comportamiento biológico de resistencia inmune adaptativa (cáncer tipo I).
Con esta investigación se puede concluir que en la población estudiada del caribe co lombiano existe una correlación entre las va riables PD-L1, infiltración linfocitaria intratu moral y TNBC, los cuales se constituyen como biomarcadores pronósticos y predictivos para la instauración de terapias dirigidas, mientras que, con las variables histopatológicas como ta maño tumoral, invasión linfovascular y demás fenotipos moleculares, no se logró establecer una asociación. A partir de este conocimiento se propone que se debe ampliar el espectro de búsqueda en los procesos que median las vías de progresión tumoral que permitan predecir el comportamiento biológico en los pacientes con esta enfermedad, haciendo énfasis en la iden tificación de puntos específicos susceptibles de intervención farmacológica, fortaleciendo con ello el desarrollo de la medicina de precisión en TNBC.