Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fave. Sección ciencias agrarias
versión impresa ISSN 1666-7719
FAVE. Secc. Cienc. agrar. vol.14 no.2 Santa Fe dic. 2015
ARTICULO ORIGINAL
Eficacia residual de fungicidas sobre la roya de la hoja del trigo y su efecto sobre componentes del rendimiento y porcentaje de proteínas en grano
Fleitas, M.C.1,2; Gerard, G.S.1,2 Y Simón, M.R.1
1Cátedra de Cerealicultura. Facultad de Ciencias Agrarias y Forestales, UNLP. Av. 60 y 119 s/n. La Plata, Buenos Aires, Argentina (CP: 1900). Tel.: +54 (0221) 423-6758 int. 410
2 CONICET CCT La Plata. Calle 8 Nº 1467. La Plata, Buenos Aires, Argentina. Tel.: +54(0221) 457-6423
constanzafleitas@gmail.com
RESUMEN
La roya de la hoja causada por Puccinia triticina Erikss. es una de las enfermedades foliares de trigo (Triticum aestivum L.) que produce considerables pérdidas en el rendimiento y la calidad del cultivo. Si bien la enfermedad puede reducir tanto la acumulación de hidratos de carbono como la de nitrógeno en el grano, generalmente el efecto sobre este último es más marcado. Existe variabilidad en la eficacia de diferentes fungicidas utilizados para su control, la cual está influenciada por varios factores, entre ellos el principio activo. El objetivo de este trabajo fue evaluar la eficacia y residualidad de diferentes mezclas de fungicidas para el control de la enfermedad y su efecto sobre los componentes del rendimiento y el porcentaje de proteínas en grano. Los fungicidas utilizados incluyeron diferentes combinaciones de triazoles y estrobilurinas y una triple mezcla de triazol, estrobilurina y carboxamida. Se realizó un ensayo completamente aleatorizado en macetas con cinco tratamientos de fungicidas aplicados a un cultivar susceptible. Todo el ensayo fue inoculado en seis oportunidades con esporas de P. triticina. El tratamiento con la triple mezcla obtuvo una mayor eficacia y residualidad de control e incrementó el número de granos/espiga, el peso de mil granos y el porcentaje de proteínas en grano.
Palabras claves: Fungicidas foliares; Trigo; Eficacia residual; Roya de la hoja
SUMMARY
Leaf rust caused by Puccinia triticina Erikss. is a major foliar disease of wheat (Triticum aestivum L.) causing considerable yield and quality losses in the crop. Although the disease can reduce both, the accumulation of carbohydrates and the nitrogen in the grain, usually the latter effect is more marked. Variability in fungicide efficacy used for disease control is affected by several factors, including the active ingredient. The aims of this study were to evaluate the efficacy and residual activity of four different fungicide mixtures against leaf rust and its effect on yield components and grain protein content. A trial was conducted in a randomized block design with five fungicide treatments (including control, triazoles, strobilurins and a triple mix including a triazole, a strobilurin and a carboxamide) applied to a susceptible cultivar. The whole experiment was inoculated six times with spores of P. triticina. The fungicides evaluated showed differences in control efficacy and residual efficacy. The treatment including the triple mixture had the highest efficacy and residual effect. It also produced the highest increase in yield components and grain protein content.
Key words: Fungicides; Wheat; Residual efficacy; Leaf rust
INTRODUCCIÓN
Las enfermedades foliares causadas por hongos son la mayor restricción biótica que limita el rendimiento y la calidad en trigo (Triticum aestivum L.) (24, 12, 27). En Argentina, la roya de la hoja es ocasionada por un organismo biotrófico (Puccinia triticina Erikss.) cuyo agente causal es un parásito obligado que no sobrevive sin un hospedante vivo. Esta enfermedad puede causar epifitias que son rápidas y explosivas (33). Roelfs et al. (22) han mencionado que las pérdidas debidas a P. triticina son usualmente pequeñas (menores al 10%), pero pueden ser severas (30 % o más). Pérez Fernández (20) registró pérdidas de hasta el 55 % en epidemias severas dado por reducciones significativas en el número de granos por espiga y/o por el peso de mil granos. Por otro lado, Campos (7) ha mencionado que las pérdidas de rendimiento en cultivares altamente susceptibles pueden superar el 30 %. Reducciones en el peso de los granos se deben a que el patógeno reduce el área fotosintéticamente activa, aumenta la respiración y transpiración en tejidos dañados lo que restringe la removilización de asimilados a granos en desarrollo (10).
Por otra parte, la infección con P. triticina puede ser más limitante para la acumulación de nitrógeno (N) en el grano que para la acumulación de materia seca. Esto ocasiona que frecuentemente la concentración de proteína aumente al controlar las royas con fungicidas (26). Si bien P. triticina puede reducir la acumulación de hidratos de carbono y de N en el grano, generalmente el efecto sobre éste último es más marcado (10, 23).
En Argentina la aplicación de fungicidas es una práctica habitual en el manejo de enfermedades en trigo. Más aún, el uso de fungicidas es importante porque la región triguera argentina combina cultivares moderadamente susceptibles de base genética estrecha, con elevado potencial de rendimiento y sembrados en una gran superficie. Todo esto, sumado a una elevada presión de inóculo del patógeno derivado de adecuados niveles de humedad, temperatura y grandes aplicaciones de N, promueve el desarrollo de P. triticina.
El principal objetivo del uso de un fungicida foliar es proteger el rendimiento alcanzable de pérdidas ocasionadas por enfermedades foliares. Sin embargo, los diferentes fungicidas pueden variar el nivel de control dependiendo del agente causal, de la especie vegetal, de las condiciones ambientales y de las medidas de manejo utilizadas. Diferencias de eficacia de control entre fungicidas pueden ser determinadas por comparación directa entre productos basados en una sola aplicación en la dosis indicada (8). En este sentido, conocer umbrales, perfiles sanitarios y la eficacia de un fungicida frente a cada patógeno en particular determinará el número correcto de aplicaciones secuenciales que se deben realizar; evitando un exceso de aplicaciones, respetando dosis de marbete y, por consiguiente, disminuyendo la probabilidad de generar resistencia en el patógeno. En general en los últimos años no se han desarrollado nuevas moléculas fungicidas con diferentes mecanismos de acción de manera que el riesgo de generar resistencia es elevado.
En Argentina los triazoles y las estrobilurinas son los fungicidas sistémicos más utilizados para controlar enfermedades foliares. Las estrobilurinas poseen un alto riesgo de generar resistencia en el patógeno, mientras que el riesgo en los triazoles es medio (19). Estos autores han señalado resistencia de royas a triazoles y estrobilurinas. Dado que existe resistencia cruzada entre estrobilurinas es esencial realizar un manejo adecuado para evitar problemas de resistencia. Por consiguiente, todo plan de aplicación de fungicidas debe contemplar la alternancia de dos o más fungicidas con diferente mecanismo de acción.
Por un lado, los triazoles son fungicidas que se caracterizan por poseer un principio activo inhibidor del ergosterol afectando la permeabilidad de la membrana lipídica del hongo. Los triazoles son fungicidas sistémicos, curativos y erradicantes que penetran en tejidos jóvenes y se mueven por xilema en forma acrópeta (3). Por otro lado, las estrobilurinas son derivados sintéticos de compuestos que se producen naturalmente (Strobilurus tenacellus) con una actividad antifúngica de amplio espectro por ser un inhibidor de la respiración mitocondrial (afectan el transporte de electrones) a nivel del complejo III. Las estrobilurinas son fungicidas mesostémicos, preventivos y curativos. Sin embargo, además de su actividad antifúngica, poseen la propiedad de inhibir la síntesis de etileno en la planta retrasando la senescencia e incrementando el rendimiento además de aumentar la asimilación de N en cereales de invierno (3). La mayoría de las estrobilurinas son lipofílicas con una fuerte afinidad por la cutícula cerosa. El principio activo se mueve ampliamente por la hoja y dependiendo del tipo de estrobilurina, puede llegar al mesófilo y al envés de la hoja (movimiento mesostémico). En consecuencia, al cabo de unos días el fungicida puede encontrarse en ambas superficies de la hoja, aún si sólo una es tratada (3); lo cual es especialmente importante en canopeos densos (como el cultivo de trigo con elevada disponibilidad de N en estados avanzados).
En los últimos años se ha incorporado la utilización de carboxamidas las cuales inhiben la fosforilación oxidativa a nivel de la succinato UQ dehidrogenasa (complejo II) lo cual impide la respiración mitocondrial (1). Este grupo químico posee un riesgo medio de generar resistencia aunque la resistencia de algunos hongos ha sido señalada (19). Las carboxamidas fueron los primeros fungicidas sistémicos descubiertos en el año 1964 y un aspecto a tener en cuenta es que posee una elevada especificidad contra basidiomicetes (agentes causales de royas y carbones) además de generar efectos positivos en la fisiología del vegetal como aumento en la eficiencia de uso de agua (28).
La variabilidad en la eficacia de diferentes fungicidas es natural. Está influenciada por varios factores, entre ellos el principio activo, la dosis de aplicación, el momento de aplicación, el volumen de agua y la presión de la enfermedad dada por la fuente de inóculo presente y las condiciones ambientales (30, 9). De Wolf (9) menciona que los fungicidas aplicados con la dosis completa, generalmente tendrán un poder residual mayor. Este autor además señala que los fungicidas poseen una eficacia residual mucho más prolongada contra royas (más de 21 días) que contra manchas foliares. Jorgensen y Bent (17) realizaron aplicaciones de fungicidas en trigo conteniendo tebuconazole y propiconazole (triazoles) para el control de roya amarilla (Puccinia striiformis Westend.) y encontraron que la eficacia residual estuvo relacionada con la dosis de aplicación. Sin embargo, a pesar de las especificaciones de la etiqueta, existe evidencia que indica que incrementar el número de aplicaciones no siempre resulta más eficaz en el control de enfermedades. Así, por ejemplo, Villar y Cencig (31) no encontraron diferencias significativas de severidad cuando se realizaron dos aplicaciones de fungicida para controlar P. triticina comparado con una sola aplicación. Esto se relaciona con el hecho de que la eficacia y residualidad de un fungicida está dada por la combinación de las características intrínsecas del fungicida (principio activo) o mezclas, las estrategias de control establecidos (como el momento aplicación), condiciones ambientales, la densidad de población del patógeno y las características generales de la planta como el cultivar, estado de crecimiento, la nutrición, las prácticas de culturales y la expresión genética de la resistencia en la planta (4).
En general, los triazoles poseen una eficacia residual más corta (7 a 14 días) (19, 3), mientras que las estrobilurinas poseen una superior, aproximadamente entre 14 a 21 días (19, 30). Las condiciones climáticas también afectan la eficacia residual de los fungicidas. Pierce y Mills (21) mencionan que lluvias frecuentes pueden disminuir la eficacia residual de aplicaciones tempranas de fungicidas, haciéndolos menos efectivos ante el desarrollo de enfermedades foliares de mitad y fin de ciclo. Balardin et al. (4) encontraron una reducción en la eficacia residual entre 7 y 10 días de una mezcla de fungicidas conteniendo triazoles y estrobilurinas aplicados a soja para el control de roya de la soja (Phakopsora pachyrhizi Syd. y P. Syd.) cuando ocurrieron lluvias (simuladas) dos horas posteriores a la aplicación.
La eficacia residual de distintos fungicidas ha sido poco investigada y en la actualidad se dispone de escasa información (8). En este trabajo se plantea estudiar la eficacia de control y la eficacia residual de una triple mezcla de triazoles, estrobilurinas y carboxamidas por sobre mezclas de triazoles y estrobilurinas en diferentes combinaciones. Por consiguiente, el objetivo del trabajo fue evaluar el comportamiento (eficacia de control y eficacia residual) de diferentes fungicidas foliares sobre la roya de la hoja del trigo y el efecto de la enfermedad sobre componentes de rendimiento y porcentaje de proteínas en grano.
MATERIALES Y MÉTODOS
Se realizó un ensayo en la Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, Argentina, durante 2012. El ensayo se sembró en macetas a la intemperie (no bajo cubierta ni invernáculo) con un diseño completamente aleatorizado con cinco tratamientos de fungicidas y trece repeticiones. En cada maceta se sembraron diez semillas del cultivar Nidera Baguette 13 (susceptible a roya de la hoja). Adicionalmente, las macetas fueron fertilizadas con 100 kg N/ha en dos momentos bajo la formulación de urea granulada (46-0-0). La primera fertilización se realizó a la siembra y la segunda a fines de macollaje [EC 24, (35)].
Todo el ensayo fue inoculado con esporas de P. triticina. Las esporas pertenecían a una mezcla de razas virulentas con amplia distribución y frecuencia en la zona triguera provistas por el Ing. Pablo Campos del INTA Bordenave. Las inoculaciones se realizaron en seis oportunidades cada siete días desde el momento en que todas las plantas tuvieron las hojas banderas completamente desplegadas (EC 37-40). Se inoculó a razón de 0,5 mg/planta de esporas diluidas en talco como vehículo. Simultáneamente con la primera inoculación se aplicaron los tratamientos de fungicidas que consistieron en un testigo sin fungicidas, tres combinaciones de triazoles y estrobilurinas y un fungicida compuesto por triazoles, estrobilurinas y carboxamidas en dosis comerciales (Tabla 1). Únicamente luego de cada inoculación, se realizó una cámara húmeda durante 48 h mojando las hojas cuidadosamente con un aspersor, colocando algodones mojados en cada maceta y cubriendo todo el ensayo con plástico transparente. Cumplido ese lapso, las macetas permanecieron a la intemperie hasta la siguiente inoculación.
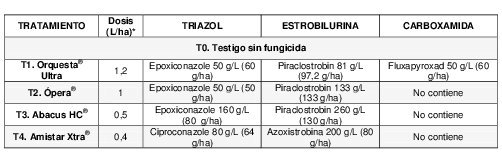
Tabla 1. Tratamientos de fungicidas foliares con sus respectivas dosis (L/ha), principios activos que los conforman con las cantidades en la mezcla (g/L) y cantidades por hectárea (g/ha).
*Las dosis aplicadas fueron las comerciales indicadas por marbete.
Las evaluaciones se realizaron a los 18, 26, 34 y 41 días posteriores a la aplicación (DPA) de fungicidas durante todo el período de formación y llenado de grano, hasta que las hojas comenzaron a manifestar senescencia. En las cuatro fechas se evaluó el número de hojas con al menos una pústula (incidencia), sobre siete hojas bandera de cada tratamiento y repetición. Por otro lado, se evaluó el número de pústulas/cm2 en las tres primeras fechas contadas a los 2-3 cm de la inserción de la hoja bandera sobre siete hojas bandera por tratamiento y repetición. En la última fecha se evaluó la severidad como porcentaje de hoja cubierta por la enfermedad dada la gran cantidad de pústulas presentes. Además, se calculó el área bajo la curva del progreso de la enfermedad (ABCPE) según Shanner y Finney (25) con el número de pústulas/cm2 en las tres primeras fechas evaluadas.
Se calculó la eficacia de control (EC) de cada fungicida en cada fecha evaluada de acuerdo a la fórmula provista por Daniels y Latin (8):
![]()
Con los valores obtenidos, se graficó la eficacia de control de cada fungicida a través del tiempo (Eficacia residual, ER). Para evaluar la EC se consideró la reducción en el número de pústulas en las tres primeras evaluaciones y de la severidad como porcentaje de hoja cubierta por la enfermedad en la cuarta evaluación.
Por otro lado, se cosecharon diez espigas por cada unidad experimental que se trillaron y se calculó el número de granos/espiga. Asimismo, se pesaron los granos y se calculó el peso de mil granos (PMG). Además, se calculó el porcentaje de proteínas en cada unidad experimental realizando dos repeticiones por cada unidad experimental. Para el cálculo del porcentaje de proteína en grano previamente se determinó el contenido de nitrógeno mediante el método Micro-Kjeldhal. El valor obtenido se multiplicó por el factor 5,7 para calcular la cantidad de proteína y se ajustó a una humedad final de 13,5 %.
El análisis de datos se realizó mediante un ANAVA (análisis de varianza) con el programa GenStat 12th Edition. Las medias se compararon mediante el test LSD (P=0,05). Finalmente se realizó una regresión entre el ABCPE y el porcentaje de proteínas en grano.
RESULTADOS
Existieron diferencias altamente significativas en la interacción Fecha de evaluación × Fungicida para las variables incidencia, pústulas/cm2 y severidad (Tabla 2) indicando que el comportamiento de P. triticina fue modificado por el fungicida en función a la fecha evaluada (Fig. 1 y 2).
Tabla 2. Cuadrados medios de valores de incidencia, eficacia de control, pústulas/cm2, severidad, y área bajo la curva del progreso de enfermedad (ABCPE) de roya de la hoja con cinco tratamientos de fungicidas.
*, ** y ***; significativo, Test de F a nivel de P=0,05; 0,01 y 0,001 respectivamente
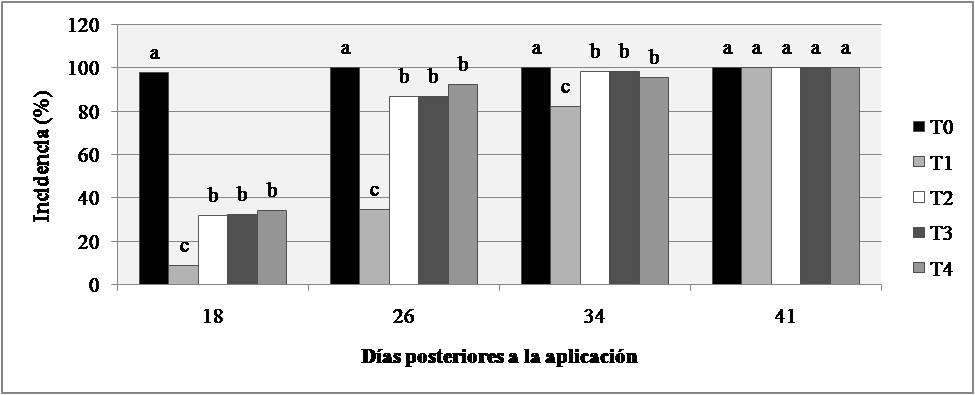
La incidencia de P. triticina fue menor en aquellas plantas tratadas con fungicidas en las tres primeras evaluaciones diferenciándose significativamente del testigo sin tratar. En éste sentido, se destaca principalmente el efecto del T1 (triple mezcla) el cual se diferenció significativamente de los demás tratamientos T2, T3 y T4 con los menores niveles de incidencia (Fig. 1). No se encontraron diferencias significativas de incidencia entre tratamientos de fungicidas 41 DPA con respecto al testigo.
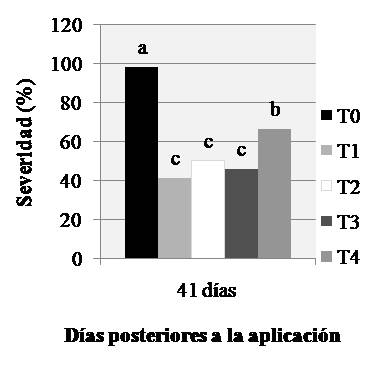
Por otro lado, el número de pústulas/cm2 fue significativamente menor con los cuatro fungicidas respecto al testigo sin tratar a los 18, 26 y 34 DPA (Fig. 2A). En los 18 y 26 DPA no se diferenciaron los valores de pústulas/cm2 con los tratamientos de fungicidas de manera significativa, aunque sí lo hicieron a los 34 DPA destacándose T1 con los menores valores seguido por T2, T3 y luego T4 (Fig. 2A). Por otro lado, a los 41 DPA existieron diferencias significativas de severidad entre los fungicidas con respecto al T0, pero además se destacan de manera significativa los tratamientos T1, T2 y T3 con menores niveles de severidad que T4 (Fig. 2B). Asimismo, existieron diferencias altamente significativas en el ABCPE con los diferentes tratamientos (Tabla 2). Para dicha variable T0 mostró una mayor área de enfermedad con respecto a los demás tratamientos (Fig. 3A).
Figura 1. Medias de Incidencia (%) de roya de la hoja de la interacción Fecha de evaluación × Fungicida con cinco tratamientos de fungicidas en cuatro evaluaciones. Letras iguales dentro de cada día no difieren en forma significativa (P=0,05).
Figura 2.A. Medias de pústulas/cm2 de la interacción Fecha de evaluación × Fungicida las tres primeras fechas evaluadas y B. Medias de severidad para la misma interacción medida como porcentaje de hoja cubierta en la cuarta fecha evaluada de roya de la hoja con cinco tratamientos de fungicidas en cuatro evaluaciones. Letras iguales dentro de cada día no difieren en forma significativa (P=0,05).
De igual manera, existieron diferencias altamente significativas en la EC de los fungicidas con respecto al testigo sin tratar en la interacción Fecha de evaluación × Fungicida (Tabla 2) indicando diferencias de eficacia entre fungicidas según la fecha evaluada. A los 18, 34 y 41 DPA se destaca la EC del T1 por sobre el resto de los fungicidas siendo T4 el que mostró la menor eficacia (Fig. 3B). Contrariamente, no se observaron diferencias significativas de eficacia entre fungicidas a los 24 DPA (Fig. 3B). Además, en la Fig. 3B se puede observar la ER de los cuatro fungicidas estudiados. Así, por ejemplo, el tratamiento T4 no solo tuvo la menor ER diferenciándose de manera significativa de los demás fungicidas a los 18, 34 y 41 días, sino que además, la disminución de la misma fue mucho más marcada, pasando de una EC del 75,6% al 32,5% entre los 34 y 41 DPA. Contrariamente, T1 (triple mezcla) tuvo la mayor EC a los 18, 34 y 41 días. Además, la eficacia de T1 disminuyó de manera mucho más gradual y sostenida pasando del 86 % al 58,2 % entre los 34 y 41 DPA.
Figura 3. A. Medias de área bajo la curva del progreso de la enfermedad (ABCPE). Letras iguales dentro de cada día no difieren en forma significativa (P=0,05). B. Medias de eficacia de control con respecto altestigo [eficacia de control tomada como cero por ciento (0%)] en la interacción Fecha de evaluación × Fungicida de roya de la hoja con cinco tratamientos de fungicidas. Letras iguales de cada barra y dentro de cada día no difieren en forma significativa (P=0,05).
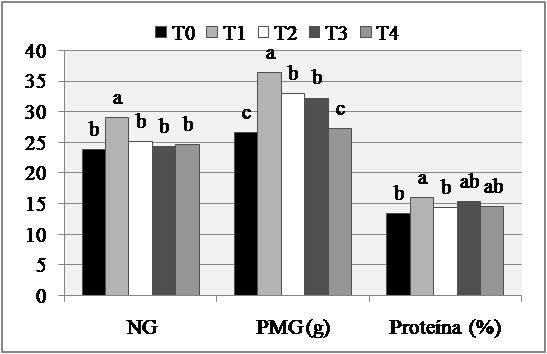
Con respecto al número de granos/espiga, PMG y porcentaje de proteínas se observaron diferencias altamente significativas entre tratamientos de fungicidas con respecto al testigo (Tabla 3). Así, por ejemplo, para la variable número de granos/espiga, las plantas tratadas T1 presentaron el mayor valor diferenciándose significativamente del T0 y de los demás tratamientos (Fig. 4A). Por otro lado, el PMG fue mayor en las plantas tratadas con T1, seguido por T2 y T3 diferenciándose significativamente de las plantas tratadas con T4 y de T0 (Fig. 4A). Cabe señalar que el PMG de las plantas tratadas con T1 fue significativamente superior con respecto a T2 y T3 los cuales no se diferenciaron entre sí (Fig. 4A).
Tabla 3. Cuadrados medios de valores granos/espiga, peso de mil granos (PMG) y porcentaje de proteínas en grano de trigo con cinco tratamientos de fungicidas.
*, ** y ***; significativo, Test de F a nivel de P=0,05; 0,01 y 0,001 respectivamente
Figura 4. A. Medias de número de granos/espiga (NG), peso de mil granos (PMG) y porcentaje de proteínas en grano en trigo con cinco tratamientos de fungicidas. Letras iguales dentro de cada día no difieren en forma significativa (P=0,05). B. Dispersión del ABCPE y porcentaje de proteínas en grano.
Finalmente, el porcentaje de proteínas en grano fue significativamente superior en aquellas plantas tratadas con T1 diferenciándose significativamente de T2, T4 y del testigo sin fungicida (Fig. 4A). Si bien no existieron diferencias significativas de T0 con respecto a T2, T3 y T4; es posible observar una tendencia al incremento en el porcentaje de proteínas en grano cuando se controla la enfermedad. En la asociación entre el ABCPE con sus respectivos valores de porcentaje de proteínas en grano se observó una relación negativa y significativa (R2= 0,134; P=0,002) (Fig. 4B).
DISCUSIÓN
En el presente trabajo, todos los fungicidas aplicados demostraron tener un efecto de control sobre el testigo sin tratar expresado por una menor incidencia, como en el número de pústulas/cm2 y en la severidad. Dentro de los fungicidas evaluados en este trabajo, se destacó T1 que contiene una carboxamida (Fluxapyroxad), la menor dosis (g/ha) de triazol comparado con T3 y T4 y la menor dosis (g/ha) de estrobilurina comparado con T2 y T3. La triple mezcla contenida en T1 mantuvo un porcentaje de control cercano al 60 % a los 41 DPA. Es probable que la carboxamida (Fluxapyroxad) haya sido una de las causas de la mayor EC del fungicida con respecto a los demás, ya que las mismas tienen elevada especificidad contra basidiomicetes (3) y ejercen un mejor control. Smith et al. (21) señalan que este tipo de carboxamida (Fluxapyroxad) posee una elevada EC sobre P. triticina y P. striiformis.
Por otro lado, la EC de T2 y T3 fue del 50 %, ambos fungicidas con eficacias superiores a T4 (32 %) a los 41 DPA. El tratamiento T3 contiene el doble de estrobilurina (Piraclostrobin) que el tratamiento T2, en tanto que contiene más de tres veces la cantidad de triazol (Epoxiconazole). Por ello la dosis de aplicación de T3 es menor, pero aún aplicando la mitad de dosis, su concentración de triazol es mayor. Este fungicida demostró tener una EC cuya tendencia fue mayor que para el T2 que contiene menor cantidad de triazol y para el T4 que contiene otra estrobilurina (Azoxistrobina) y otro triazol (Ciproconazole). Similares resultados fueron encontrados por Simón et al. (26).
Una de las características más importantes de un fungicida es su eficacia, la cual está estrechamente relacionada con el periodo residual, además del rango de patógenos que este controla (4). Conocer el periodo de residualidad de un fungicida, es decir, el periodo que el fungicida se mantiene activo, es muy importante. La EC y ER de un fungicida están influenciados por numerosos factores: el tipo de fungicida aplicado y dosis, el momento de aplicación, el tipo de enfermedad, la presión del inóculo, la forma de aplicación, las condiciones ambientales, entre otros (30, 9). Jorgensen y Bent (17) realizaron aplicaciones de fungicidas en trigo conteniendo tebuconazole y propiconazole (triazoles) para el control de roya estriada y encontraron que el poder residual estuvo relacionado con la dosis de aplicación. Estos autores observaron un mayor efecto residual del fungicida cuando las dosis fueron más altas.
La triple mezcla T1 aumentó de número de granos/espiga en forma significativa. Una infección temprana (por ejemplo, en el periodo crítico) puede afectar el número de espiguillas y el número de flores, disminuyendo el número de granos/espiga mientras que una infección durante el período de llenado de granos disminuye el peso del grano (32, 15). En este trabajo la enfermedad se manifestó desde antesis, por lo que este tratamiento que hizo un buen control alcanzó a incrementar el número de granos/espiga. Asimismo, el tratamiento T1, seguido por T2 y T3, presentaron los mayores valores de PMG comparados a T4 y a T0 (en concordancia con su mayor EC y ER).
Por otro lado, los tratamientos con fungicidas tendieron a aumentar el contenido de proteínas. Estos incrementos fueron significativos en T1. Trabajos realizados por Dimmock y Gooding (10) y Gooding (13) indican que cuando prevalecen patógenos biotróficos como P. triticina en trigo, la concentración de proteínas en grano disminuye, porque el patógeno provoca mayor daño sobre la acumulación y partición del N en el grano que el que provoca sobre la acumulación y partición de la materia seca. Esto ocasiona que frecuentemente la concentración de proteína aumente al controlar las royas con fungicidas. Simón et al. (26) demostraron que la infección con P. triticina en un cultivar susceptible disminuyó la concentración de proteínas en el grano. Asímismo, Caldwell et al. (6) y Greaney et al. (14) observaron que la infección con P. triticina en los cultivares más susceptibles incrementa la concentración de proteínas en tallos y hojas y reduce la concentración en el grano. Esto se relaciona con el hecho de que el contenido de proteínas en el grano se encuentra determinado por efectos de dilución y concentración, ya que la deposición de proteínas y de almidón aparecen como eventos independientes, controlados por mecanismos separados (16). Mientras algunos autores sostienen que el peso de los granos estaría co-limitado por fuente y por destino (5), se considera que el contenido absoluto de proteínas en el grano está mayormente limitado por fuente (18). La limitación por fuente está dada por el hecho de que entre un 70-80 % del N disponible es absorbido antes de floración y así las proteínas de los granos se forman en su mayor parte utilizando nitrógeno que se removiliza desde los tallos y las hojas hacia los granos, y en menor proporción del proveniente de la absorción remanente. Por el contrario, la acumulación de carbohidratos en los granos está más influenciada por las condiciones ambientales en el periodo de llenado del grano y la actividad fotosintética en ésta etapa (29). Por lo general, existe una relación negativa entre el rendimiento y el contenido de proteína del grano ya que los altos rendimientos suelen estar asociados a un bajo contenido de proteína. Sin embargo, esto no implica que altos porcentajes de proteínas no puedan ser alcanzados con altos niveles de rendimiento y se halla ligado a la disponibilidad de N en el suelo (29).
Por otro lado, la triple mezcla T1 no sólo presentó los mayores valores de EC sobre la enfermedad dado por menores valores de incidencia, pústulas/cm2 y severidad en la última fecha de evaluación, además incrementó el número de granos/espiga, el PMG y el porcentaje de proteínas en granos por sobre los demás fungicidas. Este incremento de dichas variables no sólo se justificaría por un mejor control de enfermedad sino además por un efecto positivo en la fisiología de la planta. Smith et al. (28) señalaron que la carboxamida Fluxapyroxad incrementó los rendimientos de grano de trigo en un 12%, y que no estuvo asociado al control de síntomas visibles de la enfermedad, sino que más bien se debió a efectos positivos sobre la fisiología de la planta como una mejor eficiencia de uso del agua. Además de una carboxamida, T1 contiene Epoxiconazole (triazol) y Piraclostrobin (estrobilurina) los cuales además de controlar la enfermedad poseen también un efecto fisiológico positivo. Ajigboye et al. (2) encontraron que en ausencia de enfermedad una mezcla de triazol y estrobilurina incrementaron la eficiencia del Fotosistema II, asociado con una mejora del intercambio gaseoso de la fotosíntesis e incremento en la tasa de transporte de electrones resultando en aumentos de la biomasa y rendimiento de grano en trigo. Por otro lado, Dimmock y Gooding (11) hallaron que la inclusión de estrobilurinas en los fungicidas para el control de enfermedades foliares en trigo, están asociados a aumentos en el rendimiento en grano, peso específico del grano y el PMG. Dichos aumentos estarían relacionados con una prolongación del periodo verde de la hoja bandera. Wu y Von Tiedemann (34) sostienen que este retraso en la senescencia del follaje se debería a que las estrobilurinas protegen de las especies reactivas de oxígeno (peróxido de hidrógeno) y por lo tanto existiría un menor estrés oxidativo en el tejido de la planta.
CONCLUSIONES
- El tratamiento con fungicida con tres principios activos (triazol, estrobilurina y carboxamida) tiene una mayor EC sobre roya de la hoja y una mayor ER.
- Dicho tratamiento mezcla genera un mayor número de granos/espiga, PMG y % de proteínas en el grano.
BILBIOGRAFIA
1 ADOCK, C. Y TASHEVA, M. 2012. Fluxapyroxad. Disponible en: www.inchem.org/documents/jmpr/jmpmono/v2012pr01.pdf. Último acceso: junio de 2015. [ Links ]
2 AJIGBOYE, O.O.;MURCHIE, E. YRAY, R.V. 2014. Foliar application of isopyrazam and epoxiconazole improves photosystem II efficiency, biomass and yield in winter wheat. Pesticide Biochemistry and Physiology 114: 52-60. [ Links ]
3 ARREGUI, M.C. Y PURICELLI, E. 2013. Fungicidas. Mecanismos de Acción de Plaguicidas, 1ra Edición. UNR (Ed.) Editorial de la Universidad Nacional de Rosario, 2013. 265 p. [ Links ]
4 BALARDIN, R.; MADALOSSO, M.; DEBORTOLI, M. Y LENZ, G. 2010. Factors Affecting Fungicide Efficacy in the Tropics. Odile Carisse (Ed.) En: Fungicides. Publicado: diciembre 2010. p. 23-38 [ Links ]
5 CALDERINI, D.F. 2006. El rendimiento de trigo en el mundo y la brecha entre el rendimiento potencial y el alcanzado: ¿Cómo aumentar el rendimiento alcanzable? Actas del Congreso "A Todo Trigo". 18 y 19 de mayo de 2006, Mar del Plata, Argentina pp. 1-7. [ Links ]
6 CALDWELL, R.M.; KRAYBILL, H.R.; SULLIVAN, J.T. Y COMPTON, L.E. 1934. Effect of leaf rust (Puccinia triticina) on yield, physical characters and composition of winter wheats. Journal of Agricultural Research 12: 1049-1071. [ Links ]
7 CAMPOS, P.E. 2014. Royas del trigo. Cordo, C.A y Sisterna MN (Coord). En: Enfermedades del trigo, Avances científicos en la Argentina. p. 223-244. [ Links ]
8 DANIELS, J.P. Y LATIN, R. 2013. Residual efficacy of fungicides for controlling brown patch on creeping bentgrass fairways. Plant Disease 97: 1620-1625. [ Links ]
9 DE WOLF, B. 2012. Kansas State Scientist on Wheat Rust Diseases: Correctly Identifying if Fungicides Needed -; or Not -; is Important. Kansas State University. Disponible en: http://www.ksre.ksu.edu/news/story/wheat_rust041912.aspx. Último acceso: junio de 2015. [ Links ]
10 DIMMOCK, J.P.R.E. Y GOODING, M.J. 2002a. The influence of foliar diseases, and their control by fungicides, on the protein concentration in wheat grain: a review. Journal of Agricultural Science Cambridge 138: 349-366. [ Links ]
11 DIMMOCK, J.P.R.E. Y GOODING, M.J. 2002b. The effects of fungicides on rate and duration of grain filing in winter wheat in relation to maintenance of flag leaf area. Journal of Agricultural Science 138: 1-16. [ Links ]
12 ERMÁCORA, C.M. 2008. Principales enfermedades en trigo: Criterios para su manejo y control. En: Satorre, E., (Ed.). Producción de Trigo. CREA. p. 51-58. [ Links ]
13 GOODING, M.J. 2006. The effect of fungicides on the grain yield and quality of wheat. Actas del Congreso "A Todo Trigo" 18 y 19 de mayo de 2006, Mar del Plata, Argentina. p. 45-52. [ Links ]
14 GREANEY, F.J.; WOODWARD, J.C. Y WHITESIDE, A.G.O. 1941. The effect of stem rust on the yield, quality, chemical composition, and milling and baking properties of Marquis wheat. Scientific Agriculture 22: 40-;60. [ Links ]
15 ISHIKAWA, S.; HARE, M. C. Y KETTLEWELL, P.S. 2012. Effects of strobilurin fungicide programmes and fertilizer nitrogen rates on winter wheat: severity of Septoria tritici, leaf senescence and yield. The Journal of Agricultural Science 150: 411-426. [ Links ]
16 JENNER, C.F.; UGALDE, T.D. Y ASPINALL, D. 1991. The physiology of starch and protein deposition in the endosperm of wheat. Australian Journal of Plant Physiology 18: 211-226. [ Links ]
17 JORGENSEN, N.J. Y BENT, J.N. 1994. Control of yellow rust (Puccinia striiformis) on winter wheat by ergosterol inhibitors at full and reduced dosages. Crop Protection 13: 323-330. [ Links ]
18 MARTRE. P.; PORTER, J.R.; JAMIESONE, P.D. Y TRIBOI, E. 2003. Modeling grain nitrogen accumulation and protein composition to understand the sink/source regulations of nitrogen remobilization for wheat. Plant Physiology 133: 1959-1967. [ Links ]
19 MUELLER, D.S. Y BRADLEY, C.A. 2008. Field crop fungicides for the north central United States.North Central Integrated Pest Management Center. Disponible en: https://www.google.com.ar/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&cad=rja&uact=8&ved=0CCQQFjABahUKEwi52oGyPHGAhVIkw0KHXrzBKU&url=http%3A%2F%2Fsoybeanresearchinfo.com%2Fpdf_docs%2Ffieldcropfungicides.pdf&ei=MjqxVbn5C8imNvrmk6gK&usg=AFQjCNEQwAro6wcRvXQ1WuNdmscXHf2s8g Último acceso: julio de 2015. [ Links ]
20 PÉREZ FERNÁNDEZ, J. 2000. Enfermedades de trigo en la Región V Sur. 8vo Congreso Nacional AAPRESID, Tomo II: disertaciones y conferencias. Mar del Plata, agosto 2000. [ Links ]
21 PIERCE, P. Y MILLS, D. 2011. Early fungicide applications: What are we seeing? Crop observation and recommendation network. The Ohio State university. Newsletter Vol. 10. Disponible en: http://corn.osu.edu/newsletters/2011/2011-10/#5. Último acceso: mayo de 2012. [ Links ]
22 ROELFS, A.P.; SINGH, R.P. Y SAARI, E.E. 1992. The wheat rusts. Hettel, G.P. (Ed.). En: Rust diseases of wheat, Concepts and methods of disease management. pp. 2-6. [ Links ]
23 SCHIERENBECK, M.; FLEITAS, M.C. Y SIMÓN, M.R. 2015. Dinámica del nitrógeno ante enfermedades fúngicas foliares en trigo: Efecto diferencial de patógenos necrotróficos y biotróficos. Editorial Académica Española. Saarbrücken, Alemania. 65 p. [ Links ]
24 SERRAGO, R.A.; MIRALLES, D.J. Y BANCAL, M.O. 2005. Foliar diseases in wheat: effect on biomass generation and in its physiological components. 7th International Wheat Conference. 27 de noviembre al 2 de diciembre, Mar del Plata, Argentina. p 308.
25 SHANNER, E. Y FINNEY, R.E. 1977. The effect of N-fertilization on the expression of slow-mildewing resistance in Knox wheat. Phytopathology 67: 1051-1056. [ Links ]
26 SIMÓN, M.R. FLEITAS, M.C. Y AGELETTI, P. 2012. Efecto de control y residualidad de fungicidas con diferentes mezclas de triazoles y estrobilurinas sobre la roya de la hoja del trigo. XIV Jornadas Fitosanitarias Argentinas, Poteros de los Funes, San Luis, cctubre de 2012. p. 329. [ Links ]
27 SIMÓN, M.R.; FLEITAS, M.C. Y SCHALAMUCK, S. 2013. Recent advances on integrated foliar diseases management with special emphasis in Argentina wheat production. En: Mizuho, N. (Ed.). Fungicides, Showcases of integrated plant disease management from around the world. College of Agriculture and Life Sciences, Department of Plant Pathology, Physiology, and Weed Science, Virginia Tech, EE.UU. 327 p. [ Links ]
28 SMITH, J.; GRIMMER, M.; WATERHOUSE, S. Y PAVELEY, N. 2013. Quantifying the non-fungicidal effects of foliar applications of fluxapyroxad (Xemium) on stomatal conductance, water use efficiency and yield in winter wheat. Communications in Agricultural and Applied Biological Sciences 78: 523-35. [ Links ]
29 STONE, P.J. Y SAVIN, R. 1999. Grain quality and its physiological determinants. En: Satorre E, Slafer GA, editors. Wheat: ecology and physiology of yield determination. Food Product Press pp. 85-119. [ Links ]
30 TENUTA, A. 2011. Foliar Diseases of Wheat - Wich Fungicide to Use. Ontario Ministry of Agriculture, Food and Rural Affairs. Disponible en: http://omafra.gov.on.ca/english/crops/field/news/croppest/2011/01cpo11a8.htm Último acceso: mayo de 2012. [ Links ]
31 VILLAR, P.A. Y CENCIG G. 2004. Control químico de la roya de la hoja del trigo: momento de aplicación. Información técnica de trigo. Campaña 2004. Publicación Miscelánea Nº 101. Mayo 2004. INTA Rafaela. Pp. 46-49. Disponible en: http://agrolluvia.com/wp-content/uploads/2009/09/r-control-quimico-roya-de-la-hoja-trigo-momento-aplicacion.pdf Último acceso: noviembre de 2015. [ Links ]
32 WANG, J.; PAWELZIK, E.; WEINERT, J.; ZHAO, Q. Y WOLF, G. 2004. Effect of fungicide treatment on the quality of wheat flour and breadmaking. Journal of Agricultural and Food Chemistry 52: 7593-7600. [ Links ]
33 WIIK, L. 2009. Control of fungal diseases in winter wheat. Doctoral Thesis Swedish University of Agricultural Sciences, Alnarp. Sweden. 108 p. [ Links ]
34 WU, Y.X. Y VON TIEDEMANN, A. 2001.Physiological effects of azoxystrobin and epoxiconazole on senescence and the oxidative status of wheat.Pesticide Biochemistry and Physiology 71:1-10. [ Links ]
35 ZADOKS, J.C.; CHANG, T.T. Y KONZAK, C.F. 1974. A decimal code for the growth stages of cereals. Weed Research 14: 415-;421. [ Links ]